« Toute tumeur du testicule est un cancer jusqu’à preuve du contraire »… ce vieil adage demeure d’actualité en 2022. Si le diagnostic et la prise en charge thérapeutique qui en découle sont parfaitement conduits, la guérison est obtenue dans 95 % des cas. Tour d’horizon pour le MG.
D’après :
– Dumont C, Masson-Lecomte A, Desgrandschamps F, et al. Item 313. Tumeurs du testicule. Rev Prat 2022;72(7);803-5.
– Culine S, Dumont C, Bonnet C, et al. Cancers du testicule de l'adulte. Rev Prat Med Gen 2020;34(1041);372-4.
Maladies de l’adulte jeune, les cancers du testicule sont principalement des tumeurs germinales (elles dérivent des gonocytes primordiaux, précurseurs embryonnaires des gamètes de l’adulte). D’un point de vue anatomopathologique, on distingue les séminomes purs (40 %) des tumeurs non séminomateuses (60 %).
En constante augmentation, l’incidence des tumeurs germinales malignes du testicule de l’adulte est d’environ 2 500 nouveaux cas par an en France, soit 5 pour 100 000 hommes. L’incidence est plus élevée dans les pays scandinaves, similaire en Amérique du Nord et nettement moindre en Afrique et en Asie. Les formes bilatérales représentent 1 à 2 % des cas. Il s’agit d’un cancer qui touche l’homme jeune, avec un pic de fréquence autour de la troisième décennie, et un second pic entre 40 et 50 ans pour les séminomes.
Le pronostic est très bon, avec une survie à 5 ans de plus de 95 % tous stades confondus, dès lors que la prise en charge est adaptée.
Les facteurs de risque identifiés à ce jour sont :
- antécédents de cryptorchidie, le risque persistant après abaissement testiculaire ;
- antécédents familiaux du premier degré de cancer du testicule ;
- antécédent personnel de tumeur du testicule ou de néoplasie germinale intratubulaire controlatérale ;
- infertilité ;
- trisomie 21 ;
- consommation régulière et prolongée de cannabis pour les tumeurs non séminomateuses.
Quels signes d’appel ?
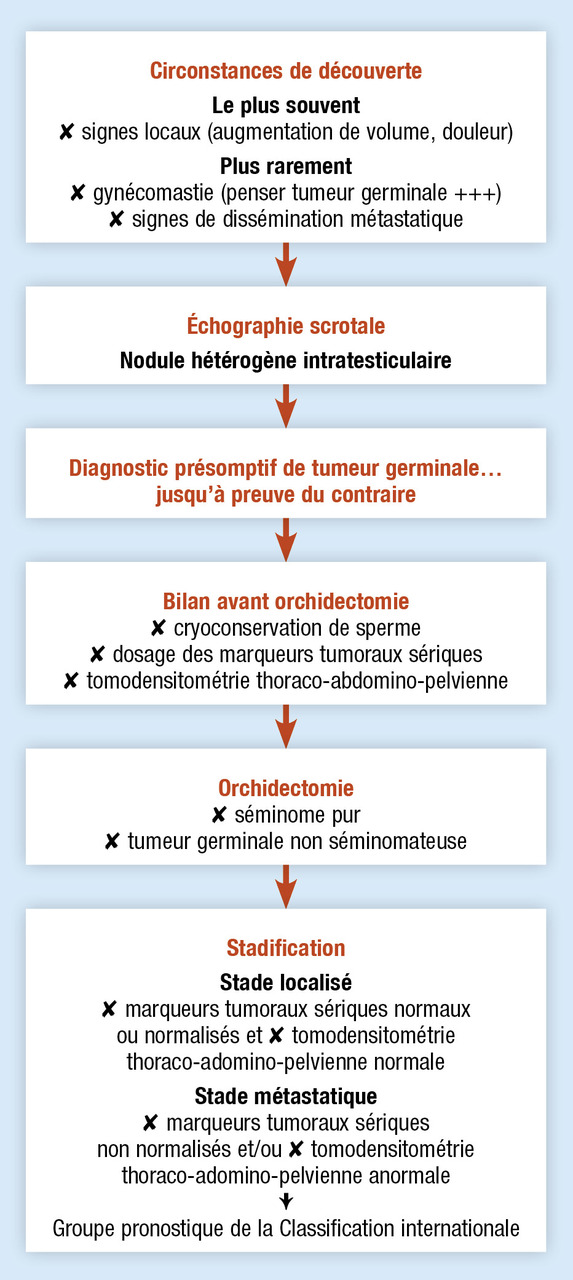
Classiquement, les tumeurs germinales du testicule sont diagnostiquées devant l’apparition de symptômes locaux (fig. 1) : augmentation progressive du volume testiculaire, autopalpation d’une masse scrotale, douleurs. Elles peuvent parfois se révéler de manière plus aiguë, à l’occasion d’une orchite ou d’un traumatisme scrotal. Leur découverte fortuite lors d’une échographie réalisée dans le cadre d’un bilan (d’infertilité, par exemple) est aussi possible.
Plus rarement, le diagnostic est porté au cours du bilan d’une masse abdominale, d’une adénopathie de Troisier, d’une gynécomastie (en cas de sécrétion tumorale d’hormone chorionique gonadotrope), d’une altération de l’état général, ou encore d’une dyspnée dans les formes massivement métastatiques d’emblée.
Quels diagnostics différentiels ?
Le principal est l’orchiépididymite, qui se distingue par la présence de signes infectieux pouvant être marqués (fièvre, douleur), de troubles urinaires, d’un examen cytobactériologique des urines positif, et d’un signe de Chevassu négatif. En cas de doute, l’échographie testiculaire peut trancher. L’hydrocèle vaginale est facilement reconnaissable par son aspect régulier et de consistance hydrique. Les autres diagnostics différentiels peuvent facilement être éliminés (kyste de l’épididyme, varicocèle, hernie inguino-scrotale…).
Un diagnostic en 3 étapes (fig. 1)
La palpation scrotale, bilatérale et comparative, met en évidence un nodule ou une masse développée aux dépens d’un testicule (fig. 1), de consistance dure et irrégulière, et indépendante de l’épididyme (conservation du sillon épididymotesticulaire ou signe de Chevassu). L’examen clinique doit également comporter la palpation des aires ganglionnaires sus-claviculaires gauches et la palpation abdominale (à la recherche d’une hépatomégalie ou d’une masse abdominale), ainsi qu’un examen général (pleuropulmonaire…) à la recherche de signes d’une localisation métastatique.
L’échographie scrotale permet, outre de confirmer l’origine testiculaire de la masse, d’explorer le testicule controlatéral. Aspect échographique d’une TGT : nodule hypo-échogène, volontiers homogène pour les séminomes, plus hétérogène pour les tumeurs non séminomateuses.
L’orchidectomie confirme le diagnostic (on enlève testicule, annexes et cordon spermatique jusqu’à l’orifice inguinal ; une prothèse peut être mise en place dans le même temps ou à distance). C’est aussi la première étape thérapeutique. Avant cet acte, ne pas oublier de :
– demander un dosage sanguin des marqueurs tumoraux (encadré) que sont l’alphafœtoprotéine (AFP), l’hormone chorionique gonadotrope (hCG) et les lacticodéshydrogénases (LDH) ;
– proposer au patient une cryoconservation de sperme (mesure médicolégale).
Le bilan d’extension, très simple, comporte un dosage postopératoire de ces marqueurs et un scanner thoraco-abdominopelvien (TAP). Pas de TEP-FDG en première intention.
Traiter selon la gravité
Dans les stades localisés (absence de métastase au scanner TAP et normalisation des marqueurs tumoraux sériques s’ils étaient anormaux avant l’orchidectomie) : une surveillance est préconisée dans la grande majorité des cas. En effet, le geste chirurgical guérit à lui seul 85 % des séminomes purs et 70 % des tumeurs non séminomateuses. La chimiothérapie adjuvante peut être discutée au cas par cas pour des patients anxieux ou risquant d’échapper à la surveillance. Quelle que soit l’attitude retenue, les taux de guérison avoisinent les 100 %.
En cas de métastases, le protocole de chimiothérapie de référence est le BEP : bléomycine 30 mg dose totale à J1, J8 et J15, étoposide 100 mg/m2/j de J1 à J5, cisplatine 20 mg/m2/j de J1 à J5. Chaque cycle est débuté toutes les 3 semaines et est délivré en hospitalisation conventionnelle de J1 à J5 et en hospitalisation de jour à J8 et J15. Le nombre de cycles est adapté au groupe pronostique, selon le niveau d’élévation des marqueurs tumoraux et d’éventuelles métastases viscérales extrapulmonaires (foie, cerveau ou os).
Le cisplatine a transformé le pronostic d’une maladie autrefois mortelle. Le nombre de décès est de moins de 100 par an en France, soit un taux de mortalité de 0,2/100 000 hommes. Sont concernés les patients métastatiques ayant un mauvais pronostic avec, au diagnostic, une très forte masse tumorale ou des métastases viscérales extrapulmonaires, et pour lesquels la recherche clinique doit être poursuivie.
Séquelles à long terme
Le risque de récidive tumorale après traitement devient très faible au-delà de 5 ans : les examens de surveillance ne sont plus préconisés. Les patients doivent être avertis d’un risque de TGT sur le testicule controlatéral d’environ 2 à 3 %, qui court jusqu’à 20 ans au moins après la première tumeur. Il justifie l’éducation à l’autopalpation testiculaire régulière.
Malgré des taux de guérison très élevés, la survie globale à long terme demeure inférieure à celle de la population générale, sauf lorsque la prise en charge se résume à une orchidectomie. Cause hypothétique : des séquelles potentiellement mortelles à long terme, comme les seconds cancers et les pathologies cardiovasculaires.
Plusieurs études ont en effet mis en évidence une hausse du risque d’événements CV chez les patients ayant reçu une chimiothérapie au décours de l’orchidectomie. En pratique, un traitement anticoagulant est recommandé lors de la chimiothérapie en cas de masse tumorale métastatique initiale importante puis un dépistage et une gestion des facteurs de risque CV à long terme.
Le risque de seconds cancers (thyroïde, poumon, appareil digestif…) est multiplié d’un facteur 2 chez les patients recevant une chimiothérapie après l’orchidectomie et d’un facteur 4 si une chimiothérapie de rattrapage pour rechute s’avère nécessaire.
Le cisplatine expose à une fréquence accrue de fatigue chronique (15 à 30 %), de syndrome métabolique et d’événement CV, de troubles de l’audition (20 à 50 %), de neuropathie périphérique (30 %) et de dégradation de la fonction rénale (25 à 50 %). Un certain nombre de mesures de suivi et de prévention s’impose (encadré 2).
Marqueurs sanguins : quel intérêt ?
L’AFP n’est élevée qu’en cas de tumeur germinale non séminomateuse. L’hCG totale peut être élevée en cas de tumeur germinale séminomateuse ou non séminomateuse. La LDH n’a pas de spécificité d’organe ni d’histologie et reflète la masse tumorale.
Ces marqueurs ont un triple rôle diagnostique, pronostique et de suivi. Avant l’orchidectomie, l’élévation de l’AFP et/ou de l’hCG confirme quasiment avant l’histologie le diagnostic de tumeur germinale. Au décours de l’orchidectomie, ils participent à la stadification de la maladie. Si la tomodensitométrie est sans anomalies, la normalisation des marqueurs est nécessaire pour conclure au stade localisé de la maladie. En cas de métastases, leur niveau d’élévation permet d’adapter les traitements.
Cancer testiculaire : suivi à long terme
Pour tous les patients
Tumeurs germinales du testicule controlatéral
Éducation à l’autopalpation testiculaire
Pour ceux traités par chimiothérapie
Asthénie, syndrome métabolique, obésité, HTA, événements cardiovasculaires
Prévention des facteurs de risque cardiovasculaires, activités physiques régulières
Troubles de l’audition et acouphènes
Conseils de protection auditive (environnement, médicaments, HTA)
Neuropathie périphérique
Prévention des facteurs aggravants (diabète, alcool…)
Altération de la fonction rénale
Hyperhydratation systématique lors de l’administration du cisplatine
Contre-indication des AINS pendant la chimiothérapie
Limiter les imageries avec produits de contraste iodés
Conseils de protection rénale à long terme (médicaments, HTA)
Seconds cancers
Prévention des facteurs de risque (tabac, alcool…)

 Encadrés
Encadrés