Lésions bénignes rares mais probablement sous-diagnostiquées, les tumeurs glomiques des doigts peuvent être invalidantes. Leur résection chirurgicale complète est l’unique option thérapeutique efficace.
Bien que décrites dans la littérature médicale depuis le début du XIXe siècle,1 et de symptomatologie très typique, les tumeurs glomiques des doigts souffrent souvent d’un retard diagnostique par méconnaissance de leur existence par le corps médical. Il s’agit de petites tumeurs pulpaires ou sous-unguéales provoquant une douleur paroxystique intense, voire « atroce », à leur contact, avec une hypersensibilité particulière aux changements de température.2 En 1924, Pierre Masson précise les caractéristiques histologiques de ces lésions provenant du glomus neuro-myo-artériel et leur donne l’appellation de « tumeurs glomiques ».3,4 En 1936, Touraine décrit pour la première fois les glomangiomes héréditaires multiples.5
Rares et le plus souvent uniques
Quatre-vingt-dix pour cent des tumeurs glomiques sont uniques et situées dans le plan sous-unguéal de la phalange distale des doigts. Les localisations multiples représentent 10 % des cas ; elles peuvent siéger sur plusieurs doigts6 ou avoir différentes localisations anatomiques.7-9
Ces tumeurs sont rares, représentant 1 à 5 % de toutes les tumeurs des tissus mous de la main,10 et leur diagnostic est parfois difficile.11
Elles peuvent survenir à tout âge, même s’il existe une légère prépondérance féminine entre 30 et 50 ans.12
Une histologie et un aspect macroscopique caractéristiques
Les tumeurs glomiques des doigts sont des tumeurs bénignes organisées périvasculaires de l’appareil neuro-myo-artériel des corps glomiques, qui sont des shunts capillaires artérioveineux innervés par les fibres nerveuses autonomes du système végétatif et entourés de cellules glomiques, correspondant à des cellules musculaires lisses.
Les tumeurs glomiques résultent de la multiplication cellulaire de la composante musculaire lisse du corps glomique, dont la fonction principale est de réguler le diamètre capillaire (et donc le flux sanguin vers la peau) lors de variations thermiques ou barométriques. Leur emplacement principal au niveau des extrémités digitales est une couche suprapériostée juste en-dessous du lit de l’ongle. Le plus souvent, leur taille varie de 1 à 5 mm. Ce sont des tumeurs macroscopiquement bien encapsulées ; leur couleur peut varier du blanc nacré au rose framboise, jusqu’au marron clair.
Il n’y a aucune relation histologique entre les tumeurs glomiques des doigts et les tumeurs glomiques des artères carotides ou des veines jugulaires (ces dernières trouvant leur origine au sein des cellules chromaffines des paraglanglions, issues embryologiquement des migrations des crêtes neurales).13
La transformation maligne des tumeurs glomiques est exceptionnelle. Lorsqu’elle survient, il s’agit de glomangiosarcomes dont les critères de prédisposition sont l’âge avancé et une taille lésionnelle initiale supérieure à 1 cm de grand axe.14
Une clinique évocatrice
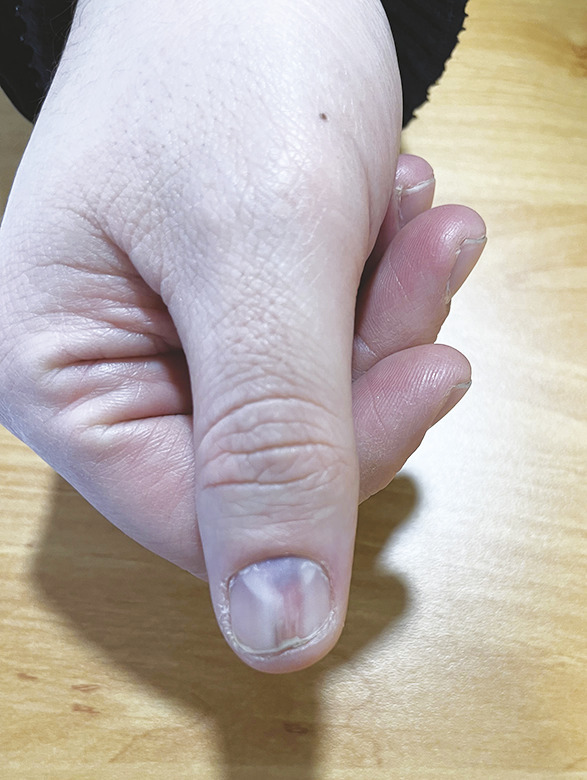
Le délai diagnostique des tumeurs glomiques est généralement très long : selon les séries, il peut se passer jusqu’à dix ans entre le début des symptômes et le diagnostic. En effet, il s’agit d’une lésion peu connue du corps médical, et la tumeur peut être confondue avec d’autres maladies. Les tumeurs glomiques surviennent fréquemment sous forme de lésions uniques et, lorsqu’elles sont situées en distalité des doigts, elles sont souvent sous-unguéales.
Trois symptômes caractéristiques
La triade typique de symptômes des tumeurs glomiques solitaires classiques aide à les repérer :
– douleur paroxystique spontanée, avec irradiation proximale vers le haut du bras ;
– zone de déclenchement punctiforme, avec exacerbation par un traumatisme local ;
– hypersensibilité au froid.11
Dans 47 % des cas, elles peuvent également être cliniquement reconnaissables par la présence d’une zone sous-unguéale de couleur bleuâtre à rouge et/ou d’une dystrophie unguéale (
Des tests cliniques simples
Trois tests cliniques sont utiles pour poser le diagnostic :16
– le test de Love17 permet le déclenchement de la douleur par palpation de la zone « gâchette » à l’aide d’un instrument fin ;
– le test de sensibilité au froid reproduit la douleur avec un glaçon ou une « bombe à froid » (ce test est moins facile à réaliser en pratique clinique que le précédent) ;
– le test de Hildreth18 ou test du garrot a un haut niveau de spécificité et de sensibilité. Il correspond à la négativation du test de Love après exsanguination du doigt atteint. Ce phénomène s’explique par la vidange vasculaire de la tumeur et la diminution de pression sur les fibres nerveuses.
La transillumination19 a également été décrite pour localiser les lésions sous-unguéales, mais elle est peu reproductible en pratique clinique.
Examens d’imagerie : indispensables pour confirmer le diagnostic
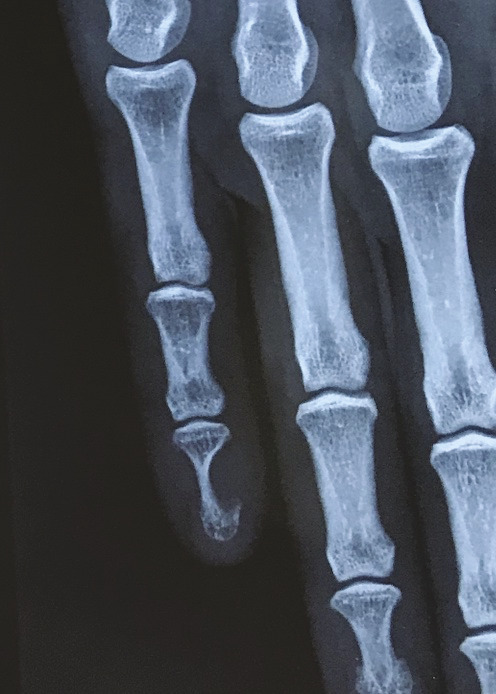
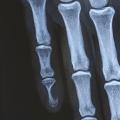
Des érosions osseuses peuvent être visibles sur les radiographies simples : un festonnage ou une empreinte de la phalange distale est mis en évidence chez 36 % des patients,15 jusqu’à de volumineuses lacunes osseuses (
L’échographie à haute résolution et Doppler couleur, par un radiologue aguerri, permet d’évaluer avec précision la taille et la localisation de la tumeur glomique. Elle apparaît sous la forme d’une masse hypoéchogène à vascularisation marquée.20
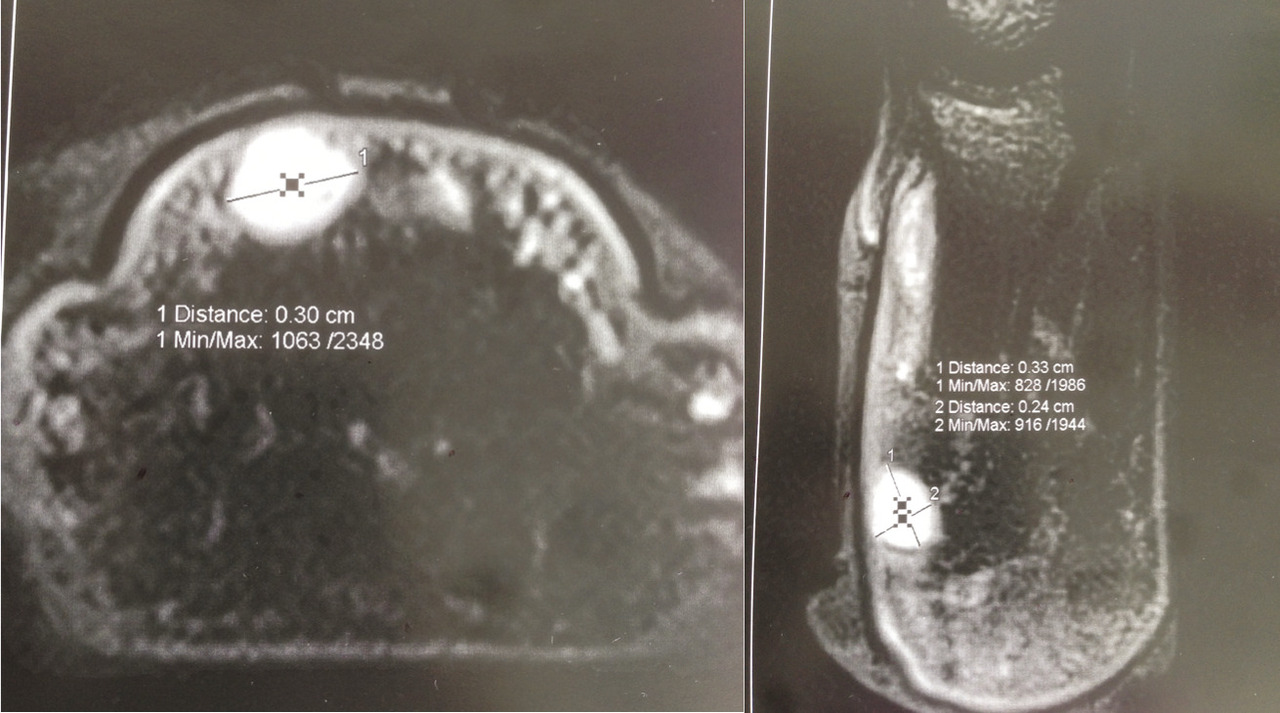
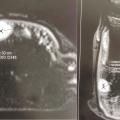
L’imagerie par résonance magnétique (IRM) avec utilisation d’antennes de surface adaptées aux doigts est l’examen de choix. Elle montre un signal T1 hypo-intense et un signal T2 hyperintense avec rehaussement sur les images pondérées en T1 après injection de gadolinium (
La chirurgie pour unique traitement
La résection chirurgicale minutieuse et complète est le seul traitement permettant une guérison définitive. Ses objectifs sont les suivants : soulagement complet de la douleur sans récidive, prévention de la déformation des ongles, récupération et cicatrisation précoces, mobilité normale des doigts et sensibilité intacte de la pulpe des doigts.
Technique chirurgicale : pas encore de gold standard !
Pour y parvenir, plusieurs techniques chirurgicales ont été décrites dans la littérature médicale, variables selon l’emplacement de la tumeur dans le lit de l’ongle et les habitudes du chirurgien. En raison de la rareté de cette lésion, la plupart des études décrivant ces techniques portent sur un nombre limité de patients, une courte période de suivi, et sont de conception rétrospective et monocentrique. Aucune conclusion évidente ne peut donc en être tirée sur la technique optimale pour réduire le risque de récidive ou de déformation.
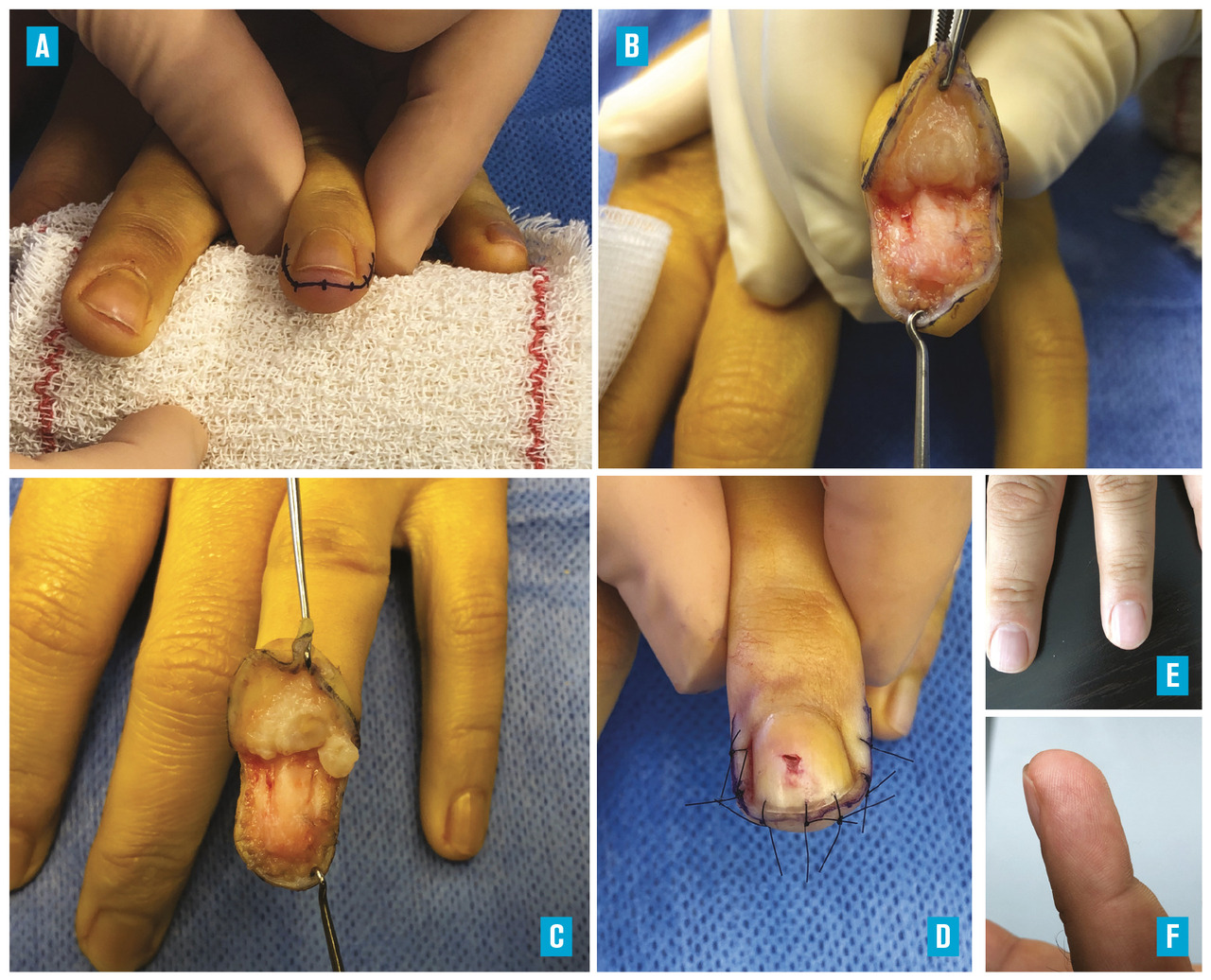
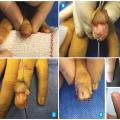
Le repérage préopératoire de la zone gâchette par le patient lui-même, à l’aide d’une pointe de feutre, permet d’optimiser l’extraction de la lésion (
Exposition tumorale indispensable
L’exposition tumorale, déterminée par une voie d’abord maîtrisée par le chirurgien, est le prérequis indispensable à l’excision complète de la tumeur, prévenant les risques de récidive.
La voie d’abord peut être transunguéale ; cette technique présente un risque de dystrophies de la matrice nécessitant une réparation méticuleuse du lit unguéal pour limiter les séquelles fonctionnelles et esthétiques.15, 22-24
Lorsqu’elle est latérale simple ou plus largement hémicirconférentielle sous-périostée en « gueule de requin »,23 la voie d’abord permet d’accéder à toutes les tumeurs digitales autour de la phalange distale, quelle que soit leur localisation (dorsale, distale, proximale et même pulpaire [
La résection tumorale par technique en « gueule de requin » est un geste bref (
Deux cas particuliers
Glomangiomes
La douleur est souvent beaucoup plus lancinante et moins explosive que pour les tumeurs glomiques solitaires. Les récidives et les nouvelles localisations sont fréquentes ; les patients doivent en être avertis. Plusieurs autres techniques ont été développées pour limiter les interventions chirurgicales itératives chez ces patients : laser, sclérothérapie ou radiothérapie ; elles sont toujours en cours d’évaluation.
Tumeurs glomiques malignes
Les glomangiosarcomes sous-unguéaux nécessitent le plus souvent l’amputation du rayon digital concerné. La décision thérapeutique est impérativement prise après concertation pluridisciplinaire en centre spécialisé d’oncologie orthopédique.
Ne pas confondre récidive et nouvelle lésion
Parfois, il existe une localisation métachrone d’une nouvelle lésion, pouvant être confondue avec une récidive. Une nouvelle localisation homodigitale, différente de la résection incomplète, peut être définie par l’association d’une première analyse anatomopathologique garantissant une excision complète, d’un intervalle d’au moins six mois sans symptômes et d’un emplacement différent sur les imageries par résonance magnétique (IRM) comparatives.
1. Wood W. On painful subcutaneous tubercle. Edinb Med Surg J 1812;8:283-91.
2. Bailey OT. The cutaneous glomus and its tumors-glomangiomas. Am J Pathol 1935;11:915-36.
3. Steffen C. The man behind the eponym: C. L. Pierre Masson. Am J Dermatopathol 2003;25:71-6.
4. Ponnelle T, Gouny P, Boudghène F, Le Breton C, Bigot JM, Callard P, Vayssairat M. Glomus tumor of the extremities. J Mal Vasc 1999;24:364-7.
5. Iqbal A, Cormack GC, Scerri G. Hereditary multiple glomangiomas. Br J Plast Surg 1998;51(1):32-7.
6. Al-Qattan MM. Re: a case of 14 glomus tumours involving all digits of both hands. J Hand Surg Eur Vol 2008;33(6):812-3.
7. Glazebrook KN, Most MJ, Schiefer TK, Inwards CY, Sim FH. Multiple glomus tumors of the lower leg. J Ultrasound Med 2010;29(4):667-70.
8. Schiefer TK, Parker WL, Anakwenze OA, Amadio PC, Inwards CY, Spinner RJ. Extradigital glomus tumors: a 20-year experience. Mayo Clin Proc 2006;81(10):1337-44.
9. Takei TR, Nalebuff EA. Extradigital glomus tumour. J Hand Surg Br 1995;20(3):409-12.
10. Tuncali D, Yilmaz AC, Terzioglu A, Aslan G. Multiple occurrences of different histologic types of the glomus tumor. J Hand Surg Am 2005;30:161-4.
11. McDermott EM, Weiss AP. Glomus tumors. J Hand Surg Am 2006;31:1397-400.
12. Fleming AN, Smith PJ. Vascular cell tumors of the hand in children. Hand Clin 2000;16(4):609-24.
13. Theodoropoulos DS. Familial multiple glomus tumours: differential diagnosis and relation to carotid body/glomus jugulare tumours. Br J Plast Surg 1998;51(7):571.
14. Folpe AL, Fanburg–Smith JC, Miettinen M, Weiss S. Atypical and Malignant Glomus Tumors. Am J Surg Pathol 2001;25(1):1-12
15. Van Geertruyden J, Lorea P, Goldschmidt D, de Fontaine S, Schuind F, Kinnen L et al. Glomus tumours of the hand. A retrospective study of 51 cases. J Hand Surg Br 1996;21:257-60.
16. Netscher DT, Aburto J, Koepplinger M. Subungual glomus tumor. J Hand Surg Am 2012, 37:821-3.
17. Love JG. Glomus tumours: diagnosis and treatment. Mayo Clin Proc 1944;19:113-6.
18. Hildreth DH. The ischemia test for glomus tumor: a new diagnostic test. Rev Surg 1970;27(2):147-8.
19. Tsiogka A, Belyayeva H, Sianos S, Rigopoulos D. Transillumination: A diagnostic tool to assess subungual glomus tumors. Skin Appendage Disord 2021;7(3):231-3.
20. Wortsman X, Jemec GB. Role of high-variable fre- quency ultrasound in preoperative diagnosis of glomus tumors: a pilot study. Am J Clin Dermatol 2009;10(1):23-7.
21. Morey VM, Garg B, Kotwal PP. Glomus tumours of the hand: Review of literature. J Clin Orthop Trauma 2016;7:286-91.
23. Asmar G, Mati T, Pop IA, Falcone MO. The ‘shark mouth’ flap approach for digital glomus tumours in 24 patients: technique and clinical outcomes. J Hand Surg Eur Vol 2020;45(2):153-9.
24. Moon SE, Won JH, Kwon OS, Kim JA. Subungual glomus tumor: clinical manifestations and outcome of surgical treatment. J Dermatol 2004;31:993-7.
25. Chou T, Pan SC, Shieh SJ, Shieh SJ, Lee JW, Chiu HY, et al. Glomus tumor: twenty-year experience and literature review. Ann Plast Surg 2016, 76 Suppl :S35-40.
26. Lee IJ, Park DH, Park MC, Pae NS. Subungual glomus tumours of the hand: diagnosis and outcome of the transungual approach. J Hand Surg Eur 2009;34:685-8.
27. Gandon F, Legaillard P, Brueton R, Le Viet D, Foucher G. Forty-eight glomus tumours of the hand. Retrospective study and four-year follow-up. Ann Chir Main Memb Super 1992;11:401-5.