Diagnostiquer une tumeur intracrânienne.
Identifier les situations d'urgence et planifier leur prise en charge.
Définition et épidémiologie
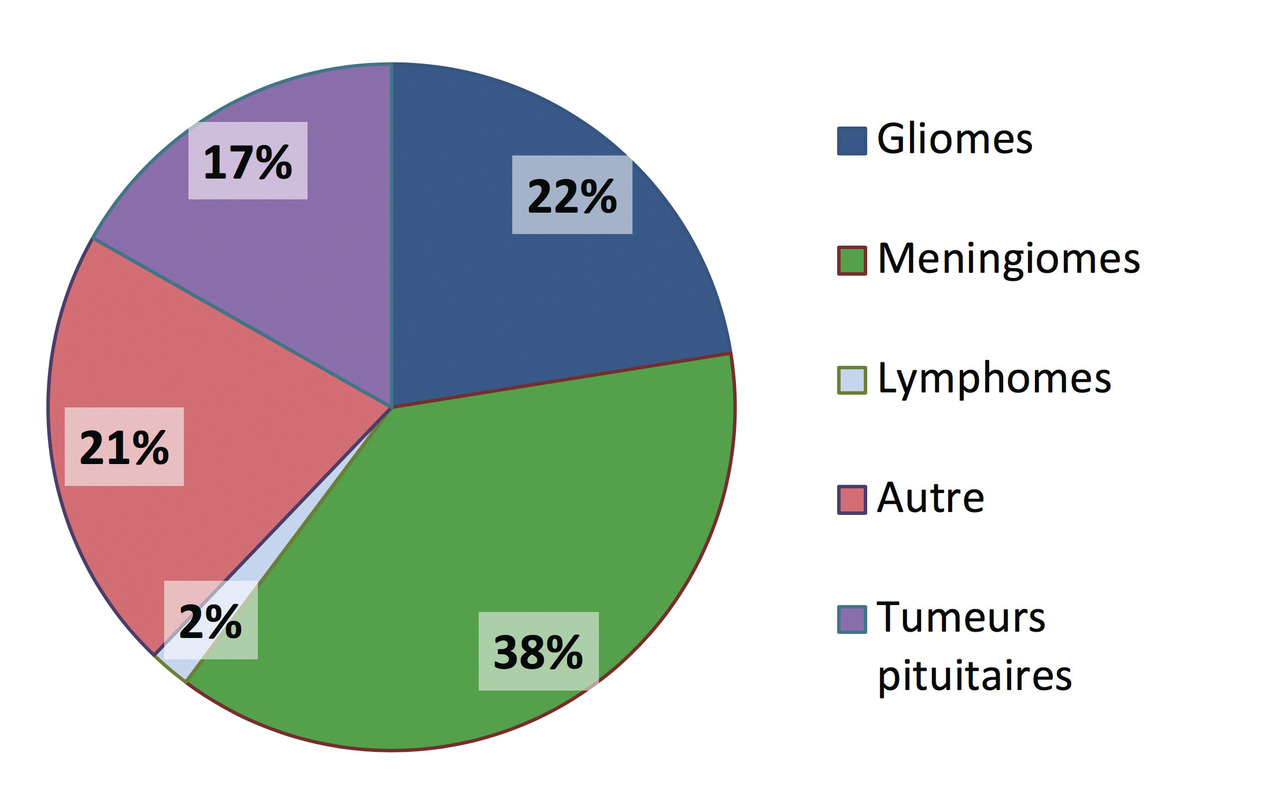
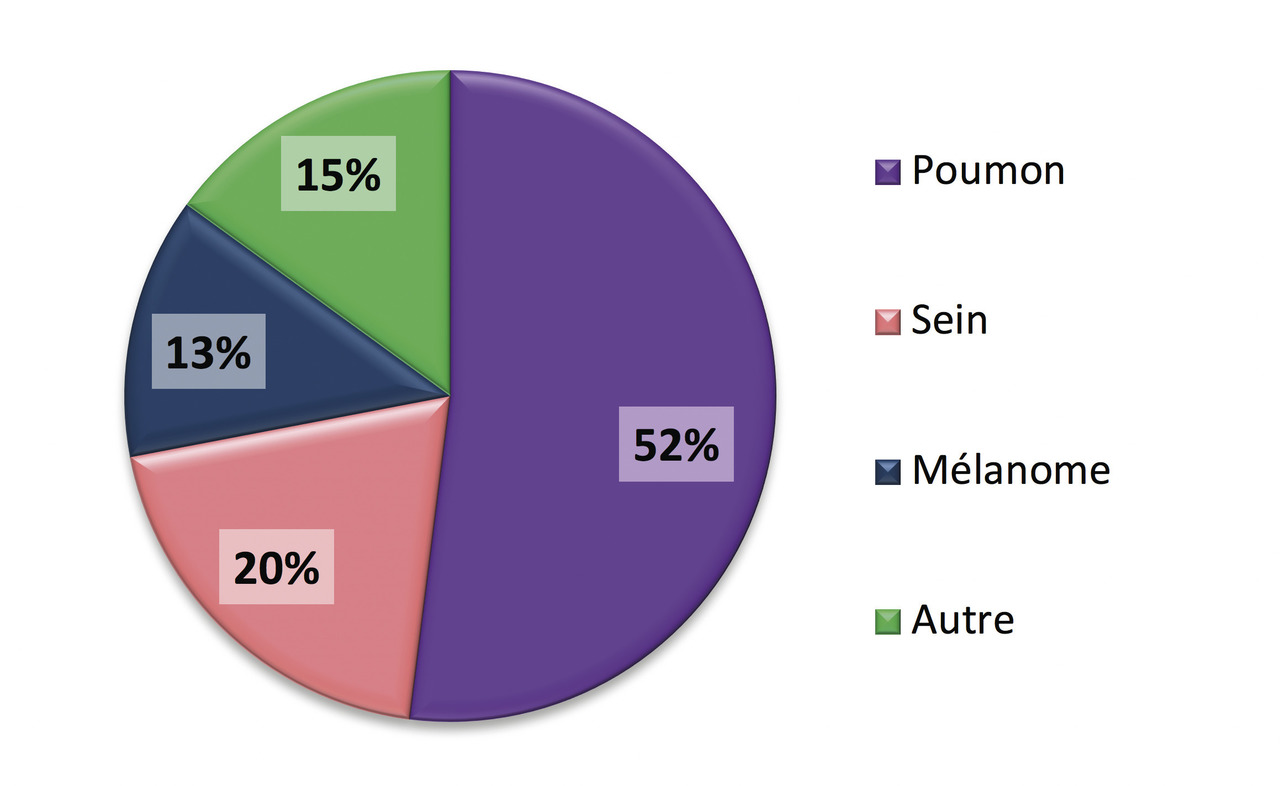
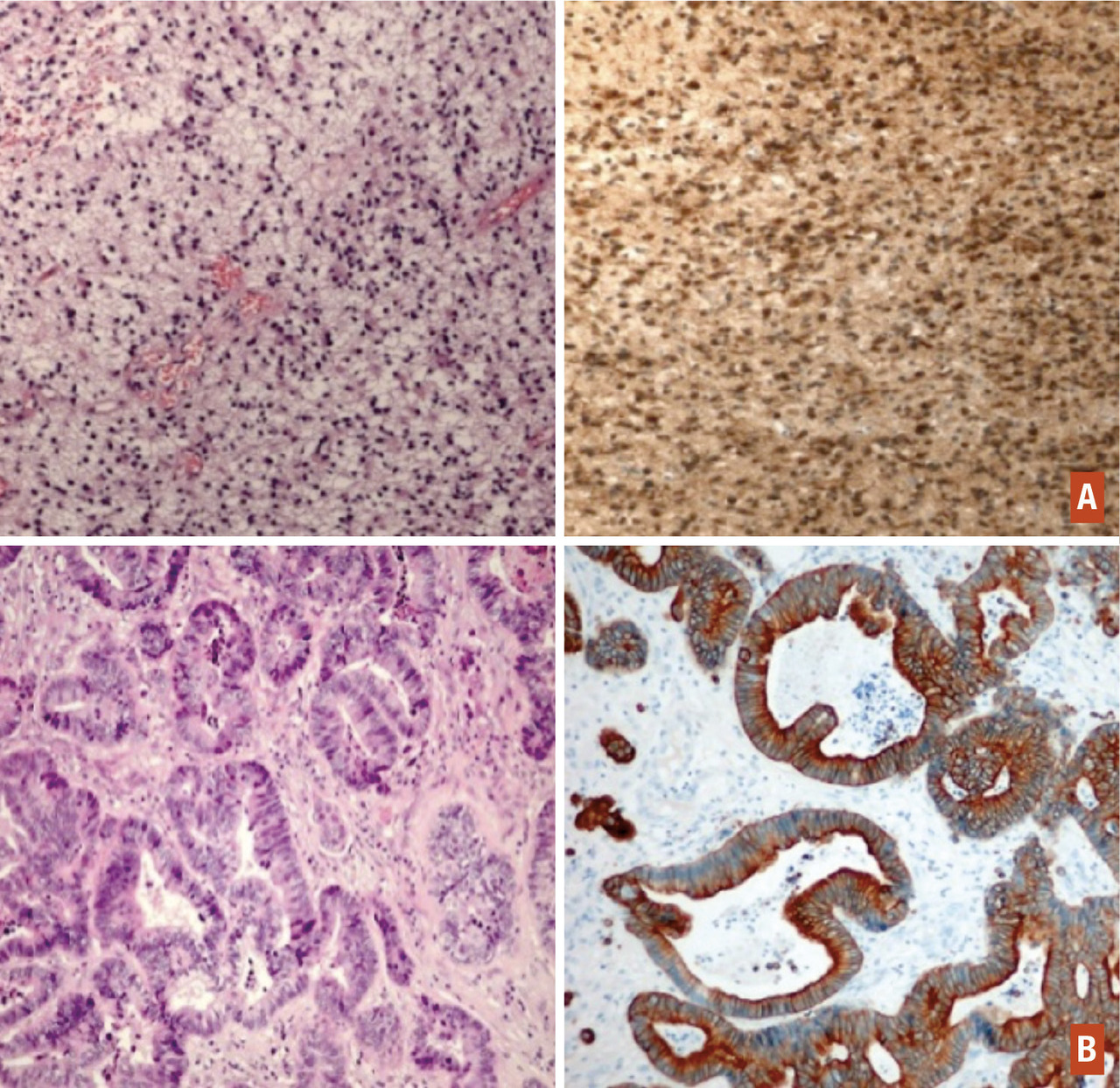
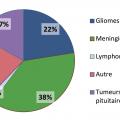
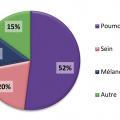
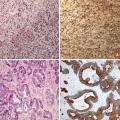
Les tumeurs cérébrales primitives les plus fréquentes sont représentées par les méningiomes, les tumeurs hypophysaires (qui ne seront pas développés dans cet article) et les tumeurs gliales ou gliomes. Les tumeurs gliales sont classées en grade de malignité croissante allant de 1 à 4. Les glioblastomes qui correspondent au grade 4 constituent la majorité des gliomes. Les métastases cérébrales compliquent l’évolution des cancers dans plus de 10 % des cas (20 % dans les séries autopsiques). Les cancers bronchopulmonaires et mammaires sont à eux seuls à l’origine de près de deux tiers des métastases cérébrales (
Diagnostiquer une tumeur cérébrale
Présentation clinique
- une altération des fonctions cognitives et des troubles des comportements ;
- une crise d’épilepsie focale partielle (60 %) ou généralisée d’emblée (40 %). Le risque est plus important pour les tumeurs de localisation corticale et d’évolution lente (tumeurs de bas grade de malignité) ;
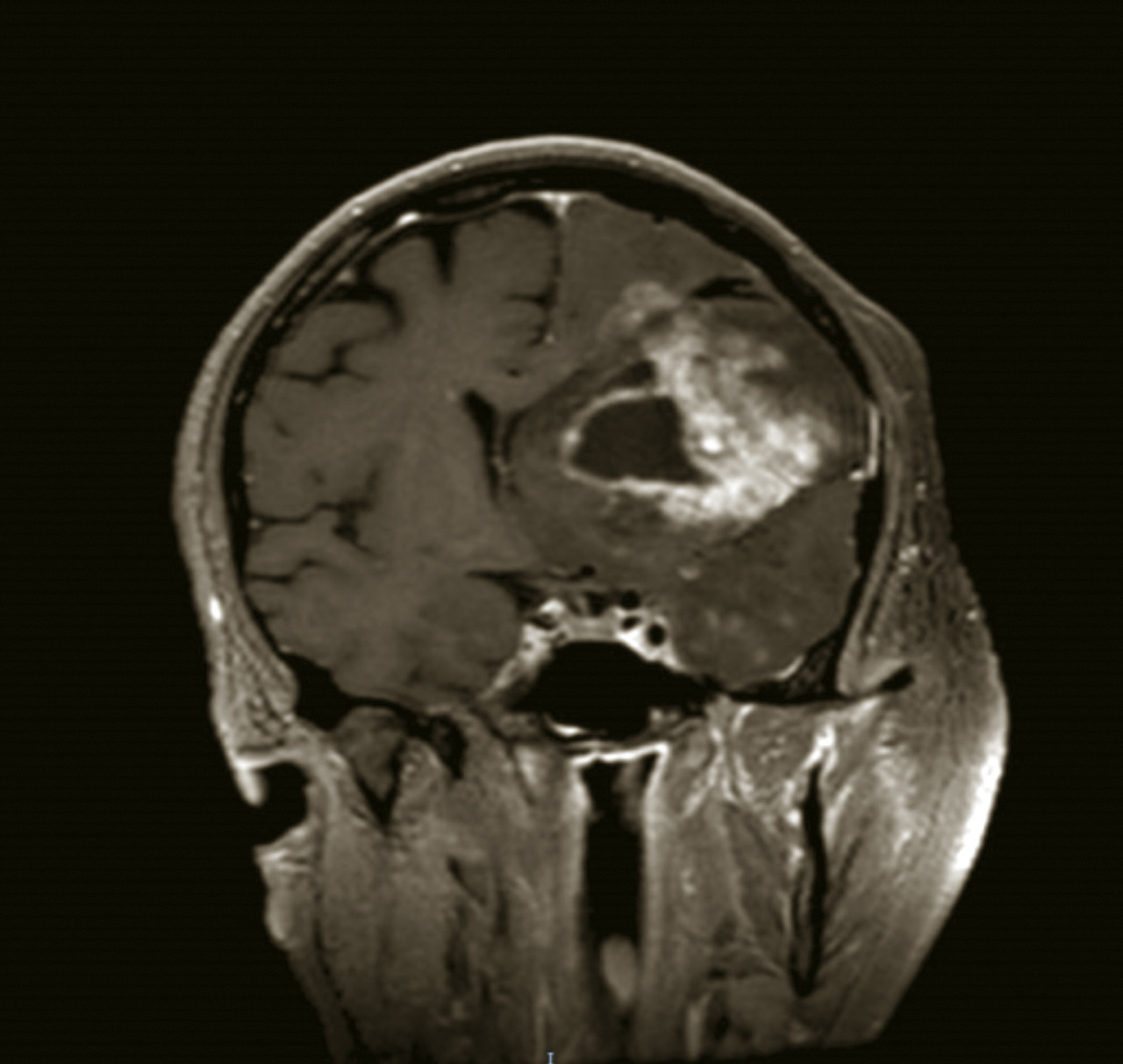
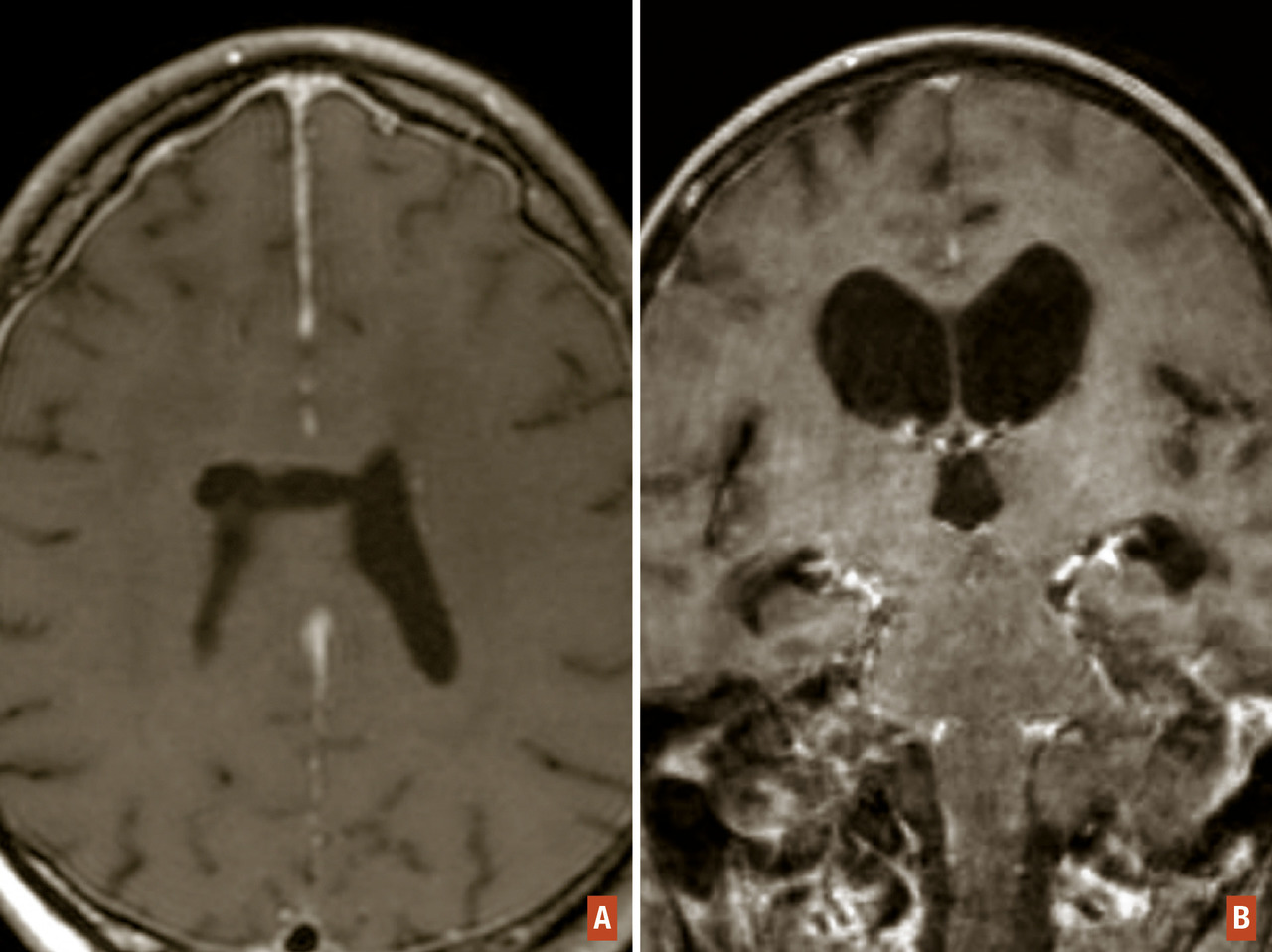
- une hypertension intracrânienne, conséquence soit de l’effet de masse exercé par la tumeur ou de l’œdème qui l’entoure sur les structures cérébrales adjacentes, soit d’une perturbation de la circulation normale du liquide céphalorachidien (LCR) entraînant une hydrocéphalie par obstruction ;
Plus rarement le mode de révélation peut être :
- une atteinte pluriradiculaire et/ou des nerfs crâniens traduisant une dissémination méningée de la tumeur cérébrale ;
- une endocrinopathie par atteinte hypothalamo-hypophysaire ;
- une découverte fortuite ou dans le bilan d’extension d’un cancer connu alors que le patient est asymptomatique.
Examens complémentaires
Imagerie cérébrale
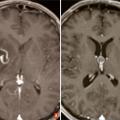
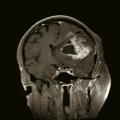
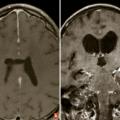
La suspicion d’une tumeur cérébrale doit conduire à une imagerie cérébrale. Le scanner cérébral sans et avec injection de produit de contraste est habituellement réservé en cas de contre-indication à l’imagerie par résonance magnétique (IRM) ou dans certaines situations d’urgence où une IRM ne peut être obtenue rapidement. L’IRM cérébrale représente actuellement l’examen de référence. Elle a plusieurs rôles : localiser le processus, préciser ses caractéristiques, diagnostiquer de possibles complications (engagement, hémorragie, hydrocéphalie…), contribuer à définir la suite de la stratégie diagnostique et thérapeutique. Elle doit être réalisée optimalement dans les trois plans de l’espace et comporter une séquence T1 sans et avec gadolinium, une séquence T2 et/ou FLAIR. L’IRM multimodale (Étude du LCR
Une ponction lombaire peut être réalisée après une imagerie cérébrale permettant de vérifier l’absence de contre-indication (lésion volumineuse avec risque d’engagement, hydrocéphalie non communicante). L’étude du LCR à titre diagnostique n’est pas systématique et est habituellement préconisée pour éliminer des diagnostics différentiels (lésions inflammatoires ou infectieuses pseudo-tumorales). Elle peut être indiquée en cas de suspicion de méningite tumorale associée devant une symptomatologie évocatrice, ou quand la nature de la tumeur est à fort risque de dissémination leptoméningée (médulloblastome, épendymomes, germinomes, lymphomes…). L’examen cytologique peut être complété par un immunomarquage spécifique de certaines tumeurs (immunocytochimie), le dosage de marqueurs tumoraux spécifiques (par exemple bêta-hCG, alphafœtoprotéine, antigène carcino-embryonnaire (ACE) dans les tumeurs germinales), une recherche de clonalité de la population cellulaire en cas de méningite lymphocytaire suspecte d’être d’origine lymphomateuse (immunophénotypage, analyse du réarrangement des gènes des immunoglobulines par PCR).Diagnostic différentiel
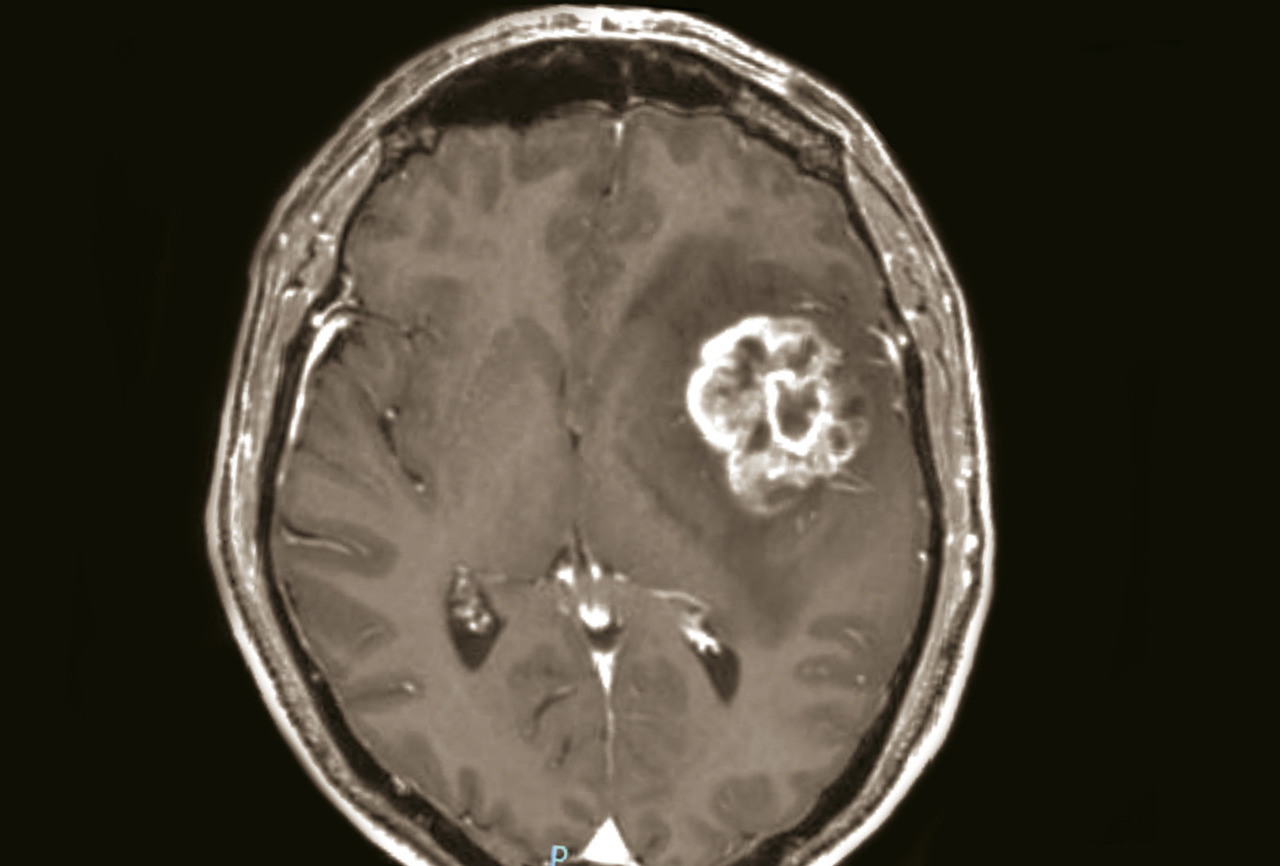
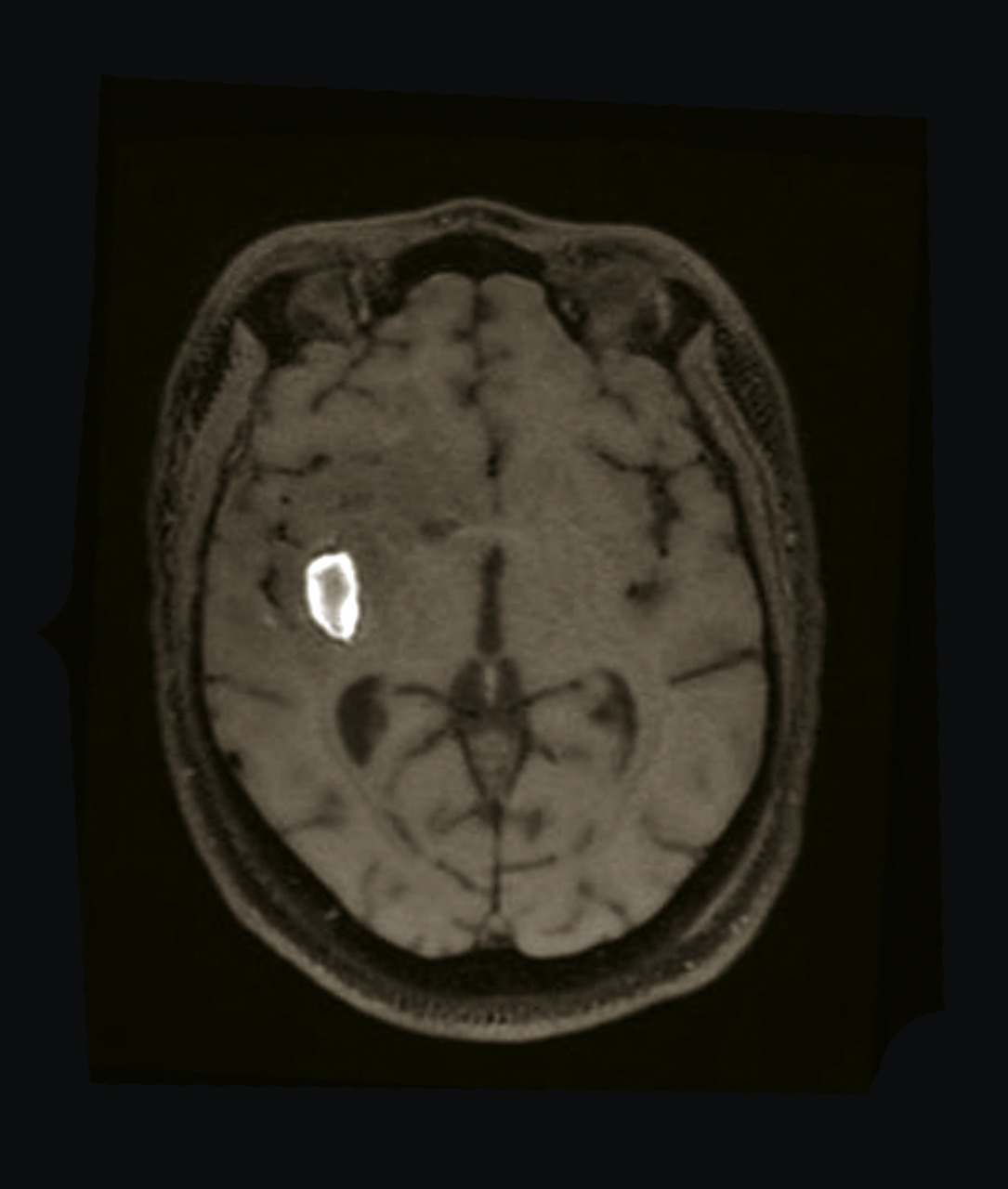
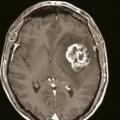
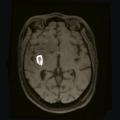
- un abcès cérébral (
fig. 4 ) en présence d’un syndrome fébrile, d’un foyer infectieux, en particulier quand la prise de contraste est annulaire, un tuberculome en cas de contage ou terrain à risque ;
- une lésion parasitaire (cysticercose en région endémique, toxoplasmose en cas d’immunodépression) ;
- une forme pseudo-tumorale d’une pathologie inflammatoire du système nerveux central (sclérose en plaques, sarcoïdose, maladie de Behçet…).
Diagnostic de certitude
Un geste chirurgical à visée diagnostique peut parfois être évité dans des circonstances bien particulières :
- quand l’aspect radiologique est suffisamment caractéristique de certaines tumeurs bénignes en particulier les méningiomes, les adénomes hypophysaires ;
- en cas de lésions cérébrales multiples évoquant des métastases cérébrales chez un patient souffrant d’un cancer connu, disséminé et en l’absence de tout syndrome infectieux ou autre contexte et antécédent susceptibles de faire évoquer un diagnostic différentiel ;
- quand un diagnostic cytologique est obtenu par l’analyse du LCR (méningite carcinomateuse, lymphome) ou une biopsie du vitré (lymphome).
Cas particulier d’une suspicion de métastase cérébrale
Avec cancer connu
Dans la majorité des cas, le cancer est connu et une confirmation histologique n’est pas nécessaire quand il existe un contexte de maladie évolutive et/ou disséminée associé à un aspect radiologique évocateur. Il faudra cependant se méfier en présence d’un syndrome infectieux ou quand le cancer est considéré comme étant en rémission depuis plusieurs années, en particulier en cas de lésion unique.Sans cancer connu
En cas de métastase cérébrale révélatrice (10 %-20 %), un bilan systémique doit être rapidement réalisé. Il doit comporter un examen clinique attentif (cutané, ganglionnaire, mammaire…), un scanner thoraco-abdomino-pelvien. La tomographie par émission de positons au fluorodésoxyglucose (TEP-FDG) est un outil intéressant, déjà utilisé en routine par de nombreuses équipes. L’indication d’une fibroscopie digestive et d’une mammographie systématique reste plus discutée en l’absence de signes d’appel. La découverte d’une lésion primitive suspecte doit amener à un contrôle histologique, ce qui peut permettre d’éviter la biopsie cérébrale. Celle-ci reste en revanche nécessaire si le bilan d’extension est négatif ou douteux. Malgré un bilan approfondi, la tumeur primitive demeure inconnue dans près de 20 % des cas.Identifier les urgences et planifier leur prise en charge
Hypertension intracrânienne
Diagnostic
Le diagnostic d’hypertension intracrânienne est clinique. Le signe clinique le plus fréquent est représenté par des céphalées. Leur séméiologie peut avoir un caractère assez variable : diffuses, en hémicrânie dans les tumeurs hémisphériques, ou de la région occipitale dans les tumeurs de la fosse postérieure. Parfois, elles peuvent revêtir un caractère pseudo-migraineux, et s’accompagner de vomissements classiquement « en jet ». La présence d’un œdème papillaire est inconstante, en particulier chez le sujet âgé. Il ne s’accompagne pas d’une baisse d’acuité visuelle, ce qui le différencie de celui accompagnant une papillite inflammatoire. Cependant, si la stase papillaire est importante et se prolonge, elle peut donner lieu à des épisodes d’éclipse visuelle pouvant précéder une cécité liée à une atrophie optique. On peut observer aussi une paralysie du VI se manifestant par une diplopie mais qui n’a pas de valeur localisatrice de la lésion. L’hypertension intracrânienne peut être révélatrice de la tumeur ou survenir dans l’évolution d’une tumeur cérébrale déjà connue. L’imagerie (scanner ou IRM cérébrale) permet d’en déterminer la ou les causes (développement tumoral, œdème péritumoral ou autres complications suscitées) et d’en évaluer l’importance par l’effet de masse exercé sur les structures anatomiques du cerveau et d’anticiper les conséquences menaçantes (Traitement
Traitement non spécifique
Traitement anti-œdémateux
Traitement de la tumeur
État de mal épileptique
Diagnostic
L’EME TCG est un diagnostic habituellement facile à poser cliniquement. Le diagnostic d’état de mal épileptique non convulsivant se traduisant par exemple par un syndrome confusionnel, des hallucinations, un déficit focal prolongé et fluctuant (aphasie) peut être en revanche moins aisé, et en l’absence de cause évidente au vu de l’évolution tumorale, un électroencéphalogramme (EEG) est indiqué. En cas de suspicion clinique forte, il est aussi possible de faire un test diagnostique par injection d’une benzodiazépine sous enregistrement EEG à la recherche d’une amélioration. Comme instrument diagnostique, l’EEG est essentiel pour poser le diagnostic dans les situations moins évidentes : patient en coma, patient curarisé. Il sert aussi pour guider le traitement. Il est toutefois important de ne pas retarder la prise en charge thérapeutique si un EEG n’est pas immédiatement disponible. Même si le patient est connu pour être porteur d’une tumeur cérébrale, il faudra chercher les facteurs favorisants associés généraux (fièvre, modification du traitement antiépileptique, trouble métabolique…) ou une complication liée à l’évolution tumorale. Il faut pratiquer en urgence un bilan biologique adapté au contexte clinique (à la recherche d’une cause métabolique, ionique, infectieuse, toxique associée) et une imagerie cérébrale (à la recherche d’un hématome intratumoral, d’une thrombophlébite cérébrale, d’une dissémination méningée, d’une augmentation de l’œdème et de l’effet de masse). Une ponction lombaire doit être discutée si le bilan étiologique de l’état de mal épileptique reste négatif après avoir réalisé une imagerie cérébrale, en particulier si le patient est immunodéprimé, s’il est fébrile sans autre point d’appel évident afin d’écarter une méningoencéphalite infectieuse ou une dissémination méningée de la tumeur.Traitement
Le traitement de l’état de mal tumoral ne se distingue pas de celui d’autres contextes cliniques.Mesures générales non spécifiques et traitement des facteurs favorisants
Traitement antiépileptique
- les crises convulsives doivent être contrôlées le plus rapidement possible dans les 30 premières minutes ;
- les médicaments doivent être administrés par voie veineuse et à doses suffisantes après un contrôle de la glycémie et une perfusion intraveineuse de sérum glucosé précédés de vitamine B1 au moindre doute de carence ;
- le traitement de première intention comprend l’injection combinée d’une benzodiazépine et de fosphénytoïne.
Autres complications
Méningite tumorale
Diagnostic
Traitement
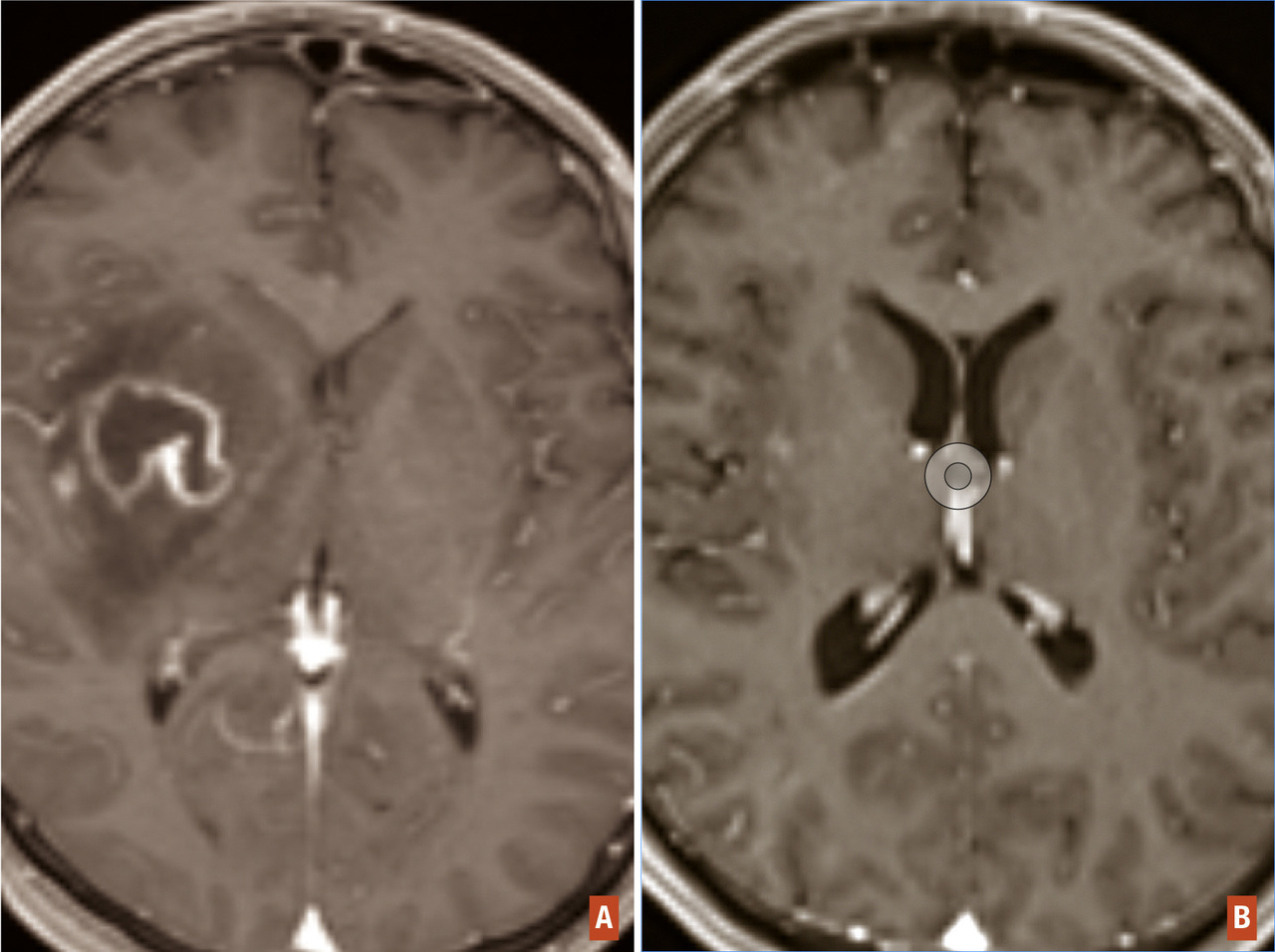
Hémorragie intratumorale
Diagnostic
Traitement
Syndrome confusionnel
Il peut s’intégrer dans l’évolution clinique d’une tumeur évolutive ou une de ses complications (voir plus haut : état de mal épileptique partiel, méningite tumorale…) mais aussi être secondaire à une cause systémique. Après avoir écarté une cause liée directement à la tumeur (IRM cérébrale, EEG, ponction lombaire, IRM médullaire), il faudra ainsi s’attacher à rechercher une étiologie générale, en particulier chez les patients les plus fragiles et ayant déjà des troubles cognitifs, par exemple une origine infectieuse, une cause métabolique (déshydratation), une hypoxémie (embolie pulmonaire, pneumocystose en cas d’immunodépression chimio-induite…), une cause iatrogénique (chimiothérapie, radiothérapie, antiépileptiques, psychotropes, antalgiques, hypnotiques, antihistaminiques…).Urgences générales en neuro-oncologie
Thromboembolisme veineux
Les patients porteurs d’une tumeur cérébrale gliale ont un risque accru de développer des phlébites éventuellement compliquées d’embolies pulmonaires, cela indépendamment du handicap moteur. Jusqu’à 20 % des patients avec un gliome de haut grade vont développer un accident thromboembolique veineux au cours de la maladie et cela dès la période périopératoire lié à la production par la tumeur de substances procoagulantes. Ils peuvent de surcroît être favorisés par certains traitements comme les thérapies anti-angiogéniques (bévacizumab). La présence d’une tumeur cérébrale ne contre-indique pas l’anticoagulation à dose efficace qui devra se poursuivre pour une durée de 6 mois. Le filtre pour la veine cave inférieure reste une alternative pour les patients ayant une contre-indication à l’anticoagulation. Le risque de récidive est important.Une thrombophlébite cérébrale intéressant une ou plusieurs veines cérébrales est beaucoup plus rare. Elle concerne habituellement les sinus duraux intracrâniens, plus rarement le réseau veineux profond. Elle peut se révéler par un tableau d’hypertension intracrânienne isolé (thrombose du sinus latéral ou du sinus longitudinal supérieur) ou se résumer à des céphalées persistantes, une crise d’épilepsie, des troubles de la vigilance (thrombophlébite profonde) ou être de découverte purement radiologique. Le diagnostic est confirmé optimalement par une angio-IRM qui visualise le thrombus et les conséquences sur le parenchyme cérébral (infarctus veineux souvent œdémateux et hémorragique).
En contexte neuro-oncologique, la thrombophlébite cérébrale est toujours favorisée par la présence d’un méningiome en regard d’un sinus et les traitements anti-angiogéniques comme le bévacizumab. Le traitement comprend anticoagulation par héparine à posologie efficace et traitement par antiépileptique (AED).
Effets indésirables du traitement oncologique
Effets indésirables des chimiothérapies
Certaines chimiothérapies sont susceptibles d’entraîner des complications neurologiques très diverses dont certaines, en raison de leur caractère aigu et invalidant, constituent des urgences et doivent conduire à une suspension voire un arrêt définitif du traitement et une prise en charge spécifique. Parmi les chimiothérapies utilisées en neuro-oncologie susceptibles d’entraîner des encéphalopathies aiguës, on peut citer le méthotrexate administré à haute dose par voie intraveineuse ou les injections par voie intrathécale, ainsi que l’ifosfamide. Il faut aussi signaler que certaines chimiothérapies figurent parmi les causes du rare syndrome d’encéphalopathie postérieure réversible (« PRES syndrome ») qui est une entité clinicoradiologique se manifestant par des céphalées, une hypertension intracrânienne, des troubles du champ visuel, des crises comitiales. Surtout l’IRM cérébrale est évocatrice quand elle montre des lésions diffuses corticales et sous-corticales possiblement symétriques pouvant prédominer dans les régions postérieures et correspondant en IRM de diffusion à un œdème vasogénique, et imposant l’arrêt du traitement.Effets indésirables de la radiothérapie
Elle peut entraîner des effets secondaires précoces, comme l’œdème radique par rupture transitoire de la barrière hématocérébrale majorant l’hypertension intracrânienne et qui peut être prévenu par une corticothérapie durant la radiothérapie ou être traité par l’introduction ou majoration des corticoïdes. La radiothérapie peut aussi entraîner des effets secondaires retardés, plusieurs mois voire plusieurs années après la fin de la radiothérapie, telle la radionécrose qui se présente et se développe comme un processus expansif mimant une récidive ou une progression tumorale. L’IRM de perfusion et la spectroscopie ainsi que la tomographie par émission de positons (TEP-scan) peuvent aider au diagnostic différentiel. Le traitement repose sur les corticoïdes. Cependant, ils peuvent se révéler inefficaces ou le patient devenir corticodépendant, et il faut parfois requérir une résection chirurgicale ou la prescription d’anti-angiogéniques.On peut aussi citer, dans les complications tardives, le rare syndrome SMART (stroke like migraine attack after radiation therapy) qui peut se présenter avec des céphalées, des crises d’épilepsie, une hémianopsie latérale homonyme, un déficit focal régressif après plusieurs heures mais parfois après quelques semaines. L’IRM retrouve un rehaussement cortical gyral diffus après injection qui est transitoire et cette complication doit être distinguée d’un accident vasculaire ou d’un « PRES syndrome ». Le traitement comprend une corticothérapie, un traitement antiagrégant plaquettaire, un traitement antiépileptique, et un bêtabloquant ou du vérapamil.
Effets indésirables des nouvelles thérapies
Les immunothérapies et les biothérapies ciblées occupent une place croissante en cancérologie. Les immunothérapies les plus utilisées sont actuellement les inhibiteurs de point de contrôle immunitaires, en particulier les anti-PD 1 comme le nivolumab et le pembrolizumab. Ils peuvent entraîner des complications neurologiques auto-immunes très variées touchant tout le système nerveux, allant du syndrome de Guillain-Barré à des tableaux d’encéphalites aiguës ou subaiguës. Heureusement, ces complications restent peu fréquentes et dans la majorité des cas régressent habituellement avec l’arrêt du traitement et l’introduction des corticoïdes. La thérapie ciblée la plus fréquemment utilisée en neuro-oncologie est actuellement le bévacizumab (anticorps monoclonal anti-VEGF) ayant une action anti-angiogénique et prescrit dans les gliomes malins. Le traitement peut se compliquer d’un saignement intratumoral dans moins de 5 % des cas et plus rarement être responsable d’un PRES syndrome ou d’une thrombophlébite cérébrale.POINTS FORTS À RETENIR
L’IRM cérébrale est l’examen diagnostique de choix.
Le diagnostic de certitude repose sur une confirmation histologique par une biopsie ou une exérèse de la lésion.
Dans certaines circonstances, une confirmation histologique n’est pas requise (un méningiome d’aspect typique, des métastases cérébrales typiques dans un contexte de cancer primitif connu disséminé).
Les tumeurs cérébrales peuvent présenter de nombreuses complications neurologiques urgentes qu’il faut savoir rechercher en cas d’aggravation clinique (un engagement cérébral, une hydrocéphalie obstructive, une hémorragie intratumorale, une méningite tumorale, un état de mal épileptique partiel, une complication des traitements comme une radionécrose).
Tumeurs intracrâniennes
Il s’agit d’une thématique qui se prête volontiers à un dossier clinique transversal. Il faut connaître la présentation clinique et radiologique des principales tumeurs cérébrales (gliome, méningiome, métastase cérébrale) pour évoquer le diagnostic. Il faut bien comprendre la démarche diagnostique devant un processus expansif intracérébral et les principaux diagnostics différentiels avant de porter le diagnostic de tumeur cérébrale qui passe en théorie par une confirmation histologique en dehors de certaines circonstances particulières évoquées dans l’article. Il faut savoir ce que l’on peut attendre des examens complémentaires, de leur contribution (spécificité) et de leurs limites. Il faut aussi connaître l’histoire naturelle d’une tumeur cérébrale et les complications neurologiques qui peuvent entacher l’évolution de la maladie. Savoir les diagnostiquer et connaître les principes du traitement, en particulier l’hypertension intracrânienne, l’épilepsie ou l’état de mal épileptique, les méningites tumorales.
DeAngelis LM, Posner JB. Neurologic complications of cancer. 2nd ed, Oxford University Press, 2008.
Mohile N. Medical complications of brain tumors. In Continuum: Lifelong Learning in Neurology-Neuro-Oncology, 2nd ed., 2017;23‑6:1635‑52.
Phillips K. Neurologic and medical management of brain tumors . In Neuro-Oncology, an issue of Neuro-logic Clinics, 1st ed., 2018;36‑3:449‑66. Neurologic Clinics - Elsevier. Eudocia Quant Lee.
Société de réanimation de langue française et Société française de médecine d’urgence. Prise en charge des états de mal épileptiques en préhospitalier, en structure d’urgence et en réanimation dans les 48 premières heures - RFE États de mal épileptiques 2018. Recommandations formalisées d’experts. SRLF/SFMU/GFRUP 1, 2018.

 Encadrés
Encadrés