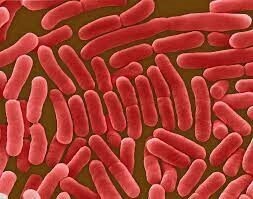
La typhoïde, dont le nom vient du grec tuphos, qui signifie « fumée, vapeur qui monte au cerveau », a été décrite en 1818 par Pierre Bretonneau. Elle est due à une bactérie du genre Salmonella enterica sérotype typhi, ou bacille d’Eberth, découverte en 1880. Il s’agit d’une entérobactérie à Gram négatif, non sporulée, mobile grâce à un flagelle, anaérobie facultative, de dimensions 0,7 - 1,5 µm × 2 - 5 µm (fig. 1). Les paratyphoïdes sont dues aux Salmonella paratyphi A et B, exceptionnellement C.
Selon l’Organisation mondiale de la santé (OMS), il y avait, en 2016, 10 à 20 millions de personnes atteintes dans le monde, dont 150 000 sont décédées.1
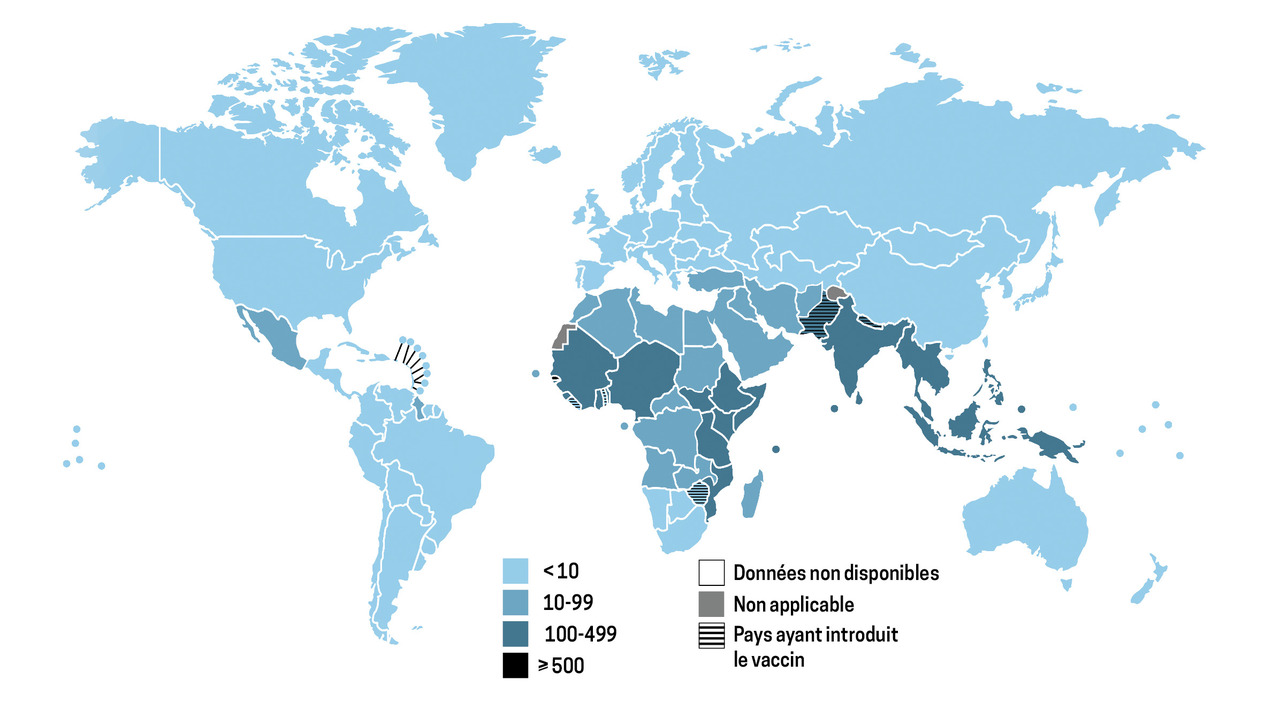
Avec l’amélioration des conditions d’hygiène, la typhoïde, autrefois cosmopolite, est désormais surtout présente dans les pays tropicaux, où sa prévalence peut atteindre 725 cas pour 100 000 habitants, contre moins de 10 pour 100 000 habitants en Europe (fig. 2). En effet, parmi les cas de typhoïde, 51 % ont été recensés en Asie, 15 % en Afrique et 14 % en Océanie.2 En France, 89 % des cas sont importés, principalement d’Inde et d’Asie du Sud-Est. Par ailleurs, des épidémies de paratyphoïde dues à S. paratyphi peuvent aussi survenir.3
L’homme se contamine par l’ingestion d’aliments souillés (eau, coquillages, crudités, viande mal cuite) et par contact avec du linge souillé ou les mains sales. La typhoïde est une affection strictement d’origine humaine ; les bactéries sont présentes dans les selles des sujets infectés, qu’ils soient symptomatiques ou non. L’ingestion de 105 à 109 bactéries provoque une infection chez 25 à 95 % des sujets.
Poser le diagnostic
Après ingestion, les bactéries envahissent les entérocytes. Elles sont englobées sans être détruites par les macrophages qui les diffusent dans le système lymphatique puis, par le canal thoracique, dans la circulation générale. L’immunité cellulaire intervient en provoquant la lyse de ces bactéries, ce qui libère une endotoxine responsable des atteintes viscérales. L’hypochlorhydrie gastrique est un facteur aggravant.
Signes évocateurs
Dans les jours qui suivent la contamination (entre 1 et 3 semaines), une fièvre apparaît et augmente progressivement, pour atteindre 40 °C, mais la fréquence cardiaque reste normale. La dissociation pouls-température est assez caractéristique de cette affection.
En outre, le patient peut se plaindre de céphalées, d’épistaxis, d’anorexie, de diarrhée avec parfois un méléna, d’insomnie et d’une asthénie inhabituelle.
L’examen clinique met en évidence une langue saburrale, un météorisme abdominal, une fosse iliaque droite gargouillante, une splénomégalie, parfois des taches rosées sur le corps – pas toujours faciles à distinguer sur une peau foncée –, mais surtout une prostration importante (d’où le nom de « tuphos »), voire un état délirant.
Ces symptômes peuvent durer une dizaine de jours et évoluer vers diverses complications (perforations et hémorragies intestinales, péritonite, insuffisance cardiaque). Le décès survient dans 10 % des cas en l’absence de traitement, mais dans moins de 1 % chez les sujets traités.4
PCR, une technique fiable
Le diagnostic est établi sur la mise en évidence, surtout pendant la première semaine de la maladie, du germe dans l’hémoculture (ou dans la moelle osseuse), la coproculture ou éventuellement les urines. Le bilan sanguin standard (leucopénie, thrombopénie, légère augmentation des transaminases ALAT) n’est pas très informatif. Le sérodiagnostic de Widal et Félix, qui ne permettait pas de distinguer une affection en cours d’une affection ancienne, est tombé en désuétude. La technique de la PCR est plus fiable (tableau 1) mais non réalisable dans tous les laboratoires.5 Par ailleurs, la PCR peut rester positive durant une quinzaine de jours (tableau 2).
Adapter le traitement à l’antibiogramme
Le traitement de la typhoïde a longtemps reposé sur le chloramphénicol. Néanmoins, la mauvaise tolérance et les phénomènes de résistance ont fait abandonner ce produit. Dans les années 1980, la résistance à d’autres antibiotiques (cotrimoxazole, amoxicilline) est apparue, occasionnant l’utilisation de quinolones de deuxième génération ou de ceftriaxone. Mais, là encore, des phénomènes de résistance ont été constatés dans certains pays (Inde), justifiant l’emploi d’autres antibiotiques (azithromycine), d’où la nécessité d’effectuer un antibiogramme (tableau 3).
L’adjonction d’antipyrétiques est utile ainsi qu’une réhydratation et éventuellement une corticothérapie en cas de complications viscérales. Une intervention chirurgicale peut être nécessaire en cas de perforation intestinale.6 En outre, le patient doit être isolé, et cette maladie est à déclaration obligatoire.
Prévention : hygiène, dépistage et vaccination
Gare à l’eau souillée et aux crudités !
La prévention repose essentiellement sur le lavage des mains et le respect de l’hygiène alimentaire dans les pays d’endémie : il faut préférer l’eau traitée ou bouillie et les aliments bien cuits.
Dépister l’entourage
Les personnes proches d’un patient atteint de typhoïde doivent bénéficier de coprocultures pour dépister et traiter les porteurs asymptomatiques. En effet, 2 à 5 % des malades traités et guéris continuent à héberger des bacilles dans leurs voies biliaires et donc à les éliminer dans les selles pendant plusieurs mois, justifiant une prolongation du traitement, voire une cholécystectomie en cas de lithiase biliaire. La lithiase biliaire et l’infestation par les schistosomes sont, de fait, des facteurs favorisant le portage chronique des salmonelles. Les schistosomes captent les bactéries, ce qui les rend inaccessibles aux antibiotiques et cela prolonge l’infection.7
Le cas le plus célèbre de porteur asymptomatique de Salmonella typhi est celui d’une jeune Irlandaise, Mary Mallon (1869 - 1938), émigrée aux États-Unis et employée comme cuisinière. Elle a contaminé involontairement des centaines de gens (dont certains sont décédés) avant qu’une enquête épidémiologique ne remonte jusqu’à la source des contaminations. Surnommée alors « Typhoid Mary », elle a été placée en quarantaine. Puis elle a récidivé en changeant de nom, mais a été démasquée et placée à nouveau en quarantaine durant vingt-six ans, jusqu’à sa mort.8
Se vacciner pour voyager en zones à risque
Outre le respect des mesures d’hygiène, la vaccination s’impose pour les personnes se rendant dans les zones endémiques.
La vaccination contre la typhoïde débute en 1888 avec Fernand Widal et André Chantemesse. En 1914, la vaccination TAB (typhoïde et paratyphoïdes A et B) devient obligatoire, puis un vaccin combiné contre la diphtérie et le tétanos (vaccin DTTAB) apparaît. Mais la mauvaise tolérance de ce dernier fait suspendre son utilisation. Actuellement, c’est le vaccin inactivé polyosidique non conjugué (Typhim Vi) qui est disponible et administrable dès l’âge de 2 ans ; il est valable trois ans.9 Il protège à 70 % contre Salmonella typhi mais pas contre les paratyphoïdes.10 Ce vaccin est obligatoire pour le personnel des laboratoires de biologie médicale (article L3111 - 4 du code de la santé publique) et fortement conseillé pour les personnes voyageant en zones tropicales. En outre, il existe un vaccin combiné typhoïde-hépatite A (Tyavax), administrable à partir de l’âge de 16 ans. Enfin, il existe un vaccin vivant atténué par voie orale (Vivotif), en gélule gastrorésistante, non disponible en France.11
2. Kim S, Lee KS, Pak GD, et al. Spatial and temporal patterns of typhoid and paratyphoid fever outbreaks: A worldwide review, 1990-2018. Clin Infect Dis 2019;69(Suppl. 6):S499-509.
3. Tourdjman M, Le Hello S, Gossner C, et al. Unusual increase in reported cases of paratyphoid A fever among travellers returning from Cambodia, January to Septembre 2013. Euro Surveillance 2013;18(39):20594.
4. Marchello CS, Birkhold M, Crump JA. Complications and mortality of typhoid fever: A global systematic review and meta-analysis. J Infect 2020;81(6):902-10.
5. Khan S, Harish BN, Menezes GA. Early diagnosis of typhoid fever by nested PCR for flagellin gene of Salmonella enterica serotype Typhi. Indian J Med Res 2012;136(5):850-4.
6. Olgemoeller F, Waluza JJ, Zeka D, et al. Intestinal perforations associated with a high mortality and frequent complications during an epidemic of multidrug-resistant typhoid fever in Blantyre, Malawi. Clin Infect Dis 2020;71(Suppl 2):S96-101.
7. Hsiao A, Toy T, Seo HJ, et al. Interaction between Salmonella and Schistosomiasis: A Review. PLoS Pathog 2016;12(12): e1005928.
8. Marineli F, Tsoucalas G, Karamanou M, et al. Mary Mallon (1869-1938) and the history of typhoid fever. Ann Gastroenterol 2013;26(2):132-4.
9. Milligan R, Paul M, Richardson M, et al. Vaccines for preventing typhoid fever. Cochrane Database Syst Rev 2018;2018(5):CD001261.
10. Manesh A, Meltzer E, Jin C, et al. Typhoid and paratyphoid fever: a clinical seminar. J Travel Med 2021;28:taab012.
11. Hancuh M, Walldorf J, Minta AA, et al. Typhoid Fever Surveillance, Incidence Estimates, and Progress Toward Typhoid Conjugate Vaccine Introduction — Worldwide, 2018–2022. MMWR Morb Mortal Wkly Rep 2023;72:171–176.