Diagnostiquer un ulcère gastrique, un ulcère duodénal, une gastrite.
Identifier les situations d'urgence et planifier leur prise en charge.
Argumenter l'attitude thérapeutique et planifier le suivi du patient.
Identifier les situations d'urgence et planifier leur prise en charge.
Argumenter l'attitude thérapeutique et planifier le suivi du patient.
Ulcère gastroduodénal
Définitions
L’ulcère est défini histologiquement comme une perte de substance de la paroi gastrique ou duodénale atteignant la musculeuse de la paroi du tube digestif. Il s’agit donc d’une destruction de la muqueuse et de la sous-muqueuse. Il peut être aigu, mettant à nu le muscle sans socle scléreux, ou chronique, avec généralement une réaction fibreuse cicatricielle majeure et des lésions d’endartérite et d’hyperplasies nerveuses. Il ne doit pas être confondu avec l’érosion, qui correspond à une lésion plus superficielle n’abrasant que la muqueuse, et l’ulcération, qui met à nu la sous-muqueuse sans la dépasser.
Physiopathologie
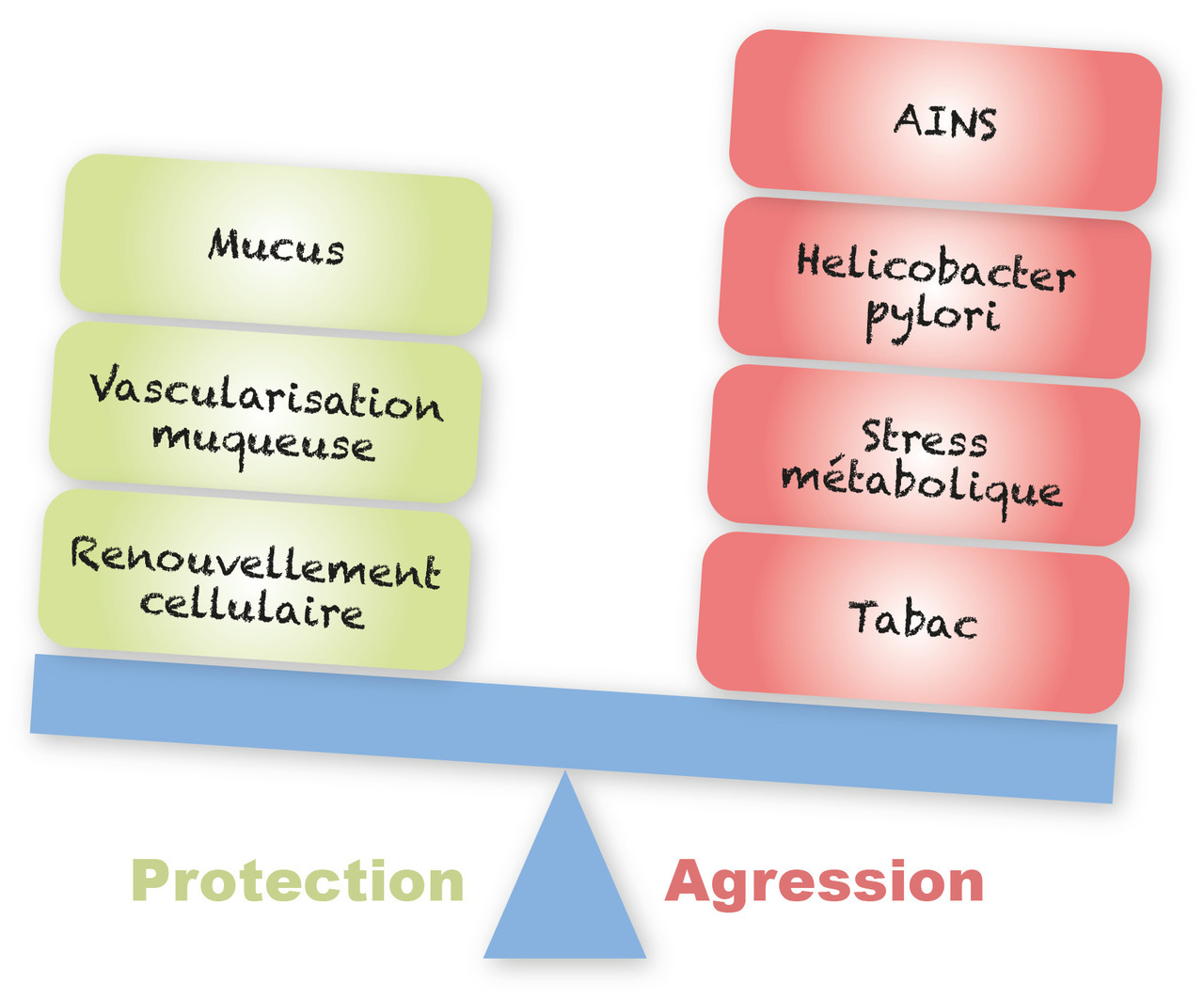
L’ulcère apparaît en cas de déséquilibre (fig. 1) entre les facteurs d’agression (AINS, aspirine, acides, stress, Helicobacter pylori, tabac) et les mécanismes de défense de la paroi gastrique ou duodénale de manière focale.
La protection se fait normalement à différents niveaux :
pré-épithéliale ou luminale : la principale protection pariétale est la sécrétion de mucus qui forme une barrière mécanique à l’agression acide protégeant les cellules de toute exposition. Une sécrétion de bicarbonates permet également de tamponner l’acide chlorhydrique à proximité des cellules pariétales gastriques ;
épithéliale : les cellules elles-mêmes se protègent de l’acidité en sécrétant du mucus et en se renouvelant ;
sous-épithéliale : le flux sanguin muqueux permet également à la cellule d’équilibrer son pH.
La protection se fait normalement à différents niveaux :
pré-épithéliale ou luminale : la principale protection pariétale est la sécrétion de mucus qui forme une barrière mécanique à l’agression acide protégeant les cellules de toute exposition. Une sécrétion de bicarbonates permet également de tamponner l’acide chlorhydrique à proximité des cellules pariétales gastriques ;
épithéliale : les cellules elles-mêmes se protègent de l’acidité en sécrétant du mucus et en se renouvelant ;
sous-épithéliale : le flux sanguin muqueux permet également à la cellule d’équilibrer son pH.
Symptômes
Le syndrome ulcéreux lorsqu’il est typique associe une douleur épigastrique sans irradiation caractérisée par sa périodicité. Cette périodicité est double avec, d’une part, une périodicité dans la journée, rythmée par les repas avec généralement une sensation de crampe ou de faim douloureuse calmée par l’alimentation (intervalle libre de 1 à 3 heures) et, d’autre part, une périodicité dans l’année, avec des périodes douloureuses entrecoupées de périodes d’accalmie de quelques mois ou années.
Malheureusement, le syndrome ulcéreux est plus souvent atypique, avec des douleurs latéralisées dans l’hypochondre droit ou gauche ou encore strictement postérieures, une absence de périodicité ou encore des formes frustres ou au contraire hyperalgiques pseudo-chirurgicales.
Il est également possible de découvrir des ulcères parfaitement asymptomatiques au cours d’une endoscopie réalisée pour un autre motif ou bien encore à l’occasion d’une complication de l’ulcère comme l’hémorragie digestive, la perforation ou beaucoup plus rarement la sténose ulcéreuse, se révélant alors par un syndrome occlusif.
Mises à part les formes compliquées ou les formes hyperalgiques où la palpation reproduit la douleur, l’examen clinique est le plus souvent normal devant un ulcère gastroduodénal, et le diagnostic définitif sera donc porté après l’endoscopie digestive.
Malheureusement, le syndrome ulcéreux est plus souvent atypique, avec des douleurs latéralisées dans l’hypochondre droit ou gauche ou encore strictement postérieures, une absence de périodicité ou encore des formes frustres ou au contraire hyperalgiques pseudo-chirurgicales.
Il est également possible de découvrir des ulcères parfaitement asymptomatiques au cours d’une endoscopie réalisée pour un autre motif ou bien encore à l’occasion d’une complication de l’ulcère comme l’hémorragie digestive, la perforation ou beaucoup plus rarement la sténose ulcéreuse, se révélant alors par un syndrome occlusif.
Mises à part les formes compliquées ou les formes hyperalgiques où la palpation reproduit la douleur, l’examen clinique est le plus souvent normal devant un ulcère gastroduodénal, et le diagnostic définitif sera donc porté après l’endoscopie digestive.
Diagnostic positif par endoscopie digestive haute
En 2019, l’image endoscopique est obtenue grâce à des capteurs CCD (charged coupled device) ou CMOS (complementary metal oxide semiconductor), et on ne parle donc plus de fibroscope mais de vidéo-endoscopes. L’endoscopie haute permet d’explorer le tube digestif de la bouche œsophagienne jusqu’au deuxième duodénum. Lorsque l’indication est diagnostique, pour explorer des symptômes, l’examen peut être pratiqué sous anesthésie locale uniquement avec un endoscope standard ou encore avec un nasofibroscope pour diminuer le réflexe nauséeux et améliorer la tolérance. Pour des raisons de confort, plus de 60 % des gastroscopies sont encore faites sous anesthésie générale en France. Avant tout geste invasif comme une endoscopie, bien que les risques en situation diagnostique soient minimes, l’information du patient sur le geste et ses risques est obligatoire, et le médecin qui l’a réalisé doit le mentionner dans le dossier.
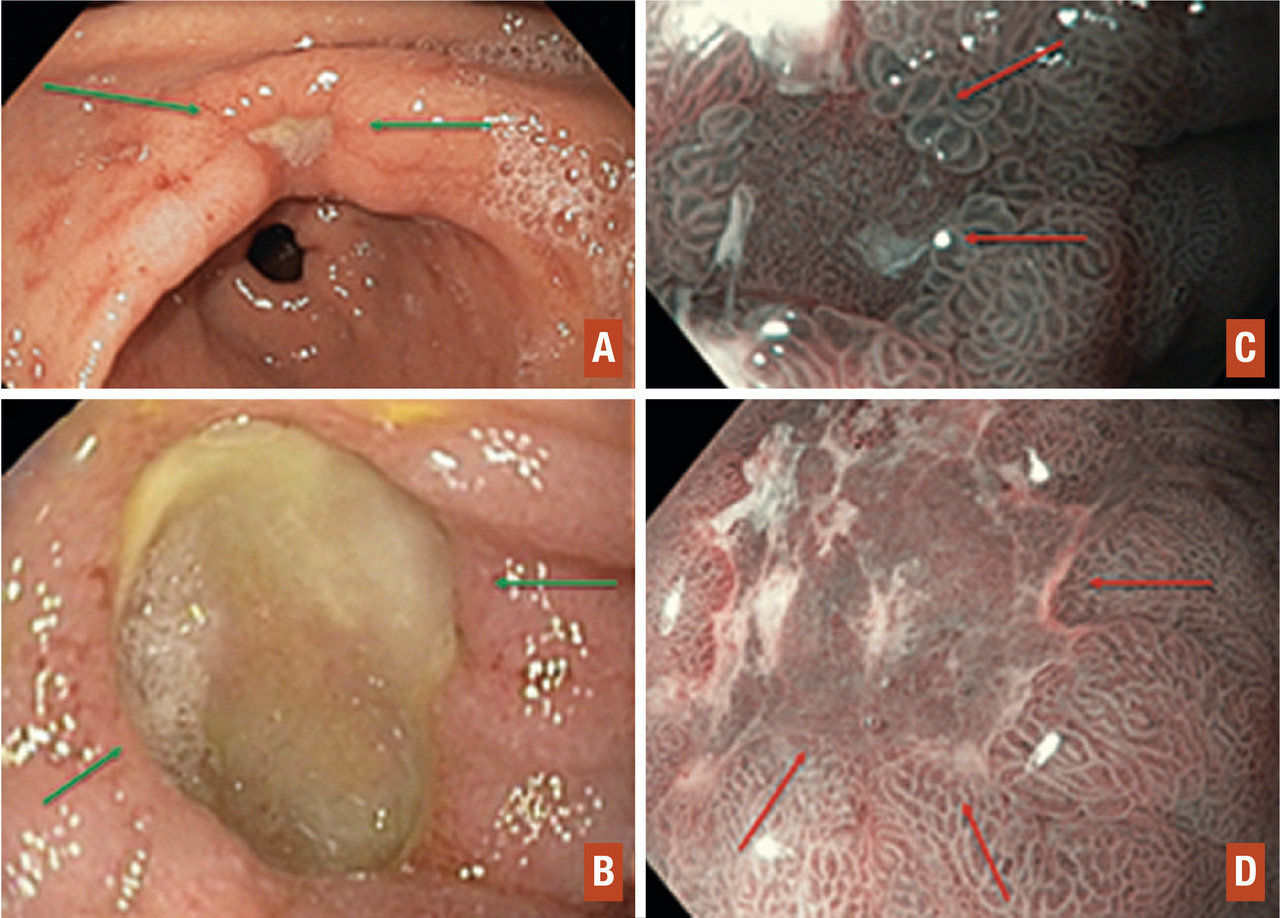
L’ulcère correspond à une perte de substance profonde avec le plus souvent un fond fibrineux lui donnant un aspect blanc au centre ou noirâtre en cas de forme nécrotique. Les ulcères bénins sont le plus souvent localisés dans l’antre et la petite courbure pour les ulcères gastriques, et dans le bulbe (fig. 2B ) pour les ulcères duodénaux. Outre le diagnostic positif de l’ulcère permettant de comprendre l’étiologie des douleurs, le rôle du gastroentérologue est de ne pas méconnaître un cancer ulcériforme lorsque l’ulcère est gastrique. En effet, l’ulcère simple (bénin) est généralement rond ou ovalaire, à bords érythémateux surélevés mais réguliers (fig. 2) avec une forme ronde ou ovale. Son fond est blanc ou noir mais sans anomalie de la muqueuse de surface lors de l’examen minutieux (chromo-endoscopie virtuelle (lumière de l’endoscope à la longueur d’onde de l’hémoglobine) ± zoom).
Au contraire, l’adénocarcinome ulcériforme peut être plus étendu (fig. 2C, 2D ), à bords renflés en massue, de forme irrégulière, déchiquetée, avec une ligne de démarcation nette entre la muqueuse irrégulière au centre de l’ulcère et la muqueuse périulcéreuse plus inflammatoire. Les adénocarcinomes sont généralement associés à des lésions prénéoplasiques, comme la métaplasie intestinale ou la dysplasie.
Des biopsies de l’antre et du fundus doivent être réalisées de manière systématique à la recherche d’une infestation à Helicobacter pylori et à la recherche d’une atrophie ou de lésions métaplasiques ou dysplasiques étendues. De plus, en cas d’ulcère gastrique uniquement, l’endoscopiste doit biopsier également les berges de l’ulcère afin de confirmer l’absence de cellules néoplasiques même si l’aspect endoscopique évoque plutôt un ulcère bénin. Après traitement de l’ulcère, la gastroscopie doit toujours être renouvelée en cas d’ulcère gastrique pour vérifier la cicatrisation et biopsier la cicatrice pour éliminer un cancer sous-jacent.
L’ulcère correspond à une perte de substance profonde avec le plus souvent un fond fibrineux lui donnant un aspect blanc au centre ou noirâtre en cas de forme nécrotique. Les ulcères bénins sont le plus souvent localisés dans l’antre et la petite courbure pour les ulcères gastriques, et dans le bulbe (fig. 2
Au contraire, l’adénocarcinome ulcériforme peut être plus étendu (fi
Des biopsies de l’antre et du fundus doivent être réalisées de manière systématique à la recherche d’une infestation à Helicobacter pylori et à la recherche d’une atrophie ou de lésions métaplasiques ou dysplasiques étendues. De plus, en cas d’ulcère gastrique uniquement, l’endoscopiste doit biopsier également les berges de l’ulcère afin de confirmer l’absence de cellules néoplasiques même si l’aspect endoscopique évoque plutôt un ulcère bénin. Après traitement de l’ulcère, la gastroscopie doit toujours être renouvelée en cas d’ulcère gastrique pour vérifier la cicatrisation et biopsier la cicatrice pour éliminer un cancer sous-jacent.
Facteurs de risque
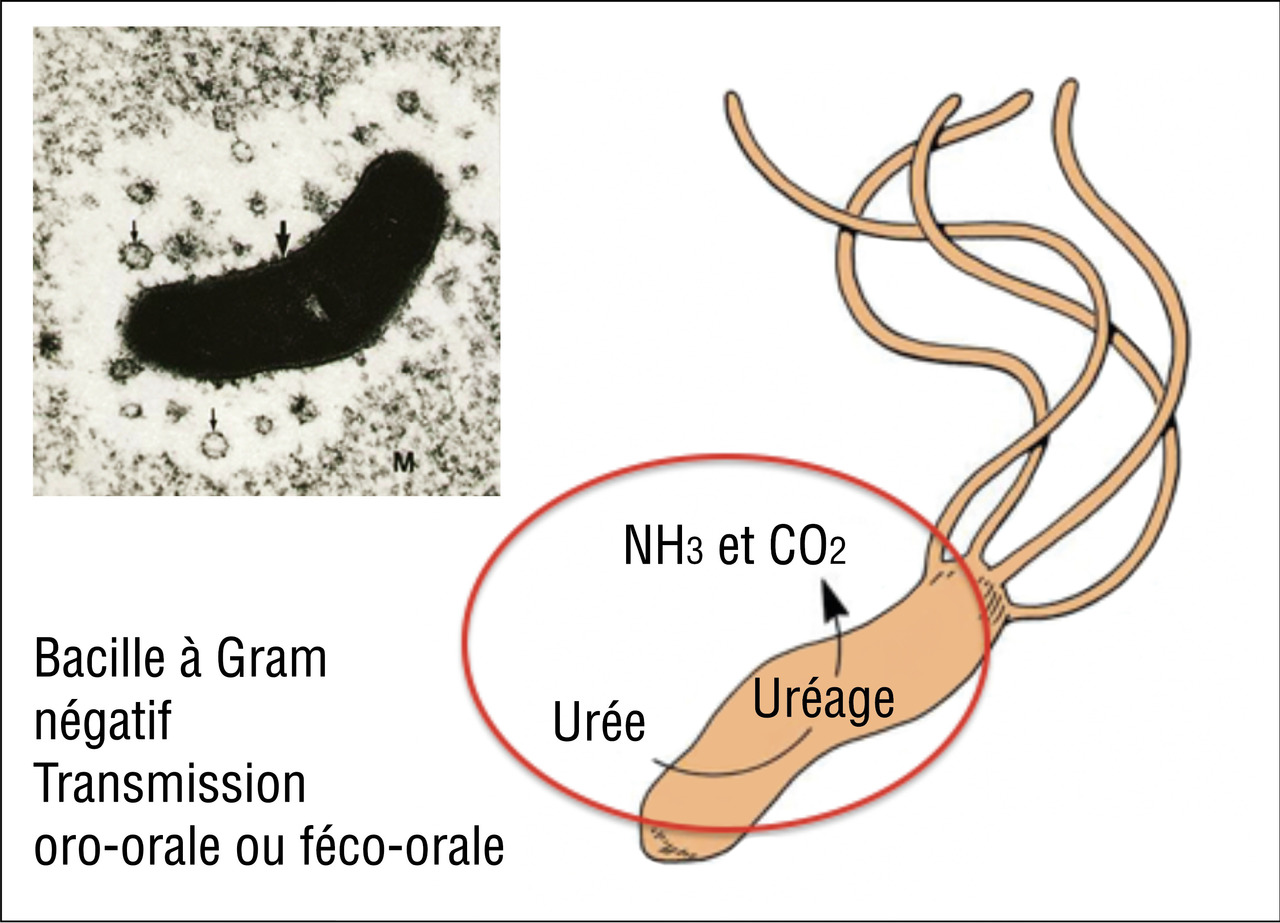
Helicobacter pylori (HP) (fig. 3)
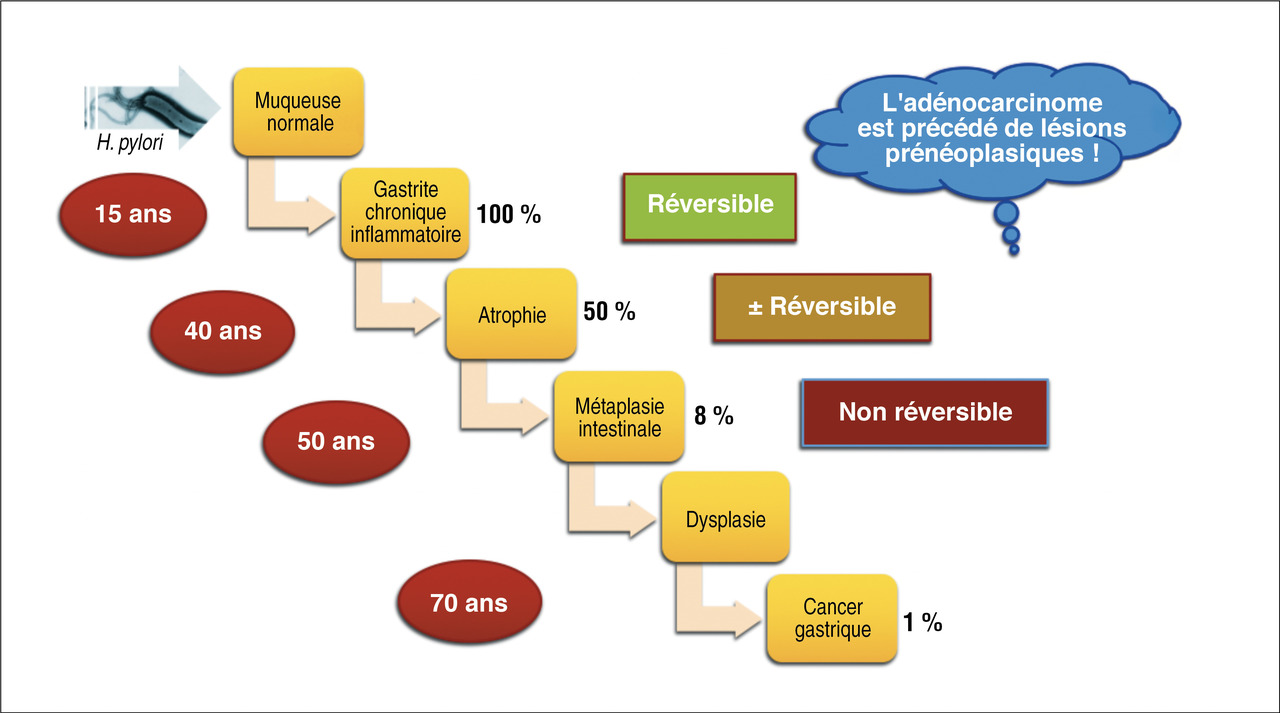
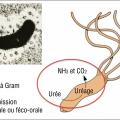
Il s'agit d'une bactérie bacille à Gram négatif à flagelles atypique puisque capable de vivre et de se multiplier dans la muqueuse gastrique à pH acide grâce à une activité uréasique conduisant à la production de NH2 (capable de capter des protons H+) et de CO2. La bactérie engendre paradoxalement une gastrite de l’antre, qui accroît encore l’acidité du suc gastrique favorisant ainsi l’agression de la muqueuse gastrique ou duodénale pouvant conduire à l’ulcère. La contamination se fait essentiellement durant l’enfance (muqueuse immature) par contamination oro-orale ou féco-orale. Les recontaminations à l’âge adulte après éradication sont exceptionnelles. La fréquence de l’infection varie d’une zone géographique à l’autre (prévalence très importante dans les pays en voie de développement) tout comme les souches de bactéries rencontrées dans les différentes parties du monde. Ces différences de souches et d’incidence expliquent également les variations de fréquence du cancer de l’estomac d’une zone à l’autre avec, par exemple, une incidence accrue en Asie ou encore au Portugal qui fait exception parmi les pays européens.Une fois l’infestation réalisée (avant 15 ans), une gastrite inflammatoire va apparaître, avec une évolution chronique entrecoupée parfois d’épisodes d’ulcères constitués. De cette gastrite chronique vont ensuite apparaître des anomalies muqueuses allant progressivement de l’atrophie (en général vers l’âge de 40 ans) à la métaplasie intestinale (en général vers l’âge de 50 ans) puis à la dysplasie, pour conduire dans environ 1 % des cas de patients infectés au développement d’un adénocarcinome de l’estomac, avec un pic d’incidence entre 60 et 70 ans (fig. 4). L’infection à HP favorise également la survenue du lymphome du MALT (Mucosae associated lymphoid tissue) gastrique mais qui est beaucoup plus rare que l’adénocarcinome (0,01 % des gastrites à HP contre 1 %).
La méthode diagnostique la plus utilisée pour faire le diagnostic d’infection à Helicobacter pylori est la biopsie gastrique avec analyse au microscope retrouvant les bactéries typiques à flagelles. Le problème réside dans le fait que ce diagnostic n’est possible qu’au cours d’une gastroscopie généralement réalisée en raison de symptômes ou d’antécédents familiaux de cancer gastrique. Le plus souvent, la recherche de HP ne se fait que dans ces deux contextes, et l’examen endoscopique est donc justifié. De plus, la biopsie permet également d’évaluer la résistance de ces bactéries pour les antibiotiques usuels soit par antibiogramme (technique courante mais complexe), soit plus récemment par PCR (technique reproductible automatisée mais encore peu diffusée).
Une solution non invasive est possible pour détecter HP avec le test à l’urée marquée au carbone 13 (Helikit ou Infai, par exemple). Son fonctionnement est simple, et utilise une méthode enzymatique fondée sur le fait que l’HP produit une uréase. En faisant ingérer au patient de l’urée marquée au carbone 13, la bactérie va dégrader l’urée en bicarbonate (HCO3-) marqué et en ammonium, ce qui va conduire à la production de CO2 (HCO3- + H+= CO2 + H20) marqué qui va diffuser dans les vaisseaux digestifs et finalement être expiré entraînant une augmentation du CO2 expiré marqué au carbone 13. C’est cette augmentation qui positive le test respiratoire.
La place de la sérologie est de plus en plus marginale, uniquement utile lorsque le test respiratoire risque d’être faussement négatif (antibiotiques en cours, inhibiteurs de la pompe à protons) et que la biopsie ne peut être réalisée.
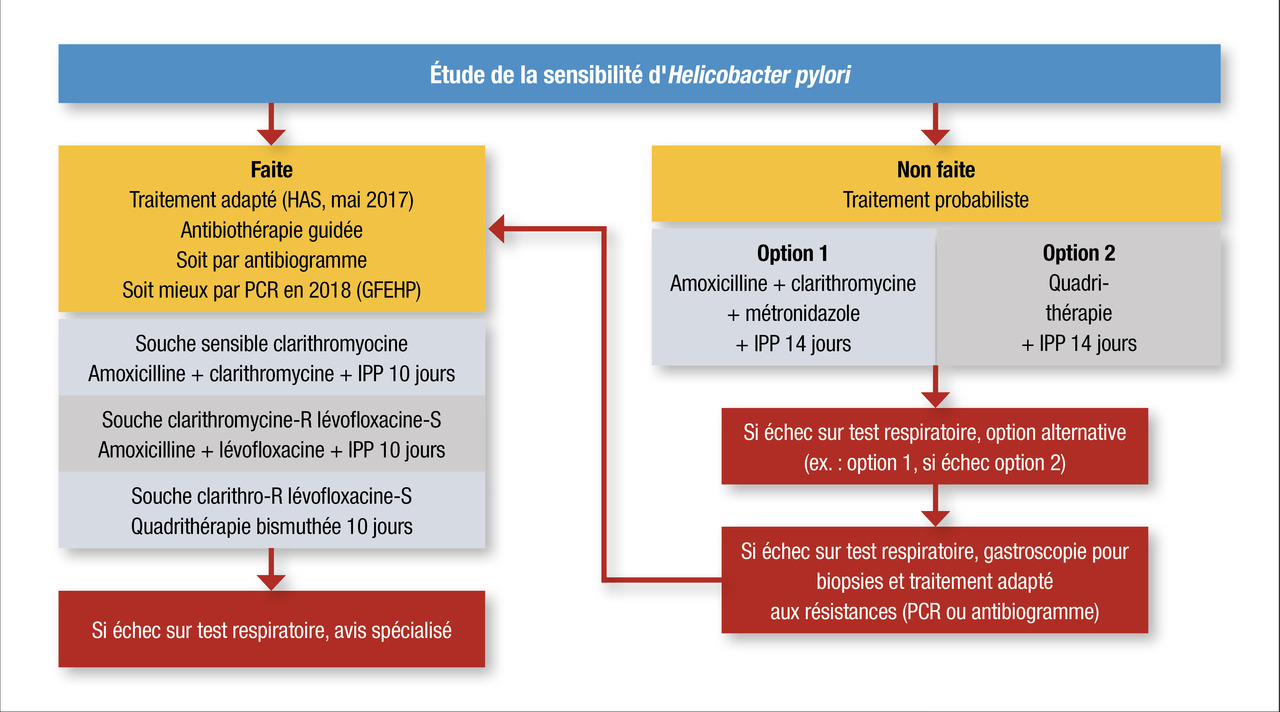
Traitement d’éradication d’HP : en 2018, toute mise en évidence d’une infestation à HP est une indication pour le traitement d’éradication, autrement dit le seul fait de trouver la bactérie indépendamment des conséquences de l’infestation (gastrite, ulcère) doit nous faire proposer l’éradication.
Aucun antibiotique n’est réellement efficace à pH acide, et les inhibiteurs de la pompe à protons sont donc incontournables (dose curative [ex : ésoméprazole 20 mg] matin + soir) dans le traitement d’éradication en association avec les antibiotiques.
D’après les recommandations de la HAS et du Groupe français d'étude de l'Hélicobacter Pylori(GFEHP), l’antibiothérapie choisie ne doit si possible plus être probabiliste mais adaptée aux résistances de la bactérie. Ces résistances doivent être évaluées par une culture avec antibiogramme ou mieux encore par PCR de HP.
En cas de souche multisensible, une bi-antibiothérapie amoxicilline (en l’absence d’allergie) et clarithromycine doit être proposée pendant 10 jours en association à l’inhibiteur de la pompe à protons. En cas de résistance à la clarithromycine, la lévofloxacine doit alors venir remplacer la clarithromycine pendant 10 jours. En cas de souche clarithromycine et lévofloxacine résistante, une quadrithérapie bismuthée (Pylera) doit alors être proposée.
Si la recherche des résistances ne peut être faite, deux options sont alors possibles avec soit la quadrithérapie bismuthée 10 jours (Pylera), soit l’association amoxicilline-clarithromycine-métronidazole pendant 14 jours, toujours en association avec les inhibiteurs de la pompe à protons.
Après le traitement, un test respiratoire à l’urée marquée réalisé au moins 15 jours après l’arrêt des inhibiteurs de la pompe à protons et 4 semaines après l’arrêt des antibiotiques doit venir confirmer l’éradication de la bactérie.
En cas d’échec d’éradication, après avoir vérifié la bonne observance du traitement, une deuxième ligne adaptée aux résistances est alors recommandée (ou l’option alternative à la première ligne en cas d’impossibilité d’évaluer les résistances [Pylera ou trithérapie pendant 14 jours). En cas d’échecs répétés, y compris malgré adaptation aux résistances bactériennes, un avis spécialisé en centre expert peut être demandé, mais la poursuite des inhibiteurs de la pompe à protons au long cours de manière préventive reste une option utilisée.
Après succès de l’éradication, la poursuite des inhibiteurs de la pompe à protons au long cours n’est justifiée que lorsque des AINS ou de l’aspirine doivent être poursuivis au long cours.
Anti-inflammatoires non stéroïdiens (AINS)
Les AINS, en bloquant la production de prostaglandines, privent l’estomac de son principal facteur de protection. C’est par l’inhibition des cyclo-oxygénases (COX-1 et 2) que l’acide arachidonique n’est plus transformé en prostaglandines. L’aspirine peut aussi favoriser la formation des ulcères par un effet inhibiteur sur la COX-1 et également par toxicité gastrique directe. Dans certaines conditions (antécédent d’ulcère gastroduodénal [même après éradication de HPi], âge > 65 ans, prise associée de corticoïdes, d’anticoagulant ou de clopidogrel), les AINS ne doivent pas être prescrits sans protection gastrique par inhibiteur de la pompe à protons à dose préventive (ex : ésoméprazole 20 mg). Les coxibs réduisent la fréquence des complications de l’ulcère mais ne dispensent pas de la prise d’un inhibiteur de la pompe à protons chez les patients à très haut risque (antécédent d’ulcère gastro-duodénal compliqué, comorbidités, multiplication des facteurs de risque).Syndrome de Zollinger-Ellison
Ce syndrome rare doit toujours être évoqué devant la présence de multiples petits ulcères du duodénum, en particulier lorsqu’ils sont récidivants ou compliqués. Il est dû à une ou plusieurs petites tumeurs endocrines sécrétantes, produisant de la gastrine, entraînant une hyperproduction d’acide dans le duodénum et fréquemment des diarrhées. Ces tumeurs sont sporadiques dans 75 % des cas ou plus rarement associées à une néoplasie endocrinienne multiple de type 1 (NEM1). Ces tumeurs sont souvent situées dans la paroi du duodénum (50-80 %), dans la tête du pancréas ou plus rarement dans les ganglions abdominaux ou d’autres organes, sont petites et sont parfois difficiles à mettre en évidence en échoendoscopie. La résection de la tumeur dans les formes localisées permet d’éliminer le syndrome sécrétoire.Stress
Le stress et les autres facteurs psychologiques n’ont jamais démontré leur responsabilité dans la survenue de l’ulcère. Les ulcères de stress qui sont fréquents chez les malades de réanimation représentent une situation à part.Traitement
Parallèlement à l’éradication de la bactérie, il est nécessaire de traiter l’ulcère lui-même en réduisant l’agression de la muqueuse (pH > 3). Le traitement principal repose sur les inhibiteurs de la pompe à protons dont la dose dépend de la molécule choisie (ex : ésoméprazole 20 mg par jour le matin à jeun ou pantoprazole 40 mg). Attention, la dose est doublée pendant l’éradication d’Helicobacter pylori, puis ramenée à la monodose curative pour le reste du traitement. La durée totale du traitement doit être de 6 semaines supplémentaires après le traitement d’éradication (soit environ 8 semaines au total) en cas d’ulcère gastrique, d’ulcère duodénal compliqué, de persistance de douleurs épigastriques après la phase initiale ou encore lorsque des AINS, des antiagrégants ou anticoagulants doivent être poursuivis. Pour l’ulcère duodénal simple sans poursuite des AINS, le traitement total par inhibiteur de la pompe à protons doit être de 4 semaines (éradication de 10 à 14 jours selon le schéma, puis inhibiteurs de la pompe à protons seuls).
Dans les cas de poursuite au long cours des AINS, les inhibiteurs de la pompe à protons doivent être poursuivis à dose préventive (ex : ésoméprazole 20 mg) de manière systématique. Pour ce qui est de l’aspirine, le traitement préventif ne se justifie que si l’ulcère était compliqué initialement.
Le traitement chirurgical de l’ulcère est devenu exceptionnel, et n’est proposé qu’aux patients avec des ulcères récidivants malgré la correction des facteurs favorisants et la prescription au long cours d’inhibiteurs de la pompe à protons. Tout ulcère gastrique traînant doit faire rechercher un cancer ulcériforme, qui est alors une indication chirurgicale propre. Les ulcères récidivants du duodénum doivent faire éliminer le gastrinome ou syndrome de Zollinger-Ellison. Lorsqu’il n’y a pas de cancer, la chirurgie proposée est alors la vagotomie hypersélective ou la vagotomie tritronculaire avec antrectomie.
Dans les cas de poursuite au long cours des AINS, les inhibiteurs de la pompe à protons doivent être poursuivis à dose préventive (ex : ésoméprazole 20 mg) de manière systématique. Pour ce qui est de l’aspirine, le traitement préventif ne se justifie que si l’ulcère était compliqué initialement.
Le traitement chirurgical de l’ulcère est devenu exceptionnel, et n’est proposé qu’aux patients avec des ulcères récidivants malgré la correction des facteurs favorisants et la prescription au long cours d’inhibiteurs de la pompe à protons. Tout ulcère gastrique traînant doit faire rechercher un cancer ulcériforme, qui est alors une indication chirurgicale propre. Les ulcères récidivants du duodénum doivent faire éliminer le gastrinome ou syndrome de Zollinger-Ellison. Lorsqu’il n’y a pas de cancer, la chirurgie proposée est alors la vagotomie hypersélective ou la vagotomie tritronculaire avec antrectomie.
Ulcères compliqués
Hémorragie ulcéreuse
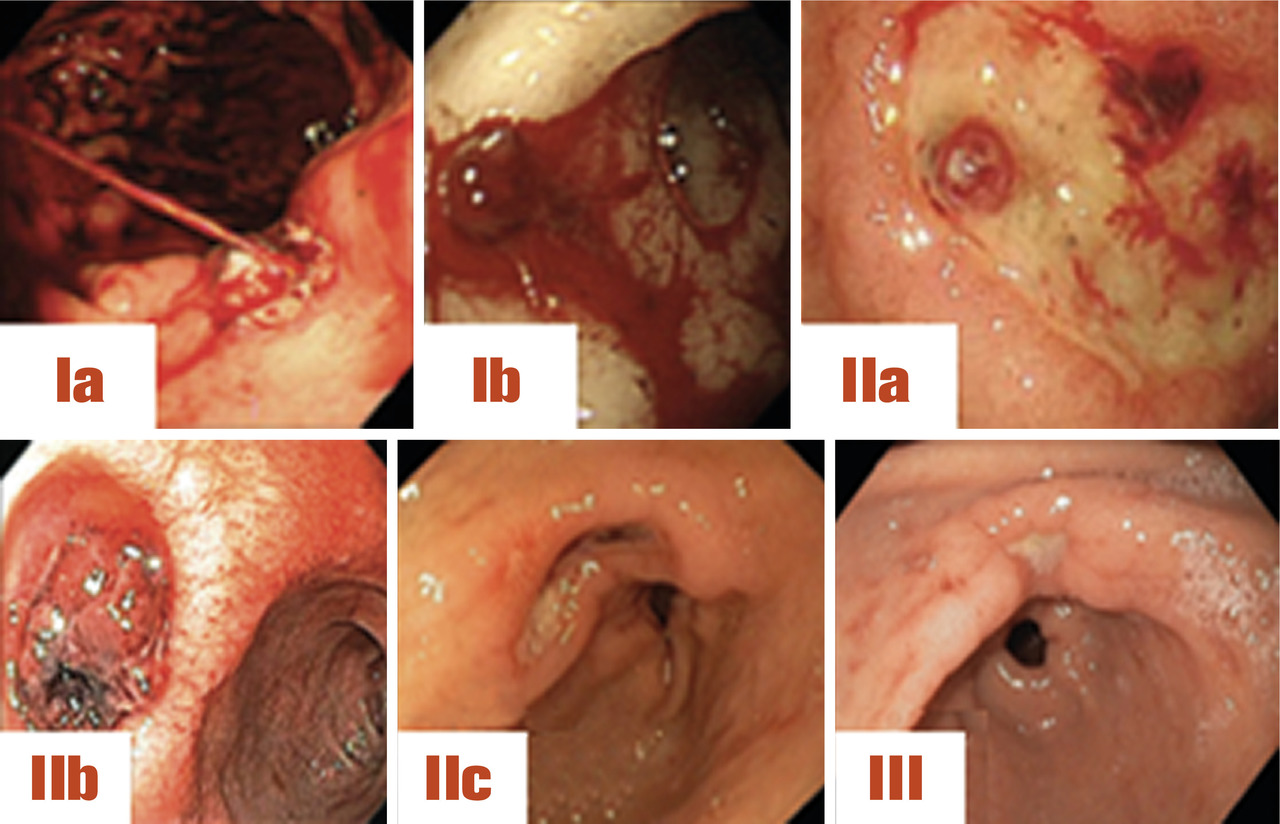
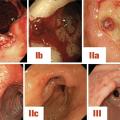
L’ulcère peut se compliquer d’hémorragie digestive par érosion des vaisseaux de la paroi gastrique, on parle alors d’ulcère angio-térébrant. La sévérité de ces hémorragies peut aller d’un saignement occulte se traduisant par une carence en fer (attention au cancer ulcériforme dans ce cas) jusqu’au choc hémorragique en cas de saignement très abondant. L’extériorisation peut alors être haute (hématémèses) et/ou basse (méléna et rectorragies si débit hémorragique élevé). Dans les formes sévères, la localisation à rechercher en premier lieu est la face postérieure du bulbe avec érosion des branches de l’artère gastroduodénale.Pendant l’endoscopie, l’aspect de l’ulcère ayant saigné dans la classification de Forrest (fig. 6) permet de prédire le risque de récidive hémorragique et de décider si un traitement d’hémostase endoscopique est justifié ou non.
Forrest I = saignement actif (risque de récidive de 55 %) :
Ia : saignement en jet ;
Ib : saignement en nappe.
Forrest II = saignement récent mais non actif :
IIa : vaisseau visible (risque récidive hémorragique 43 %) ;
IIb : caillot adhérent (risque récidive hémorragique 22 %) ;
IIc : taches pigmentées (risque récidive hémorragique 10 %).
Forrest III = saignement terminé (risque de récidive de 5 %) :
III : fond propre, ulcère fibrineux.
Cette classification de Forrest est également corrélée au risque de chirurgie et de décès.
Un traitement endoscopique est clairement recommandé en cas d’ulcère Forrest I (Ia et Ib) et IIa. Ce traitement d’hémostase se discute pour le Forrest IIb selon les équipes mais est de plus en plus pratiqué. Les ulcères Forrest IIc et III doivent être traités par inhibiteur de la pompe à protons sans associer d’hémostase endoscopique systématique.
Lorsqu’un traitement endoscopique est indiqué, les recommandations actuelles sont d’associer deux techniques d’hémostase parmi l’injection d’adrénaline diluée, l’hémostase thermique par pince chaude et/ou la pose de clip hémostatique.
L’efficacité du traitement endoscopique est de plus de 90 %, mais en cas de récidive hémorragique il est classique de proposer un deuxième voire un troisième geste d’hémostase endoscopique avant de passer la main au radiologue interventionnel ou au chirurgien si l’endoscopiste parvient à faire l’hémostase et ne décrit pas de situation inaccessible à l’endoscopie.
Au-delà de ces 2 ou 3 tentatives endoscopiques ou plus tôt si l’endoscopiste décrit d’emblée une situation hors de contrôle, deux options sont alors possibles :
soit le scanner injecté à la recherche d’un blush suivi d’une embolisation radiologique ;
soit une prise en charge chirurgicale (ligature de l’artère responsable) éventuellement précédée d’une imagerie injectée en coupe.
Ulcère perforé
L’ulcère peut parfois se révéler d’emblée par un tableau de péritonite, lorsque l’ulcère creuse le muscle jusqu’à le traverser. Le plus souvent, les patients consultent pour un tableau de péritonite, avec une douleur diffuse du ventre, une contracture abdominale et un tableau septique. Dans ces cas péritonéaux, le traitement est alors chirurgical pour toilette péritonéale et suture de l’ulcère ou résection en cas d’ulcère majeur.Le traitement conservateur, médical (méthode de Taylor), n’est possible que dans les formes sans péritonite diffuse et consiste à associer une sonde nasogastrique en aspiration pour diminuer la tension pariétale gastrique et diminuer la production de liquide acide associée à un traitement par inhibiteur de la pompe à protons. En pratique, la prise en charge médicale est moins fréquente que la prise en charge chirurgicale car la présentation clinique est souvent péritonéale.
Exceptionnelle sténose sur ulcère
Ce tableau ne se voit presque plus car les patients consultent généralement avant que la sténose ne soit symptomatique, mais il est possible qu’un ulcère, à force d’évoluer, puisse rétrécir la lumière gastrique et en particulier de l’antre jusqu’à entraîner une sténose symptomatique se manifestant par des symptômes obstructifs ou subocclusifs.Diagnostics différentiels
Plusieurs diagnostics différentiels doivent être évoqués et éliminés en fonction de la symptomatologie douloureuse :pancréatite aiguë : le tableau ne répond généralement pas à la périodicité évoquée dans l’ulcère. La douleur est généralement profonde, transfixiante, plutôt aggravée par les repas et évoluant par crises violentes, sans périodicité dans l’année (sauf dans le cas de la pancréatite chronique où les poussées peuvent être entrecoupées d’accalmie) ;
colique hépatique : les tableaux biliaires présentent généralement une inhibition respiratoire et un signe de Murphy qui n’existe généralement pas dans l’ulcère ;
infarctus du myocarde inférieur : la douleur de l’infarctus du myocarde pouvant s’associer à des signes digestifs (vomissement), ce tableau doit être éliminé devant toute douleur épigastrique atypique.
Examens complémentaires
Comme nous l’avons déjà mentionné plus haut, l’examen incontournable devant une suspicion d’ulcère est l’endoscopie digestive haute ou œsogastroduodénale pour faire le diagnostic positif de l’ulcère, faire des biopsies antrales et fundiques à la recherche d’HP et de lésions prénéoplasiques (atrophie, métaplasie, dysplasie), faire des biopsies des berges de l’ulcère pour l’ulcère gastrique afin de ne pas méconnaître le cancer ulcériforme.
Gastrite
Définition
La gastrite est définie par la présence d’une infiltration inflammatoire de la muqueuse gastrique par différents types de cellules inflammatoires.
Parmi les multiples causes de gastrites, dont la plupart sont sans réelle gravité et sans prise en charge spécifique, une entité très différente, et dont la prise en charge est spécifique, doit être connue. Il s’agit de la maladie de Biermer.
Parmi les multiples causes de gastrites, dont la plupart sont sans réelle gravité et sans prise en charge spécifique, une entité très différente, et dont la prise en charge est spécifique, doit être connue. Il s’agit de la maladie de Biermer.
Gastrite chronique auto-immune ou maladie de Biermer
Diagnostic de la maladie
La gastrite de Biermer est une maladie rare, auto-immune touchant le plus souvent des femmes de plus de 50 ans ayant parfois des antécédents de maladies auto-immunes d’autres organes (thyroïdite, syndrome de Gougerot-Sjögren…). Dans cette maladie, la production d’auto-anticoprs anticellules pariétales fundiques et antifacteur intrinsèque conduit à la destruction des cellules pariétales avec un infiltrat lymphocytaire de la paroi gastrique. Cela conduit à une atrophie gastrique antrofundique pouvant favoriser le développement des lésions néoplasiques gastriques avec la séquence métaplasie, dysplasie et adénocarcinome. Parallèlement, cette maladie peut aussi favoriser le développement de petites tumeurs endocrines du fundus appelées ECL-omes, généralement multiples et de petite taille (< 1 cm) qui sont le plus souvent bien différenciées et ne dégénèrent jamais.La destruction des cellules gastriques conduit à une diminution de la production de facteur intrinsèque, qui est pourtant indispensable à l’absorption de la vitamine B12 dans l’iléon terminal par le biais d’un transporteur appelé la cubiline et qui fixe le facteur intrinsèque chargé de B12. Dans la maladie de Biermer, la sous-production de facteur intrinsèque conduit à une carence en B12 qui favorise le développement d’une anémie macrocytaire. Les symptômes associés à cette carence sont, outre l’anémie, la glossite et les atteintes neurologiques (sclérose combinée de la moelle).
Prise en charge
Substitution : la plus classique se fait par injection intramusculaire de B12 avec un protocole habituel de 1 000 microgrammes tous les 2 jours pendant 12 jours suivis d’une injection de 1 000 microgrammes par mois à vie. Cependant, la vitamine B12 est environ 100 fois moins absorbée que chez le sujet sain, mais une absorption minime est possible par voie orale, et des prescriptions orales de fortes doses sont également possibles.Une supplémentation en fer est parfois associée au traitement B12 car des carences martiales sont parfois associées à la carence en B12 en raison de l’achlorhydrie induite qui bloque l’absorption duodénale du fer.
Surveillance de l’estomac : en parallèle de la supplémentation, une surveillance endoscopique de l’estomac est recommandée tous les 3 ans, à la recherche de lésions néoplasiques gastriques. Cette surveillance doit être poursuivie au moins jusqu’à 70 ans puis adaptée aux comorbidités et à l’état général du patient.
Autres gastrites
Gastrite chronique à HP
L’infection initiale à HP donne d’abord une gastrite aiguë, le plus souvent asymptomatique mais pouvant donner des tableaux aspécifiques de douleurs épigastriques, nausées et vomissements. À la phase aiguë, l’endoscopie révèle parfois des lésions érythémateuses de l’antre, œdématiées et congestives, parfois érosives. Le diagnostic est confirmé par la présence d’HP sur les biopsies associée à un infiltrat à polynucléaires neutrophiles.Si la bactérie n’est pas éradiquée, cette forme aiguë évolue ensuite vers une forme chronique. La topographie de cette gastrite dépend de la sécrétion d’acide chlorhydrique du patient. Chez les hypersécréteurs, la gastrite est antrale, avec développement d’ulcères duodénaux, alors que chez les hyposécréteurs acides, la gastrite est pangastrique avec développement progressif d’une atrophie puis de métaplasie et au pire de lésions néoplasiques (dysplasiques, puis adénocarcinome) [fig. 4].
Gastrite chronique lymphocytaire
Atteinte inflammatoire par des lymphocytes dans un contexte de maladie cœliaque.Gastrite granulomateuse
Caractérisée par la présence de granulomes épithélioïdes (± giganto-cellulaires) dans le chorion. Ses causes sont multiples, maladie de Crohn, tuberculose, anisakiase, sarcoïdose, idiopathique…Gastrite de Crohn
Dans le contexte de maladie de Crohn, 30 % des patients présentent une infiltration inflammatoire péricellulaire gastrique à lymphocytes et polynucléaires.Autres gastrites
Il existe aussi des gastrites virales, radiques, phlegmoneuses rarissimes chez le sujet immunodéprimé…Gastrites hypertrophiques
Devant une gastrite à gros plis, ne pas méconnaître la linite gastrique qui est une forme particulière d’adénocarcinome gastrique avec cellules en bague à chaton (indifférentiées) infiltrant toutes les couches de la paroi gastrique. Le pronostic de cette forme est très sombre. Les autres causes de gastrite à gros plis sont : la maladie de Ménétrier qui est une gastrite hypertrophique (hypertrophie des glandes muqueuses) se manifestant parfois par une exsudation avec pour conséquence une hypomagnésémie et une fuite protidique. Cette maladie d’origine inconnue présente un risque de dégénérescence néoplasique ; la gastrite hypertrophique du syndrome de Zollinger-Ellison avec épaississement des plis du fundus par hyperplasie des glandes sous l’effet de la gastrine.•Points forts
Ulcère gastrique et duodénal. Gastrite
Les deux principales causes d’ulcère sont l’infection à Helicobacter pylori et la prise d’anti-inflammatoire non stéroïdiens.
Devant un ulcère gastrique, l’obsession est de ne pas méconnaître un cancer ulcériforme et de dépister les lésions prénéoplasiques gastriques qui donneront lieu à un suivi.
L’endoscopie reste l’examen incontournable du diagnostic de l’ulcère, de son traitement dans les formes hémorragiques et du diagnostic différentiel avec le cancer.
Helicobacter pylori doit être éradiqué systématiquement lorsqu’il est mis en évidence, et si possible en recherchant ses résistances par antibiogramme ou PCR (si disponible) pour adapter l’antibiothérapie.

 Encadrés
Encadrés