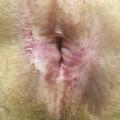
Quels diagnostics évoquer devant une dermatose anale chronique ?
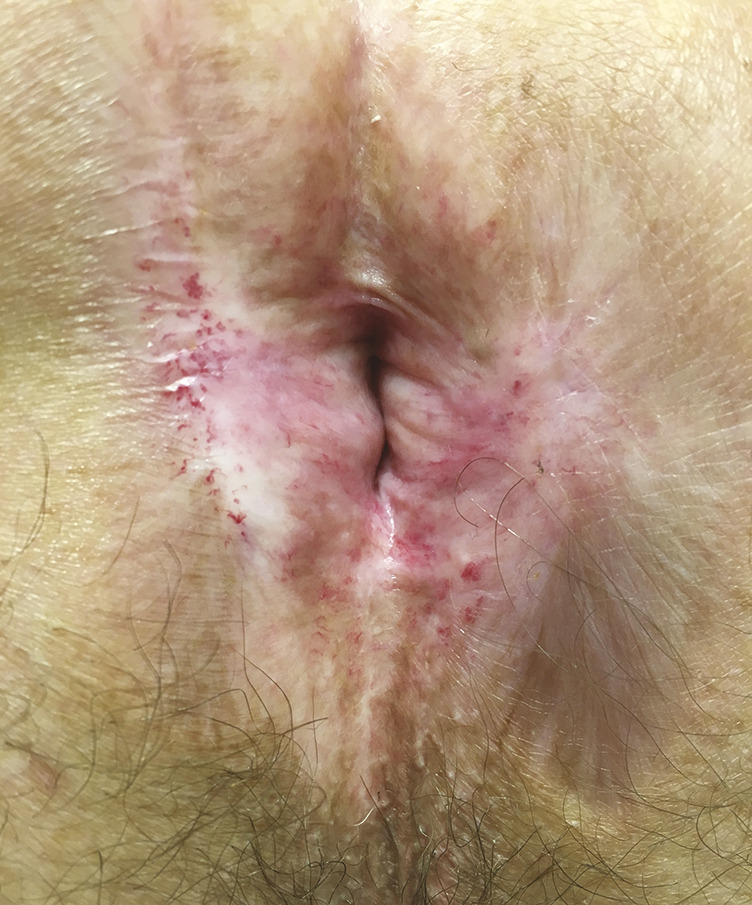
Devant une dermatose de la région ano-périnéale, plusieurs diagnostics sont à évoquer (tableau 1). Parfois l’aspect macroscopique est fortement évocateur. Mais, le plus souvent, il est modifié par l’évolution chronique, le traumatisme itératif du grattage et de l’essuyage, la surinfection et/ou la toxicité locale des nombreux topiques appliqués par le patient. En cas de doute diagnostique, il faut donc faire des prélèvements à visée infectieuse et/ou histologique qui permettent le plus souvent de poser un diagnostic formel.
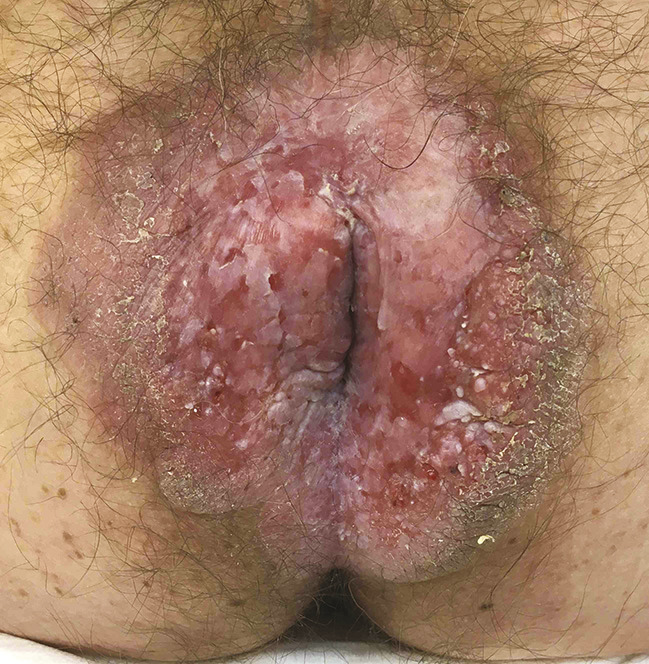
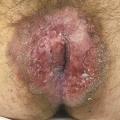
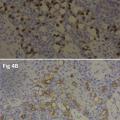
Le patient consulte son médecin traitant qui lui prescrit plusieurs topiques hémorroïdaires, sans aucune amélioration clinique. Il est ensuite adressé à un gastroentérologue qui lui prescrit des dermocorticoïdes avec des crèmes émollientes, sans aucun effet clinique. Le patient est finalement référé dans un centre de proctologie spécialisé. Une biopsie cutanée est alors pratiquée et révèle une maladie de Paget anale (fig. 2).
Le patient consulte son médecin traitant qui lui prescrit plusieurs topiques hémorroïdaires, sans aucune amélioration clinique. Il est ensuite adressé à un gastroentérologue qui lui prescrit des dermocorticoïdes avec des crèmes émollientes, sans aucun effet clinique. Le patient est finalement référé dans un centre de proctologie spécialisé. Une biopsie cutanée est alors pratiquée et révèle une maladie de Paget anale (fig. 2).
Quelles sont les caractéristiques de la maladie de Paget ano-périnéale ?
La maladie de Paget est une affection rare, avec moins de 200 cas publiés dans la littérature. L’atteinte est habituellement mammaire et la forme extramammaire est encore plus rare. Elle a été décrite la première fois au niveau péno-scrotal en 1989, mais le premier cas ano- périnéal a été publié par Darier et Coulillaud en 1893.
La localisation ano-périnéale représenterait moins de 7 % de toutes les localisations de la maladie de Paget et moins de 20 % des formes extramammaires. Elle atteint plus fréquemment les femmes et probablement les Caucasiens, avec un pic d’incidence entre 50 et 80 ans. Elle survient dans les zones de distribution des glandes apocrines : vulve, scrotum, pénis et région ano-périnéale, voire les creux axillaires, les paupières, les conduits auditifs externes et l’ombilic (tableau 2).1
Au niveau ano-périnéal, les symptômes cliniques sont peu spécifi ques : prurit chronique/persistant, saignements et/ou douleurs anales. Le tableau 3 résume les principales circonstances de découverte de la maladie de Paget ano-périnéale. Dans 10 % des cas, les patients sont asymptomatiques. De surcroît, à l’examen clinique, les lésions sont polymorphes, pouvant varier de plaques érythémateuses inflammatoires planes, plus ou moins étendues, à des pla-ques suintantes, ulcérées, hypertrophiques et/ou lichénifiées par endroits. Il faut être particulièrement attentif aux zones ulcérées ou infiltrées à la palpation, car elles correspondent souvent au site d’invasion tumorale. Le diagnostic est donc souvent tardif, en moyenne après 2 ans d’évolution, après l’échec de l’application de multiples topiques, notamment de dermocorticoïdes. Il convient donc de l’évoquer devant toute dermatose érythémateuse prurigineuse chronique. La persistance d’un prurit malgré un traitement par dermocorticoïdes bien conduit doit faire suspecter un processus cancéreux et conduire à une biopsie qui, encore une fois, doit être réalisée au moindre doute.2
La localisation ano-périnéale représenterait moins de 7 % de toutes les localisations de la maladie de Paget et moins de 20 % des formes extramammaires. Elle atteint plus fréquemment les femmes et probablement les Caucasiens, avec un pic d’incidence entre 50 et 80 ans. Elle survient dans les zones de distribution des glandes apocrines : vulve, scrotum, pénis et région ano-périnéale, voire les creux axillaires, les paupières, les conduits auditifs externes et l’ombilic (tableau 2).1
Au niveau ano-périnéal, les symptômes cliniques sont peu spécifi ques : prurit chronique/persistant, saignements et/ou douleurs anales. Le tableau 3 résume les principales circonstances de découverte de la maladie de Paget ano-périnéale. Dans 10 % des cas, les patients sont asymptomatiques. De surcroît, à l’examen clinique, les lésions sont polymorphes, pouvant varier de plaques érythémateuses inflammatoires planes, plus ou moins étendues, à des pla-ques suintantes, ulcérées, hypertrophiques et/ou lichénifiées par endroits. Il faut être particulièrement attentif aux zones ulcérées ou infiltrées à la palpation, car elles correspondent souvent au site d’invasion tumorale. Le diagnostic est donc souvent tardif, en moyenne après 2 ans d’évolution, après l’échec de l’application de multiples topiques, notamment de dermocorticoïdes. Il convient donc de l’évoquer devant toute dermatose érythémateuse prurigineuse chronique. La persistance d’un prurit malgré un traitement par dermocorticoïdes bien conduit doit faire suspecter un processus cancéreux et conduire à une biopsie qui, encore une fois, doit être réalisée au moindre doute.2
Quel est le mécanisme histopathogénique ?
Au niveau ano-périnéal, il faut distinguer les formes primaires des formes secondaires à un cancer. Une revue des publications de 1990 à 2008 a montré qu’un cancer synchrone ou métachrone était associé dans 10 à 30 % des cas (tableau 4).
Pour autant, le mécanisme histopathogénique de la maladie n’est pas encore élucidé. Ainsi, en cas de forme primaire, les cellules de Paget semblent se développer à partir des cellules souches indifférenciées et pluripotentes de l’épiderme ou des annexes, et acquérir ensuite une différenciation apocrine, ou directement à partir des glandes sudoripares « eccrines » ou apocrines intra-épidermiques. En revanche, en cas de forme secondaire, le phénomène pagétoïde correspondrait à la diffusion de cellules cancéreuses ayant un tropisme épidermique. Cela étant dit, le mécanisme de cette diffusion par une éventuelle exfoliation des cellules cancéreuses du cancer pri- mitif n’est pas formel aujourd’hui.3
Pour autant, le mécanisme histopathogénique de la maladie n’est pas encore élucidé. Ainsi, en cas de forme primaire, les cellules de Paget semblent se développer à partir des cellules souches indifférenciées et pluripotentes de l’épiderme ou des annexes, et acquérir ensuite une différenciation apocrine, ou directement à partir des glandes sudoripares « eccrines » ou apocrines intra-épidermiques. En revanche, en cas de forme secondaire, le phénomène pagétoïde correspondrait à la diffusion de cellules cancéreuses ayant un tropisme épidermique. Cela étant dit, le mécanisme de cette diffusion par une éventuelle exfoliation des cellules cancéreuses du cancer pri- mitif n’est pas formel aujourd’hui.3
Quel est l’apport de l’histologie ?
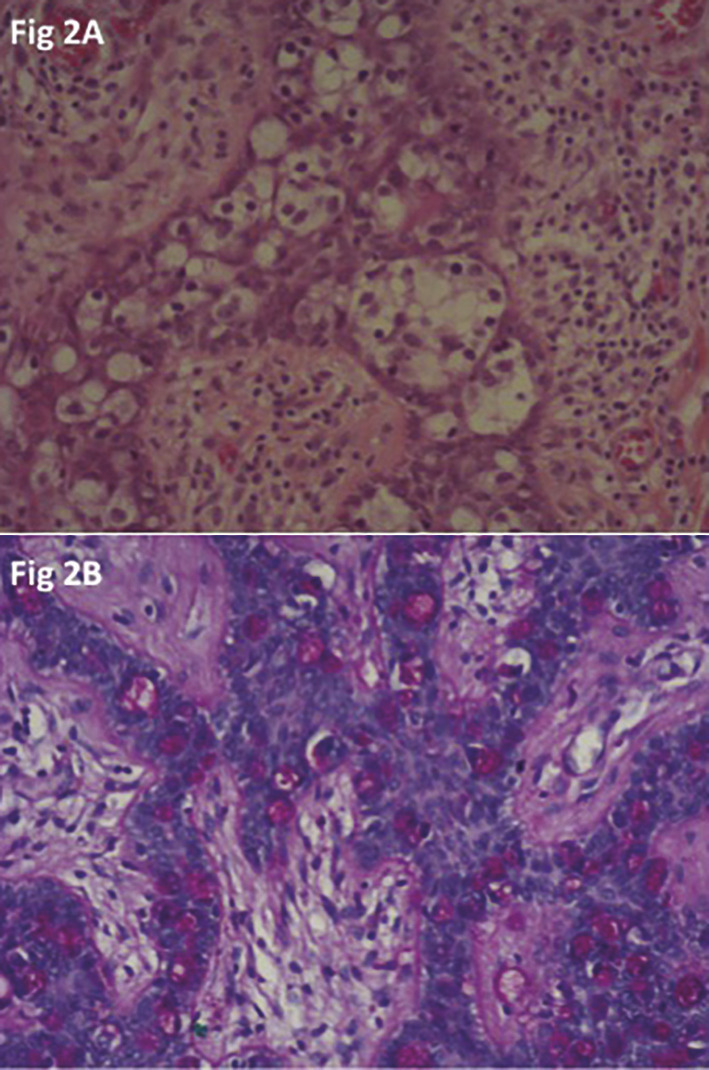
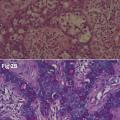
L’histologie de la maladie de Paget extramammaire est identique à celle du sein. Il s’agit d’un carcinome intra-épidermique d’évolution habituellement lente, peu ou pas envahissant, se développant sur le revêtement cutané. L’histologie montre un épiderme acanthosique, parfois ulcéré, contenant de nombreuses cellules de Paget en migration intra-épidermique. La cellule de Paget prend le plus souvent l’aspect d’une cellule large globuleuse avec un cytoplasme clair et abondant et un nucléole proéminent (cellules classiques de type A). Elle peut avoir également des caractéristiques mucipares, avec un aspect de cellules en bague à chaton avec un noyau déplacé excentrique et des gouttelettes de mucine cytoplasmique PAS (periodic acid schiff) positif (cellules de type B). Sur le plan immuno- histochimique, la cellule de Paget exprime les cytokératines de bas poids moléculaire (CK7 et CK19) et l’antigène carcino-embryonnaire.
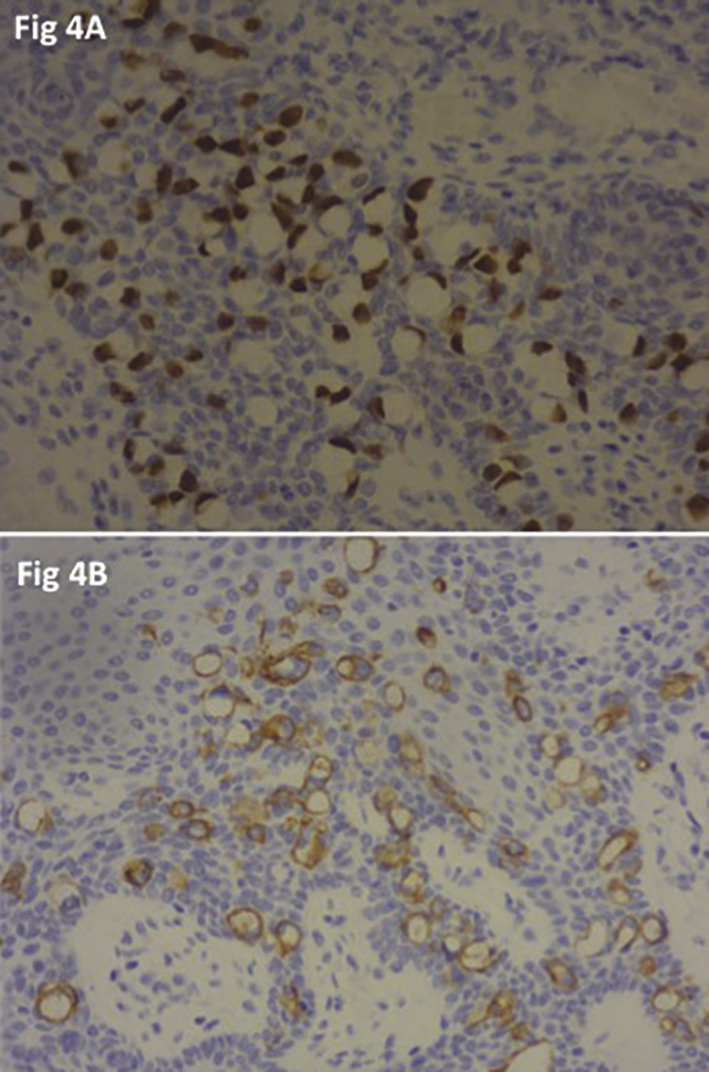
Par ailleurs, l’analyse immuno-histochimique peut aider à discriminer une forme primaire d’une forme secondaire (diffusion pagétoïde). Ainsi, la cytokératine 20 est un marqueur typique des carcinomes ano- colorectaux à diffusion pagétoïde. En revanche, le GCDFP15 (gross cystic disease fluid protein) est positif en cas de forme primaire et est le plus souvent négatif en cas de phénomène pagétoïde. Manifestement, le profil immuno-histochimique CK20+/GCDFP15- est en faveur d’une maladie secondaire, plus in- vasive, avec un risque plus élevé de récidive. La présence de cellules en bague à chaton oriente également vers une origine secondaire. De surcroît, ces cellules sont retrouvées aussi bien au niveau de la lésion primitive que secondaire (tableau 5).2
Par ailleurs, l’analyse immuno-histochimique peut aider à discriminer une forme primaire d’une forme secondaire (diffusion pagétoïde). Ainsi, la cytokératine 20 est un marqueur typique des carcinomes ano- colorectaux à diffusion pagétoïde. En revanche, le GCDFP15 (gross cystic disease fluid protein) est positif en cas de forme primaire et est le plus souvent négatif en cas de phénomène pagétoïde. Manifestement, le profil immuno-histochimique CK20+/GCDFP15- est en faveur d’une maladie secondaire, plus in- vasive, avec un risque plus élevé de récidive. La présence de cellules en bague à chaton oriente également vers une origine secondaire. De surcroît, ces cellules sont retrouvées aussi bien au niveau de la lésion primitive que secondaire (tableau 5).2
Quel bilan faut-il faire ?
Le diagnostic d’une maladie de Paget extramammaire et en l’occurrence ano-périnéale impose la recherche d’une tumeur primitive synchrone associée. Le tableau 6 résume l’ensemble des explorations à envisager. Cette recherche peut bien sûr être orientée par le résultat de l’analyse immuno-histochimique.
Chez notre patient, l’imagerie par résonance magnétique (IRM) ano-périnéale montre une hyperdiffusion focale de la partie basse du canal anal. Le dosage de l’antigène carcino-embryonnaire est élevé à 11 µg/L (normale < 4,3 µg/L) tandis que le dosage du squamous cell carcinoma (SCC) est normal. La fibroscopie gastrique et la coloscopie ne montrent pas de lésion primitive. La tomodensitométrie thoraco-abdomino- pelvienne ne montre aucune lésion suspecte d’adénopathie ou de métastase à distance.
Chez notre patient, l’imagerie par résonance magnétique (IRM) ano-périnéale montre une hyperdiffusion focale de la partie basse du canal anal. Le dosage de l’antigène carcino-embryonnaire est élevé à 11 µg/L (normale < 4,3 µg/L) tandis que le dosage du squamous cell carcinoma (SCC) est normal. La fibroscopie gastrique et la coloscopie ne montrent pas de lésion primitive. La tomodensitométrie thoraco-abdomino- pelvienne ne montre aucune lésion suspecte d’adénopathie ou de métastase à distance.
Quel est le traitement ?
Une exérèse cutanée étendue est l’étalon-or pour les lésions non invasives avec des marges latérales macroscopiques de 1 cm, voire 2 cm si les limites macroscopiques ne sont pas clairement définies. Parfois, il est nécessaire de pratiquer plusieurs exérèses pour obtenir des marges saines R0. En effet, les lésions sont souvent multifocales, non contiguës et invisibles à l’œil nu. Afin de réduire de manière significative le taux de résidu microscopique tout en assurant une épargne tissulaire maximale des structures anatomiques critiques (vulve, canal anal, etc.), la chirurgie micrographique de Mohs permet une exérèse chirurgicale guidée progressivement par une analyse extemporanée peropératoire des marges latérales et profondes.4
L’analyse congelée peropératoire des marges est également une alternative qui permet aussi une analyse peropératoire des marges suivie ultérieurement d’un examen histologique standard visant à dépister les faux négatifs possibles de l’extemporané.
Des techniques de reconstruction avec des greffes cutanées ou des lambeaux musculo-cutanés, associées ou non à une colostomie, sont parfois nécessaires en cas d’exérèse élargie délabrante. D’autres ont proposé des traitements non chirurgicaux visant à éviter le risque mutilant de la chirurgie large comme l’injection intralésionnelle d’interféron, l’application locale d’imi- quimod, de 5-fluoro-uracile ou de bléomycine, la photothérapie dynamique et la thérapie laser, mais les données de la littérature reposent seulement sur des petites séries ouvertes ou des cas cliniques isolés.
En cas de lésions invasives, une exérèse plus étendue avec curage ganglionnaire peut être préconisée, pouvant aller jusqu’à l’amputation abdomino-périnéale, éventuellement associée à une radio-chimiothérapie.
Chez les patients inopérables et/ou en cas de chirurgie potentiellement trop mutilante, une radiothérapie, voire une radio-chimiothérapie, peuvent être proposées en alternative à la chirurgie, mais cette attitude n’est pas officiellement validée en l’absence d’étude contrôlée randomisée publiée. Pour finir, la chimiothérapie systémique seule n’est indiquée qu’en cas de maladie métastatique avancée.
Naturellement, en cas de forme secondaire, le cancer synchrone est traité selon les modalités habituelles.5
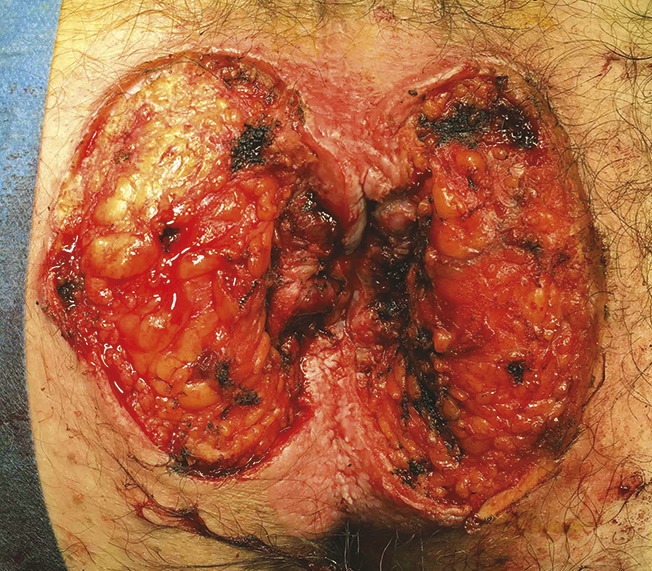
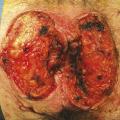
Chez notre patient, une exérèse chirurgicale large des lésions ano-périnéales est réalisée (fig. 3). L’analyse histologique confirme le diagnostic de maladie de Paget étendue avec un foyer à droite d’un adénocarcinome peu différencié de type colloïde muqueux infiltrant toute l’épaisseur du derme évoquant une origine primitive colorectale ou des glandes anales en raison de la positivité des marqueurs CDX2 et CK20 à l’immunohistochimie (fig. 4). Les limites latérales de l’exérèse sont atteintes mais la limite profonde est saine. Le patient refuse tout traitement complémentaire.
L’analyse congelée peropératoire des marges est également une alternative qui permet aussi une analyse peropératoire des marges suivie ultérieurement d’un examen histologique standard visant à dépister les faux négatifs possibles de l’extemporané.
Des techniques de reconstruction avec des greffes cutanées ou des lambeaux musculo-cutanés, associées ou non à une colostomie, sont parfois nécessaires en cas d’exérèse élargie délabrante. D’autres ont proposé des traitements non chirurgicaux visant à éviter le risque mutilant de la chirurgie large comme l’injection intralésionnelle d’interféron, l’application locale d’imi- quimod, de 5-fluoro-uracile ou de bléomycine, la photothérapie dynamique et la thérapie laser, mais les données de la littérature reposent seulement sur des petites séries ouvertes ou des cas cliniques isolés.
En cas de lésions invasives, une exérèse plus étendue avec curage ganglionnaire peut être préconisée, pouvant aller jusqu’à l’amputation abdomino-périnéale, éventuellement associée à une radio-chimiothérapie.
Chez les patients inopérables et/ou en cas de chirurgie potentiellement trop mutilante, une radiothérapie, voire une radio-chimiothérapie, peuvent être proposées en alternative à la chirurgie, mais cette attitude n’est pas officiellement validée en l’absence d’étude contrôlée randomisée publiée. Pour finir, la chimiothérapie systémique seule n’est indiquée qu’en cas de maladie métastatique avancée.
Naturellement, en cas de forme secondaire, le cancer synchrone est traité selon les modalités habituelles.5
Chez notre patient, une exérèse chirurgicale large des lésions ano-périnéales est réalisée (fig. 3). L’analyse histologique confirme le diagnostic de maladie de Paget étendue avec un foyer à droite d’un adénocarcinome peu différencié de type colloïde muqueux infiltrant toute l’épaisseur du derme évoquant une origine primitive colorectale ou des glandes anales en raison de la positivité des marqueurs CDX2 et CK20 à l’immunohistochimie (fig. 4). Les limites latérales de l’exérèse sont atteintes mais la limite profonde est saine. Le patient refuse tout traitement complémentaire.
Quel est le pronostic ?
Parmi les facteurs pronostiques de la maladie de Paget ano-périnéale, la profondeur de l’atteinte de plus de 1 mm est associée à un risque plus important de dissémination métastatique, ganglionnaire et de récidive locale après exérèse. Ainsi, la classification histologique de Tsutsumida identifie 4 niveaux d’atteinte (tableau 7) avec un risque ganglionnaire et métastatique plus important à partir de l’invasion du derme réticulaire. Cela étant dit, le pronostic de la forme primaire est relativement bon, avec une survie globale et sans récidive d’environ 60 % à 5 ans alors que le pronostic est moins bon en cas de cancer synchrone ou métachrone, notamment urothélial.6
Quel doit être le suivi post-thérapeutique ?
La surveillance doit être longue, sur plusieurs années, en raison du risque de récidive et d’évolution métastatique, notamment pendant les 3 premières années, estimé dans les différentes études entre 30 et 60 % et le plus souvent en rapport avec une exérèse incomplète. Des cas de récidive à plus de 15 ans du traitement initial ont même été rapportés. En pratique, le suivi repose au moins sur un examen clinique trimestriel pendant les 3 premières années puis annuel pendant 10 ans avec biopsie de la moindre lésion suspecte de récidive locale (ulcération, infiltration). En revanche, il n’existe pas de recommandations pour un bilan paraclinique mais des imageries et des coloscopies répétées sont utiles pour dépister un éventuel cancer métachrone.5
La cicatrisation des lésions du patient se fait correctement, de manière dirigée avec des soins locaux quotidiens. Cependant, une adénopathie inguinale droite survient au bout de quelques semaines. La tomodensitométrie couplée à la tomographie à émission de positons (TEP/TDM) montre une fixation hypermétabolique anale avec une SUVmax* à 7 et une fixation bilatérale des ganglions inguinaux et ilio-obturateurs avec une SUV entre 1,9 et 4,4. La ponction-biopsie du ganglion inguinal révèle la présence d’un adénocarcinome peu différencié compatible avec la lésion périanale réséquée.
Le dossier du patient est présenté en réunion de concertation pluridisciplinaire d’oncologie digestive. Une radio-chimiothérapie suivie d’une amputation abdomino-périnéale complémentaire avec curage ganglionnaire sont proposées, mais le patient refuse la chirurgie. Il reçoit donc une chimiothérapie par Folfox, puis par Xeloda associée à 45 Gy d’une radio- thérapie pelvienne couvrant les aires inguinales.
Il est actuellement en pause thérapeutique depuis 12 mois, asymptomatique sur le plan clinique (fig. 5) avec une stabilité en imagerie.
La cicatrisation des lésions du patient se fait correctement, de manière dirigée avec des soins locaux quotidiens. Cependant, une adénopathie inguinale droite survient au bout de quelques semaines. La tomodensitométrie couplée à la tomographie à émission de positons (TEP/TDM) montre une fixation hypermétabolique anale avec une SUVmax* à 7 et une fixation bilatérale des ganglions inguinaux et ilio-obturateurs avec une SUV entre 1,9 et 4,4. La ponction-biopsie du ganglion inguinal révèle la présence d’un adénocarcinome peu différencié compatible avec la lésion périanale réséquée.
Le dossier du patient est présenté en réunion de concertation pluridisciplinaire d’oncologie digestive. Une radio-chimiothérapie suivie d’une amputation abdomino-périnéale complémentaire avec curage ganglionnaire sont proposées, mais le patient refuse la chirurgie. Il reçoit donc une chimiothérapie par Folfox, puis par Xeloda associée à 45 Gy d’une radio- thérapie pelvienne couvrant les aires inguinales.
Il est actuellement en pause thérapeutique depuis 12 mois, asymptomatique sur le plan clinique (fig. 5) avec une stabilité en imagerie.
Références
1. De Parades V, Zeitoun JD, Contou JF, Molinié V. Les éponymes en coloproctologie… Paget de la maladie. Colon Rectum 2013;7:117-8.
2. Minocozzi A, Borzellino G, Momo R, Steccanella F, Pitoni F, de Manzoni G. Perianal Paget’s disease: presentation of six cases and lierature review. Int J Colorectal Dis 2010;25:1-7.
3. Nagai Y, Kazama S, Yamada D, et al. Perianal and vulvar extramammary Paget disease : a report of six cases and mapping biopsy of the anal canal. Ann Dermatol 2016;5:624-8.
4. Kim SJ, Thompson AK, Zubair AS, et al. Surgical treatment and outcomes of patients with extramammary Paget disease: a cohort study. Dermatol Surg 2017;43:708-14.
5. Sephered V, Davidson EJ, Davis-Humphreys J. Extramammary Paget’s disease. BJOG 2005;112:273-9.
6. Isik O, Aytac E, Brainard J, Valente MA, Abbas MA, Gorgun E. Perianal Paget’s disease: three decades experience of a single institution. Int J Colorectal Dis 2016;31:29-34.
2. Minocozzi A, Borzellino G, Momo R, Steccanella F, Pitoni F, de Manzoni G. Perianal Paget’s disease: presentation of six cases and lierature review. Int J Colorectal Dis 2010;25:1-7.
3. Nagai Y, Kazama S, Yamada D, et al. Perianal and vulvar extramammary Paget disease : a report of six cases and mapping biopsy of the anal canal. Ann Dermatol 2016;5:624-8.
4. Kim SJ, Thompson AK, Zubair AS, et al. Surgical treatment and outcomes of patients with extramammary Paget disease: a cohort study. Dermatol Surg 2017;43:708-14.
5. Sephered V, Davidson EJ, Davis-Humphreys J. Extramammary Paget’s disease. BJOG 2005;112:273-9.
6. Isik O, Aytac E, Brainard J, Valente MA, Abbas MA, Gorgun E. Perianal Paget’s disease: three decades experience of a single institution. Int J Colorectal Dis 2016;31:29-34.
Dans cet article
- Quels diagnostics évoquer devant une dermatose anale chronique ?
- Quelles sont les caractéristiques de la maladie de Paget ano-périnéale ?
- Quel est le mécanisme histopathogénique ?
- Quel est l’apport de l’histologie ?
- Quel bilan faut-il faire ?
- Quel est le traitement ?
- Quel est le pronostic ?
- Quel doit être le suivi post-thérapeutique ?