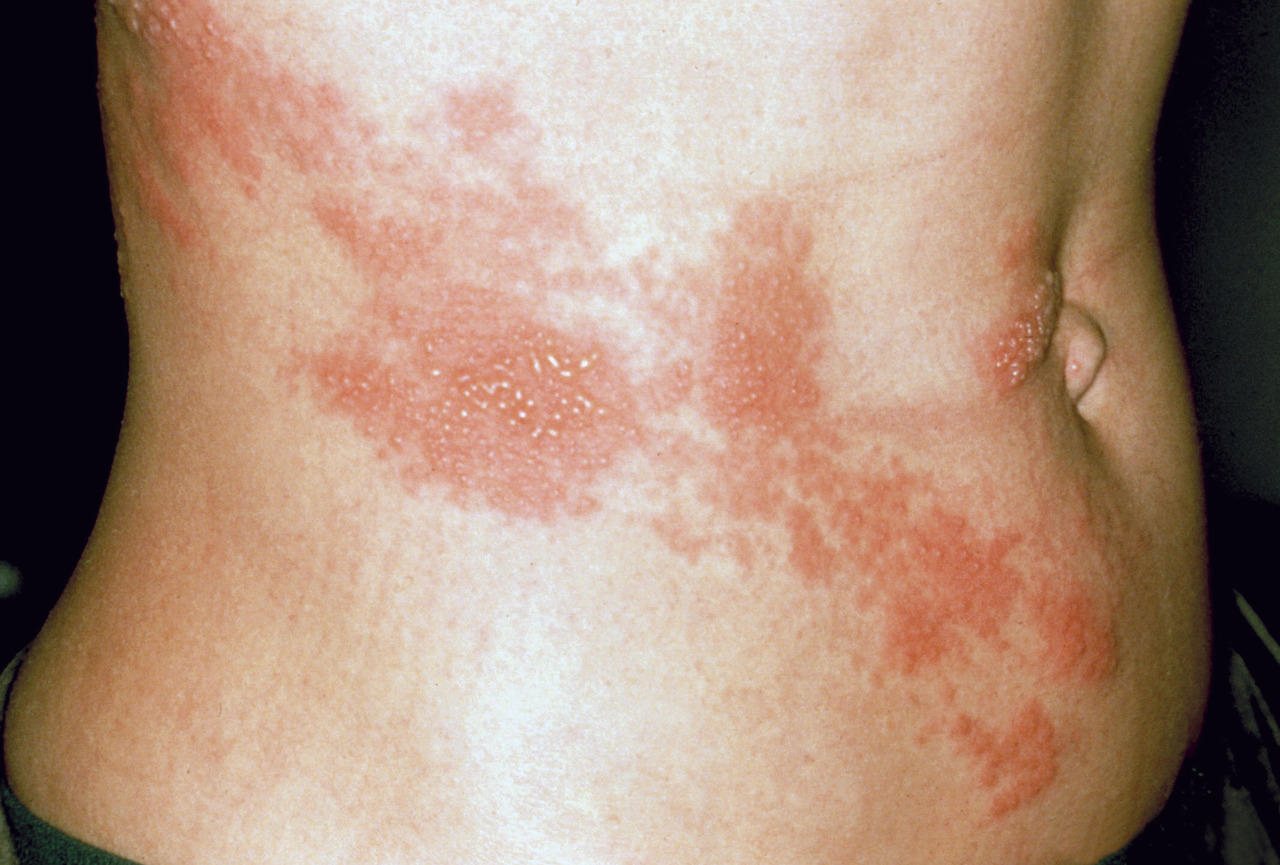
Le risque de zona et de douleurs post-zostériennes augmente beaucoup après 50 ans. La vaccination est efficace et recommandée entre 65 et 74 ans, mais en pratique seul 1 % de cette population cible est vaccinée en France.
Le zona est une maladie virale commune liée à la réactivation du virus varicelle-zona (VZV) acquis plus tôt, majoritairement dans l’enfance ; après une primo-infection symptomatique (varicelle) ou non (la quasi-totalité des individus de plus de 50 ans ont eu un contage avec ce virus), le virus se loge au fond des ganglions spinaux de certains dermatomes. Les systèmes immunitaires innés et acquis maintiennent une réponse T proliférative au sein de ces ganglions empêchant la prolifération du virus. Il existe en particulier une réponse T proliférative très bien connue et toute diminution de cette vigilance immunitaire entraîne une prolifération du virus varicelle-zona et la survenue d’un zona sous la forme d’une éruption érythémateuse et vésiculeuse souvent douloureuse dans les dermatomes correspondants.1 Des liens entre la diminution de cette veille immunologique et les circonstances d’immunodépression sont démontrés depuis longtemps.1 Ainsi, infection par le virus de l’immunodéficience humaine, cancers, transplantations d’organe, traitements immunosuppresseurs sont associés à une augmentation du risque de zona. Cependant, en dehors de toute comorbidité, le vieillissement représente un sur-risque majeur de zona. L’immunosénescence (immunodépression liée au vieillissement) entraîne une décroissance de prolifération lymphocytaire T, spécifique du virus varicelle-zona. Bien qu’hétérogène, elle se manifeste généralement aux environs de 50 ans ; de façon remarquable, l’incidence annuelle du zona est assez stable jusqu’à 50 ans (de 2 à 4/10 000 individus) et commence à augmenter fortement vers ce même âge pour atteindre plus de 12 à 14/10 000 vers 80 ans quel que soit le pays étudié.1 Ainsi, si 1 personne sur 4 ou 5 aura un zona durant sa vie, deux tiers des zonas surviennent après 50 ans.
La douleur post-zostérienne de type neuropathique est la complication la mieux connue du zona, plus fréquente chez les plus âgés avec près de 30 % de douleurs post-zostériennes à 1 mois chez les plus de 70 ans et plus de 15 % chez les plus de 80 ans à 1 an.2 L’impact des douleurs post-zostériennes sur le fonctionnement cognitif, les effets indésirables des traitements antalgiques prescrits au long cours et les accidents vasculaires cérébraux comptent parmi les autres complications du zona.3 Plusieurs hypothèses physiopathologiques sont avancées concernant les accidents vasculaires cérébraux aux premiers rangs desquels l’inflammation aiguë mais aussi une atteinte directe du virus varicelle-zona sur l’endothélium vasculaire cérébral créant une véritable pathologie vasculaire à virus varicelle-zona (JID). Au-delà, le zona a un impact plus global en altérant le statut fonctionnel et la qualité de vie des patients les plus âgés, deux enjeux majeurs dans la prise en charge de cette population.4 Bien qu’ils réduisent la durée du portage et la survenue de nouvelles lésions, les traitements curatifs ne sont efficaces que dans les 48 heures qui suivent le début de la phase aiguë et réduisent modérément la survenue des douleurs post-zostériennes.
La pathologie est donc relativement bien connue mais peu d’avancées avaient été réalisées en termes de prévention jusqu’à l’arrivée d’un vaccin vivant atténué il y a plus de 10 ans ;3, 4 depuis quelques années un second vaccin de type conjugué a aussi montré son intérêt.
La douleur post-zostérienne de type neuropathique est la complication la mieux connue du zona, plus fréquente chez les plus âgés avec près de 30 % de douleurs post-zostériennes à 1 mois chez les plus de 70 ans et plus de 15 % chez les plus de 80 ans à 1 an.2 L’impact des douleurs post-zostériennes sur le fonctionnement cognitif, les effets indésirables des traitements antalgiques prescrits au long cours et les accidents vasculaires cérébraux comptent parmi les autres complications du zona.3 Plusieurs hypothèses physiopathologiques sont avancées concernant les accidents vasculaires cérébraux aux premiers rangs desquels l’inflammation aiguë mais aussi une atteinte directe du virus varicelle-zona sur l’endothélium vasculaire cérébral créant une véritable pathologie vasculaire à virus varicelle-zona (JID). Au-delà, le zona a un impact plus global en altérant le statut fonctionnel et la qualité de vie des patients les plus âgés, deux enjeux majeurs dans la prise en charge de cette population.4 Bien qu’ils réduisent la durée du portage et la survenue de nouvelles lésions, les traitements curatifs ne sont efficaces que dans les 48 heures qui suivent le début de la phase aiguë et réduisent modérément la survenue des douleurs post-zostériennes.
La pathologie est donc relativement bien connue mais peu d’avancées avaient été réalisées en termes de prévention jusqu’à l’arrivée d’un vaccin vivant atténué il y a plus de 10 ans ;3, 4 depuis quelques années un second vaccin de type conjugué a aussi montré son intérêt.
Vaccin vivant atténué
Depuis la fin des années 2000 un vaccin vivant atténué, Zostavax, a montré une efficacité à prévenir le zona et ses conséquences (douleurs post- zostériennes, qualité de vie, statut fonctionnel). Il est recommandé aux États-Unis depuis plus de 10 ans et en France depuis 2016. Ce vaccin est fabriqué à partir de la même souche que le vaccin anti-varicelle de l’enfant mais 10 fois plus concentré. Le schéma vaccinal est simple et consiste en une injection unique par voie sous-cutanée. Il est contre-indiqué seulement en cas de déficit immunitaire ou d’allergie, et sa pratique ne nécessite aucune sérologie préalable. Il peut être injecté chez les patients sous anticoagulants. Depuis 10 ans, les données d’efficacité et de tolérance en vraie vie sont nombreuses et ne révèlent que peu d’effets indésirables :5 les plus fréquents (> 10 %) sont représentés par un érythème (35 %), une douleur au point d’injection (34,5 %), un œdème ou un prurit (26,2 %) au point d’injection ou des céphalées (6,3 %) ; hématome, induration, chaleur au point d’injection sont rares (1/100) ; la survenue d’une varicelle est exceptionnelle (< 1/10 000). Une étude pivot a montré dans la population cible des plus de 50 ans (69 ans en moyenne) une réduction de l’incidence du zona de 51,3 % (intervalle de confiance [IC] à 95 % : 44,2-57,6), une prévention des douleurs post-zostériennes de 66,5 % (IC à 95 % : 47,5-79,2) et une diminution de 66 % du fardeau (déclin fonctionnel) secondaire à un épisode de zona.1 L’efficacité sur l’incidence annuelle du zona décroît avec l’âge (20 % après 80 ans), mais la réduction des douleurs post-zostériennes et de l’impact sur le statut fonctionnel est quasi identique quel que soit l’âge.1
La durée de l’efficacité vaccinale reste débattue et aucun délai de revaccination n’est actuellement proposé alors qu’il semble qu’au-delà de 10 ans le taux d’individus protégés serait très faible. Aux États-Unis, premier pays à avoir recommandé la vaccination et où un nouveau vaccin vient d’être recommandé en première ligne, un délai de 5 ans est proposé chez les individus déjà vaccinés en insistant sur le fait qu’il n’y a pas d’étude montrant moins d’efficacité ni plus d’effets indésirables en proposant des délais plus courts.
Depuis 2016, ce vaccin est recommandé par plusieurs sociétés européennes pour tout individu de plus de 50 ans. Cependant, les politiques vaccinales à travers le monde étant fondées non seulement sur l’efficacité des vaccins mais aussi sur l’intérêt économique qu’on leur accorde (étude de coût-efficacité), le vaccin Zostavax a été recommandé de façon très variable même à l’intérieur de l’Europe. En France, la recommandation concerne uniquement les personnes de 65 à 74 ans et le remboursement est partiel (35 % par l’Assurance maladie). La faible politique d’implantation de cette stratégie, les difficultés d’interprétation de cette recommandation et probablement la méconnaissance de la haute prévalence de la maladie de la part des professionnels de santé concourent certainement à une couverture vaccinale très faible de l’ordre de 1 % dans la population cible.
À l’opposé, en 2013, à la suite d’une recommandation édictée en 2010 à partir de données médico-économiques (étude coût-efficacité dans le contexte anglais), l’Angleterre mettait en place une stratégie vaccinale globale en proposant le vaccin chez les patients de 70 ans avec un rattrapage pour une tranche d’âge supérieure jusqu’à 79 ans.6 Depuis cette même année et chaque année est publiée la tranche d’âge à vacciner. En parallèle, un programme d’implantation stricte a été élaboré associant à la fois des incitations à vacciner visant les médecins généralistes, un accès au vaccin facilité en le proposant en même temps que le vaccin antigrippal, suivis d’une mesure de l’efficacité sur l’incidence du zona et des couvertures vaccinales. Les résultats sont probants avec des taux de couverture variant de 72 % la première année à 58 % la dernière année et une efficacité sur l’incidence et les complications légèrement supérieures aux données attendues.6 Début 2018, alors que l’incidence du zona avait nettement diminué chez les sujets vaccinés entre 2013 et 2017, il existait une diminution parallèle des couvertures vaccinales ; grâce à ses données de surveillance, le comité technique vaccinal anglais a adapté immédiatement ses recommandations en élargissant la période de vaccination à l’année entière pour faciliter l’accès au vaccin.7 Cela démontre en matière de politique vaccinale qu’une recommandation n’a d’impact qu’associée à un programme d’implantation et d’analyse d’impact.
La durée de l’efficacité vaccinale reste débattue et aucun délai de revaccination n’est actuellement proposé alors qu’il semble qu’au-delà de 10 ans le taux d’individus protégés serait très faible. Aux États-Unis, premier pays à avoir recommandé la vaccination et où un nouveau vaccin vient d’être recommandé en première ligne, un délai de 5 ans est proposé chez les individus déjà vaccinés en insistant sur le fait qu’il n’y a pas d’étude montrant moins d’efficacité ni plus d’effets indésirables en proposant des délais plus courts.
Depuis 2016, ce vaccin est recommandé par plusieurs sociétés européennes pour tout individu de plus de 50 ans. Cependant, les politiques vaccinales à travers le monde étant fondées non seulement sur l’efficacité des vaccins mais aussi sur l’intérêt économique qu’on leur accorde (étude de coût-efficacité), le vaccin Zostavax a été recommandé de façon très variable même à l’intérieur de l’Europe. En France, la recommandation concerne uniquement les personnes de 65 à 74 ans et le remboursement est partiel (35 % par l’Assurance maladie). La faible politique d’implantation de cette stratégie, les difficultés d’interprétation de cette recommandation et probablement la méconnaissance de la haute prévalence de la maladie de la part des professionnels de santé concourent certainement à une couverture vaccinale très faible de l’ordre de 1 % dans la population cible.
À l’opposé, en 2013, à la suite d’une recommandation édictée en 2010 à partir de données médico-économiques (étude coût-efficacité dans le contexte anglais), l’Angleterre mettait en place une stratégie vaccinale globale en proposant le vaccin chez les patients de 70 ans avec un rattrapage pour une tranche d’âge supérieure jusqu’à 79 ans.6 Depuis cette même année et chaque année est publiée la tranche d’âge à vacciner. En parallèle, un programme d’implantation stricte a été élaboré associant à la fois des incitations à vacciner visant les médecins généralistes, un accès au vaccin facilité en le proposant en même temps que le vaccin antigrippal, suivis d’une mesure de l’efficacité sur l’incidence du zona et des couvertures vaccinales. Les résultats sont probants avec des taux de couverture variant de 72 % la première année à 58 % la dernière année et une efficacité sur l’incidence et les complications légèrement supérieures aux données attendues.6 Début 2018, alors que l’incidence du zona avait nettement diminué chez les sujets vaccinés entre 2013 et 2017, il existait une diminution parallèle des couvertures vaccinales ; grâce à ses données de surveillance, le comité technique vaccinal anglais a adapté immédiatement ses recommandations en élargissant la période de vaccination à l’année entière pour faciliter l’accès au vaccin.7 Cela démontre en matière de politique vaccinale qu’une recommandation n’a d’impact qu’associée à un programme d’implantation et d’analyse d’impact.
Vaccin inactivé recombinant et adjuvanté
Un second vaccin anti-zona a été testé ces dernières années, Shingrix. Ce vaccin est préparé à partir d’une glycoprotéine E recombinée (gpE) du virus varicelle-zona associée à un adjuvant déjà connu, le AS01B. La protéine gpE étant impliquée dans la réplication et la prolifération du virus varicelle-zona, elle constitue une cible de réponse cellulaire T ; l’adjuvant AS01B stimulant une forte réponse humorale et cellulaire T, il serait rationnel d’obtenir une forte réponse vaccinale.8, 9
Le schéma vaccinal consiste en l’administration de deux doses en intramusculaire, la seconde devant être injectée entre 2 et 6 mois après la première.
Deux essais randomisés en double aveugle (ZOE-50 et ZOE-70) ont été récemment conduits pour mesurer l’impact de ce nouveau vaccin sur l’incidence du zona ; la définition des cas était clinique (cas vu par un médecin < 48 heures) avec confirmation par polymerase chain reaction (PCR) de la présence de l’ADN du virus varicelle-zona sur 3 prélèvements sur 3 lésions, ou sur avis d’un comité spécifique si la PCR était douteuse. Ils ont montré une réduction de près de 90 % de l’incidence du zona chez les individus de plus de 50 ans sur une période de suivi de plus de 3 ans. Cette remarquable réduction concernait de façon exceptionnelle toutes les tranches d’âge. Les analyses spécifiques chez les plus de 80 ans ont en effet montré des taux d’efficacité comparables avec près de 90 % de réduction de l’incidence du zona.8, 9
En revanche, les effets indésirables étaient nombreux après chacune des injections ; 79 % des personnes vaccinées avaient une réaction locale (douleur, rougeur ou œdème) et 53 % une réaction systémique (fatigue, fièvre, myalgie, symptômes gastro- intestinaux ou frissons) ; des effets indésirables de grade 3 locaux ou systémiques étaient aussi présents respectivement chez 8,5 % et 6 % des individus.8, 9 Aucun effet indésirable n’a limité la pratique de la seconde dose réalisée chez plus de 95 % des sujets de l’étude ZOE-70.9
Le vaccin est recommandé en première intention aux États-Unis depuis début 2018 ; il peut être réalisé en même temps que le vaccin antigrippal quadrivalent non adjuvé, en cas d’immunodépression modérée (avant chimiothérapie ou sous faible dose de corticothérapie, équivalent-prednisone 20 mg), sans besoin de recourir à une sérologie VZV préalable et pour toutes les populations de plus de 50 ans ;10 en Europe, la demande est acceptée depuis mars 2018.11 Il reste à chaque pays à le certifier, recommander et mettre en place une réelle politique d’implantation et de suivi.
Le schéma vaccinal consiste en l’administration de deux doses en intramusculaire, la seconde devant être injectée entre 2 et 6 mois après la première.
Deux essais randomisés en double aveugle (ZOE-50 et ZOE-70) ont été récemment conduits pour mesurer l’impact de ce nouveau vaccin sur l’incidence du zona ; la définition des cas était clinique (cas vu par un médecin < 48 heures) avec confirmation par polymerase chain reaction (PCR) de la présence de l’ADN du virus varicelle-zona sur 3 prélèvements sur 3 lésions, ou sur avis d’un comité spécifique si la PCR était douteuse. Ils ont montré une réduction de près de 90 % de l’incidence du zona chez les individus de plus de 50 ans sur une période de suivi de plus de 3 ans. Cette remarquable réduction concernait de façon exceptionnelle toutes les tranches d’âge. Les analyses spécifiques chez les plus de 80 ans ont en effet montré des taux d’efficacité comparables avec près de 90 % de réduction de l’incidence du zona.8, 9
En revanche, les effets indésirables étaient nombreux après chacune des injections ; 79 % des personnes vaccinées avaient une réaction locale (douleur, rougeur ou œdème) et 53 % une réaction systémique (fatigue, fièvre, myalgie, symptômes gastro- intestinaux ou frissons) ; des effets indésirables de grade 3 locaux ou systémiques étaient aussi présents respectivement chez 8,5 % et 6 % des individus.8, 9 Aucun effet indésirable n’a limité la pratique de la seconde dose réalisée chez plus de 95 % des sujets de l’étude ZOE-70.9
Le vaccin est recommandé en première intention aux États-Unis depuis début 2018 ; il peut être réalisé en même temps que le vaccin antigrippal quadrivalent non adjuvé, en cas d’immunodépression modérée (avant chimiothérapie ou sous faible dose de corticothérapie, équivalent-prednisone 20 mg), sans besoin de recourir à une sérologie VZV préalable et pour toutes les populations de plus de 50 ans ;10 en Europe, la demande est acceptée depuis mars 2018.11 Il reste à chaque pays à le certifier, recommander et mettre en place une réelle politique d’implantation et de suivi.
CONCLUSION
Compte tenu de l’impact démontré du zona sur la dépendance (statut fonctionnel) et de l’efficacité du vaccin actuellement disponible (Zostavax) pour la prévenir, l’ensemble de la population vieillissante devrait déjà pouvoir bénéficier de cette vaccination. Plus encore, l’arrivée du vaccin recombinant adjuvanté, Shingrix, aux résultats prometteurs pour toutes les populations notamment les plus âgées devrait permettre de rendre le zona exceptionnel et d’en diminuer le fardeau. Cela ne dépend donc que de la politique d’implantation vaccinale décidée et évaluée, tournée en particulier vers les médecins de soins primaires responsables communautaires de la prévention vaccinale. V
Références
1. Levin MJ. Immune senescence and vaccines to prevent herpes zoster in older persons. Cur Op Immunol 2012;494-500.
2. Bouhassira D, Chassany O, Gaillat J, et al. Patient perspective on herpes zoster and its complications: an observational prospective study in patients aged over 50 years in general practice. Pain 2012;153:342-9.
3. Attal N, Deback C, Gavazzi G, et al; Herpes Zoster and Functional Decline Consortium. Functional decline and herpes zoster in older people: an interplay of multiple factors. Aging Clin Exp Res 2015;27:757-65.
4. Johnson RW, Rice AS. Clinical practice. Postherpetic neuralgia. N Engl J Med 2014;371:1526-33.
5. Langan SM, Smeeth L, Margolis DJ, Thomas SL. Herpes zoster vaccine effectiveness against incident herpes zoster and post-herpetic neuralgia in an older US population: a cohort study. PLoS Med 2013;10:e1001420.
6. Amirthalingam G, Andrews N, Keel P, et al. Evaluation of the effect of the herpes zoster vaccination programme 3 years after its introduction in England: a population-based study. Lancet Public Health 2018;3:e82-e90.
7. Cosford P, Swindells M. The shingles immunisation programme: evaluation of the programme and implementation in 2018. https://assets.publishing.service.gov.uk ou https://bit.ly/2Jwb6sy
8. Lal H, Cunningham AL, Godeaux O, et al. Efficacy of an adjuvanted herpes zoster subunit vaccine in older adults. N Eng J Med 372:2087-96.
9. Cunningham AL, Lal H, Kovac M, et al. Impact of the herpes zoster subunit vaccine in adults 70 years of age or older. N Eng J Med 2016;375:1019-32.
10. Dooling KL, Guo A, Patel M, et al. Recommendations of the Advisory Committee on Immunization Practices for Use of Herpes Zoster Vaccines. MMWR Morb Mortal Wkly Rep 2018;67:103-8.
11. European Commission (2018) Community register of medicinal products for human use. http://ec.europ a.eu/healt h/docum ents/community-regis ter/html/h1272.htm#EndOf Page
2. Bouhassira D, Chassany O, Gaillat J, et al. Patient perspective on herpes zoster and its complications: an observational prospective study in patients aged over 50 years in general practice. Pain 2012;153:342-9.
3. Attal N, Deback C, Gavazzi G, et al; Herpes Zoster and Functional Decline Consortium. Functional decline and herpes zoster in older people: an interplay of multiple factors. Aging Clin Exp Res 2015;27:757-65.
4. Johnson RW, Rice AS. Clinical practice. Postherpetic neuralgia. N Engl J Med 2014;371:1526-33.
5. Langan SM, Smeeth L, Margolis DJ, Thomas SL. Herpes zoster vaccine effectiveness against incident herpes zoster and post-herpetic neuralgia in an older US population: a cohort study. PLoS Med 2013;10:e1001420.
6. Amirthalingam G, Andrews N, Keel P, et al. Evaluation of the effect of the herpes zoster vaccination programme 3 years after its introduction in England: a population-based study. Lancet Public Health 2018;3:e82-e90.
7. Cosford P, Swindells M. The shingles immunisation programme: evaluation of the programme and implementation in 2018. https://assets.publishing.service.gov.uk ou https://bit.ly/2Jwb6sy
8. Lal H, Cunningham AL, Godeaux O, et al. Efficacy of an adjuvanted herpes zoster subunit vaccine in older adults. N Eng J Med 372:2087-96.
9. Cunningham AL, Lal H, Kovac M, et al. Impact of the herpes zoster subunit vaccine in adults 70 years of age or older. N Eng J Med 2016;375:1019-32.
10. Dooling KL, Guo A, Patel M, et al. Recommendations of the Advisory Committee on Immunization Practices for Use of Herpes Zoster Vaccines. MMWR Morb Mortal Wkly Rep 2018;67:103-8.
11. European Commission (2018) Community register of medicinal products for human use. http://ec.europ a.eu/healt h/docum ents/community-regis ter/html/h1272.htm#EndOf Page