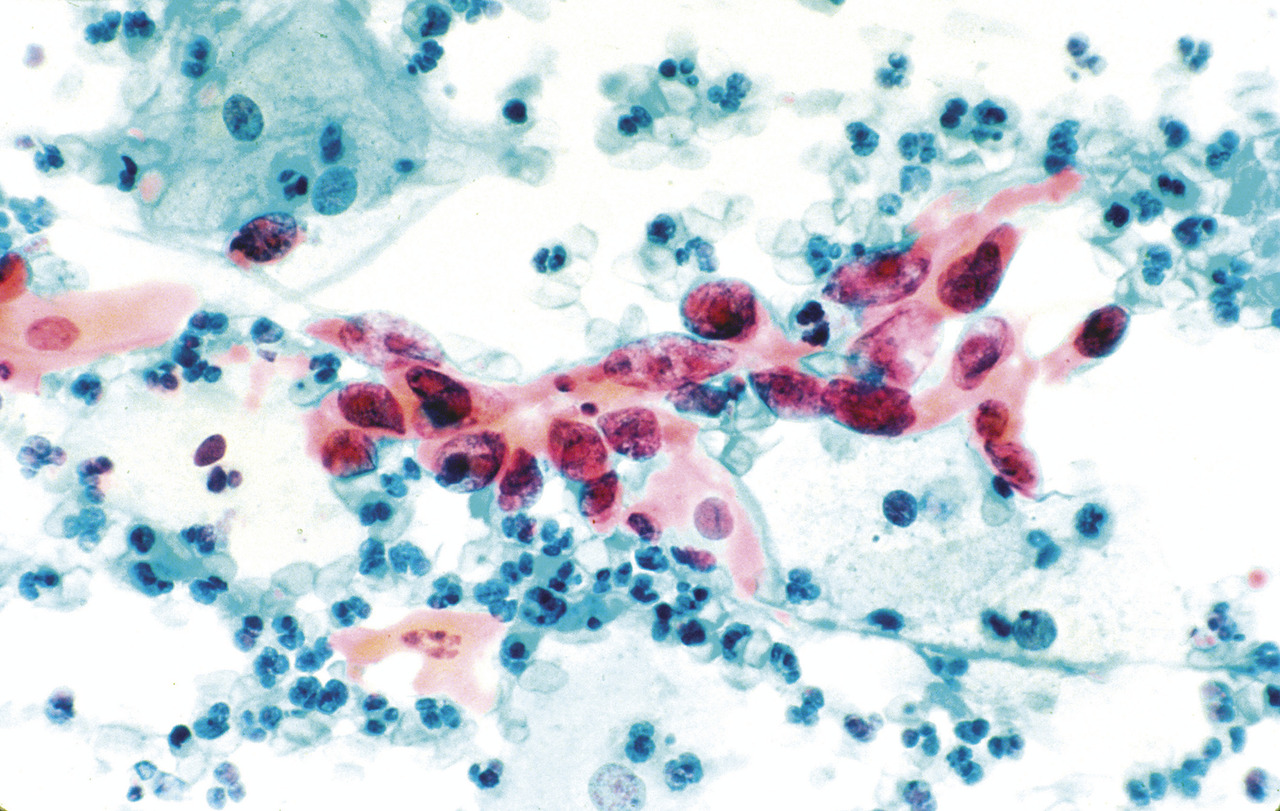
Chez la femme, le cancer du col de l’utérus est le plus fréquent et le plus connu, mais d’autres cancers peuvent être dus aux papillomavirus : cancer de la vulve et du vagin. Chez l’homme, le cancer du pénis, rare, peut être dû aux papillomavirus. Enfin, dans les deux sexes, outre les verrues génitales dont les condylomes acuminés, les papillomavirus peuvent être responsables des cancers de l’anus et d’une fraction importante des cancers de la gorge. Les recommandations vaccinales françaises concernent les filles de 11 à 14 ans, avec un rattrapage jusqu’à 19 ans révolus, et les hommes ayant des relations sexuelles avec d’autres hommes jusqu’à 26 ans. Comparée à d’autres pays, la couverture vaccinale est particulièrement basse en France.
Les papillomavirus : 13 génotypes carcinogènes
Ils se répartissent en papillomavirus à faible risque et à haut risque en fonction de leur potentiel oncogène. Parmi les virus à bas risque oncogène, les génotypes 6 et 11 sont responsables de 90 % des condylomes. Parmi les virus à haut risque oncogène, 13 génotypes ont été considérés comme carcinogènes par l’International Agency for Research on Cancer (IARC) en fonction de leur prévalence dans les cancers du col de l’utérus. Les génotypes 16 et 18 sont en cause dans 50 à 60 % des lésions précancéreuses de haut grade et 70 % des cancers du col de l’utérus. Ils sont par ailleurs détectés dans 70 à 80 % des cancers de l’anus, dans 55 à 60 % des cancers du vagin, 48 et 40 % respectivement des cancers du pénis et de la vulve.
Les génotypes 31, 33, 45, 52 et 58 sont responsables de 30 à 40 % des lésions précancéreuses de haut grade, de 15 à 20 % des cancers du col, 18 % des cancers du vagin, 4 à 11 % des cancers de l’anus, 10 à 14 % des cancers de la vulve et 9 % des cancers du pénis.1
Les papillomavirus sont associés à près de 100 % de cancers du col de l’utérus, 90 % des cancers de l’anus, 70 % des cancers du vagin, 50 % des cancers du pénis, 40 % des cancers de la vulve et 20 à 60 % des cancers de l’oropharynx.
Le cancer du col de l’utérus est au 4e rang des cancers de la femme au niveau mondial, avec plus de 500 000 nouveaux cas par an et 500 000 décès. Il occupe la 11e place en France, avec 3 000 nouveaux cas par an et 1 000 décès. La mise en place de programmes de dépistage des lésions précancéreuses par cytologie cervico-utérine a permis de diminuer son incidence en France comme dans de nombreux pays industrialisés.
Les cancers de l’anus, de la vulve et du vagin sont plus rares. Le nombre annuel de cancer de l’anus est estimé à environ 1 000 par an en France (800 cas chez les femmes et 300 chez les hommes).
L’infection génitale par un papillomavirus est très fréquente chez les hommes et les femmes sexuellement actifs. L’exposition aux papillomavirus se produit chez les sujets jeunes peu après le début de l’activité sexuelle. On estime que 80 % des femmes sont infectées par les papillomavirus au cours de leur vie.
L’infection naturelle induit, par l’intermédiaire des protéines de capsides L1, des anticorps neutralisants spécifiques dans 50 à 70 % des cas susceptibles d’induire une protection partielle contre une nouvelle infection. Il existe également une immunité à médiation cellulaire susceptible de faire régresser les lésions associées aux virus. Après l’infection, le virus est éliminé dans l’immense majorité des cas. En l’absence de contrôle de l’infection par le système immunitaire, celle-ci peut persister, et les lésions peuvent évoluer vers des lésions précancéreuses. Là encore, ces lésions peuvent régresser mais parfois évoluer vers un cancer.
Les différentes lésions observées sont classées d’après leur aspect cytologique. On distingue les lésions malpighiennes intraépithéliales de signification indéterminée (ASC-US pour atypical squamous cell of undetermined significance), les lésions malpighiennes intraépithéliales de bas grade (LSIL pour low grade squamous intraepithelial lesion), les lésions malpighiennes intraépithéliales de haut grade (HSIL pour high grade squamous intraepithelial lesion) et les cancers invasifs. Les lésions de bas grade sont les CIN1 (CIN pour cervical intarepithelial neoplasia). Les lésions de haut grade regroupent les CIN2 et les CIN3.
Recommandations vaccinales actuelles en France
Trois vaccins contre les infections à papillomavirus disposent d’une autorisation de mise sur le marché (AMM) en Europe et sont disponibles en France :
– Cervarix, vaccin bivalent qui comporte les génotypes 16 et 18 (laboratoire GSK) ;
– Gardasil ou Gardasil 4 (Sanofi Pasteur MSD) comportant les génotypes 6, 11, 16, 18 ;
– Gardasil 9 (MSD) comportant les 4 génotypes de Gardasil 4 et 5 génotypes supplémentaires, 31, 33, 45, 52, 58.2
Les schémas d’administration sont de 2 doses espacées de 6 mois chez les 11-14 ans ; et de 3 doses (0 ; 1 à 2 mois ; 6 mois) chez les 15-26 ans.
Les recommandations françaises actuelles sont de vacciner toutes les filles de 11-14 ans et d’effectuer un rattrapage jusqu’à l’âge de 19 ans révolus. Il existe par ailleurs une recommandation de vacciner les hommes homosexuels jusqu’à 26 ans et les sujets immunodéprimés des deux sexes de 9 à 23 ans.3
Tolérance des vaccins
Compte tenu de l’âge d’administration du vaccin, de nombreux travaux ont été consacrés aux risques de maladies auto-immunes dans les suites de cette vaccination. Les résultats de ces travaux vont tous dans le même sens : il n’y a pas d’augmentation du risque de développer une maladie auto-immune dans la population vaccinée, par rapport à la population non vaccinée. L’étude française coordonnée par l’Agence nationale de sécurité du médicament (ANSM) et la Caisse nationale d’assurance maladie (CNAM)5 a comparé la survenue de 14 maladies auto-immunes dans une cohorte de 2 256 716 filles dont 842 120 vaccinées, pendant 3 ans. Dans la totalité de la cohorte, 3 974 maladies auto-immunes se sont révélées au cours de l’étude : 2 978 dans la population non vaccinée et 996 dans la population vaccinée : il n’y a donc pas d’augmentation du risque dans la population vaccinée, ce qui en langage statistique se traduit par hazard ratio ajusté (HRa) = 1,07 (intervalle de confiance [IC] à 95 % : 0,99-1,16).
Dans cette même étude, l’effectif très important permet d’étudier le risque maladie par maladie. On trouve une augmentation du risque d’apparition d’un syndrome de Guillain-Barré dans la population vaccinée par rapport à la population non vaccinée : odds ratio (OR) = 4 (IC à 95 % : 1,84-8,69). Cela voudrait dire que, du fait de la rareté du syndrome de Guillain-Barré, le nombre de cas supplémentaires de ce syndrome attribuables à la vaccination serait de l’ordre de 1 ou 2 cas pour 100 000 jeunes filles vaccinées. Deux autres études, effectuées sur des effectifs encore plus importants (10 millions en Angleterre et 60 millions aux États-Unis), n’ont pas montré d’augmentation de risque du syndrome de Guillain-Barré, de même que deux études effectuées respectivement en Suède et au Danemark après utilisation du vaccin quadrivalent. Après plus de 10 ans de recul et 270 millions de doses distribuées, la conclusion de l’Organisation mondiale de la santé est que ce vaccin est bien toléré,6 conclusion partagée par une récente revue Cochrane.7
Immunogénicité-efficacité des vaccins
Lors des essais cliniques, un pic du titre d’anticorps est observé 4 semaines après la 3e dose suivi d’un déclin au cours de la première année puis d’une stabilisation en plateau. Les titres d’anticorps restent élevés pendant au moins 10 ans pour les vaccins bi- et quadrivalents et au moins 5 ans (mais le recul est par définition moins important) pour le vaccin nonavalent.
Les trois vaccins ont tous été initialement homologués pour un schéma de vaccination à 3 doses.
Le schéma à 2 doses a ensuite été approuvé pour les trois vaccins chez les 9-15 ans après avoir montré la non-infériorité de la réponse immunitaire par rapport à celle des jeunes femmes adultes chez lesquelles l’efficacité était attestée.
Efficacité des vaccins bivalent et tétravalent
Méta-analyse de la revue Cochrane
Les conclusions de la récente revue Cochrane7 qui a inclus 26 études contrôlées randomisées totalisant 73 428 femmes sont que les vaccins réduisent le risque de lésion cervicale précancéreuse CIN2+ associées aux HPV 16 et 18 de 164 à 2 pour 10 000 chez les femmes de 15 à 25 ans non infectées par les papillomavirus et le risque de lésions précancéreuses, quel que soit le type de papillomavirus, de 287 à 106 pour 10 000.Chez les femmes quel que soit leur statut HPV (positif ou négatif) vaccinées entre 15 et 26 ans, la vaccination réduit le risque de lésions précancéreuses associées aux HPV 16 et 18 de 341 à 157 pour 10 000, et le risque de lésions précancéreuses tous types d’HPV confondus de 559 à 391 pour 10 000.
Des études à plus long terme sont nécessaires pour évaluer les effets sur les cancers.
Efficacité des vaccins bi- et tétravalent sur le terrain
Efficacité sur la circulation des virus dont les génotypes sont contenus dans les vaccins et donc sur la prévalence et l’incidence des infections à HPV vaccinaux dans divers pays, Australie, États-Unis, Royaume-Uni : après 6 ans de disponibilité du vaccin tétravalent, on observe une réduction de 86 % de la prévalence des infections dues aux virus vaccinaux chez les femmes de 18 à 24 ans ayant un schéma vaccinal complet par rapport aux femmes non vaccinées en Australie, et de 89 % chez les jeunes filles ou jeunes femmes de 14 à 24 ans après au moins une dose de vaccin aux États-Unis.8-10Efficacité du vaccin quadrivalent sur les condylomes, en particulier en Australie, avec une franche diminution de leur prévalence chez les femmes jeunes ayant bénéficié de la vaccination mais aussi chez les hommes jeunes hétérosexuels alors qu’ils ne sont pas vaccinés, témoignant d’une immunité de groupe, lorsque la couverture vaccinale des filles est suffisamment élevée.11
Efficacité sur les lésions précancéreuses : réduction de 45 % des CIN2/3 (IC à 95 % : 33-57) chez des femmes de 11 à 27 ans ayant eu un schéma vaccinal complet par rapport aux femmes non vaccinées en Australie,12 réduction de 73 % (IC à 95 % : 33-90) des lésions CIN 2/3 au Danemark chez les femmes vaccinées13 et de 75 % (IC à 95 % : 65-82) des lésions CIN2 en Suède14 chez les femmes vaccinées avant 17 ans.
Efficacité sur les cancers : un premier travail (suivi de cohortes ayant participé à des essais cliniques) vient de rapporter une efficacité sur les cancers en comparant 9 529 femmes vaccinées entre 14 et 19 ans à 178 38 femmes non vaccinées avec 10 cancers liés à HPV dans le groupe non vacciné contre 0 dans le groupe vacciné.15
Efficacité du vaccin nonavalent
Infection par le papillomavirus chez les hommes
Elle est supérieure à 20 % dans plus de la moitié des études rapportées. L’HPV 16 est le plus fréquent. Le risque d’acquisition d’une infection génitale par le papillomavirus augmente avec le nombre de partenaires. Ce risque est plus important chez les homosexuels masculins.
Chez les hommes hétérosexuels, la prévalence des infections anales par les papillomavirus était de 24,8 % dans une étude réalisée aux États-Unis et un tiers des infections étaient dues à des papillomavirus oncogènes.18 La prévalence est plus élevée chez les homosexuels masculins et encore plus élevée chez les homosexuels masculins infectés par le virus de l’immunodéficience humaine (VIH).
La prévalence de l’infection orale est de l’ordre de 4 à 7 %, en fonction des études. Elle augmente avec l’âge, le nombre de partenaires sexuels et le nombre de cigarettes fumées par jour.
Les verrues anogénitales touchent autant la population masculine que féminine. En France, le nombre de nouveaux cas par an a été estimé à 20 000 chez les femmes et 23 000 chez les hommes.18 Les HPV 6 et 11 sont en cause dans plus de 90 % des condylomes acuminés. Les verrues ano- génitales sont contagieuses. Elles n’évoluent pas vers des lésions néoplasiques mais ont un caractère récidivant dans 30 % des cas.
Cancers
Cancer anal
L’incidence mondiale se situe en moyenne autour de 1 cas pour 100 000 et est en augmentation chez les hommes et chez les femmes. Les données des registres français estiment pour l’année 2015 à 280 nouveaux cas chez les hommes et 800 cas chez les femmes.Les incidences les plus élevées sont constatées chez les homosexuels masculins, les femmes ayant un antécédent de cancer du col utérin ou de la vulve ainsi que chez les personnes immunodéprimées. Le risque de cancer anal est 20 fois plus élevé chez les homosexuels masculins que chez les hétérosexuels, ceux infectés par le VIH étant les plus à risque. Le type histologique le plus fréquent est le carcinome épidermoïde. Le lien entre l’infection par HPV 16 et le cancer anal est considéré comme causal. C’est le génotype le plus prévalent. Les papillomavirus sont présents dans la majorité des néoplasies anales intraépithéliales : 91,5 % dans les AIN1 (AIN pour anal intraepithelial neoplasia) et 93,9 % dans les AIN 2/3.
Cancer du pénis
On estime qu’entre un quart et la moitié des cancers du pénis sont attribuables aux papillomavirus à haut risque oncogène. L’incidence du cancer du pénis est faible en Europe et en Amérique du Nord.18Cancer de la sphère oto-rhino-pharyngée
Le lien de causalité est aujourd’hui établi entre l’infection persistante par HPV 16 et les cancers de la région oropharyngée (oropharynx, amygdale, base de la langue) ainsi que ceux de la cavité buccale. Une étude rétrospective multicentrique effectuée en France et ayant collecté 314 échantillons de tumeurs de l’oropharynx et de la cavité orale a mis en évidence la présence d’ADN de papillomavirus dans 46,5 % des cancers de l’oropharynx (dans 89,7 % des cas HPV 16) et dans 10,5 % des cancers de la cavité orale (dans 95,5 % des cas HPV 16).Outre l’infection par HPV 16, des facteurs de risque indépendants sont en cause dans une proportion importante de ces cancers, en premier lieu le tabac et l’alcool.
En France, les registres des cancers regroupent les localisations « lèvres-bouche-pharynx ». L’incidence de ces cancers se situe au 5e rang des cancers chez l’homme, avec 8 010 nouveaux cas estimés en 2015, et au 10e rang chez la femme, avec 3 600 cas estimés en 2015.
Vaccination des hommes dans les autres pays
– aux États-Unis chez les garçons de 11-12 ans, avec un rattrapage des 13-21 ans ; la vaccination est également recommandée pour les homosexuels masculins jusqu’à 26 ans ; la couverture vaccinale pour 3 doses reste faible : 21,6 % en 2014 ;
– en Australie chez les garçons de 12-13 ans, avec un rattrapage des 14-15 ans ; la couverture vaccinale à 15 ans était de 72,9 % en 2016 (78,6 % pour les filles de même âge) ;19
– au Canada chez les sujets de sexe masculin de 9 à 26 ans ; une seule province (Île-du-Prince-Édouard) a mis en place le programme ; en 2013-2014, la couverture vaccinale des garçons est de 79 % (85 % chez les filles) ;
– l’Autriche est le seul pays d’Europe à recommander le vaccin chez le garçon depuis 2008.
Immunogénicité
Les réponses en anticorps anti-HPV des garçons âgés de 9 à 15 ans ne sont pas inférieures aux réponses observées chez les hommes âgés de 16 à 26 ans pour lesquels une efficacité a été établie dans les études de phase III. L’immunogénicité est corrélée à l’âge et est significativement plus élevée chez les sujets jeunes au moins après la 3e injection.
Efficacité
Les critères d’efficacité étaient les lésions génitales externes liées aux HPV 6, 11, 16 et 18 (verrues génitales externes, néoplasies intraépithéliales péniennes, périnéales, périanales de grade 1/2/3 et infections persistantes) et dans la population homosexuelle les néoplasies intraépithéliales anales et le cancer anal. Une efficacité a été démontrée contre les verrues génitales et, chez les homosexuels masculins, contre les lésions précancéreuses anales.18-20
Tolérance
Discussion : qui vacciner ?
En ce qui concerne la France, il est fondamental d’appliquer les recommandations et d’augmenter la couverture vaccinale des filles. L’étude de la couverture vaccinale d’autres pays montre qu’une fois de plus nous sommes très en retard. En 2016, la couverture vaccinale des filles de 11-14 ans en France était de 19,1 % pour 1 dose. Comparativement, la couverture vaccinale pour la vaccination complète est de 42 % aux États-Unis, de 78 % en Australie, 88 % en Suède, 86 % au Royaume-Uni et 87 % au Portugal.
Les raisons de cette très mauvaise couverture vaccinale française sont multiples et ne peuvent être analysées ici. De nombreuses jeunes filles ne vont pouvoir que regretter de ne pas s’être fait vacciner. Une campagne de promotion de cette vaccination serait la bienvenue, et seul l’État peut en avoir la responsabilité. La gratuité de cette vaccination pour la population ou son remboursement à 100 % comme c’est le cas pour le vaccin triple rougeole-oreillons-rubéole serait un signe fort et contribuerait à l’augmentation de la couverture vaccinale.
Les recommandations françaises actuelles, hormis pour les homosexuels masculins ne concernent que les filles. La question de la vaccination de tous les garçons doit être posée.
La recommandation de ne vacciner que les homosexuels masculins, si elle n’est justifiée que par la preuve d’efficacité vis-à-vis des lésions précancéreuses anales, ne peut pas résumer l’intérêt de ces vaccins chez les hommes.
L’argument qui veut que la vaccination des hommes soit d’autant moins nécessaire que la couverture vaccinale des filles est élevée traduit une réalité sur le plan scientifique et statistique mais n’est pas réaliste sur le plan pragmatique. D’une part, la couverture vaccinale des filles est faible et, en supposant qu’on parvienne à l’élever à un niveau assurant au minimum une immunité de groupe qui semble être d’au moins 50 %, il faudra du temps, et pendant ce temps il n’existe chez l’homme aucune protection individuelle et aucun dépistage concernant les lésions précancéreuses anales.
Certes, il n’est pas démontré d’action sur les cancers de l’oropharynx et de la cavité buccale, mais quel est le risque, y compris en santé publique, de parier sur l’efficacité en sachant que de façon certaine le fait de vacciner les garçons et les filles ralentira la diffusion du virus, donc de l’infection et donc de ses conséquences. Souvenons-nous de la rubéole. La vaccination des hommes contre ce virus ne présente aucun intérêt d’un point de vue de la protection individuelle, pourtant il a fallu vacciner à la fois les hommes et les femmes pour obtenir des résultats conséquents sur la circulation du virus et maintenant espérer l’élimination de la rubéole congénitale qui sera obtenue avec l’augmentation de la couverture vaccinale.
Pour toutes ces raisons, la recommandation vaccinale doit s’étendre à tous les garçons.
On pourrait y ajouter un argument d’équité au moins au titre de la protection individuelle.
Promouvoir et élargir la vaccination
Dans quelles circonstances le vaccin est-il actuellement remboursé ?
Le vaccin contre le papillomavirus est actuellement remboursé dans le cadre des recommandations du HCSP :— pour les filles, il suffit de respecter l’âge (11-14 ans et rattrapage jusqu’à 19 ans) ;— pour les garçons, dans la mesure où la recommandation est ciblée sur une catégorie très précise, la prescription du vaccin à un homme de 25 ans peut ainsi ne pas être remboursé. Si on prescrit le vaccin Gardasil 9 à un garçon de 25 ans, il ne sera pas remboursé. C’est sans doute une des raisons des recommandations du HCSP de mettre à disposition ce vaccin dans les Cegidd (centres gratuits d’information, de dépistage et de diagnostic) et les centres de vaccination aux hommes ayant eu des relations sexuelles avec les hommes jusqu’à l’âge de 26 ans.
2. Haut Conseil de la santé publique. Avis relatif à la place du vaccin Gardasil 9 dans la stratégie actuelle de prévention des infections à papillomavirus humains, 10 février 2017 http://www.hcsp.fr/explore.cgi/avisrapportsdomaine?clefr=602
3. Calendrier des vaccinations et recommandations vaccinales 2018.
4. Haut Conseil de la santé publique. Vaccination contre les infections à papillomavirus humains. Rapport – données actualisées – 10 juillet 2014.
5. Agence nationale de sécurité du médicament et des produits de santé, Caisse nationale d’assurance maladie. Vaccins anti-HPV et risque de maladies auto-immunes : étude pharmaco épidémiologique. Rapport final ANSM-CNAM, septembre 2015
6. World Health Organisation – Organisation mondiale de la santé. Weekly epidemiological record – Relevé épidémiologique hebdomadaire 2017;92:241-68.
7. Arbyn M, Xu L, Simoens C, Martin-Hirsch PPL. Proplylactic vaccination against human papillomavirus to prevent cervical cancer and its precursors. Cochrane Database Syst Rev. 2018 May 9;5:CD009069.
8. Garland SM, Kjaer SK Munoz M, et al. Impact and effectiveness of the quadrivalent human papillomavirus vaccine: a systematic review of ten years of real-world experience. Clin Infect Dis 2016;63:519-27.
9. Markowitz LE, Gui L, Hariri S, Steinau M, Dunne EF, Unger ER. Prevalence of HPV after introduction of the vaccination program in the United States. Pediatrics 2016;137(3):e20151968.
10. Tabrizi SN, Brotherton JM, Kaldor JM, et al. Assessment of herd immunity and cross-protection after a human papillomavirus vaccination programme in Australia: a repeat cross-sectional study. Lancet Infect Dis 2014;14:958-66.
11. Ali H, Donovan B, Wand H, et al. Genital warts in young australians five years into national human papillomavirus vaccination programme: national surveillance data. BMJ 2013;346:f2942.
12. Crowe E, Pandeya N, Brotherton JM, et al. Effectiveness of quadrivalent human papillomavirus vaccine for the prevention of cervical abnormalities: case-control study nested within a population based screening programme in Australia. BMJ 2014;348:g1458.
13. Baldur-Felskov B, Dehlendorff C, Munk C, Kjaer SK. Early impact of human papillomavirus vaccination on cervical neoplasia nationwide follow-up of young danish women. J Natl Cancer Inst 2014;106:djt460.
14. Herweijer E, Sundstrom K, Ploner A, Uhnoo I, Sparen P, Amheim-Dahlstrom L. Quadrivalent HPV vaccine effectiveness against high grade cervical lesions by age at vaccination: a population-based study. Int J Cancer 2016;138:2867-74.
15. Luostarinen T, Apter D, Dillner J, et al. Vaccination protects against invasive HPV – associated cancers. Int J Cancer 2018;142:2186-57.
16. Joura EA, Giuliano AR, Iversen OE, et al. A 9-valent HPV vaccine against infection and intraepithelial neoplasia in women. N Engl J Med 2015;372:711-23.
17. Huh WK, Joura EA, Giuliano AR, et al. Finaly, immunogenicity and safety analyses of a nine-valent human papillomavirus vaccine in women aged 16-26 years: a randomised, double-blind trial. Lancet 2017;390:2143-59.
18. Haut Conseil de la santé publique. Avis relatif aux recommandations vaccinales contre les infections à papillomavirus humains chez les hommes, 19 février 2016. http://www.hcsp.fr/explore.cgi/avisrapportdomaine?clefr=552
19. Hall MT, Simms KT, Lew JB, et al. The projected timeframe until cervical cancer elimination in Australia: a modelling study. Lancet Public Health 2018.pii: S2468-2667(18)30183-X.
20. Harder T, Wichmann O, Klug SJ, Vandersande M, Wiese-Posselt M. Efficacy effectiveness and safety of vaccination against human papillomavirus in males: a systematic review. BMC Medicine 2018;16:110-24.
Dans cet article
- Les papillomavirus : 13 génotypes carcinogènes
- Recommandations vaccinales actuelles en France
- Tolérance des vaccins
- Immunogénicité-efficacité des vaccins
- Infection par le papillomavirus chez les hommes
- Vaccination des hommes dans les autres pays
- Discussion : qui vacciner ?
- Promouvoir et élargir la vaccination

 Encadrés
Encadrés