Les résultats des essais de phase III de cinq vaccins contre la Covid-19 sont disponibles (pour certains, il s’agit d’une analyse intermédiaire) et plusieurs autres vaccins sont en cours d’essai. Nous proposons un résumé rapide des données de ces premiers vaccins.
Letableau 1 résume leurs caractéristiques. Le vaccin Comirnaty de Pfizer-BioNTech1 et le vaccin de Moderna2 sont des vaccins à ARN messager, tandis que le vaccin d’AstraZeneca3, le vaccin Spout-nik V de Gamaleïa4 et le vaccin Ad26.COV2.S de Janssen5 sont des vaccins à adénovirus.
Tous ces vaccins, sauf celui de Janssen qui est en une dose, consistent en deux doses administrées en principe à 21 ou à 28 jours d’écart, mais dans l’essai du vaccin d’AstraZeneca la durée entre les deux injections a varié entre 4 et 12 semaines. En dehors de l’essai d’AstraZeneca, qui est en grande partie en simple aveugle, les essais sont en double aveugle : ni les participants ni le personnel soignant ne savent si le produit injecté est le vrai vaccin ou le produit contrôle.
Le
Tous ces vaccins, sauf celui de Janssen qui est en une dose, consistent en deux doses administrées en principe à 21 ou à 28 jours d’écart, mais dans l’essai du vaccin d’AstraZeneca la durée entre les deux injections a varié entre 4 et 12 semaines. En dehors de l’essai d’AstraZeneca, qui est en grande partie en simple aveugle, les essais sont en double aveugle : ni les participants ni le personnel soignant ne savent si le produit injecté est le vrai vaccin ou le produit contrôle.
Efficacité
Le critère de jugement principal était le diagnostic de Covid-19 posé à partir de symptômes et confirmé par un test. Le diagnostic était établi sur des bases un peu différentes dans chaque essai, mais ils restent globalement comparables.
Dans l’essai de Pfizer-BioNTech, le diagnostic était établi par la présence d’au moins un des symptômes suivants : fièvre, toux (nouvelle ou augmentation), difficulté respiratoire (nouvelle ou augmentation), frissons, douleurs musculaires (nouvelles ou augmentation), perte de l’odorat, perte du goût, mal de gorge, diarrhée, vomissements, combiné à un test de recherche directe du génome viral (NAAT) positif réalisé sur un prélèvement fait pendant les symptômes ou moins de 5 jours avant ou après.
Dans l’essai de Moderna, le diagnostic était établi soit par la présence d’au moins deux des symptômes suivants : fièvre d’au moins 38 °C, frissons, douleurs musculaires, céphalées, mal de gorge ou perte de l’odorat ou du goût, soit par la présence d’au moins un symptôme respiratoire (toux, essoufflement ou pneumonie confirmée cliniquement ou radiologiquement). Ce diagnostic devait être confirmé par au moins un prélèvement positif pour une reverse transcription polymerase chain reaction (RT-PCR).
Dans l’essai d’AstraZeneca, le diagnostic était établi par la présence d’au moins un des symptômes suivants : fièvre d’au moins 37,8 °C, toux, essoufflement, perte d’odorat ou de goût confirmé par un test NAAT positif.
Dans l’essai de Gamaleïa, le diagnostic était posé à partir d’une PCR positive réalisée à la suite de symptômes signalés par les participants.
Dans l’essai de Janssen, le diagnostic était établi à partir d’un test PCR associé à un ou plusieurs symptômes.
Seuls étaient pris en compte les cas survenant après la seconde dose, plus de 7 jours après pour le vaccin de Pfizer-BioNTech, plus de 14 jours après pour les vaccins de Moderna et d’AstraZeneca, à partir du 21e jour de la première dose pour le vaccin de Gamaleïa, soit le jour même de la seconde dose et à partir du 14e jour après la vaccination pour le vaccin de Janssen.
Dans l’essai du vaccin d’AstraZeneca, des problèmes de dosage du produit actif ont conduit à administrer à une partie des participants une première dose qui était la moitié de la dose prévue.
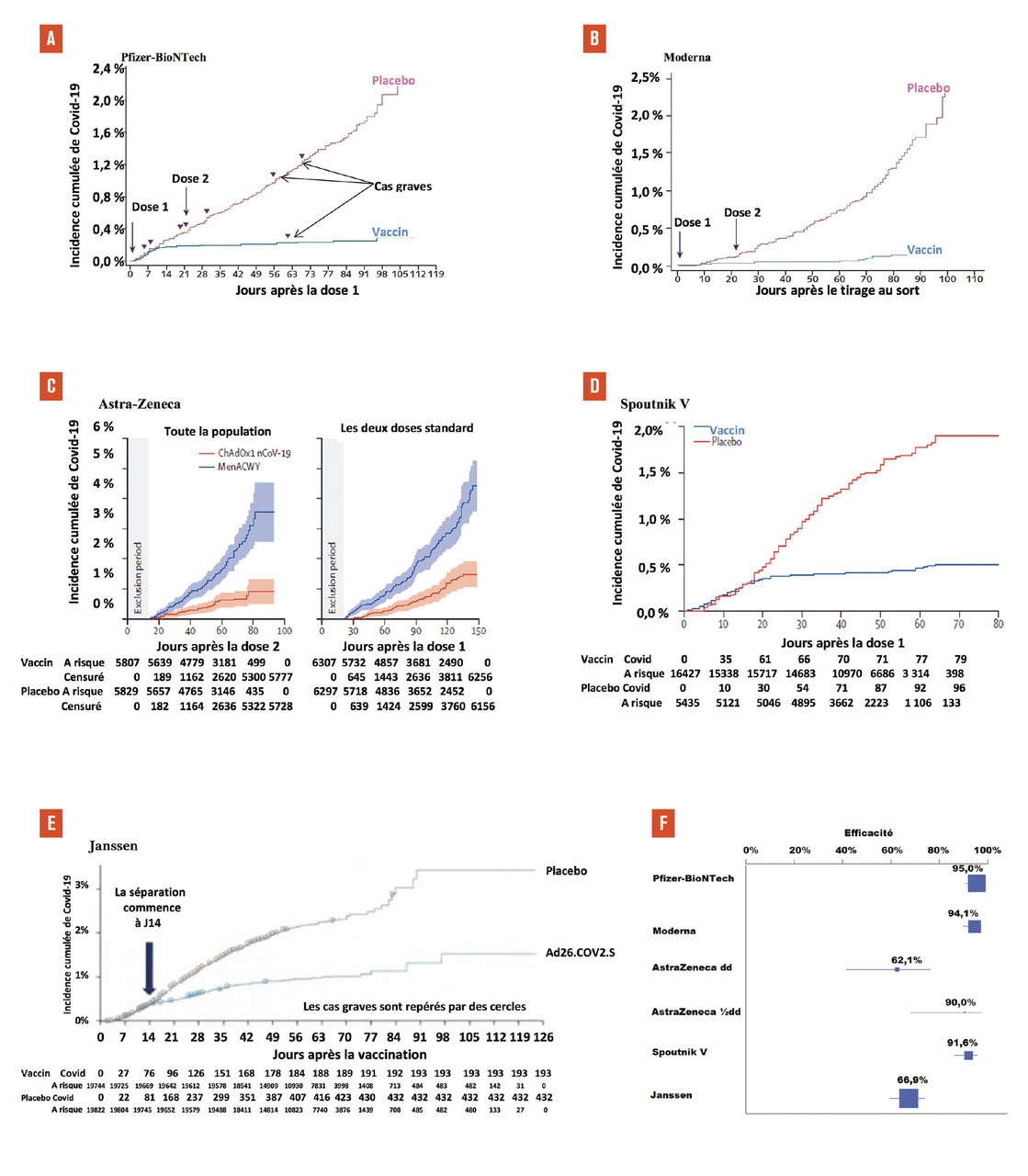
Les résultats sont présentés dans letableau 2 et la figure . Pour les vaccins de Pfizer-BioNTech, Moderna et Gamaleïa, les premiers effets s’observent environ 14 jours après la première injection, quand les deux courbes se séparent (fig. A, B et D ). Pour le vaccin d’AstraZeneca, les courbes ne commencent que 14 jours après la seconde dose ou 20 jours après la dose 1 (fig. C ). Dans l’essai de Janssen, les courbes se séparent 7 jours après l’injection (fig. E ). L’incidence augmente ensuite très peu dans le groupe vacciné. L’efficacité du vaccin de Pfizer-BioNTech est estimée à 95,0 % (intervalle de confiance [IC] à 95 % : 90,3-97,6), celle du vaccin de Moderna est à 94,1 % (IC à 95 % : 89,3-96,8), celle du vaccin d’AstraZeneca est de 62,1 %, dans la population qui a reçu les deux doses standard (IC à 95 % : 41,0-75,7), celle du vaccin de Gamaleïa s’élève à 91,6 % (IC à 95 % : 85,6-95,2), et celle du vaccin de Janssen est de 66,9 % (IC à 95 % : 59,0-73,4). Ces chiffres sont assez satisfaisants dans la mesure où l’efficacité de plusieurs de ces vaccins dépasse l’efficacité de la plupart des vaccins viraux, qui varie entre 60 à 70 %.
Dans l’essai de Pfizer-BioNTech, le diagnostic était établi par la présence d’au moins un des symptômes suivants : fièvre, toux (nouvelle ou augmentation), difficulté respiratoire (nouvelle ou augmentation), frissons, douleurs musculaires (nouvelles ou augmentation), perte de l’odorat, perte du goût, mal de gorge, diarrhée, vomissements, combiné à un test de recherche directe du génome viral (NAAT) positif réalisé sur un prélèvement fait pendant les symptômes ou moins de 5 jours avant ou après.
Dans l’essai de Moderna, le diagnostic était établi soit par la présence d’au moins deux des symptômes suivants : fièvre d’au moins 38 °C, frissons, douleurs musculaires, céphalées, mal de gorge ou perte de l’odorat ou du goût, soit par la présence d’au moins un symptôme respiratoire (toux, essoufflement ou pneumonie confirmée cliniquement ou radiologiquement). Ce diagnostic devait être confirmé par au moins un prélèvement positif pour une reverse transcription polymerase chain reaction (RT-PCR).
Dans l’essai d’AstraZeneca, le diagnostic était établi par la présence d’au moins un des symptômes suivants : fièvre d’au moins 37,8 °C, toux, essoufflement, perte d’odorat ou de goût confirmé par un test NAAT positif.
Dans l’essai de Gamaleïa, le diagnostic était posé à partir d’une PCR positive réalisée à la suite de symptômes signalés par les participants.
Dans l’essai de Janssen, le diagnostic était établi à partir d’un test PCR associé à un ou plusieurs symptômes.
Seuls étaient pris en compte les cas survenant après la seconde dose, plus de 7 jours après pour le vaccin de Pfizer-BioNTech, plus de 14 jours après pour les vaccins de Moderna et d’AstraZeneca, à partir du 21e jour de la première dose pour le vaccin de Gamaleïa, soit le jour même de la seconde dose et à partir du 14e jour après la vaccination pour le vaccin de Janssen.
Dans l’essai du vaccin d’AstraZeneca, des problèmes de dosage du produit actif ont conduit à administrer à une partie des participants une première dose qui était la moitié de la dose prévue.
Les résultats sont présentés dans le
Sécurité
La sécurité des vaccins a été étudiée dans les cinq essais. Le tableau 3 présente les principaux effets relevés.
Les réactions à court terme n’ont été rapportées que pour les vaccins de Pfizer-BioNTech, de Moderna et de Janssen. Une douleur au point d’injection, des maux de tête, de la fatigue et de la fièvre ont été observés plus fréquemment dans le groupe vacciné que dans le groupe placebo, et certains de ces effets indésirables étaient plus fréquents après la seconde dose. Toutefois, ces effets étaient d’une gravité faible ou modérée et ne duraient pas plus de deux à trois jours.
Les effets indésirables à plus long terme sont globalement aussi fréquents dans les deux groupes, en dehors de quatre cas de paralysie faciale rapportés après le vaccin de Pfizer-BioNTech, mais il y en a 3 cas dans le groupe vacciné contre 2 cas dans le groupe placebo dans l’essai du vaccin de Janssen. Les décès étaient également répartis entre les deux groupes et ont été considérés comme étant sans lien avec la vaccination. La sécurité des cinq vaccins est assez similaire à celles des autres vaccins viraux.
La surveillance post-autorisation de mise sur le marché (post-AMM) a mis en évidence un risque de choc anaphylactique estimé à 11 par million de doses du vaccin de Pfizer-BioNTech,6 et à 2,5 par million de doses du vaccin de Moderna.7
La surveillance post-AMM du vaccin d’AstraZeneca en France a été étudiée par les centres de pharmacovigilance d’Amiens et de Rouen.8 Sur la période d’étude du 8 au 11 février 2021, environ 30 000 personnes ont été vaccinées. Un total de 179 cas de syndrome pseudogrippal, dont 81 cas graves, ont été notifiés. Les symptômes associés étaient des céphalées, tremblements, fièvre, trouble de conscience, nausées et vomissements, insomnie, tachycardie, dysesthésie ou paresthésie. La plupart de ces effets sont survenus moins de 24 heures après l’injection du vaccin. Toutefois, sur la période de suivi, il n’y a eu ni hospitalisation ni mise en jeu du pronostic vital. Ces effets indésirables étaient attendus, d’après le résumé des caractéristiques du produit, mais leur sévérité n’avait pas été anticipée. La population ayant reçu ce vaccin devait avoir moins de 65 ans et incluait beaucoup de professionnels de santé. Pour éviter les arrêts de travail simultanés au sein d’un service hospitalier, l’Agence nationale de sécurité du médicament et des produits de santé recommande de ne pas vacciner en même temps le personnel d’un même service.
Les réactions à court terme n’ont été rapportées que pour les vaccins de Pfizer-BioNTech, de Moderna et de Janssen. Une douleur au point d’injection, des maux de tête, de la fatigue et de la fièvre ont été observés plus fréquemment dans le groupe vacciné que dans le groupe placebo, et certains de ces effets indésirables étaient plus fréquents après la seconde dose. Toutefois, ces effets étaient d’une gravité faible ou modérée et ne duraient pas plus de deux à trois jours.
Les effets indésirables à plus long terme sont globalement aussi fréquents dans les deux groupes, en dehors de quatre cas de paralysie faciale rapportés après le vaccin de Pfizer-BioNTech, mais il y en a 3 cas dans le groupe vacciné contre 2 cas dans le groupe placebo dans l’essai du vaccin de Janssen. Les décès étaient également répartis entre les deux groupes et ont été considérés comme étant sans lien avec la vaccination. La sécurité des cinq vaccins est assez similaire à celles des autres vaccins viraux.
La surveillance post-autorisation de mise sur le marché (post-AMM) a mis en évidence un risque de choc anaphylactique estimé à 11 par million de doses du vaccin de Pfizer-BioNTech,6 et à 2,5 par million de doses du vaccin de Moderna.7
La surveillance post-AMM du vaccin d’AstraZeneca en France a été étudiée par les centres de pharmacovigilance d’Amiens et de Rouen.8 Sur la période d’étude du 8 au 11 février 2021, environ 30 000 personnes ont été vaccinées. Un total de 179 cas de syndrome pseudogrippal, dont 81 cas graves, ont été notifiés. Les symptômes associés étaient des céphalées, tremblements, fièvre, trouble de conscience, nausées et vomissements, insomnie, tachycardie, dysesthésie ou paresthésie. La plupart de ces effets sont survenus moins de 24 heures après l’injection du vaccin. Toutefois, sur la période de suivi, il n’y a eu ni hospitalisation ni mise en jeu du pronostic vital. Ces effets indésirables étaient attendus, d’après le résumé des caractéristiques du produit, mais leur sévérité n’avait pas été anticipée. La population ayant reçu ce vaccin devait avoir moins de 65 ans et incluait beaucoup de professionnels de santé. Pour éviter les arrêts de travail simultanés au sein d’un service hospitalier, l’Agence nationale de sécurité du médicament et des produits de santé recommande de ne pas vacciner en même temps le personnel d’un même service.
Décalage de la seconde dose et effet de la première dose
La situation dramatique au Royaume-Uni, avec la présence d’un variant plus contagieux, a contraint le gouvernement britannique à faire le choix de décaler la seconde dose à 12 semaines (durée maximale entre les deux injections dans l’essai de phase III du vaccin d’AstraZeneca) pour l’ensemble des vaccins. Le but de cette stratégie est d’accélérer la vaccination en augmentant le nombre de doses disponibles.
Il n’y a pas de données sur l’effet d’un décalage de la seconde dose pour les vaccins de Pfizer-BioNTech et de Moderna. Cependant, des analyses complémentaires des essais de ces vaccins, réalisées par le comité des vaccinations du Royaume-Uni, ont permis d’estimer l’effet à court terme de la première dose. Dans l’essai du vaccin de Pfizer-BioNTech, la comparaison du risque clinique de la Covid-19 entre les deux groupes, vaccin et placebo, dans les deux semaines encadrant la seconde dose (J15-J28) met en évidence une efficacité de la première dose de 91 % (tableau 4 ). Dans l’essai du vaccin de Moderna, la comparaison des risques chez les participants n’ayant reçu qu’une dose (de vaccin ou de placebo) au moment de l’analyse a montré une réduction du risque de 92,1 % par rapport au placebo (tableau 5 ).
Cependant, l’étude de l’efficacité à court terme de la première dose ne permet pas de conclure qu’une seule dose du vaccin suffirait à assurer une protection durable. Le principe de la seconde dose est de prolonger la protection contre la Covid-19 et de renforcer le système immunitaire.
Le vaccin de Janssen ne nécessite qu’une seule dose, ce qui est un avantage logistique important.
Il n’y a pas de données sur l’effet d’un décalage de la seconde dose pour les vaccins de Pfizer-BioNTech et de Moderna. Cependant, des analyses complémentaires des essais de ces vaccins, réalisées par le comité des vaccinations du Royaume-Uni, ont permis d’estimer l’effet à court terme de la première dose. Dans l’essai du vaccin de Pfizer-BioNTech, la comparaison du risque clinique de la Covid-19 entre les deux groupes, vaccin et placebo, dans les deux semaines encadrant la seconde dose (J15-J28) met en évidence une efficacité de la première dose de 91 % (
Cependant, l’étude de l’efficacité à court terme de la première dose ne permet pas de conclure qu’une seule dose du vaccin suffirait à assurer une protection durable. Le principe de la seconde dose est de prolonger la protection contre la Covid-19 et de renforcer le système immunitaire.
Le vaccin de Janssen ne nécessite qu’une seule dose, ce qui est un avantage logistique important.
Effet de l’âge
Certains pays ont décidé de limiter l’utilisation du vaccin d’AstraZeneca aux personnes de moins de 65 ans (mais ce n’est plus le cas de la France à ce jour). L’argument avancé est que les données sont insuffisantes dans la population plus âgée. En réalité, il y a moins de personnes âgées dans les essais d’AstraZeneca et de Gamaleïa que dans les essais de Pfizer-BioNTech, de Moderna et de Janssen (respectivement 10 % de personnes âgées de plus de 60 ans dans les deux premiers essais et 25%, 25 % et 22 % de personnes de 65 ans et plus dans les trois autres). Mais rien n’indique une différence d’effet en fonction de l’âge.
Discussion
Nous avons résumé les quatre articles et le rapport de la FDA décrivant les essais de phase III des vaccins actuellement disponibles en Occident. L’essai du vaccin d’AstraZeneca est constitué en réalité de l’agrégation de quatre essais qui ont rencontré diverses difficultés : deux de ces essais ont été modifiés en cours d’essai, et deux ont eu des problèmes avec le dosage du vaccin. Dans les deux premiers essais, les participants ne devaient recevoir qu’une seule dose, et les essais ont été ensuite modifiés en ajoutant une seconde dose. Dans le deuxième essai, 57 % des participants ont reçu, lors de la première injection, une dose qui était la moitié de la dose prévue. Dans le quatrième essai, quelques participants ont aussi reçu une demi-dose, certains lors de la première injection et d’autres lors de la seconde injection. Toutes ces complications sont certainement légitimes mais finissent par entacher la crédibilité de l’étude.
Une étude9 portant sur 5,4 millions d’Écossais a comparé l’efficacité des vaccins de Pfizer-BioNTech et d’AstraZeneca. Cette étude, pas encore publiée mais largement relayée dans les médias, a montré que la réduction du risque d’hospitalisation pour Covid-19 était de de 85 % (IC à 95 % : 76-91) avec le vaccin de Pfizer-BioNTech et de 94 % (IC à 95 % : 73-99) avec le vaccin d’AstraZeneca. Ces bons résultats observés avec le vaccin d’AstraZeneca pour un critère d’efficacité différent de celui des essais sont encourageants.
Ces vaccins ne sont pas les seuls disponibles aujourd’hui, mais nous n’avons pas d’information sur les vaccins chinois de Sinopharm, Sinovac et Sinopharm Wuhan. Par ailleurs, nous attendons les données sur les vaccins de CureVac acquis par l’Union européenne, mais toujours en cours d’évaluation, et celui de Novavax.
Une étude9 portant sur 5,4 millions d’Écossais a comparé l’efficacité des vaccins de Pfizer-BioNTech et d’AstraZeneca. Cette étude, pas encore publiée mais largement relayée dans les médias, a montré que la réduction du risque d’hospitalisation pour Covid-19 était de de 85 % (IC à 95 % : 76-91) avec le vaccin de Pfizer-BioNTech et de 94 % (IC à 95 % : 73-99) avec le vaccin d’AstraZeneca. Ces bons résultats observés avec le vaccin d’AstraZeneca pour un critère d’efficacité différent de celui des essais sont encourageants.
Ces vaccins ne sont pas les seuls disponibles aujourd’hui, mais nous n’avons pas d’information sur les vaccins chinois de Sinopharm, Sinovac et Sinopharm Wuhan. Par ailleurs, nous attendons les données sur les vaccins de CureVac acquis par l’Union européenne, mais toujours en cours d’évaluation, et celui de Novavax.
Encadre
Treize pays européens dont la France ont suspendu le vaccin d’AstraZeneca à la suite de plusieurs signalements de problèmes de coagulation. L’OMS et les autorités médicales britanniques appellent à poursuivre la vaccination car il n’existe aucune preuve d’un risque accru de formation de caillots sanguins chez les personnes ayant reçu ce vaccin. Rapportés aux millions de personnes qui ont reçu au moins une dose de ce vaccin, ces cas sont très rares et ne modifient pas significativement le rapport bénéfice-risque. Renoncer à un bénéfice certain par crainte d’un risque dont l’existence reste à démontrer représente une perte de chance importante pour la population française.
Références
1. Polack FP, Thomas SJ, Kitchin N, et al . Safety and efficacy of the BNT162b2 mRNA Covid-19 vaccine. N Engl J Med 2020;383:2603-15.
2. Baden LR, El Sahly AM, Essink B. Efficacy and safety of the mRNA-1273 SARS-CoV-2 vaccine. N Engl J Med 2020;384:403-16.
3. Voysey, Costa Clemens SA, Madhi SA, et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. Lancet 2021;397:99-111.
4. Logunov DY, Dolzhikova IV, Shcheblyakov DV, et al. Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia. Lancet 2021;397:671-81.
5. Agnihothram S. Emergency Use Authorization (EUA) for an Unapproved Product Review Memorandum, 2021.
6. Shimabukuro TT, Cole M, Su JR. Reports of anaphylaxis after receipt of mRNA COVID-19 Vaccines in the US - December 14, 2020-January 18, 2021. JAMA 2021. doi: 10.1001/jama.2021.1967.
7. Centers for Disease Control and Prevention (CDC) COVID-19 Response team; Food and Drug Administration. Allergic reactions including anaphylaxis after receipt of the first dose of Moderna COVID-19 vaccine - United States, December 21, 2020-January 10, 2021. Morb Mortal Wkly Rep 2021;70 :125-9.
8. Agence nationale de sécurité du médicament et des produits de santé. Point de situation sur la surveillance des vaccins contre la COVID-19. Centre régional de pharmacovigilance (CRPV) d’Amiens et CRPV de Rouen. Enquête de pharmacovigilance du vaccin COVID-19 Vaccine AstraZeneca. ANSM, 2021. https://www.ansm.sante.fr/S-informer/Points-d-information-Points-d-information/Point-de-situation-sur-la-surveillance-des-vaccins-contre-la-COVID-198 ou http://bit.ly/2OhqT5o
9. Vasileiou E, Simpson CR, et al. Effectiveness of first dose of COVID-19 vaccines against hospital admissions in Scotland: National Prospective Cohort Study of 5.4 Million People. Lancet 2021, 19 Feb. https://www.ed.ac.uk/files/atoms/files/scotland_firstvaccinedata_preprint.pdf
2. Baden LR, El Sahly AM, Essink B. Efficacy and safety of the mRNA-1273 SARS-CoV-2 vaccine. N Engl J Med 2020;384:403-16.
3. Voysey, Costa Clemens SA, Madhi SA, et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. Lancet 2021;397:99-111.
4. Logunov DY, Dolzhikova IV, Shcheblyakov DV, et al. Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia. Lancet 2021;397:671-81.
5. Agnihothram S. Emergency Use Authorization (EUA) for an Unapproved Product Review Memorandum, 2021.
6. Shimabukuro TT, Cole M, Su JR. Reports of anaphylaxis after receipt of mRNA COVID-19 Vaccines in the US - December 14, 2020-January 18, 2021. JAMA 2021. doi: 10.1001/jama.2021.1967.
7. Centers for Disease Control and Prevention (CDC) COVID-19 Response team; Food and Drug Administration. Allergic reactions including anaphylaxis after receipt of the first dose of Moderna COVID-19 vaccine - United States, December 21, 2020-January 10, 2021. Morb Mortal Wkly Rep 2021;70 :125-9.
8. Agence nationale de sécurité du médicament et des produits de santé. Point de situation sur la surveillance des vaccins contre la COVID-19. Centre régional de pharmacovigilance (CRPV) d’Amiens et CRPV de Rouen. Enquête de pharmacovigilance du vaccin COVID-19 Vaccine AstraZeneca. ANSM, 2021. https://www.ansm.sante.fr/S-informer/Points-d-information-Points-d-information/Point-de-situation-sur-la-surveillance-des-vaccins-contre-la-COVID-198 ou http://bit.ly/2OhqT5o
9. Vasileiou E, Simpson CR, et al. Effectiveness of first dose of COVID-19 vaccines against hospital admissions in Scotland: National Prospective Cohort Study of 5.4 Million People. Lancet 2021, 19 Feb. https://www.ed.ac.uk/files/atoms/files/scotland_firstvaccinedata_preprint.pdf

 Encadrés
Encadrés