En termes de vaccins anti-Covid, les connaissances évoluent à un rythme soutenu. A la rentrée 2021, leur efficacité chez les enfants, la surveillance des événements déclarés comme indésirables, et l’analyse de la relation de cause à effet, ou encore l’impact des variants, étaient d’actualité. A tout moment, cependant, des questions en suspens persistent, qui attendent la publication de nouvelles données.
En date du 29 septembre 2021, cinq vaccins contre la Covid-19 étaient autorisés sur le territoire européen : les vaccins à ARN messager, Comirnaty de Pfizer-BioNTech1 et Spikevax de Moderna2, et les vaccins à adénovirus : Vaxzevria (ancien nom : ChAdOx1 nCoV-19) d’AstraZeneca3, Ad26.COV2.S de Janssen4, enfin Spoutnik V de Gamaleya5, qui n’est pas autorisé en France.
Un résumé rapide des résultats des essais de phase III de ces premiers vaccins a été publié en mars 2021 dans La Revue du Praticien.6 Nouvelles données cliniques et épidémiologiques à l’appui, nous présenterons dans un premier temps les résultats des essais pédiatriques des vaccins Pfizer-BioNTech et Moderna. Puis nous actualiserons les résultats de l’essai d’AstraZeneca et étudierons le risque de thrombose associé à ce vaccin. Enfin, nous présenterons les différents variants du Sars-CoV-2, les résultats d’efficacité des vaccins contre les variants, en insistant sur le variant Delta, aujourd’hui dominant, et les données disponibles sur la réduction de la transmission du virus par les personnes vaccinées.
Un résumé rapide des résultats des essais de phase III de ces premiers vaccins a été publié en mars 2021 dans La Revue du Praticien.6 Nouvelles données cliniques et épidémiologiques à l’appui, nous présenterons dans un premier temps les résultats des essais pédiatriques des vaccins Pfizer-BioNTech et Moderna. Puis nous actualiserons les résultats de l’essai d’AstraZeneca et étudierons le risque de thrombose associé à ce vaccin. Enfin, nous présenterons les différents variants du Sars-CoV-2, les résultats d’efficacité des vaccins contre les variants, en insistant sur le variant Delta, aujourd’hui dominant, et les données disponibles sur la réduction de la transmission du virus par les personnes vaccinées.
Efficacité : mises à jour*
Outre les essais pédiatriques des vaccins à ARN messager, de nouvelles données ont été publiées sur le vaccin d’AstraZeneca, non autorisé chez les enfants.
Vaccins à ARN messager chez les enfants de 12 ans et plus
Concernant le vaccin de Pfizer-BioNTech, l’essai principal décrit dans notre précédent article incluait des personnes de 16 ans et plus. Une extension de cet essai, portant sur 2 260 enfants de 12 à 15 ans, a montré que les taux d’anticorps anti-Sars-CoV-2 étaient comparables dans cette population et chez les 16 à 25 ans du premier essai. L’efficacité du vaccin a été évaluée chez des enfants sans signe d’infection avant l’inclusion ; 18 des 1 129 enfants du groupe contrôle ont eu la Covid-19 contre 0 parmi les 1 131 vaccinés.7
Pour le vaccin Moderna, l’essai principal, décrit dans notre précédent article, incluait des personnes de 18 ans et plus. Un essai complémentaire, incluant un peu plus de 3 000 enfants de 12 à 17 ans, a montré des taux d’anticorps anti-Sars-CoV-2 comparables à ceux qui ont été observés chez les 18 à 25 ans. De plus, aucun des 2 163 enfants vaccinés n’a eu la Covid-19, versus 4 des 1 073 enfants ayant reçu le placebo. Les effets indésirables les plus fréquemment rapportés sont la fatigue, la douleur et la rougeur au point d’injection ; leur intensité est faible à modérée et de courte durée.
Pour le vaccin Moderna, l’essai principal, décrit dans notre précédent article, incluait des personnes de 18 ans et plus. Un essai complémentaire, incluant un peu plus de 3 000 enfants de 12 à 17 ans, a montré des taux d’anticorps anti-Sars-CoV-2 comparables à ceux qui ont été observés chez les 18 à 25 ans. De plus, aucun des 2 163 enfants vaccinés n’a eu la Covid-19, versus 4 des 1 073 enfants ayant reçu le placebo. Les effets indésirables les plus fréquemment rapportés sont la fatigue, la douleur et la rougeur au point d’injection ; leur intensité est faible à modérée et de courte durée.
Vaccin d’AstraZeneca : un deuxième essai américain
Un premier essai clinique, décrit dans notre premier article, a été conduit au Royaume-Uni, au Brésil et en Afrique du Sud. Des problèmes de dosage du produit actif ont conduit à administrer à une partie des participants une première dose qui était la moitié de la dose prévue. L’analyse des résultats montre une efficacité du vaccin de 62,1 % (intervalle de confiance à 95 % (IC à 95 %) : 41,0 %-75,7 %) dans la population qui a reçu les deux doses standard.
Depuis, un deuxième essai a été réalisé aux États-Unis, au Pérou et au Chili.8 Ses caractéristiques sont résumées dans lestableau x 1 et 2. Deux participants sur trois ont reçu le vaccin et un sur trois a reçu du sérum physiologique. Comme dans le premier essai, l’efficacité du vaccin a été évaluée en comparant les pourcentages de cas de Covid-19 symptomatiques survenant au-delà de 15 jours après la deuxième dose et confirmés par un test PCR positif : avec ce critère, l’efficacité s’élève à 76 % (IC à 95 % : 68 %-82 %). Le vaccin protège à 100 % des cas graves de Covid-19 (8 cas dans le groupe placebo, mais aucun dans le groupe vacciné). Les résultats étaient comparables dans les différentes classes d’âge, et 20 % des participants avaient 65 ans ou plus.
La synthèse des résultats des deux essais (avec les deux doses standard pour le premier) aboutit à une estimation globale de l’efficacité sur le risque de Covid-19 symptomatique de 69 % (IC à 95 % : 55,4 %-82,7 %). Dans les deux essais, aucun événement grave n’a été rapporté et identifié comme lié au vaccin. Ce vaccin n’est pas autorisé chez les enfants, les essais n’ont inclus que des personnes de 18 ans et plus.
Depuis, un deuxième essai a été réalisé aux États-Unis, au Pérou et au Chili.8 Ses caractéristiques sont résumées dans les
La synthèse des résultats des deux essais (avec les deux doses standard pour le premier) aboutit à une estimation globale de l’efficacité sur le risque de Covid-19 symptomatique de 69 % (IC à 95 % : 55,4 %-82,7 %). Dans les deux essais, aucun événement grave n’a été rapporté et identifié comme lié au vaccin. Ce vaccin n’est pas autorisé chez les enfants, les essais n’ont inclus que des personnes de 18 ans et plus.
Surveillance post-AMM
On ne peut pas considérer que tous les événements indésirables qui surviennent dans les 15 jours après vaccination sont attribuables au vaccin. En effet, la vie continue après vaccination, et les personnes récemment vaccinées restent exposées aux risques de mort subite cardiaque, d’accidents, etc. C’est donc une erreur d’attribuer au vaccin tous les décès signalés après vaccination. Pour conclure qu’un vaccin augmente un risque, il faut montrer qu’il y a plus de cas chez les personnes vaccinées que chez des personnes comparables non vaccinées.
Vaccin d’AstraZeneca : la fréquence des thromboses estimée à 1/100 000
Les syndromes pseudogrippaux ont été les premiers effets indésirables graves signalés au début de la campagne vaccinale, et ils sont fréquents. En cas de fièvre et/ou de douleurs, l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) conseille de privilégier le paracétamol, à la dose la plus faible et le moins longtemps possible.
À la suite de la vaccination à grande échelle par le vaccin d’AstraZeneca en Europe, des cas de thromboses ont été rapportés chez des personnes récemment vaccinées. Ces thromboses sont particulières par leur siège, cérébral ou abdominal, et par leur association à des signes de coagulation intravasculaire disséminée, en particulier à une thrombopénie. L’Agence européenne du médicament (EMA) a compté 62 cas de thrombose veineuse cérébrale et 24 cas de thrombose veineuse splanchnique responsables de 18 décès, observés jusqu’au 22 mars 2021, date à laquelle 25 millions de personnes avaient reçu au moins une dose de vaccin. Ces cas ont été signalés par les systèmes de surveillance de la Communauté européenne et du Royaume-Uni.9 L’EMA estime la fréquence de ces thromboses à 1 pour 100 000, sur la base des signalements, et a conclu que ces risques rares devaient être mentionnés sur la liste des effets secondaires du vaccin AstraZeneca. Ces effets semblent apparaître, au plus tard, deux semaines après la vaccination.10, 11
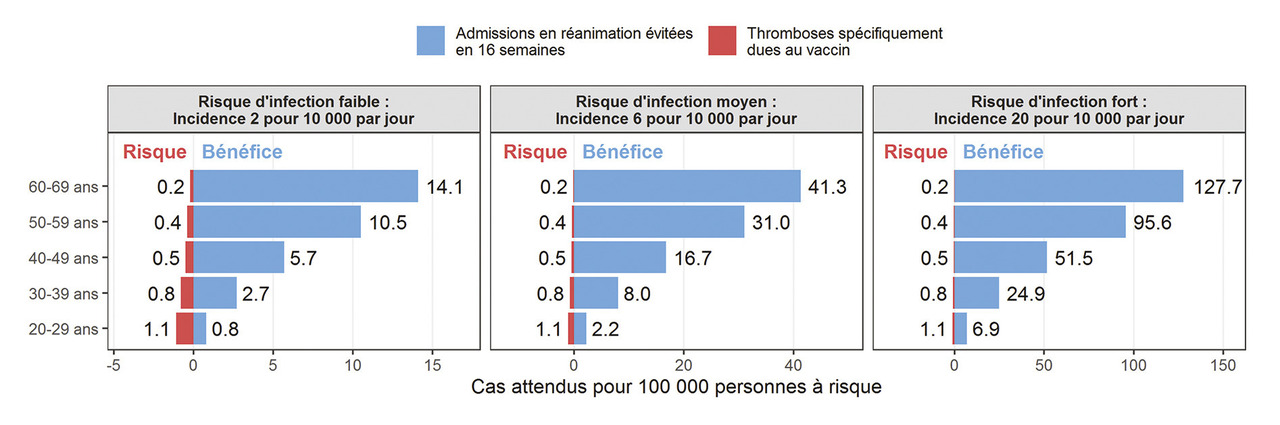
Le Winton Centre for Risk and Evidence Communication de l’université de Cambridge a évalué la balance bénéfice-risque en fonction de l’âge des personnes vaccinées et du risque d’infection12 (fig. 1 ). Cette balance est bien meilleure si le risque d’infection est élevé et si les personnes vaccinées sont âgées. Elle est mauvaise dans la population de 20 à 29 ans et varie, selon le risque d’infection, de 0,8 à 6,9 admissions en réanimation évitées par le vaccin pour 1,1 thrombose causée par le vaccin. Au contraire, la balance bénéfice-risque est bonne dans les autres classes d’âge, et d’autant meilleure que la population est plus âgée (NDLA : L’infection par le Sars-CoV-2 provoque aussi des thromboses).
En France, la Haute Autorité de santé (HAS) a alors recommandé de n’utiliser ce vaccin que chez les personnes de 55 ans ou plus. Les plus jeunes ayant déjà reçu une dose du vaccin AstraZeneca ont ensuite reçu une seconde dose d’un vaccin à ARN messager (Pfizer-BioNTech ou Moderna).13 Cette utilisation successive de deux vaccins différents n’a pas été évaluée.
À la suite de la vaccination à grande échelle par le vaccin d’AstraZeneca en Europe, des cas de thromboses ont été rapportés chez des personnes récemment vaccinées. Ces thromboses sont particulières par leur siège, cérébral ou abdominal, et par leur association à des signes de coagulation intravasculaire disséminée, en particulier à une thrombopénie. L’Agence européenne du médicament (EMA) a compté 62 cas de thrombose veineuse cérébrale et 24 cas de thrombose veineuse splanchnique responsables de 18 décès, observés jusqu’au 22 mars 2021, date à laquelle 25 millions de personnes avaient reçu au moins une dose de vaccin. Ces cas ont été signalés par les systèmes de surveillance de la Communauté européenne et du Royaume-Uni.9 L’EMA estime la fréquence de ces thromboses à 1 pour 100 000, sur la base des signalements, et a conclu que ces risques rares devaient être mentionnés sur la liste des effets secondaires du vaccin AstraZeneca. Ces effets semblent apparaître, au plus tard, deux semaines après la vaccination.10, 11
Le Winton Centre for Risk and Evidence Communication de l’université de Cambridge a évalué la balance bénéfice-risque en fonction de l’âge des personnes vaccinées et du risque d’infection12 (
En France, la Haute Autorité de santé (HAS) a alors recommandé de n’utiliser ce vaccin que chez les personnes de 55 ans ou plus. Les plus jeunes ayant déjà reçu une dose du vaccin AstraZeneca ont ensuite reçu une seconde dose d’un vaccin à ARN messager (Pfizer-BioNTech ou Moderna).13 Cette utilisation successive de deux vaccins différents n’a pas été évaluée.
Le vaccin Janssen, peu utilisé en France
Il faut noter que le vaccin de Janssen, qui repose sur la même technologie d’adénovirus inactivé que celui d’AstraZeneca, pourrait lui aussi provoquer de rares événements thrombotiques (8 cas de thrombose cérébrale ont été signalés, parmi plus de 7 millions de personnes vaccinées). Après une étude de pharmacovigilance, l’EMA a conclu qu’il existe un lien entre la survenue d’une thrombose et ce vaccin. Elle considérait cependant que l’effet est rare, que le rapport bénéfice-risque reste positif et recommandait de continuer à l’utiliser.14
Des données récentes montrent que ce vaccin en dose unique est moins efficace, la HAS a donc conseillé d’injecter une seconde dose avec un vaccin à ARN (https://www.has-sante.fr/jcms/p_3283044/fr/avis-n-2021-0061/ac/seesp-du-23-aout-2021-du-college-de-la-has-relatif-a-la-definition-des-populations-a-cibler-par-la-campagne-de-rappel-vaccinal-chez-les-personnes-ayant-eu-une-primovaccination-complete-contre-la-covid-19). Ce vaccin a été peu utilisé en France.
Des données récentes montrent que ce vaccin en dose unique est moins efficace, la HAS a donc conseillé d’injecter une seconde dose avec un vaccin à ARN (https://www.has-sante.fr/jcms/p_3283044/fr/avis-n-2021-0061/ac/seesp-du-23-aout-2021-du-college-de-la-has-relatif-a-la-definition-des-populations-a-cibler-par-la-campagne-de-rappel-vaccinal-chez-les-personnes-ayant-eu-une-primovaccination-complete-contre-la-covid-19). Ce vaccin a été peu utilisé en France.
Vaccin de Pfizer-BioNTech : le point sur les paralysies faciales et les myocardites
Dans notre premier article, nous avions mentionné plusieurs cas de paralysie faciale après vaccination par le vaccin Comirnaty de Pfizer-BioNTech. Une étude récente, utilisant la base de données de pharmacovigilance de l’Organisation mondiale de la santé (OMS), a comparé les proportions de paralysies faciales parmi les effets indésirables notifiés, avec les vaccins à ARN, d’une part, et les vaccins contre d’autres virus, d’autre part.15 À la date du 9 mars 2021, on dénombrait 844 paralysies faciales (749 cas avec le vaccin Pfizer-BioNTech et 95 avec celui de Moderna) parmi 133 883 effets indésirables relevés pour les vaccins à ARN messager (0,6 %), à comparer à 5 734 paralysies faciales parmi 1 265 182 effets indésirables notifiés pour les vaccins contre d’autres virus (0,5 %). Cette étude indique donc qu’il n’y a pas plus de signalements de paralysies faciales avec ces deux vaccins à ARN contre le Sars-CoV-2 qu’avec les vaccins contre les autres virus. Une publication plus récente rappelle que ces autres vaccins augmentent le risque de paralysie faciale, donc tout ce que l’on peut affirmer est que ce risque n’est pas spécifique des vaccins à ARN contre le Sars-CoV-2 mais est partagé par des vaccins contre d’autres virus.16, 17
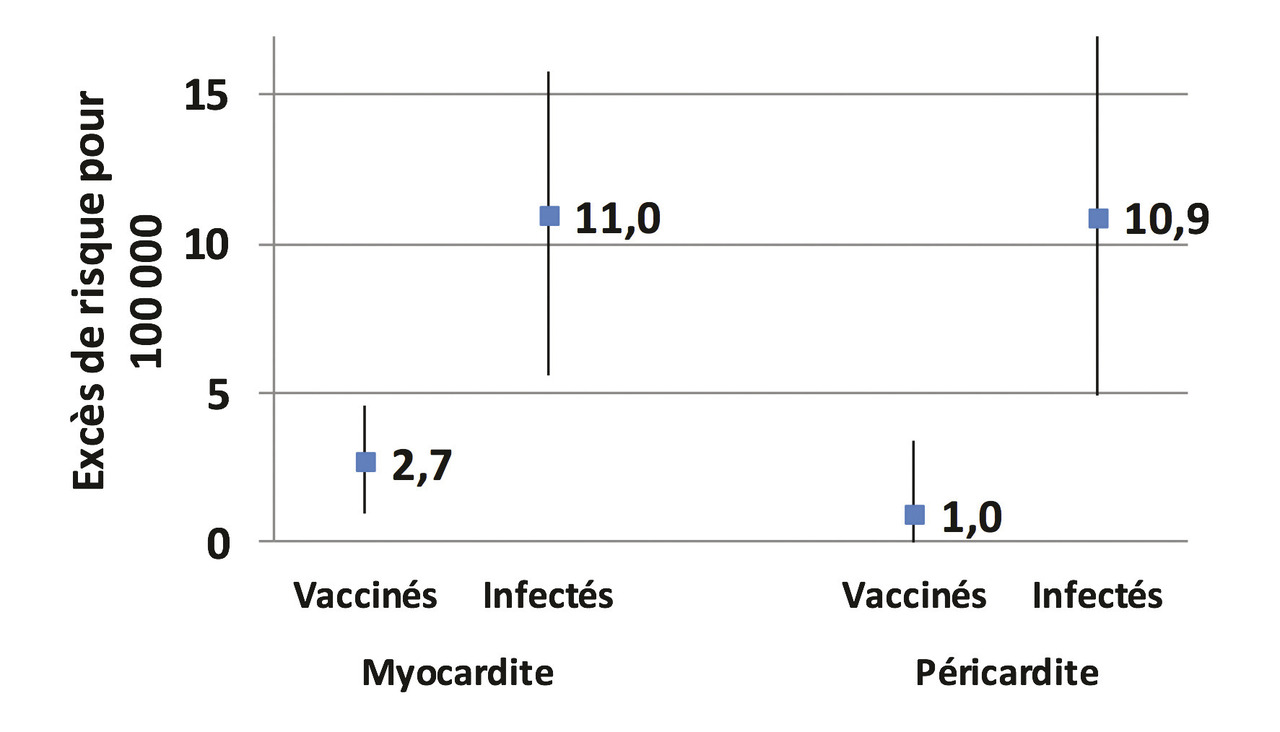
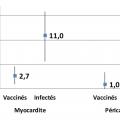
Des cas de myocardites et de péricardites ont été signalés après vaccination contre la Covid-19 avec les vaccins Pfizer ou Moderna. Une étude récente, menée en Israël sur une importante base de données de santé, compare ces risques chez des témoins, des patients infectés par le Sars-CoV-2, et des personnes vaccinées avec le vaccin Pfizer. Comparé à celui des témoins, le risque de myocardite est augmenté de 2,7 pour 100 000 vaccinés mais de 11 pour 100 000 personnes infectées par le Sars-CoV-2 (fig. 2 ).18 Ces effets indésirables doivent être signalés, afin d’assurer une prise en charge rapide en cas de douleur thoracique, de dyspnée ou de palpitations.19
Des cas de myocardites et de péricardites ont été signalés après vaccination contre la Covid-19 avec les vaccins Pfizer ou Moderna. Une étude récente, menée en Israël sur une importante base de données de santé, compare ces risques chez des témoins, des patients infectés par le Sars-CoV-2, et des personnes vaccinées avec le vaccin Pfizer. Comparé à celui des témoins, le risque de myocardite est augmenté de 2,7 pour 100 000 vaccinés mais de 11 pour 100 000 personnes infectées par le Sars-CoV-2 (
Les variants classés selon la dangerosité et la région
Un virus se multiplie dans l’organisme qu’il infecte et cette prolifération peut s’accompagner de mutations, modifications génétiques donnant naissance à de nouveaux variants. Les variants de la Covid-19 sont répertoriés par l’OMS, les Centers for Disease Control and Prevention (CDC) des États-Unis et l’European Center for Disease Control (ECDC)20-22, qui les classent en fonction de leur niveau de dangerosité globale en :
– variant à suivre (« variant of interest », VOI) ;
– variant préoccupant (« variant of concern », VOC) : si on observe une augmentation de la transmissibilité, une maladie plus grave, un échec de certains tests diagnostiques, ou une diminution de l’efficacité des traitements ou des vaccins ;
– variant de haute conséquence (« variant of high consequence », VOHC), en cas de véritable échappement au diagnostic, au traitement ou au vaccin.
Jusqu’à présent, aucun variant n’est considéré comme « de haute conséquence » dans le monde, mais quatre variants sont considérés comme préoccupants selon l’OMS et l’ECDC :
– le variant Alpha (« anglais », B.1.1.7, 501Y.V1) a été découvert en septembre 2020 ; il est 43 à 90 % plus contagieux que les souches préexistantes au Royaume-Uni23, 24 ;
– le variant Bêta (« sud-africain », B.1.351, 501Y.V2), identifié en octobre 2020, a été estimé comme étant 50 % plus transmissible que les souches préexistantes en Afrique du Sud25 ;
– le variant Gamma (« brésilien », P.1, 501Y.V3), détecté pour la première fois en décembre 2020, est 40 à 120 % plus transmissible que les souches préexistantes au Brésil26, il est génétiquement proche du variant Bêta ;
– le variant Delta (« indien », B.1.617.2), découvert en octobre 2020 en Inde, est plus contagieux que le variant Alpha, lui-même plus contagieux que la souche originelle.
Ces variants ont des mutations au niveau de la protéine Spike, qui permet au virus de pénétrer dans les cellules humaines (via le récepteur ACE2) et qui constitue la principale cible pour notre système immunitaire.27 Le classement en variant préoccupant dépend de la prévalence locale du variant et peut donc différer selon la région. Par exemple, les CDC des États-Unis considèrent comme préoccupant le variant californien, pour l’instant absent en France, alors que Santé publique France a considéré comme préoccupant un variant breton B.1.1.7 + E484K/Q, qui a très peu circulé.
– variant à suivre (« variant of interest », VOI) ;
– variant préoccupant (« variant of concern », VOC) : si on observe une augmentation de la transmissibilité, une maladie plus grave, un échec de certains tests diagnostiques, ou une diminution de l’efficacité des traitements ou des vaccins ;
– variant de haute conséquence (« variant of high consequence », VOHC), en cas de véritable échappement au diagnostic, au traitement ou au vaccin.
Jusqu’à présent, aucun variant n’est considéré comme « de haute conséquence » dans le monde, mais quatre variants sont considérés comme préoccupants selon l’OMS et l’ECDC :
– le variant Alpha (« anglais », B.1.1.7, 501Y.V1) a été découvert en septembre 2020 ; il est 43 à 90 % plus contagieux que les souches préexistantes au Royaume-Uni23, 24 ;
– le variant Bêta (« sud-africain », B.1.351, 501Y.V2), identifié en octobre 2020, a été estimé comme étant 50 % plus transmissible que les souches préexistantes en Afrique du Sud25 ;
– le variant Gamma (« brésilien », P.1, 501Y.V3), détecté pour la première fois en décembre 2020, est 40 à 120 % plus transmissible que les souches préexistantes au Brésil26, il est génétiquement proche du variant Bêta ;
– le variant Delta (« indien », B.1.617.2), découvert en octobre 2020 en Inde, est plus contagieux que le variant Alpha, lui-même plus contagieux que la souche originelle.
Ces variants ont des mutations au niveau de la protéine Spike, qui permet au virus de pénétrer dans les cellules humaines (via le récepteur ACE2) et qui constitue la principale cible pour notre système immunitaire.27 Le classement en variant préoccupant dépend de la prévalence locale du variant et peut donc différer selon la région. Par exemple, les CDC des États-Unis considèrent comme préoccupant le variant californien, pour l’instant absent en France, alors que Santé publique France a considéré comme préoccupant un variant breton B.1.1.7 + E484K/Q, qui a très peu circulé.
Deux sources pour surveiller la fréquence des variants en France
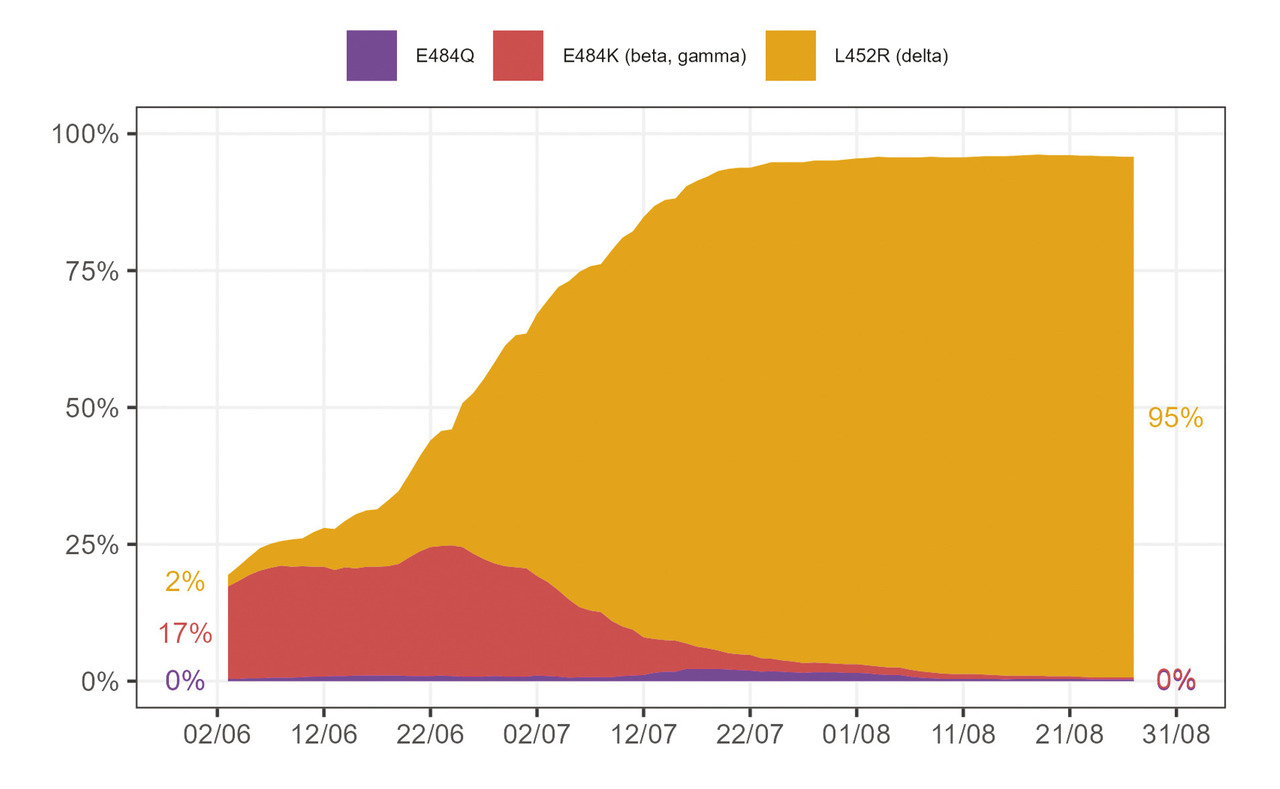
Les tests PCR de criblage permettent de suspecter la présence de certains variants. Depuis le 31 mai 2021, le système de criblage identifie la présence de trois mutations : L452R, plus ou moins spécifique du variant Delta, E484K, plus ou moins spécifique des variants Bêta ou Gamma, et E484Q. Cette méthode de criblage a été utilisée pour 53 à 58 % des tests PCR positifs réalisés entre le 12 juin et le 19 septembre 2021, et du 18 au 24 septembre, 95 % des tests criblés révélaient la mutation L452R, donc étaient probablement des variants Delta (fig. 3 ).28
Le séquençage complet d’une sélection des prélèvements positifs réalisés un jour donné constitue une enquête Flash. Ces enquêtes sont hebdomadaires depuis l’enquête n° 13 du 29 juin 2021. Jusqu’à l’enquête Flash 21, elles ont porté sur des prélèvements positifs arrivés dans des laboratoires ayant choisi de participer. À partir de l’enquête Flash 22, du 31 août 2021, la participation des laboratoires est devenue obligatoire. La sélection des prélèvements (en principe 1 sur 2) est décrite comme aléatoire, mais le texte précise : « en évitant notamment d’inclure l’ensemble d’un lot appartenant à un même cluster », ce qui n’a évidemment rien d’aléatoire. L’enquête n° 20, réalisée le 17 août 2021, a porté sur 4 455 prélèvements en métropole et avait trouvé 99,6 % de variant Delta.29
Le séquençage complet d’une sélection des prélèvements positifs réalisés un jour donné constitue une enquête Flash. Ces enquêtes sont hebdomadaires depuis l’enquête n° 13 du 29 juin 2021. Jusqu’à l’enquête Flash 21, elles ont porté sur des prélèvements positifs arrivés dans des laboratoires ayant choisi de participer. À partir de l’enquête Flash 22, du 31 août 2021, la participation des laboratoires est devenue obligatoire. La sélection des prélèvements (en principe 1 sur 2) est décrite comme aléatoire, mais le texte précise : « en évitant notamment d’inclure l’ensemble d’un lot appartenant à un même cluster », ce qui n’a évidemment rien d’aléatoire. L’enquête n° 20, réalisée le 17 août 2021, a porté sur 4 455 prélèvements en métropole et avait trouvé 99,6 % de variant Delta.29
Quelle efficacité des vaccins contre les variants ?
On dispose de données in vitro et in vivo sur l’efficacité des vaccins contre les variants.
In vitro, certaines études traitent de l’immunité à long terme liée aux lymphocytes30, mais la plupart portent sur des essais de neutralisation par les anticorps.31-33 Ces essais consistent à exposer les différents variants à du sérum de personnes soit vaccinées, soit guéries, et à déduire (à partir de la réaction observée) la concentration en anticorps, spécifique ou non, contre chaque variant.
Une étude britannique montre que l’activité neutralisante des anticorps contre le variant Delta est bonne après deux doses du vaccin Pfizer-BioNTech.34
In vivo, des études ont évalué l’efficacité des vaccins dans des populations exposées à certains variants, notamment Alpha et Delta, à partir de divers critères : détection du virus (éventuellement en réduisant le nombre des cycles de PCR), Covid-19 symptomatique, hospitalisation, réanimation, décès.
Une enquête, réalisée au Royaume-Uni, a reposé sur la surveillance répétée, par tests RT-PCR, d’un échantillon de ménages sélectionnés, indépendamment des symptômes, du statut vaccinal et d’un antécédent d’infection par le Sars-CoV-2. L’efficacité des vaccins Pfizer et AstraZeneca a été étudiée, sur la base de la positivité des tests RT-PCR, au cours de deux périodes disjointes : du 1er décembre 2020 au 16 mai 2021, période où le variant Alpha était prépondérant, et du 17 mai au 1er août 2021, période ou le variant Delta avait remplacé le variant Alpha. Ce travail montre que les deux vaccins sont très efficaces contre les deux variants et plus efficaces qu’une infection antérieure.35
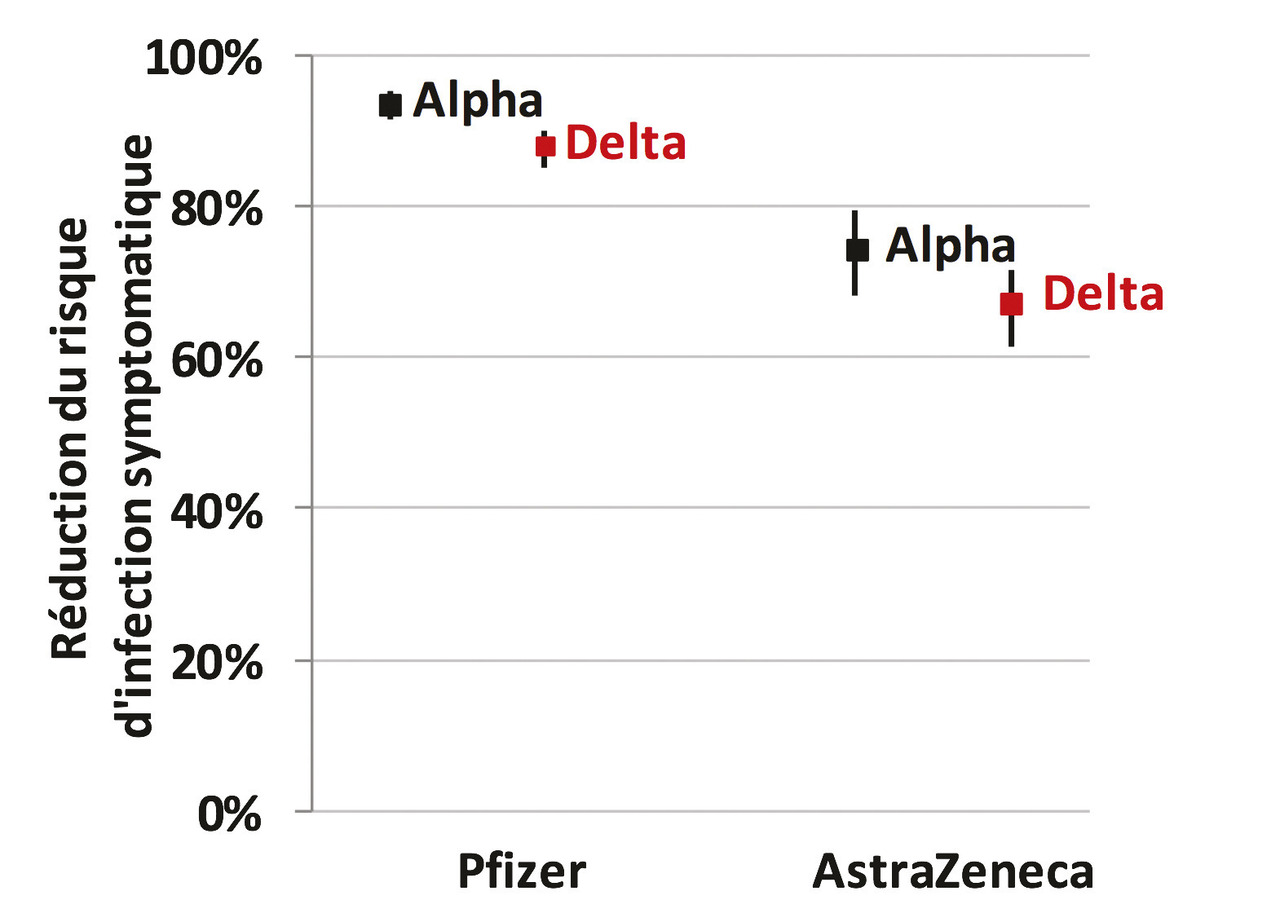
En Angleterre, une enquête cas-témoins a comparé la proportion de non-vaccinés chez des personnes symptomatiques infectées par les variants Alpha ou Delta et chez des témoins, testés pour symptômes mais négatifs. Elle montre que l’efficacité de deux doses du vaccin Pfizer-BioNTech, mesurée avec le critère des infections symptomatiques, est un peu moins bonne contre le variant Delta que contre le variant Alpha (88 % au lieu de 94 %). Il en est de même pour le vaccin AstraZeneca (fig. 4 ).36
Une enquête de cohorte, réalisée entre janvier et juillet 2021 aux États-Unis, a comparé les risques d’infection et d’hospitalisation dans trois populations de même taille, une non vaccinée et deux vaccinées, respectivement avec les vaccins Pfizer et Moderna. Pour cela, des triplets appariés sur le sexe, l’âge, la race, l’ethnie, et la réalisation de tests RT-PCR antérieurs pour Sars-CoV-2 ont été constitués. Les vaccinés étaient, en plus, appariés sur la date de vaccination. Comparés à ceux des non-vaccinés, les risques d’infection et d’hospitalisation pour le Sars-CoV-2 des deux populations vaccinées ont été réduits respectivement de 86 % et 92 %, pour Moderna, et de 76 % et 85 % pour Pfizer. En juillet 2021, alors que le variant Delta était devenu largement majoritaire, la réduction du risque d’hospitalisation est restée importante (Moderna 81 % ; Pfizer 75 %), mais la réduction du risque d’infection était moindre, surtout pour Pfizer (Moderna 76 % ; Pfizer 42 %).37
La Direction de la recherche, des études, de l’évaluation et des statistiques (DREES), a montré qu’entre le 6 et le 12 septembre 2021, moment où le variant Delta représente l’essentiel de la circulation du virus, la population non vaccinée a 8 fois plus de risque de positivité, 8 fois plus de risque d’admission à l’hôpital et 5 fois plus de risque de décès que la population complètement vaccinée.38
In vitro, certaines études traitent de l’immunité à long terme liée aux lymphocytes30, mais la plupart portent sur des essais de neutralisation par les anticorps.31-33 Ces essais consistent à exposer les différents variants à du sérum de personnes soit vaccinées, soit guéries, et à déduire (à partir de la réaction observée) la concentration en anticorps, spécifique ou non, contre chaque variant.
Une étude britannique montre que l’activité neutralisante des anticorps contre le variant Delta est bonne après deux doses du vaccin Pfizer-BioNTech.34
In vivo, des études ont évalué l’efficacité des vaccins dans des populations exposées à certains variants, notamment Alpha et Delta, à partir de divers critères : détection du virus (éventuellement en réduisant le nombre des cycles de PCR), Covid-19 symptomatique, hospitalisation, réanimation, décès.
Une enquête, réalisée au Royaume-Uni, a reposé sur la surveillance répétée, par tests RT-PCR, d’un échantillon de ménages sélectionnés, indépendamment des symptômes, du statut vaccinal et d’un antécédent d’infection par le Sars-CoV-2. L’efficacité des vaccins Pfizer et AstraZeneca a été étudiée, sur la base de la positivité des tests RT-PCR, au cours de deux périodes disjointes : du 1er décembre 2020 au 16 mai 2021, période où le variant Alpha était prépondérant, et du 17 mai au 1er août 2021, période ou le variant Delta avait remplacé le variant Alpha. Ce travail montre que les deux vaccins sont très efficaces contre les deux variants et plus efficaces qu’une infection antérieure.35
En Angleterre, une enquête cas-témoins a comparé la proportion de non-vaccinés chez des personnes symptomatiques infectées par les variants Alpha ou Delta et chez des témoins, testés pour symptômes mais négatifs. Elle montre que l’efficacité de deux doses du vaccin Pfizer-BioNTech, mesurée avec le critère des infections symptomatiques, est un peu moins bonne contre le variant Delta que contre le variant Alpha (88 % au lieu de 94 %). Il en est de même pour le vaccin AstraZeneca (
Une enquête de cohorte, réalisée entre janvier et juillet 2021 aux États-Unis, a comparé les risques d’infection et d’hospitalisation dans trois populations de même taille, une non vaccinée et deux vaccinées, respectivement avec les vaccins Pfizer et Moderna. Pour cela, des triplets appariés sur le sexe, l’âge, la race, l’ethnie, et la réalisation de tests RT-PCR antérieurs pour Sars-CoV-2 ont été constitués. Les vaccinés étaient, en plus, appariés sur la date de vaccination. Comparés à ceux des non-vaccinés, les risques d’infection et d’hospitalisation pour le Sars-CoV-2 des deux populations vaccinées ont été réduits respectivement de 86 % et 92 %, pour Moderna, et de 76 % et 85 % pour Pfizer. En juillet 2021, alors que le variant Delta était devenu largement majoritaire, la réduction du risque d’hospitalisation est restée importante (Moderna 81 % ; Pfizer 75 %), mais la réduction du risque d’infection était moindre, surtout pour Pfizer (Moderna 76 % ; Pfizer 42 %).37
La Direction de la recherche, des études, de l’évaluation et des statistiques (DREES), a montré qu’entre le 6 et le 12 septembre 2021, moment où le variant Delta représente l’essentiel de la circulation du virus, la population non vaccinée a 8 fois plus de risque de positivité, 8 fois plus de risque d’admission à l’hôpital et 5 fois plus de risque de décès que la population complètement vaccinée.38
Réduction de la transmission virale par les personnes vaccinées
La transmission du virus par des individus infectés asymptomatiques contribue de manière significative à la pandémie en cours. On estime en effet que plus de la moitié des transmissions se font à partir d’individus sans symptômes, soit parce qu’ils ne seront jamais symptomatiques, soit parce qu’ils sont présymptomatiques. C’est l’une des raisons pour lesquelles un dépistage massif (par exemple en utilisant des tests PCR sur prélèvements salivaires groupés) serait nécessaire pour identifier et isoler les personnes asymptomatiques.
Les essais ont montré que les vaccins contre la Covid-19 protégeaient les personnes vaccinées d’une infection symptomatique. Depuis, la comparaison des risques d’infection par le Sars-CoV-2 aux États-Unis, chez des personnes ayant reçu au moins une dose du vaccin Pfizer-BioNTech et chez des personnes non vaccinées, a montré une réduction du risque d’infection asymptomatique de 79 % (IC à 95 % : 63 % ; 88 %) plus de dix jours après la vaccination.39, 40 Pfizer a depuis confirmé ces résultats : d’après des données israéliennes, le vaccin aurait une efficacité de 94 % deux semaines après la seconde dose.41 Si les vaccins protègent efficacement des infections, tant symptomatiques qu’asymptomatiques, on peut supposer qu’ils réduisent aussi efficacement le risque de transmission du virus.
Les essais ont montré que les vaccins contre la Covid-19 protégeaient les personnes vaccinées d’une infection symptomatique. Depuis, la comparaison des risques d’infection par le Sars-CoV-2 aux États-Unis, chez des personnes ayant reçu au moins une dose du vaccin Pfizer-BioNTech et chez des personnes non vaccinées, a montré une réduction du risque d’infection asymptomatique de 79 % (IC à 95 % : 63 % ; 88 %) plus de dix jours après la vaccination.39, 40 Pfizer a depuis confirmé ces résultats : d’après des données israéliennes, le vaccin aurait une efficacité de 94 % deux semaines après la seconde dose.41 Si les vaccins protègent efficacement des infections, tant symptomatiques qu’asymptomatiques, on peut supposer qu’ils réduisent aussi efficacement le risque de transmission du virus.
Études en cours et questions en suspens
En France, les enfants de 12 à 17 ans ne peuvent être vaccinés qu’avec le vaccin Pfizer-BioNTech ou le vaccin Moderna.
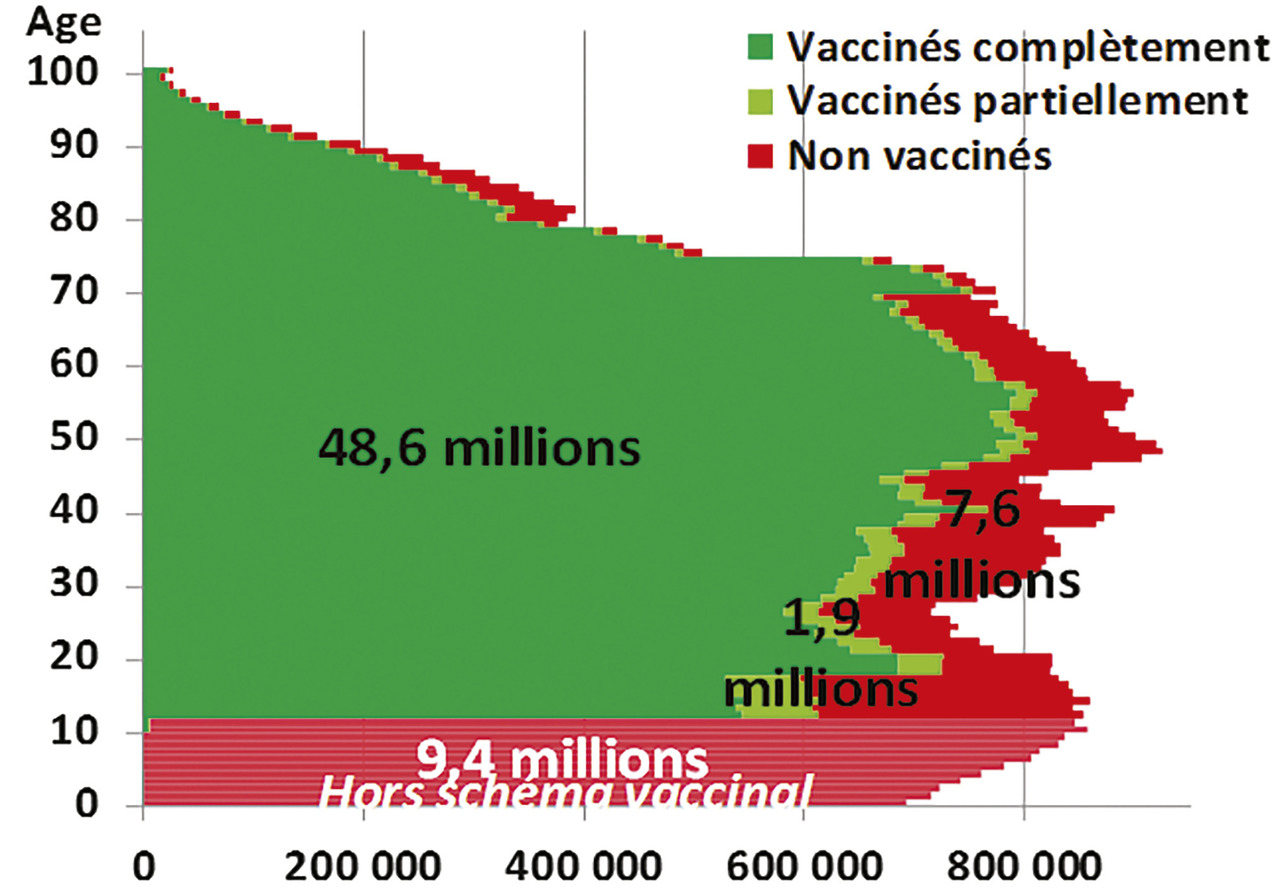
Au 26 septembre 2021, la population de 12 ans et plus, éligible à la vaccination, comptait 84 % de personnes complètement vaccinées, 3 % de personnes en cours de vaccination, et 13 % de non vaccinées (fig. 5 ). La couverture maximale était observée dans la population de 70 à 79 ans, avec 3 % de non-vaccinés, mais il restait 14 % de non-vaccinés dans la population âgée de 80 ans et plus ; d’où l’urgence à organiser la vaccination à domicile de ces personnes trop âgées et peu mobiles. Pfizer a annoncé que son vaccin, qui devait initialement être conservé entre -80 °C et -60 °C, pouvait être stocké pendant deux semaines entre -25 °C et -15 °C, 42 ce qui devrait faciliter son utilisation.
La HAS recommande une dose de rappel avec un vaccin à ARNm pour les personnes de 65 ans et plus, ainsi que pour les personnes à risque de forme grave de Covid-19. Ce rappel permettra de renforcer la protection, qui paraît diminuer au cours du temps, selon une étude réalisée en Israël après l’arrivée du variant Delta.43 Ce rappel doit être administré au moins six mois après la primovaccination complète.44 L’OMS ne soutient pas cette recommandation. La priorité aujourd’hui, en France, devrait être la vaccination des personnes de 12 ans et plus qui ne sont pas encore vaccinées, en commençant par celles de 80 ans et plus.45
Les résultats d’une étude en cours sur les adolescents de 12 à 17 ans pour évaluer l’efficacité du vaccin Janssen sont attendus pour la fin de l’année. Les laboratoires Pfizer-BioNTech, Moderna et Janssen mènent actuellement des essais cliniques chez des enfants âgés de 6 mois à 11 ans.46-48 Pfizer vient d’annoncer de bons résultats pour l’efficacité et la tolérance du vaccin dans la sous population de 5 à 11 ans.
Tant qu’il y aura des personnes non vaccinées, le virus trouvera un hôte à infecter et continuera de muter. Une raison de plus pour renforcer la campagne de vaccination !
Au 26 septembre 2021, la population de 12 ans et plus, éligible à la vaccination, comptait 84 % de personnes complètement vaccinées, 3 % de personnes en cours de vaccination, et 13 % de non vaccinées (
La HAS recommande une dose de rappel avec un vaccin à ARNm pour les personnes de 65 ans et plus, ainsi que pour les personnes à risque de forme grave de Covid-19. Ce rappel permettra de renforcer la protection, qui paraît diminuer au cours du temps, selon une étude réalisée en Israël après l’arrivée du variant Delta.43 Ce rappel doit être administré au moins six mois après la primovaccination complète.44 L’OMS ne soutient pas cette recommandation. La priorité aujourd’hui, en France, devrait être la vaccination des personnes de 12 ans et plus qui ne sont pas encore vaccinées, en commençant par celles de 80 ans et plus.45
Les résultats d’une étude en cours sur les adolescents de 12 à 17 ans pour évaluer l’efficacité du vaccin Janssen sont attendus pour la fin de l’année. Les laboratoires Pfizer-BioNTech, Moderna et Janssen mènent actuellement des essais cliniques chez des enfants âgés de 6 mois à 11 ans.46-48 Pfizer vient d’annoncer de bons résultats pour l’efficacité et la tolérance du vaccin dans la sous population de 5 à 11 ans.
Tant qu’il y aura des personnes non vaccinées, le virus trouvera un hôte à infecter et continuera de muter. Une raison de plus pour renforcer la campagne de vaccination !
* En date du 29 septembre 2021.Attention ! L’efficacité d’un vaccin dépend du critère de jugement. Les essais sur ces vaccins ont en général retenu comme critère principal le diagnostic de Covid-19 symptomatique confirmé par un test PCR. Si on prend en compte un critère différent, par exemple une Covid grave, c’est-à-dire nécessitant au moins une ventilation, on n’obtient pas la même mesure de l’efficacité.NDLR : Au moment où nous imprimons ces pages, une nouvelle étude épidémiologique confirme les bénéfices de la vaccination (rapports Épi-Phare), dont vous trouverez le détail sur : https://bit.ly/3DDfaCH
Références
1. Polack FP, Thomas SJ, Kitchin N, Absalon J, Gurtman A, Lockhart S, et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med 2020;383(27):2603-15.
2. Baden LR, Sahly HME, Essink B, Kotloff K, Frey S, Novak R, et al. Efficacy and safety of the mRNA-1273 Sars-CoV-2 Vaccine. N Engl J Med 2021;384(5):403-16.
3. Voysey M, Clemens SAC, Madhi SA, Weckx LY, Folegatti PM, Aley PK, et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against Sars-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. The Lancet 2021;397(10269):99-111.
4. FDA. Janssen Covid-19 vaccine EUA fact sheet for healthcare providers. 2021 [cité le 27 février 2021]. Disponible sur : https://www.fda.gov/media/146304/download
5. Logunov DY, Dolzhikova IV, Shcheblyakov DV, Tukhvatulin AI, Zubkova OV, Dzharullaeva AS, et al. Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia. The Lancet 2021;397:(10275):671-81.
6. Ibrahimi N, Chaltiel D, Hill C. Vaccins contre la Covid-19 disponibles en Europe. Rev Prat 2021;71(3):239-44.
7. Pfizer. Pfizer-BioNTech announce positive topline results of pivotal Covid-19 vaccine study in adolescents. 2021 [cité le 31 mars 2021]. Disponible sur : https://www.pfizer.com/news/press-release/press-release-detail/pfizer-biontech-announce-positive-topline-results-pivotal
8. Kemp A. AZD1222 US Phase III primary analysis confirms safety and efficacy [en ligne]. 2021 [cité le 15 avril 2021]. Disponible sur : https://www.astrazeneca.com/media-centre/press-releases/2021/azd1222-us-phase-iii-primary-analysis-confirms-safety-and-efficacy.html
9. EMA. AstraZeneca’s Covid-19 vaccine: EMA finds possible link to very rare cases of unusual blood clots with low platelets. 2021 [cité le 21 avril 2021]. Disponible sur : https://www.ema.europa.eu/en/news/astrazenecas-covid-19-vaccine-ema-finds-possible-link-very-rare-cases-unusual-blood-clots-low-blood
10. Schultz NH, Sørvoll IH, Michelsen AE, Munthe LA, Lund-Johansen F, Ahlen MT, et al. Thrombosis and thrombocytopenia after ChAdOx1 nCoV-19 vaccination. N Engl J Med 2021;384(22):2124-30.
11. Greinacher A, Thiele T, Warkentin TE, Weisser K, Kyrle PA, Eichinger S. Thrombotic thrombocytopenia after ChAdOx1 nCov-19 vaccination. N Engl J Med 2021;384(22):2092-101.
12. Winton Centre for Risk and Evidence Communication. Communicating the potential benefits and harms of the Astra-Zeneca Covid-19 vaccine. 2021 [cité le 21 avril 2021]. Disponible sur : https://wintoncentre.maths.cam.ac.uk/news/communicating-potential-benefits-and-harms-astra-zeneca-covid-19-vaccine/
13. HAS. Covid-19 : quelle stratégie vaccinale pour les moins de 55 ans ayant déjà reçu une dose d’AstraZeneca ? 2021 [cité le 21 avril 2021]. Disponible sur : https://www.has-sante.fr/jcms/p_3260335/fr/covid-19-quelle-strategie-vaccinale-pour-les-moins-de-55-ans-ayant-deja-recu-une-dose-d-astrazeneca
14. EMA, European Medicines Agency. Covid-19 Vaccine Janssen: assessment of very rare cases of unusual blood clots with low platelets continues. 2021 [cité le 21 avril 2021]. Disponible sur : https://www.ema.europa.eu/en/news/covid-19-vaccine-janssen-assessment-very-rare-cases-unusual-blood-clots-low-platelets-continues
15. Renoud L, Khouri C, Revol B, Lepelley M, Perez J, Roustit M, et al. Association of facial paralysis with mRNA Covid-19 vaccines: a disproportionality analysis using the World Health Organization Pharmacovigilance Database. JAMA Intern Med 2021;181(9):1243-5.
16. Ozonoff A, Nanishi E, Levy O. Bell’s palsy and Sars-CoV-2 vaccines. Lancet Infect Dis. 2021;21(4):450-2.
17. Ng JH, Tan EK. Caution in Interpreting Facial Paralysis Data to Understand COVID-19 Vaccination Risks. JAMA Intern Med. 2021 Aug 16.
18. Barda N, Dagan N, Ben-Shlomo Y, Kepten E, Waxman J, Ohana R, et al. Safety of the BNT162b2 mRNA Covid-19 vaccine in a nationwide setting. N Engl J Med 2021;385(12):1078-90.
19. Gouvernement du Canada. Santé Canada met à jour les étiquettes des vaccins contre la Covid-19 de Pfizer-BioNTech et de Moderna pour y inclure des renseignements sur la myocardite et la péricardite. 2021 [cité le 9 juillet 2021]. Disponible sur : https://canadiensensante.gc.ca/recall-alert-rappel-avis/hc-sc/2021/75959a-fra.php
20. Santé publique France, CNR. Analyse de risque liée aux variants émergents de Sars-CoV-2 réalisée conjointement par le CNR des virus des infections respiratoires et Santé publique France. 2021 [cité le 1er juin 2021]. Disponible sur : https://www.google.com/url?sa=t&rct=j&q=&esrc= s&source=web&cd=&ved=2ahUKEwiC7qKC8JvxAhXYAm MBHY23DAgQFjAAegQIAhAD&url=https%3A%2F%2F www.santepubliquefrance.fr%2Fcontent%2Fdownload %2F338799%2Ffile%2Fanalyse_risque_variants_2 0210421.pdf&usg=AOvVaw2mABaQoNN6iOS-oUveEV00
21. Centers for Disease Control and Prevention (CDC). Coronavirus disease 2019 (Covid-19). 2020 [cité le 4 juin 2021]. https://www.cdc.gov/coronavirus/2019-ncov/variants/variant-info.html (NDLR : mis à jour)
22. European Centre for Disease Prevention and Control. Sars-CoV-2 variants of concern as of 3 June 2021. 2021 [cité le 4 juin 2021]. Disponible sur : https://www.ecdc.europa.eu/en/covid-19/variants-concern (ndlr : mis à jour)
23. Davies NG, Abbott S, Barnard RC, Jarvis CI, Kucharski AJ, Munday JD et al. Estimated transmissibility and impact of Sars-CoV-2 lineage B.1.1.7 in England. Science. 2021;372(6538):eabg3055.
24. Karim SSA, de Olivera T. New Sars-CoV-2 Variants. Clinical, public health, and vaccine implications. N Engl J Med 2021;384(19):1866-8.
25. CMMID Repository. Estimates of severity and transmissibility of novel Sars-CoV-2 variant 501Y.V2 in South Africa. 2021 [cité le 22 avril 2021]. Disponible sur : https://cmmid.github.io/topics/covid19/sa-novel-variant.html
26. Faria NR, Mellan TA, Whittaker C, Claro IM, da S Candido D, Mishra S, et al. Genomics and epidemiology of the P.1 Sars-CoV-2 lineage in Manaus, Brazil. Science 2021;372(6544):815-21.
27. Korsia-Meffre S. Covid-19 : mutations, variants, lignées, N501Y, E484K… de quoi parle-t-on ? Vidal 2021 [cité le 22 avril 2021]. https://www.vidal.fr/actualites/26672-covid-19-mutations-variants-lignees-n501y-e484k-de-quoi-parle-t-on.html
28. data.gouv.fr. Données de laboratoires pour le dépistage : indicateurs sur les variants (SI-DEP). 2021 [cité le 3 septembre 2021] https://www.data.gouv.fr/fr/datasets/donnees-de-laboratoires-pour-le-depistage-indicateurs-sur-les-variants
29. Santé publique France. Covid-19 : point épidémiologique hebdomadaire du 25 août 2021. Disponible sur : https://www.santepubliquefrance.fr/dossiers/coronavirus-covid-19/coronavirus-circulation-des-variants-du-sars-cov-2#block-338801 (NDLR : mis à jour).
30. Peng H, Yang L, Wang L, Li J, Huang J, Lu ZQ, et al. Long-lived memory T lymphocyte responses against Sars coronavirus nucleocapsid protein in Sars-recovered patients. Virology 2006;351(2):466-75.
31. Betton M, Livrozet M, Planas D, Fayol A, Monel B, Védie B, et al. Sera neutralizing activities against Sars-CoV-2 and multiple variants six month after hospitalization for Covid-19. Clin Infect Dis 2021;73(6):e1337-e1344.
32. Luchsinger LL, Ransegnola BP, Jin DK, Muecksch F, Weisblum Y, Bao W, et al. Serological assays estimate highly variable Sars-CoV-2 neutralizing antibody activity in recovered Covid-19 patients. J Clin Microbiol 2020;58(12): e02005-20.
33. Liu Y, Liu J, Xia H, Zhang X, Fontes-Garfias CR, Swanson KA, et al. Neutralizing activity of BNT162b2-elicited serum. N Engl J Med 2021;384(15):1466-8.
34. Wall EC, Wu M, Harvey R, Kelly G, Warchal S, Sawyer C, et al. Neutralising antibody activity against Sars-CoV-2 VOCs B. 1.617. 2 and B. 1.351 by BNT162b2 vaccination. The Lancet 2021;397(10292):2331-3.
35. Pouwels KB, Pritchard E, Matthews PC, Stoesser N, Eyre DW, Vihta KD, et al. Impact of Delta on viral burden and vaccine effectiveness against new Sars-CoV-2 infections in the UK. medRxiv. doi: https://doi.org/10.1101/2021.08.18.21262237
36. Bernal JL, Andrews N, Gower C, Gallagher E, Simmons R, Thelwall S, et al. Effectiveness of Covid-19 vaccines against the B. 1.617. 2 (Delta) variant. N Engl J Med 2021;385(7):585-94.
37. Puranik A, Lenehan PJ, Silvert E, Niesen MJM, Corchado-Garcia J, O’Horo JC, et al. Comparison of two highly-effective mRNA vaccines for Covid-19 during periods of Alpha and Delta variant prevalence. medRxiv. Disponible sur : https://www.medrxiv.org/content/10.1101/2021.08.06.21261707v2
38. Direction de la recherche, des études, de l’évaluation et des statistiques. Les travaux de la DREES liés à la crise sanitaire de la Covid-19. 2021 [cité le 29 septembre 2021]. Disponible sur : https://drees.solidarites-sante.gouv.fr/article/les-travaux-de-la-drees-lies-la-crise-sanitaire-de-la-covid-19
39. businesswire.com. Real-world evidence confirms high effectiveness of Pfizer-BioNTech Covid-19 vaccine and profound public health impact of vaccination one year after pandemic declared. 2021 [cité le 4 juin 2021]. Disponible sur : https://www.businesswire.com/news/home/20210311005482/en/Real-World-Evidence-Confirms-High-Effectiveness-of-Pfizer-BioNTech-COVID-19-Vaccine-and-Profound-Public-Health-Impact-of-Vaccination-One-Year-After-Pandemic-Declared
40. Tande AJ, Pollock BD, Shah ND, Farrugia G, Virk A, Swift M, et al. Impact of the Coronavirus Disease 2019 (COVID-19) Vaccine on Asymptomatic Infection Among Patients Undergoing Preprocedural COVID-19 Molecular Screening. Clin Infect Dis. 2021:ciab229. doi:10.1093/cid/ciab229
41. Kustin T, Harel N, Finkel U, Perchik S, Harari S, Tahor M, et al. Evidence for increased breakthrough rates of Sars-CoV-2 variants of concern in BNT162b2-mRNA-vaccinated individuals. Nat Med 2021;27(8):1379-84.
42. Food and Drug Administration. Coronavirus (Covid-19) update: FDA allows more flexible storage, transportation conditions for Pfizer-BioNTech Covid-19 vaccine. 2021 [cité le 25 février 2021]. Disponible sur : https://www.fda.gov/news-events/press-announcements/coronavirus-covid-19-update-fda-allows-more-flexible-storage-transportation-conditions-pfizer
43. Levine-Tiefenbrun M, Yelin I, Alapi H, Katz R, Herzel E, Kuint J, et al. Viral loads of Delta-variant Sars-CoV2 breakthrough infections following vaccination and booster with the BNT162b2 vaccine. medRxiv. doi: https://doi.org/10.1101/2021.08.29.21262798
44. Haute Autorité de santé. Covid-19 : la HAS précise les populations éligibles à une dose de rappel de vaccin. 2021 [cité le 24 août 2021]. Disponible sur : https://www.has-sante.fr/jcms/p_3283153/fr/covid-19-la-has-precise-les-populations-eligibles-a-une-dose-de-rappel-de-vaccin
45. Organisation mondiale de la santé. Considerations in boosting Covid vaccine immune responses. 2021 [cité le 13 août 2021]. Disponible sur : https://www.who.int/news-room/events/detail/2021/08/13/default-calendar/who-consultation-on-covid-19-vaccines-research-13-august-2021
46. businesswire.com. Pfizer-BioNTech announce positive topline results of pivotal Covid-19 vaccine study in adolescents. 2021 [cité le 23 avril 2021]. Disponible sur : https://www.businesswire.com/news/home/20210331005503/en/Pfizer-BioNTech-Announce-Positive-Topline-Results-of-Pivotal-COVID-19-Vaccine-Study-in-Adolescents
47. Moderna. Moderna announces first participants dosed in phase 2/3 study of Covid-19 vaccine candidate in pediatric population. 2021 [cité le 16 juin 2021]. Disponible sur : https://investors.modernatx.com/news-releases/news-release-details/moderna-announces-first-participants-dosed-phase-23-study-0/
48. Johnson & Johnson. Johnson & Johnson expands phase 2a clinical trial of Covid-19 vaccine candidate to include adolescents. 2021 [cité le 23 avril 2021]. Disponible sur : https://www.jnj.com/johnson-johnson-expands-phase-2a-clinical-trial-of-covid-19-vaccine-candidate-to-include-adolescents
2. Baden LR, Sahly HME, Essink B, Kotloff K, Frey S, Novak R, et al. Efficacy and safety of the mRNA-1273 Sars-CoV-2 Vaccine. N Engl J Med 2021;384(5):403-16.
3. Voysey M, Clemens SAC, Madhi SA, Weckx LY, Folegatti PM, Aley PK, et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against Sars-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. The Lancet 2021;397(10269):99-111.
4. FDA. Janssen Covid-19 vaccine EUA fact sheet for healthcare providers. 2021 [cité le 27 février 2021]. Disponible sur : https://www.fda.gov/media/146304/download
5. Logunov DY, Dolzhikova IV, Shcheblyakov DV, Tukhvatulin AI, Zubkova OV, Dzharullaeva AS, et al. Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia. The Lancet 2021;397:(10275):671-81.
6. Ibrahimi N, Chaltiel D, Hill C. Vaccins contre la Covid-19 disponibles en Europe. Rev Prat 2021;71(3):239-44.
7. Pfizer. Pfizer-BioNTech announce positive topline results of pivotal Covid-19 vaccine study in adolescents. 2021 [cité le 31 mars 2021]. Disponible sur : https://www.pfizer.com/news/press-release/press-release-detail/pfizer-biontech-announce-positive-topline-results-pivotal
8. Kemp A. AZD1222 US Phase III primary analysis confirms safety and efficacy [en ligne]. 2021 [cité le 15 avril 2021]. Disponible sur : https://www.astrazeneca.com/media-centre/press-releases/2021/azd1222-us-phase-iii-primary-analysis-confirms-safety-and-efficacy.html
9. EMA. AstraZeneca’s Covid-19 vaccine: EMA finds possible link to very rare cases of unusual blood clots with low platelets. 2021 [cité le 21 avril 2021]. Disponible sur : https://www.ema.europa.eu/en/news/astrazenecas-covid-19-vaccine-ema-finds-possible-link-very-rare-cases-unusual-blood-clots-low-blood
10. Schultz NH, Sørvoll IH, Michelsen AE, Munthe LA, Lund-Johansen F, Ahlen MT, et al. Thrombosis and thrombocytopenia after ChAdOx1 nCoV-19 vaccination. N Engl J Med 2021;384(22):2124-30.
11. Greinacher A, Thiele T, Warkentin TE, Weisser K, Kyrle PA, Eichinger S. Thrombotic thrombocytopenia after ChAdOx1 nCov-19 vaccination. N Engl J Med 2021;384(22):2092-101.
12. Winton Centre for Risk and Evidence Communication. Communicating the potential benefits and harms of the Astra-Zeneca Covid-19 vaccine. 2021 [cité le 21 avril 2021]. Disponible sur : https://wintoncentre.maths.cam.ac.uk/news/communicating-potential-benefits-and-harms-astra-zeneca-covid-19-vaccine/
13. HAS. Covid-19 : quelle stratégie vaccinale pour les moins de 55 ans ayant déjà reçu une dose d’AstraZeneca ? 2021 [cité le 21 avril 2021]. Disponible sur : https://www.has-sante.fr/jcms/p_3260335/fr/covid-19-quelle-strategie-vaccinale-pour-les-moins-de-55-ans-ayant-deja-recu-une-dose-d-astrazeneca
14. EMA, European Medicines Agency. Covid-19 Vaccine Janssen: assessment of very rare cases of unusual blood clots with low platelets continues. 2021 [cité le 21 avril 2021]. Disponible sur : https://www.ema.europa.eu/en/news/covid-19-vaccine-janssen-assessment-very-rare-cases-unusual-blood-clots-low-platelets-continues
15. Renoud L, Khouri C, Revol B, Lepelley M, Perez J, Roustit M, et al. Association of facial paralysis with mRNA Covid-19 vaccines: a disproportionality analysis using the World Health Organization Pharmacovigilance Database. JAMA Intern Med 2021;181(9):1243-5.
16. Ozonoff A, Nanishi E, Levy O. Bell’s palsy and Sars-CoV-2 vaccines. Lancet Infect Dis. 2021;21(4):450-2.
17. Ng JH, Tan EK. Caution in Interpreting Facial Paralysis Data to Understand COVID-19 Vaccination Risks. JAMA Intern Med. 2021 Aug 16.
18. Barda N, Dagan N, Ben-Shlomo Y, Kepten E, Waxman J, Ohana R, et al. Safety of the BNT162b2 mRNA Covid-19 vaccine in a nationwide setting. N Engl J Med 2021;385(12):1078-90.
19. Gouvernement du Canada. Santé Canada met à jour les étiquettes des vaccins contre la Covid-19 de Pfizer-BioNTech et de Moderna pour y inclure des renseignements sur la myocardite et la péricardite. 2021 [cité le 9 juillet 2021]. Disponible sur : https://canadiensensante.gc.ca/recall-alert-rappel-avis/hc-sc/2021/75959a-fra.php
20. Santé publique France, CNR. Analyse de risque liée aux variants émergents de Sars-CoV-2 réalisée conjointement par le CNR des virus des infections respiratoires et Santé publique France. 2021 [cité le 1er juin 2021]. Disponible sur : https://www.google.com/url?sa=t&rct=j&q=&esrc= s&source=web&cd=&ved=2ahUKEwiC7qKC8JvxAhXYAm MBHY23DAgQFjAAegQIAhAD&url=https%3A%2F%2F www.santepubliquefrance.fr%2Fcontent%2Fdownload %2F338799%2Ffile%2Fanalyse_risque_variants_2 0210421.pdf&usg=AOvVaw2mABaQoNN6iOS-oUveEV00
21. Centers for Disease Control and Prevention (CDC). Coronavirus disease 2019 (Covid-19). 2020 [cité le 4 juin 2021]. https://www.cdc.gov/coronavirus/2019-ncov/variants/variant-info.html (NDLR : mis à jour)
22. European Centre for Disease Prevention and Control. Sars-CoV-2 variants of concern as of 3 June 2021. 2021 [cité le 4 juin 2021]. Disponible sur : https://www.ecdc.europa.eu/en/covid-19/variants-concern (ndlr : mis à jour)
23. Davies NG, Abbott S, Barnard RC, Jarvis CI, Kucharski AJ, Munday JD et al. Estimated transmissibility and impact of Sars-CoV-2 lineage B.1.1.7 in England. Science. 2021;372(6538):eabg3055.
24. Karim SSA, de Olivera T. New Sars-CoV-2 Variants. Clinical, public health, and vaccine implications. N Engl J Med 2021;384(19):1866-8.
25. CMMID Repository. Estimates of severity and transmissibility of novel Sars-CoV-2 variant 501Y.V2 in South Africa. 2021 [cité le 22 avril 2021]. Disponible sur : https://cmmid.github.io/topics/covid19/sa-novel-variant.html
26. Faria NR, Mellan TA, Whittaker C, Claro IM, da S Candido D, Mishra S, et al. Genomics and epidemiology of the P.1 Sars-CoV-2 lineage in Manaus, Brazil. Science 2021;372(6544):815-21.
27. Korsia-Meffre S. Covid-19 : mutations, variants, lignées, N501Y, E484K… de quoi parle-t-on ? Vidal 2021 [cité le 22 avril 2021]. https://www.vidal.fr/actualites/26672-covid-19-mutations-variants-lignees-n501y-e484k-de-quoi-parle-t-on.html
28. data.gouv.fr. Données de laboratoires pour le dépistage : indicateurs sur les variants (SI-DEP). 2021 [cité le 3 septembre 2021] https://www.data.gouv.fr/fr/datasets/donnees-de-laboratoires-pour-le-depistage-indicateurs-sur-les-variants
29. Santé publique France. Covid-19 : point épidémiologique hebdomadaire du 25 août 2021. Disponible sur : https://www.santepubliquefrance.fr/dossiers/coronavirus-covid-19/coronavirus-circulation-des-variants-du-sars-cov-2#block-338801 (NDLR : mis à jour).
30. Peng H, Yang L, Wang L, Li J, Huang J, Lu ZQ, et al. Long-lived memory T lymphocyte responses against Sars coronavirus nucleocapsid protein in Sars-recovered patients. Virology 2006;351(2):466-75.
31. Betton M, Livrozet M, Planas D, Fayol A, Monel B, Védie B, et al. Sera neutralizing activities against Sars-CoV-2 and multiple variants six month after hospitalization for Covid-19. Clin Infect Dis 2021;73(6):e1337-e1344.
32. Luchsinger LL, Ransegnola BP, Jin DK, Muecksch F, Weisblum Y, Bao W, et al. Serological assays estimate highly variable Sars-CoV-2 neutralizing antibody activity in recovered Covid-19 patients. J Clin Microbiol 2020;58(12): e02005-20.
33. Liu Y, Liu J, Xia H, Zhang X, Fontes-Garfias CR, Swanson KA, et al. Neutralizing activity of BNT162b2-elicited serum. N Engl J Med 2021;384(15):1466-8.
34. Wall EC, Wu M, Harvey R, Kelly G, Warchal S, Sawyer C, et al. Neutralising antibody activity against Sars-CoV-2 VOCs B. 1.617. 2 and B. 1.351 by BNT162b2 vaccination. The Lancet 2021;397(10292):2331-3.
35. Pouwels KB, Pritchard E, Matthews PC, Stoesser N, Eyre DW, Vihta KD, et al. Impact of Delta on viral burden and vaccine effectiveness against new Sars-CoV-2 infections in the UK. medRxiv. doi: https://doi.org/10.1101/2021.08.18.21262237
36. Bernal JL, Andrews N, Gower C, Gallagher E, Simmons R, Thelwall S, et al. Effectiveness of Covid-19 vaccines against the B. 1.617. 2 (Delta) variant. N Engl J Med 2021;385(7):585-94.
37. Puranik A, Lenehan PJ, Silvert E, Niesen MJM, Corchado-Garcia J, O’Horo JC, et al. Comparison of two highly-effective mRNA vaccines for Covid-19 during periods of Alpha and Delta variant prevalence. medRxiv. Disponible sur : https://www.medrxiv.org/content/10.1101/2021.08.06.21261707v2
38. Direction de la recherche, des études, de l’évaluation et des statistiques. Les travaux de la DREES liés à la crise sanitaire de la Covid-19. 2021 [cité le 29 septembre 2021]. Disponible sur : https://drees.solidarites-sante.gouv.fr/article/les-travaux-de-la-drees-lies-la-crise-sanitaire-de-la-covid-19
39. businesswire.com. Real-world evidence confirms high effectiveness of Pfizer-BioNTech Covid-19 vaccine and profound public health impact of vaccination one year after pandemic declared. 2021 [cité le 4 juin 2021]. Disponible sur : https://www.businesswire.com/news/home/20210311005482/en/Real-World-Evidence-Confirms-High-Effectiveness-of-Pfizer-BioNTech-COVID-19-Vaccine-and-Profound-Public-Health-Impact-of-Vaccination-One-Year-After-Pandemic-Declared
40. Tande AJ, Pollock BD, Shah ND, Farrugia G, Virk A, Swift M, et al. Impact of the Coronavirus Disease 2019 (COVID-19) Vaccine on Asymptomatic Infection Among Patients Undergoing Preprocedural COVID-19 Molecular Screening. Clin Infect Dis. 2021:ciab229. doi:10.1093/cid/ciab229
41. Kustin T, Harel N, Finkel U, Perchik S, Harari S, Tahor M, et al. Evidence for increased breakthrough rates of Sars-CoV-2 variants of concern in BNT162b2-mRNA-vaccinated individuals. Nat Med 2021;27(8):1379-84.
42. Food and Drug Administration. Coronavirus (Covid-19) update: FDA allows more flexible storage, transportation conditions for Pfizer-BioNTech Covid-19 vaccine. 2021 [cité le 25 février 2021]. Disponible sur : https://www.fda.gov/news-events/press-announcements/coronavirus-covid-19-update-fda-allows-more-flexible-storage-transportation-conditions-pfizer
43. Levine-Tiefenbrun M, Yelin I, Alapi H, Katz R, Herzel E, Kuint J, et al. Viral loads of Delta-variant Sars-CoV2 breakthrough infections following vaccination and booster with the BNT162b2 vaccine. medRxiv. doi: https://doi.org/10.1101/2021.08.29.21262798
44. Haute Autorité de santé. Covid-19 : la HAS précise les populations éligibles à une dose de rappel de vaccin. 2021 [cité le 24 août 2021]. Disponible sur : https://www.has-sante.fr/jcms/p_3283153/fr/covid-19-la-has-precise-les-populations-eligibles-a-une-dose-de-rappel-de-vaccin
45. Organisation mondiale de la santé. Considerations in boosting Covid vaccine immune responses. 2021 [cité le 13 août 2021]. Disponible sur : https://www.who.int/news-room/events/detail/2021/08/13/default-calendar/who-consultation-on-covid-19-vaccines-research-13-august-2021
46. businesswire.com. Pfizer-BioNTech announce positive topline results of pivotal Covid-19 vaccine study in adolescents. 2021 [cité le 23 avril 2021]. Disponible sur : https://www.businesswire.com/news/home/20210331005503/en/Pfizer-BioNTech-Announce-Positive-Topline-Results-of-Pivotal-COVID-19-Vaccine-Study-in-Adolescents
47. Moderna. Moderna announces first participants dosed in phase 2/3 study of Covid-19 vaccine candidate in pediatric population. 2021 [cité le 16 juin 2021]. Disponible sur : https://investors.modernatx.com/news-releases/news-release-details/moderna-announces-first-participants-dosed-phase-23-study-0/
48. Johnson & Johnson. Johnson & Johnson expands phase 2a clinical trial of Covid-19 vaccine candidate to include adolescents. 2021 [cité le 23 avril 2021]. Disponible sur : https://www.jnj.com/johnson-johnson-expands-phase-2a-clinical-trial-of-covid-19-vaccine-candidate-to-include-adolescents