Quatre types de vaccins contre le virus respiratoire syncytial sont en cours de développement. Ils devraient permettre de réduire le nombre d’hospitalisations dans les deux classes d’âge principalement touchées par ce virus : les nouveau-nés (grâce à la vaccination maternelle) et les personnes âgées de plus de 60 ans.
La responsabilité importante du virus respiratoire syncytial (VRS) dans les infections respiratoires basses est établie depuis sa découverte en 1955. Il est le principal virus responsable d’infections respiratoires basses chez l’enfant de moins de 5 ans, notamment les bronchiolites aiguës du nourrisson. Son implication dans les pathologies respiratoires de l’adulte, en particulier chez la personne âgée de plus de 60 ans, est également désormais reconnue. Les avancées thérapeutiques ont mené à la mise sur le marché d’anticorps monoclonaux (palivizumab et nirsévimab) utilisés en prévention des bronchiolites mais également à la conception de vaccins anti-VRS, qui seront disponibles dans les mois à venir.
Un virus particulièrement agressif aux âges extrêmes de la vie
Circulation saisonnière
L’infection à VRS se transmet par voie respiratoire (inhalation de gouttelettes) et/ou manuportée. L’incubation dure classiquement de trois à cinq jours. Le virus se réplique d’abord dans le nasopharynx, entraînant une rhinorrhée. La fièvre est modérée et présente chez moins de la moitié des patients. Les signes d’infection respiratoire basse (IRB) se manifestent un à trois jours plus tard.
Le VRS est un virus ubiquitaire ; on considère que tous les enfants sont infectés par le VRS au cours de leurs deux premières années de vie, et que plus des deux tiers d’entre eux l’auront été durant la première année. L’immunité n’étant pas protectrice à vie, jusqu’à 10 % des adultes se réinfectent par le VRS tous les ans. Les réinfections sont encore plus fréquentes chez les jeunes enfants.
La circulation du VRS en France métropolitaine est saisonnière, avec des épidémies débutant généralement fin septembre et se terminant en avril. Une circulation toute l’année peut être observée dans les zones tropicales, à l’instar d’autres virus respiratoires comme la grippe.
Des épidémies nosocomiales sont décrites, notamment chez les personnes âgées vivant en institution ou dans les services hospitaliers. Les moyens de protection contre ces épidémies nosocomiales sont classiques : port de masque et de gants, lavage des mains et hospitalisation en chambre simple jusqu’à guérison clinique.
Le VRS est un virus ubiquitaire ; on considère que tous les enfants sont infectés par le VRS au cours de leurs deux premières années de vie, et que plus des deux tiers d’entre eux l’auront été durant la première année. L’immunité n’étant pas protectrice à vie, jusqu’à 10 % des adultes se réinfectent par le VRS tous les ans. Les réinfections sont encore plus fréquentes chez les jeunes enfants.
La circulation du VRS en France métropolitaine est saisonnière, avec des épidémies débutant généralement fin septembre et se terminant en avril. Une circulation toute l’année peut être observée dans les zones tropicales, à l’instar d’autres virus respiratoires comme la grippe.
Des épidémies nosocomiales sont décrites, notamment chez les personnes âgées vivant en institution ou dans les services hospitaliers. Les moyens de protection contre ces épidémies nosocomiales sont classiques : port de masque et de gants, lavage des mains et hospitalisation en chambre simple jusqu’à guérison clinique.
La moitié des enfants infectés par le VRS évolue vers la bronchiolite aiguë du nourrisson
Au niveau mondial, le VRS serait responsable d’environ 25 % des IRB chez les enfants de moins de 5 ans, conduisant à 3,6 millions d’hospitalisations et plus de 100 000 décès, principalement dans les pays en développement.1
On estime que jusqu’à 50 % des enfants infectés par le VRS peuvent évoluer vers la bronchiolite aiguë du nourrisson et que 1 à 3 % de ces cas conduisent à une hospitalisation.
En France, il y aurait près de 450 000 cas de bronchiolite aiguë du nourrisson par an, et plus de 10 000 hospitalisations. Il s’agit de la première cause d’hospitalisation des enfants de moins de 6 mois, avec un pic entre 1 et 3 mois. Des facteurs de risque d’hospitalisation (prématurité et faible poids à la naissance, exposition au tabac, pathologies cardiaques et pulmonaires, syndrome de Down, déficits immunitaires) sont identifiés, mais la majorité des enfants hospitalisés n’ont pas d’autre facteur de risque que leur jeune âge (moins de 2 mois).
On estime que jusqu’à 50 % des enfants infectés par le VRS peuvent évoluer vers la bronchiolite aiguë du nourrisson et que 1 à 3 % de ces cas conduisent à une hospitalisation.
En France, il y aurait près de 450 000 cas de bronchiolite aiguë du nourrisson par an, et plus de 10 000 hospitalisations. Il s’agit de la première cause d’hospitalisation des enfants de moins de 6 mois, avec un pic entre 1 et 3 mois. Des facteurs de risque d’hospitalisation (prématurité et faible poids à la naissance, exposition au tabac, pathologies cardiaques et pulmonaires, syndrome de Down, déficits immunitaires) sont identifiés, mais la majorité des enfants hospitalisés n’ont pas d’autre facteur de risque que leur jeune âge (moins de 2 mois).
Le VRS est responsable d’hospitalisations et de décès chez les personnes âgées et fragilisées
Le rôle du VRS dans les infections respiratoires basses de l’adulte âgé a été reconnu dans les années 1960 et 1970, à la suite d’épidémies dans des services d’hospitalisation. La mortalité chez les patients hospitalisés est d’environ 7 % dans les pays occidentaux, similaire au taux de décès lors d’infections grippales.2
Une méta-analyse a estimé qu’en France les infections à VRS sont responsables annuellement de 25 000 hospitalisations et de près de 2 000 décès chez les personnes âgées de plus de 60 ans.3 Certaines populations ont un surrisque d’hospitalisation : patients avec pathologies cardiaques et/ou pulmonaires (bronchopneumopathie chronique obstructive [BPCO], asthme), patients avec pathologies chroniques (diabète, insuffisance rénale), patients immunodéprimés et patients de plus de 75 ans.4 Les patients immunodéprimés sont à risque d’infection sévère par le VRS, notamment les patients transplantés pulmonaires et ceux ayant reçu une greffe de cellules souches hématopoïétiques. Les taux de décès, plus importants chez ces patients immunodéprimés, peuvent aller jusqu’à 30 %.
Une méta-analyse a estimé qu’en France les infections à VRS sont responsables annuellement de 25 000 hospitalisations et de près de 2 000 décès chez les personnes âgées de plus de 60 ans.3 Certaines populations ont un surrisque d’hospitalisation : patients avec pathologies cardiaques et/ou pulmonaires (bronchopneumopathie chronique obstructive [BPCO], asthme), patients avec pathologies chroniques (diabète, insuffisance rénale), patients immunodéprimés et patients de plus de 75 ans.4 Les patients immunodéprimés sont à risque d’infection sévère par le VRS, notamment les patients transplantés pulmonaires et ceux ayant reçu une greffe de cellules souches hématopoïétiques. Les taux de décès, plus importants chez ces patients immunodéprimés, peuvent aller jusqu’à 30 %.
Réponse immunitaire à l’infection
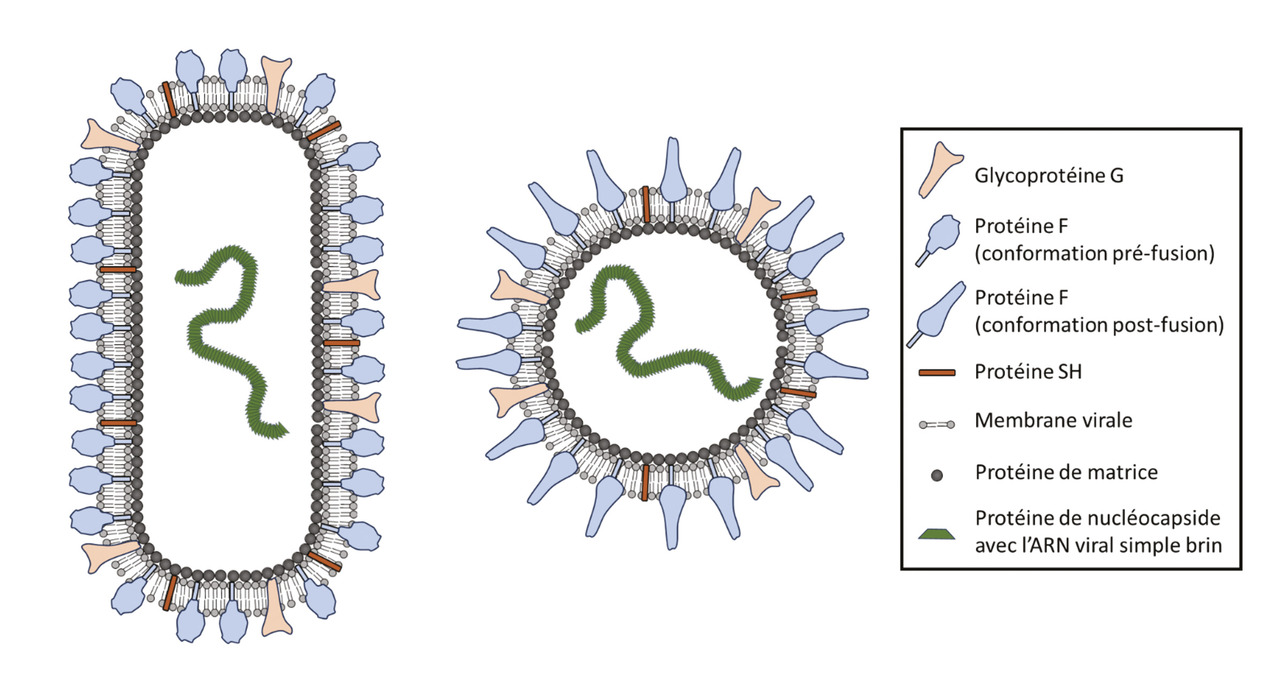
Le VRS est un virus appartenant à la famille des Pneumoviridae. Il s’agit d’un virus enveloppé à ARN simple brin d’environ 15 kb. Il possède à sa surface trois glycoprotéines : la protéine d’attachement G, la protéine de fusion F et la petite protéine hydrophobe SH (figure ).
Les anticorps neutralisants produits lors de l’infection sont dirigés contre les protéines F et G. La protéine G est moins immunogène que la protéine F, et elle est très variable entre les deux groupes antigéniques : A et B, alors que la protéine F est plus conservée entre les virus. Les anticorps neutralisants sont dirigés contre la protéine F dans sa conformation pré-fusion (pré-F).
Les anticorps neutralisants permettent principalement de protéger contre les réinfections, donc, indirectement, de diminuer le nombre de formes graves. La protection contre les formes sévères est, elle, principalement due à la réponse immunitaire T.
Durant le troisième trimestre de la grossesse, le transfert passif des anticorps (immunoglobulines G) maternels vers le fœtus permet une protection de l’enfant dans les premières semaines de vie. La demi-vie de ces anticorps maternels est courte (de 21 à 26 jours), expliquant cette protection très limitée dans le temps.
Les anticorps neutralisants produits lors de l’infection sont dirigés contre les protéines F et G. La protéine G est moins immunogène que la protéine F, et elle est très variable entre les deux groupes antigéniques : A et B, alors que la protéine F est plus conservée entre les virus. Les anticorps neutralisants sont dirigés contre la protéine F dans sa conformation pré-fusion (pré-F).
Les anticorps neutralisants permettent principalement de protéger contre les réinfections, donc, indirectement, de diminuer le nombre de formes graves. La protection contre les formes sévères est, elle, principalement due à la réponse immunitaire T.
Durant le troisième trimestre de la grossesse, le transfert passif des anticorps (immunoglobulines G) maternels vers le fœtus permet une protection de l’enfant dans les premières semaines de vie. La demi-vie de ces anticorps maternels est courte (de 21 à 26 jours), expliquant cette protection très limitée dans le temps.
Quatre types de vaccins anti-VRS en développement
Différents vaccins anti-VRS sont en cours de développement, fondés sur plusieurs technologies : vaccins sous-unitaires composés de protéines recombinantes ou de pseudo-particules virales, vaccins à ARN messager, vaccins à vecteur recombinant et vaccins vivants atténués (tableau ).
Deux vaccins à protéines recombinantes approuvés par l’EMA
Les vaccins les plus avancés sont les vaccins utilisant la protéine F stabilisée dans sa conformation pré-fusion (pré-F). Il s’agit des vaccins développés par Pfizer (Abrysvo) et par GSK (Arexvy). Ces vaccins ont été évalués dans deux populations : les personnes âgées de plus de 65 ans et les femmes enceintes. Leur schéma vaccinal actuel est d’une seule injection par voie intramusculaire.
Chez le jeune adulte (de 18 à 50 ans), son efficacité est de 86,7 % pour la prévention des infections symptomatiques à VRS, et l’élimination du virus est accélérée chez les sujets vaccinés.5
Dans l’essai de phase III ayant inclus plus de 35 000 personnes de plus de 60 ans, la vaccination a permis une protection de 66,7 et 85,7 % contre les IRB à VRS avec au moins deux et au moins trois symptômes, respectivement.6 Cet effet protecteur a persisté durant toute l’étude, c’est-à-dire un an. La tolérance du vaccin était bonne, les patients rapportant des douleurs au point d’injection, des myalgies et des céphalées.
L’administration de ce même vaccin chez plus de 3 500 femmes enceintes, entre 24 et 36 semaines d’aménorrhée, a entraîné une réduction de 81,8 % des infections respiratoires basses sévères et une diminution de 57,1 % des infections à VRS ayant nécessité une consultation médicale durant les 90 premiers jours de vie du nouveau-né.7 Ces niveaux de protection baissent avec le temps, passant à une diminution de 69,4 % des infections respiratoires basses sévères pour les 180 premiers jours de vie.
Les résultats encourageants de ces essais cliniques ont amené l’Agence européenne du médicament (EMA) à autoriser le vaccin Abrysvo chez les personnes âgées et les femmes enceintes en juillet 2023.
Les résultats de l’étude de phase III chez près de 25 000 personnes âgées de plus de 65 ans ont montré une protection vaccinale de 94,1 % contre les infections respiratoires basses sévères.8 Ce vaccin était efficace sur les deux groupes de VRS.
Les réactions au site d’injection étaient fréquentes (douleurs principalement), et certains patients rapportaient également des myalgies, céphalées et de la fatigue.
Le vaccin Arexvy a obtenu une autorisation de mise sur le marché pour les personnes âgées en avril 2023.
Il reste cependant une inconnue concernant la durée de protection conférée par ces deux vaccins, notamment chez les personnes âgées, et donc la fréquence à laquelle il faudra renouveler la vaccination. L’efficacité chez les patients immunodéprimés reste également à déterminer.
Abrysvo, vaccin bivalent VRS A et B, AMM pour les personnes âgées et les femmes enceintes
Le vaccin développé par Pfizer est un vaccin bivalent, contenant 60 μg de protéine pré-F du VRS-A et 60 μg de protéine pré-F du VRS-B, non adjuvanté.Chez le jeune adulte (de 18 à 50 ans), son efficacité est de 86,7 % pour la prévention des infections symptomatiques à VRS, et l’élimination du virus est accélérée chez les sujets vaccinés.5
Dans l’essai de phase III ayant inclus plus de 35 000 personnes de plus de 60 ans, la vaccination a permis une protection de 66,7 et 85,7 % contre les IRB à VRS avec au moins deux et au moins trois symptômes, respectivement.6 Cet effet protecteur a persisté durant toute l’étude, c’est-à-dire un an. La tolérance du vaccin était bonne, les patients rapportant des douleurs au point d’injection, des myalgies et des céphalées.
L’administration de ce même vaccin chez plus de 3 500 femmes enceintes, entre 24 et 36 semaines d’aménorrhée, a entraîné une réduction de 81,8 % des infections respiratoires basses sévères et une diminution de 57,1 % des infections à VRS ayant nécessité une consultation médicale durant les 90 premiers jours de vie du nouveau-né.7 Ces niveaux de protection baissent avec le temps, passant à une diminution de 69,4 % des infections respiratoires basses sévères pour les 180 premiers jours de vie.
Les résultats encourageants de ces essais cliniques ont amené l’Agence européenne du médicament (EMA) à autoriser le vaccin Abrysvo chez les personnes âgées et les femmes enceintes en juillet 2023.
Arexvy, vaccin monovalent, AMM pour les personnes âgées
Le vaccin développé par GSK est un vaccin monovalent, adjuvanté.Les résultats de l’étude de phase III chez près de 25 000 personnes âgées de plus de 65 ans ont montré une protection vaccinale de 94,1 % contre les infections respiratoires basses sévères.8 Ce vaccin était efficace sur les deux groupes de VRS.
Les réactions au site d’injection étaient fréquentes (douleurs principalement), et certains patients rapportaient également des myalgies, céphalées et de la fatigue.
Le vaccin Arexvy a obtenu une autorisation de mise sur le marché pour les personnes âgées en avril 2023.
Il reste cependant une inconnue concernant la durée de protection conférée par ces deux vaccins, notamment chez les personnes âgées, et donc la fréquence à laquelle il faudra renouveler la vaccination. L’efficacité chez les patients immunodéprimés reste également à déterminer.
Vaccins à ARN messager, des essais combinant VRS, SARS-CoV-2 et virus de la grippe
Parmi les vaccins en cours de développement, les vaccins fondés sur la technologie de l’ARN messager peuvent être cités. Le candidat-vaccin mRNA-1345 de Moderna a montré une efficacité de 83,7 % dans la protection contre les infections respiratoires basses à VRS dans une analyse intermédiaire d’un essai comprenant plus de 36 000 patients âgés de plus de 60 ans. L’essai de phase II/III se poursuit. Des essais en cours évaluent la possibilité de combiner le VRS au virus de la grippe et/ou au SARS-CoV-2 dans ces vaccins fondés sur la technologie de l’ARN messager. Cela pourrait permettre des rappels vaccinaux simplifiés dans les populations à risque.
Vecteurs viraux recombinants
Des vaccins fondés sur des vecteurs viraux recombinants sont également en développement. Ainsi, le vaccin MVA-BN-RSV est fondé sur le virus de la vaccine codant pour plusieurs protéines du VRS. Dans un essai de phase II, ce vaccin a permis de réduire de 79,2 % les infections chez des adultes sains âgés de 18 à 50 ans. Un essai de phase III incluant des patients âgés de plus de 60 ans est en cours afin de confirmer ces résultats.
Un autre vaccin fondé sur un vecteur adénovirus est en cours d’évaluation dans la population pédiatrique (Ad26.RSV.preF, Janssen).
Un autre vaccin fondé sur un vecteur adénovirus est en cours d’évaluation dans la population pédiatrique (Ad26.RSV.preF, Janssen).
Vaccins vivants atténués
Des vaccins vivants atténués sont aussi en cours d’évaluation dans la population pédiatrique. Ces vaccins sont administrés par voie nasale, afin de stimuler la production d’immunoglobulines A sécrétoires et l’immunité mucosale contre l’infection et la clairance de cette infection.
Élargissement des moyens de prévention contre le VRS
Les moyens à disposition pour la prévention des infections par le VRS évoluent rapidement. L’arrivée de vaccins devrait permettre de réduire le nombre d’hospitalisations dans les deux classes d’âge principalement touchées par le VRS : les nouveau-nés et les personnes âgées de plus de 60 ans.
Pour les nouveau-nés, la vaccination maternelle permet de protéger l’enfant durant ses six premiers mois de vie, période de susceptibilité accrue à ce virus. Il est à noter que le nirsévimab, un nouvel anticorps monoclonal, est également mis sur le marché à l’automne 2023 pour la prévention des infections par VRS chez les enfants de moins de 2 ans. Cela permet de protéger les enfants dont les mères n’auraient pas pu bénéficier de la vaccination ou qui seraient nés prématurément, limitant donc le transfert passif des anticorps maternels.
La vaccination des personnes âgées de plus de 60 ans pourrait permettre de réduire le nombre de décès annuels dus aux pneumonies à VRS. Les futurs vaccins permettront peut-être d’immuniser contre plusieurs virus respiratoires en une seule injection.
Pour les nouveau-nés, la vaccination maternelle permet de protéger l’enfant durant ses six premiers mois de vie, période de susceptibilité accrue à ce virus. Il est à noter que le nirsévimab, un nouvel anticorps monoclonal, est également mis sur le marché à l’automne 2023 pour la prévention des infections par VRS chez les enfants de moins de 2 ans. Cela permet de protéger les enfants dont les mères n’auraient pas pu bénéficier de la vaccination ou qui seraient nés prématurément, limitant donc le transfert passif des anticorps maternels.
La vaccination des personnes âgées de plus de 60 ans pourrait permettre de réduire le nombre de décès annuels dus aux pneumonies à VRS. Les futurs vaccins permettront peut-être d’immuniser contre plusieurs virus respiratoires en une seule injection.
Références
1. Li Y, Wang X, Blau DM, Caballero MT, Feikin DR, Gill CJ, et al. Global, regional, and national disease burden estimates of acute lower respiratory infections due to respiratory syncytial virus in children younger than 5 years in 2019: A systematic analysis. Lancet 2022;399(10340):2047-64.
2. GBD 2016 Lower Respiratory Infections Collaborators. Estimates of the global, regional, and national morbidity, mortality, and aetiologies of lower respiratory infections in 195 countries, 1990-2016: A systematic analysis for the Global Burden of Disease Study 2016. Lancet Infect Dis 2018;18(11):1191-210.
3. Savic M, Penders Y, Shi T, Branche A, Pirçon JY. Respiratory syncytial virus disease burden in adults aged 60 years and older in high-income countries: A systematic literature review and meta-analysis. Influenza Other Respir Viruses 2023;17(1):e13031.
4. Branche AR, Saiman L, Walsh EE, Falsey AR, Sieling WD, Greendyke W, et al. Incidence of respiratory syncytial virus infection among hospitalized adults, 2017–2020. Clin Infect Dis 2022;74(6):1004-11.
5. Schmoele-Thoma B, Zareba AM, Jiang Q, Maddur MS, Danaf R, Mann A, et al. Vaccine efficacy in adults in a respiratory syncytial virus challenge study. N Engl J Med 2022;386(25):2377-86.
6. Walsh EE, Perez Marc G, Zareba AM, Falsey AR, Jiang Q, Patton M, et al. Efficacy and safety of a bivalent RSV prefusion F vaccine in older adults. NEngl J Med 2023;388(16):1465-77.
7. Kampmann B, Madhi SA, Munjal I, Simões EAF, Pahud BA, Llapur C, et al. Bivalent prefusion F vaccine in pregnancy to prevent RSV illness in infants. N Engl J Med 2023;388(16):1451-64.
8. Papi A, Ison MG, Langley JM, Lee DG, Leroux-Roels I, Martinon-Torres F, et al. Respiratory syncytial virus prefusion F protein vaccine in older adults. N Engl J Med 2023;388(7):595-608.
2. GBD 2016 Lower Respiratory Infections Collaborators. Estimates of the global, regional, and national morbidity, mortality, and aetiologies of lower respiratory infections in 195 countries, 1990-2016: A systematic analysis for the Global Burden of Disease Study 2016. Lancet Infect Dis 2018;18(11):1191-210.
3. Savic M, Penders Y, Shi T, Branche A, Pirçon JY. Respiratory syncytial virus disease burden in adults aged 60 years and older in high-income countries: A systematic literature review and meta-analysis. Influenza Other Respir Viruses 2023;17(1):e13031.
4. Branche AR, Saiman L, Walsh EE, Falsey AR, Sieling WD, Greendyke W, et al. Incidence of respiratory syncytial virus infection among hospitalized adults, 2017–2020. Clin Infect Dis 2022;74(6):1004-11.
5. Schmoele-Thoma B, Zareba AM, Jiang Q, Maddur MS, Danaf R, Mann A, et al. Vaccine efficacy in adults in a respiratory syncytial virus challenge study. N Engl J Med 2022;386(25):2377-86.
6. Walsh EE, Perez Marc G, Zareba AM, Falsey AR, Jiang Q, Patton M, et al. Efficacy and safety of a bivalent RSV prefusion F vaccine in older adults. NEngl J Med 2023;388(16):1465-77.
7. Kampmann B, Madhi SA, Munjal I, Simões EAF, Pahud BA, Llapur C, et al. Bivalent prefusion F vaccine in pregnancy to prevent RSV illness in infants. N Engl J Med 2023;388(16):1451-64.
8. Papi A, Ison MG, Langley JM, Lee DG, Leroux-Roels I, Martinon-Torres F, et al. Respiratory syncytial virus prefusion F protein vaccine in older adults. N Engl J Med 2023;388(7):595-608.