Le cancer du rectum est l’un des cancers digestifs les plus fréquents et compte pour environ un tiers des cas de cancers colorectaux. Durant de nombreuses années, le principal objectif thérapeutique des essais cliniques a été de réduire le risque de récidive locorégionale. Pour le cancer du rectum localement avancé (T3-4 et/ou N+), deux progrès majeurs, la proctectomie avec exérèse complète du mésorectum et la radiothérapie préopératoire, ont permis de réduire le risque de récidive locorégionale à 5-7 % environ. Deux schémas de radiothérapie préopératoire ont été développés :
– un schéma de radiothérapie courte (SRC) : 25 Gy en 5 fractions durant cinq jours consécutifs, puis chirurgie sept à dix jours après ;
– un schéma de chimioradiothérapie (CRT) longue : de 45 à 50 Gy en cinq fractions par semaine de 1,8 à 2 Gy avec une fluoropyrimidine, puis chirurgie six à huit semaines après.
Ces deux schémas sont associés à une réduction significative du risque de récidive locorégionale, mais le SRC ne permet pas de réduire la taille tumorale, et une CRT doit être préférée si la résection risque d’être incomplète (R1) du fait de l’envahissement de la marge de résection circonférentielle à l’imagerie par résonance magnétique (IRM) diagnostique.1 Après CRT, le taux de réponse pathologique complète (RPc) est de l’ordre de 15 % ; c’est un facteur pronostique associé à une réduction des risques de récidive locorégionale et métastatique et une augmentation des survies sans récidive et globale.2
Cette stratégie thérapeutique combinant radiothérapie préopératoire et exérèse complète du mésorectum n’a pas permis de réduire le risque de récidive métastatique. À la différence des cancers du côlon, l’intérêt d’une chimiothérapie adjuvante pour les cancers du bas et moyen rectum n’a jamais été formellement démontré dans une étude de phase III, malgré un faisceau d’arguments concordants.1, 3, 4 La morbidité de la séquence thérapeutique explique en partie ces résultats. Dans les essais ayant randomisé les patients au moment du diagnostic (avant tout traitement), seuls 50 à 70 % d’entre eux pouvaient recevoir une chimiothérapie adjuvante.1, 3, 4 Le meilleur niveau de preuve a finalement été apporté par l’étude de phase II ADORE dans laquelle les patients étaient randomisés en postopératoire selon le stade ypTNM (stade II ou III après CRT) entre un schéma FUFOL (5-FU et acide folinique, Mayo Clinic) et un FOLFOX4 simplifié pour une durée de quatre mois.5 Le FOLFOX4 était associé à un bénéfice significatif en survie sans récidive (hazard ratio [HR] = 0,66 ; intervalle de confiance à 95 % [IC 95 %] : 0,43-0,99) et en survie globale (HR = 0,46 ; IC 95 % : 0,21-0,97). Le bénéfice était essentiellement observé pour le sous-groupe des tumeurs ypN+, et une chimiothérapie adjuvante par FOLFOX4 est considérée comme une option chez ces patients.1, 5
Récemment, plusieurs études ont évalué de nouveaux schémas thérapeutiques intégrant une chimiothérapie néoadjuvante. Deux études de phase III positives rapportées en 2020 ont changé les standards thérapeutiques.
– un schéma de radiothérapie courte (SRC) : 25 Gy en 5 fractions durant cinq jours consécutifs, puis chirurgie sept à dix jours après ;
– un schéma de chimioradiothérapie (CRT) longue : de 45 à 50 Gy en cinq fractions par semaine de 1,8 à 2 Gy avec une fluoropyrimidine, puis chirurgie six à huit semaines après.
Ces deux schémas sont associés à une réduction significative du risque de récidive locorégionale, mais le SRC ne permet pas de réduire la taille tumorale, et une CRT doit être préférée si la résection risque d’être incomplète (R1) du fait de l’envahissement de la marge de résection circonférentielle à l’imagerie par résonance magnétique (IRM) diagnostique.1 Après CRT, le taux de réponse pathologique complète (RPc) est de l’ordre de 15 % ; c’est un facteur pronostique associé à une réduction des risques de récidive locorégionale et métastatique et une augmentation des survies sans récidive et globale.2
Cette stratégie thérapeutique combinant radiothérapie préopératoire et exérèse complète du mésorectum n’a pas permis de réduire le risque de récidive métastatique. À la différence des cancers du côlon, l’intérêt d’une chimiothérapie adjuvante pour les cancers du bas et moyen rectum n’a jamais été formellement démontré dans une étude de phase III, malgré un faisceau d’arguments concordants.1, 3, 4 La morbidité de la séquence thérapeutique explique en partie ces résultats. Dans les essais ayant randomisé les patients au moment du diagnostic (avant tout traitement), seuls 50 à 70 % d’entre eux pouvaient recevoir une chimiothérapie adjuvante.1, 3, 4 Le meilleur niveau de preuve a finalement été apporté par l’étude de phase II ADORE dans laquelle les patients étaient randomisés en postopératoire selon le stade ypTNM (stade II ou III après CRT) entre un schéma FUFOL (5-FU et acide folinique, Mayo Clinic) et un FOLFOX4 simplifié pour une durée de quatre mois.5 Le FOLFOX4 était associé à un bénéfice significatif en survie sans récidive (hazard ratio [HR] = 0,66 ; intervalle de confiance à 95 % [IC 95 %] : 0,43-0,99) et en survie globale (HR = 0,46 ; IC 95 % : 0,21-0,97). Le bénéfice était essentiellement observé pour le sous-groupe des tumeurs ypN+, et une chimiothérapie adjuvante par FOLFOX4 est considérée comme une option chez ces patients.1, 5
Récemment, plusieurs études ont évalué de nouveaux schémas thérapeutiques intégrant une chimiothérapie néoadjuvante. Deux études de phase III positives rapportées en 2020 ont changé les standards thérapeutiques.
Impact de l’allongement du délai entre radiothérapie et chirurgie
Plusieurs études rétrospectives avaient suggéré qu’un allongement du délai entre la fin de la radiothérapie et la chirurgie était associé à une augmentation du taux de RPc. Ces données provenaient de séries de patients traités par SRC ou CRT. Cette question a été évaluée prospectivement dans des études de phase III.
L’essai de phase III STOCKHOLM III a comparé trois bras de traitement : un bras SCR « classique » (chirurgie à 7-10 jours), un bras SCR « allongé » (chirurgie à 4-8 semaines) et un bras de radiothérapie (50 Gy sans chimiothérapie concomitante, chirurgie à 4-8 semaines). Par rapport à la SRC « classique », le bras SRC « allongé » était associé à une augmentation significative du taux de RPc (10 % vs < 1 % ; p < 0,0001), à une augmentation des hospitalisations pour toxicité aiguë (7 % vs < 1 % ; p < 0,0001) mais à une diminution de la morbidité chirurgicale (41 % vs 53 % ; p = 0,001).6 Malgré l’augmentation du taux de RPc, les taux de récidive locorégionale ou métastatique et les taux de survie sans récidive et globale étaient similaires entre les trois bras.6
Dans l’essai de phase III GRECCAR-6, l’allongement du délai de sept à onze semaines entre la fin de la CRT et la chirurgie n’était pas associé à une augmentation du taux de RPc (15 % vs 17 %, respectivement ; p = 0,60).7 En revanche, il était associé à une augmentation de la morbidité postopératoire (44,5 % vs 32 % ; p = 0,04) et à une moins bonne qualité de résection complète du mésorectum (79 % vs 90 % ; p = 0,016). Les taux de récidive locorégionale et métastatique, et les taux de survie sans récidive et globale étaient identiques dans les deux bras.7
En conclusion, l’allongement du délai entre la fin de la radiothérapie et la chirurgie augmente le taux de réponse pathologique complète après un schéma de radiothérapie courte mais pas après chimioradiothérapie. Cette augmentation du taux de réponse pathologique complète n’est pas associée à un bénéfice en termes de survie dans l’essai STOCKHOLM III.
L’essai de phase III STOCKHOLM III a comparé trois bras de traitement : un bras SCR « classique » (chirurgie à 7-10 jours), un bras SCR « allongé » (chirurgie à 4-8 semaines) et un bras de radiothérapie (50 Gy sans chimiothérapie concomitante, chirurgie à 4-8 semaines). Par rapport à la SRC « classique », le bras SRC « allongé » était associé à une augmentation significative du taux de RPc (10 % vs < 1 % ; p < 0,0001), à une augmentation des hospitalisations pour toxicité aiguë (7 % vs < 1 % ; p < 0,0001) mais à une diminution de la morbidité chirurgicale (41 % vs 53 % ; p = 0,001).6 Malgré l’augmentation du taux de RPc, les taux de récidive locorégionale ou métastatique et les taux de survie sans récidive et globale étaient similaires entre les trois bras.6
Dans l’essai de phase III GRECCAR-6, l’allongement du délai de sept à onze semaines entre la fin de la CRT et la chirurgie n’était pas associé à une augmentation du taux de RPc (15 % vs 17 %, respectivement ; p = 0,60).7 En revanche, il était associé à une augmentation de la morbidité postopératoire (44,5 % vs 32 % ; p = 0,04) et à une moins bonne qualité de résection complète du mésorectum (79 % vs 90 % ; p = 0,016). Les taux de récidive locorégionale et métastatique, et les taux de survie sans récidive et globale étaient identiques dans les deux bras.7
En conclusion, l’allongement du délai entre la fin de la radiothérapie et la chirurgie augmente le taux de réponse pathologique complète après un schéma de radiothérapie courte mais pas après chimioradiothérapie. Cette augmentation du taux de réponse pathologique complète n’est pas associée à un bénéfice en termes de survie dans l’essai STOCKHOLM III.
Effet de la chimiothérapie sur la tumeur rectale
L’efficacité d’une chimiothérapie d’induction sur la tumeur primitive rectale a été démontrée dans plusieurs études de phase II, en situation localement avancée ou métastatique. Ces études ont évalué plusieurs protocoles de chimiothérapie : FOLFOX, CAPOX ou FOLFIRINOX. Dans toutes ces études, et quel que soit le protocole utilisé, la chimiothérapie systémique permettait d’obtenir un contrôle tumoral dans plus de 95 % des cas, des réponses objectives et une amélioration rapide des symptômes rectaux chez plus de 90 % des patients.4
Ces résultats, la possibilité d’allonger le délai entre la fin de la radiothérapie et la chirurgie ainsi que les difficultés d’administration de la chimiothérapie adjuvante après chirurgie ont amené plusieurs équipes à développer des schémas comportant une chimiothérapie néoadjuvante en induction (avant la radiothérapie) ou en consolidation (entre la radiothérapie et la chirurgie).
Ces résultats, la possibilité d’allonger le délai entre la fin de la radiothérapie et la chirurgie ainsi que les difficultés d’administration de la chimiothérapie adjuvante après chirurgie ont amené plusieurs équipes à développer des schémas comportant une chimiothérapie néoadjuvante en induction (avant la radiothérapie) ou en consolidation (entre la radiothérapie et la chirurgie).
Schéma de radiothérapie courte et chimiothérapie de consolidation
Plusieurs études de phase III ont évalué le bénéfice d’une chimiothérapie de consolidation après SRC. Dans toutes ces études, le protocole de chimiothérapie reposait sur une combinaison de fluoropyrimidine et d’oxaliplatine.
L’essai de phase III POLISH II a comparé un bras expérimental avec une SCR suivie de trois cycles de FOLFOX (chirurgie à 11 semaines) à un bras contrôle avec une CRT (50,4 Gy ; capécitabine + oxaliplatine concomitamment ; chirurgie à 6-8 semaines).8 Bien que plus élevés dans le bras SRC + FOLFOX, les taux de résection R0 (77 % vs 71 %) et de RPc (16 % vs 12 %) n’étaient pas significativement différents. Le bras SRC + FOLFOX était associé à un meilleur profil de tolérance (toutes toxicités 83 % vs 75 % ; p = 0,006), mais les taux de toxicités de grade 3-4 ou les décès, ainsi que les complications postopératoires et tardives, n’étaient pas différents entre les deux bras. Les taux de récidive locorégionale ou métastatique et les taux de survie sans récidive et globale étaient similaires.8
L’essai de phase III de non-infériorité STELLAR a comparé un bras expérimental avec une SCR suivie de quatre cycles de CAPOX (chirurgie à 15-17 semaines) à une CRT (50 Gy avec capécitabine ; chirurgie à 6-8 semaines).9 Une chimiothérapie adjuvante était prévue dans les deux bras, deux cycles dans le bras SRC et six cycles de CAPOX dans le bras CRT (tableau 1 ). Le taux de toxicité de grade 3-4 durant le traitement préopératoire était significativement plus élevé dans le bras SRC + CAPOX (26,5 % vs 12,6 % ; p < 0,001), mais les taux de complications postopératoires étaient similaires (14,0 % vs 15,7 % ; p = 0,625). Le taux de RPc était augmenté de manière non significative dans le bras SRC + CAPOX (16,6 % vs 11,8 %). Après une médiane de suivi de 35 mois, la non-infériorité entre les deux bras était démontrée pour la survie sans récidive (HR = 0,88 ; IC 95 % : 0,70-1,13 ; p < 0,001) (tableau 2 ). Les taux de survie sans métastase et de récidive locorégionale à trois ans n’étaient pas différents entre les deux bras.9
Par rapport à une chimioradiothérapie « classique », la séquence radiothérapie courte suivie d’une chimiothérapie de consolidation par trois cycles de FOLFOX (6 semaines) ou quatre cycles de CAPOX (12 semaines) n’améliore pas la survie sans récidive.
L’essai de phase III POLISH II a comparé un bras expérimental avec une SCR suivie de trois cycles de FOLFOX (chirurgie à 11 semaines) à un bras contrôle avec une CRT (50,4 Gy ; capécitabine + oxaliplatine concomitamment ; chirurgie à 6-8 semaines).8 Bien que plus élevés dans le bras SRC + FOLFOX, les taux de résection R0 (77 % vs 71 %) et de RPc (16 % vs 12 %) n’étaient pas significativement différents. Le bras SRC + FOLFOX était associé à un meilleur profil de tolérance (toutes toxicités 83 % vs 75 % ; p = 0,006), mais les taux de toxicités de grade 3-4 ou les décès, ainsi que les complications postopératoires et tardives, n’étaient pas différents entre les deux bras. Les taux de récidive locorégionale ou métastatique et les taux de survie sans récidive et globale étaient similaires.8
L’essai de phase III de non-infériorité STELLAR a comparé un bras expérimental avec une SCR suivie de quatre cycles de CAPOX (chirurgie à 15-17 semaines) à une CRT (50 Gy avec capécitabine ; chirurgie à 6-8 semaines).9 Une chimiothérapie adjuvante était prévue dans les deux bras, deux cycles dans le bras SRC et six cycles de CAPOX dans le bras CRT (
Par rapport à une chimioradiothérapie « classique », la séquence radiothérapie courte suivie d’une chimiothérapie de consolidation par trois cycles de FOLFOX (6 semaines) ou quatre cycles de CAPOX (12 semaines) n’améliore pas la survie sans récidive.
Chimioradiothérapie et chimiothérapie d’induction ou de consolidation
L’efficacité d’une chimiothérapie d’induction par CAPOX ou FOLFOX avant CRT a été évaluée dans plusieurs études de phase II.4 Le nombre de cycles en induction variait de un à quatre, et la CRT pouvait comporter concomitamment de l’oxaliplatine. En intention de traiter, le taux de RPc variait de 14 à 25 % selon les études.4
L’étude de phase II randomisée GCR-3 a comparé deux bras de traitement dans lesquels une chimiothérapie de type CAPOX (4 cycles) était administrée soit en induction, soit en adjuvant (après la chirurgie).10 L’administration de CAPOX en induction était mieux tolérée et associée à une dose-intensité plus élevée. Les taux de résection R0, de RPc, et les survies sans récidive et globale étaient similaires.
L’intérêt d’une chimiothérapie de consolidation de type FOLFOX après CRT a également été évalué dans des études de phase II.11, 12 Une étude de phase II a évalué plusieurs bras dans lesquels le nombre de cycles de FOLFOX délivrés variait de deux à six, augmentant d’autant le délai entre la fin de la CRT et la chirurgie. Le taux de RPc augmentait significativement en fonction du nombre de cycles de FOLFOX : 25 % après deux cycles, 30 % après quatre cycles et 38 % après six cycles (p = 0,0036). Le taux d’effets secondaires de grade 3-4 augmentait également avec le nombre de cycles reçus, mais la difficulté chirurgicale et les taux de complications postopératoires étaient similaires.11
L’étude de phase II CAO/ARO/AIO-12 a comparé deux bras comportant une chimiothérapie néoadjuvante, en induction ou en consolidation (FOLFOX 3 cycles). Les toxicités de grade 3-4 de la CRT étaient moindres et l’observance meilleure lorsque que la CRT était réalisée en premier (bras consolidation). Le taux de RPc était supérieur dans le bras consolidation (25 % vs 17 %), et seul ce bras atteignait l’hypothèse statistique prédéfinie.12 Ce bras consolidation est en cours d’évaluation dans une étude de phase III randomisée vs CRT (CAO/ARO/AIO-18).
En conclusion, les résultats de ces études valident la faisabilité et l’intérêt potentiel d’associer une chimiothérapie néoadjuvante au schéma de chimioradiothérapie longue. L’administration de cette chimiothérapie en consolidation semble associée à un taux de réponse pathologique complète supérieur par rapport à son administration en induction. Il est important de souligner que, bien que l’obtention d’une réponse pathologique complète soit un facteur pronostique, il ne s’agit pas d’un critère de substitution de la survie sans récidive ou globale.
L’étude de phase II randomisée GCR-3 a comparé deux bras de traitement dans lesquels une chimiothérapie de type CAPOX (4 cycles) était administrée soit en induction, soit en adjuvant (après la chirurgie).10 L’administration de CAPOX en induction était mieux tolérée et associée à une dose-intensité plus élevée. Les taux de résection R0, de RPc, et les survies sans récidive et globale étaient similaires.
L’intérêt d’une chimiothérapie de consolidation de type FOLFOX après CRT a également été évalué dans des études de phase II.11, 12 Une étude de phase II a évalué plusieurs bras dans lesquels le nombre de cycles de FOLFOX délivrés variait de deux à six, augmentant d’autant le délai entre la fin de la CRT et la chirurgie. Le taux de RPc augmentait significativement en fonction du nombre de cycles de FOLFOX : 25 % après deux cycles, 30 % après quatre cycles et 38 % après six cycles (p = 0,0036). Le taux d’effets secondaires de grade 3-4 augmentait également avec le nombre de cycles reçus, mais la difficulté chirurgicale et les taux de complications postopératoires étaient similaires.11
L’étude de phase II CAO/ARO/AIO-12 a comparé deux bras comportant une chimiothérapie néoadjuvante, en induction ou en consolidation (FOLFOX 3 cycles). Les toxicités de grade 3-4 de la CRT étaient moindres et l’observance meilleure lorsque que la CRT était réalisée en premier (bras consolidation). Le taux de RPc était supérieur dans le bras consolidation (25 % vs 17 %), et seul ce bras atteignait l’hypothèse statistique prédéfinie.12 Ce bras consolidation est en cours d’évaluation dans une étude de phase III randomisée vs CRT (CAO/ARO/AIO-18).
En conclusion, les résultats de ces études valident la faisabilité et l’intérêt potentiel d’associer une chimiothérapie néoadjuvante au schéma de chimioradiothérapie longue. L’administration de cette chimiothérapie en consolidation semble associée à un taux de réponse pathologique complète supérieur par rapport à son administration en induction. Il est important de souligner que, bien que l’obtention d’une réponse pathologique complète soit un facteur pronostique, il ne s’agit pas d’un critère de substitution de la survie sans récidive ou globale.
Réduction du risque de récidive métastatique dans deux études de phase III récentes
Le bénéfice d’une chimiothérapie néoadjuvante a été démontré récemment par deux essais de phase III. Ces deux études ont évalué des schémas expérimentaux différents mais avaient le même bras contrôle (CRT 50,4 Gy avec capécitabine).
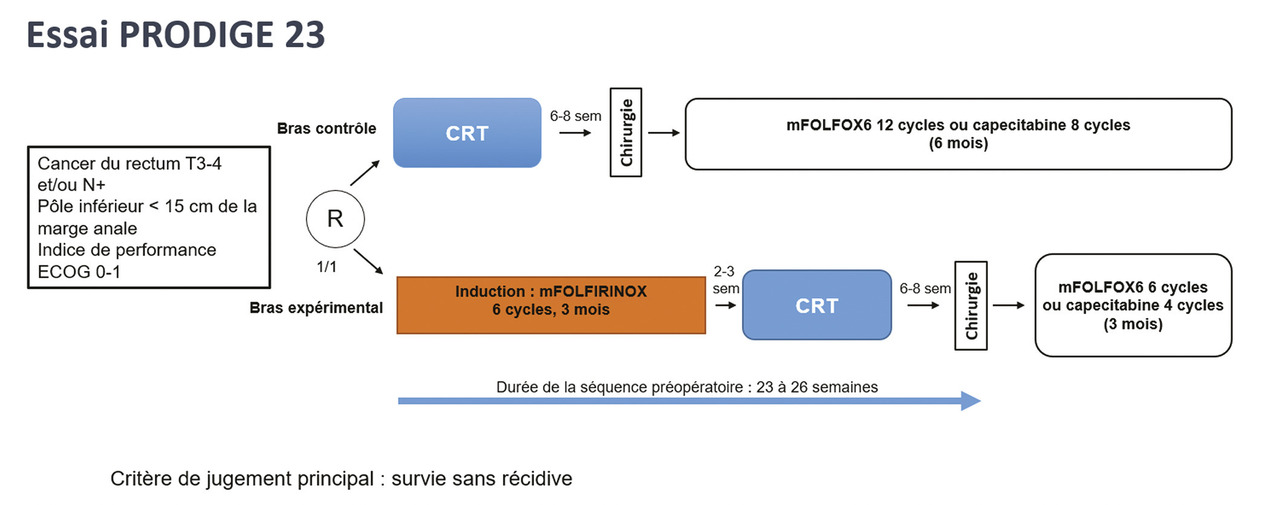
L’essai PRODIGE 23 a évalué une chimiothérapie d’induction par FOLFIRINOX (6 cycles) suivie d’une CRT.13 Une chimiothérapie adjuvante faisait partie du schéma thérapeutique dans les deux bras, de six mois dans le bras contrôle et de trois mois dans le bras expérimental (fig. 1 ).
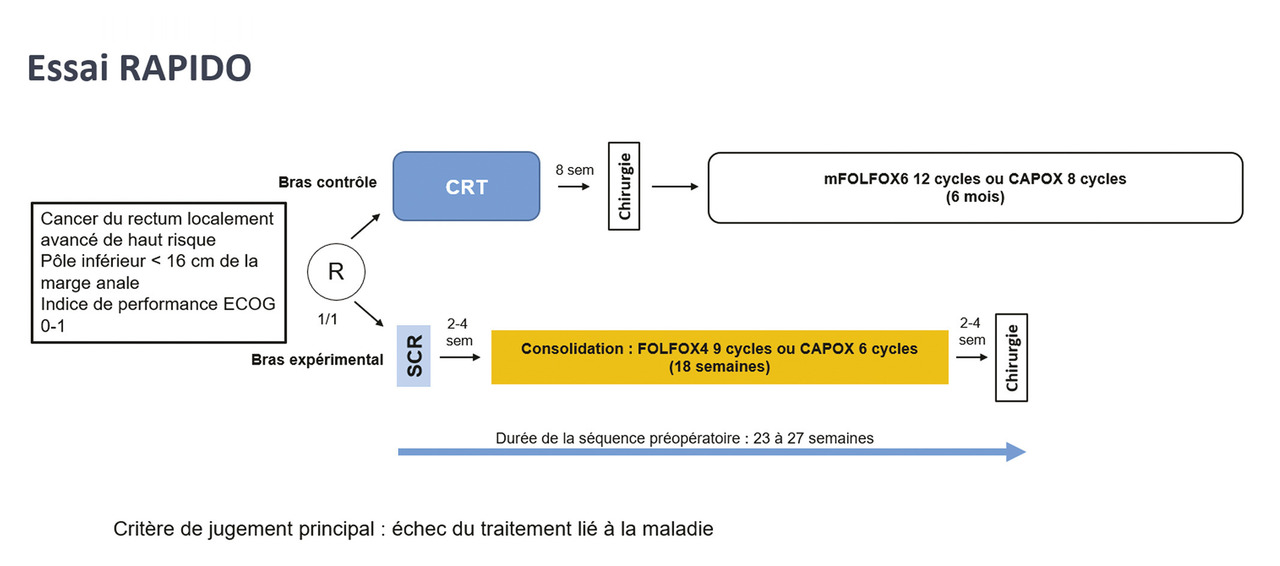
L’essai RAPIDO a évalué une SCR suivie d’une chimiothérapie de consolidation par CAPOX (6 cycles) ou FOLFOX (9 cycles).14 Une chimiothérapie adjuvante pouvait être réalisée, selon le choix du centre, dans le bras contrôle, mais le bras expérimental n’en comportait pas (fig. 2 , tableau 1 ).
L’essai PRODIGE 23 a évalué une chimiothérapie d’induction par FOLFIRINOX (6 cycles) suivie d’une CRT.13 Une chimiothérapie adjuvante faisait partie du schéma thérapeutique dans les deux bras, de six mois dans le bras contrôle et de trois mois dans le bras expérimental (
L’essai RAPIDO a évalué une SCR suivie d’une chimiothérapie de consolidation par CAPOX (6 cycles) ou FOLFOX (9 cycles).14 Une chimiothérapie adjuvante pouvait être réalisée, selon le choix du centre, dans le bras contrôle, mais le bras expérimental n’en comportait pas (
L’essai PRODIGE 23
Les patients inclus dans PRODIGE 23 devaient avoir un cancer du rectum localement avancé (T3-4 et/ou N+). Cette étude a été menée exclusivement en France. Le profil de tolérance de FOLFIRINOX était acceptable, et 90 % des patients ont reçu les six cycles prévus. La dose de radiothérapie n’était pas différente entre les deux bras, mais la CRT était moins bien tolérée après FOLFIRINOX, avec des taux d’arrêt de la capécitabine (8,3 % vs 3,1 % ; p < 0,02) et de neutropénie de grade 3-4 (2,8 % vs 0 % ; p < 0,02) significativement plus élevés. Lors du bilan d’évaluation avant chirurgie, le nombre de patients non opérables à visée curative était significativement plus élevé dans le bras contrôle (8 vs 0 ; p = 0,007). Concernant la chirurgie, la morbidité postopératoire, les taux de réhospitalisation et de réintervention et la mortalité postopératoire n’étaient pas différents entre les deux bras. Seul le taux de mortalité postopératoire dans les soixante jours était significativement plus élevé dans le bras contrôle (2,8 % vs 0 % ; p = 0,03). La tolérance et la dose-intensité de la chimiothérapie adjuvante étaient significativement meilleures dans le bras expérimental que dans le bras contrôle. Il n’existait pas de différence entre les deux bras pour la qualité de vie.
Après une médiane de suivi de 46,5 mois, l’étude PRODIGE 23 est positive pour son critère de jugement principal avec un taux de survie sans maladie à trois ans significativement plus élevé dans le bras FOLFIRINOX en induction (en analyse univariée [HR = 0,69 ; IC 95 % : 0,49-0,97 ; p = 0,034] et en analyse multivariée [HR = 0,68 ; IC 95 % : 0,48-0,97 ; p = 0,03]). Le taux de survie sans métastase à trois ans (HR = 0,64 ; IC 95 % : 0,44-0,93 ; p = 0,017) était significativement plus élevé et le taux de récidive locorégionale moindre (4,8 % vs 7,0 %) dans le bras expérimental (tableau 2 ).13
Après une médiane de suivi de 46,5 mois, l’étude PRODIGE 23 est positive pour son critère de jugement principal avec un taux de survie sans maladie à trois ans significativement plus élevé dans le bras FOLFIRINOX en induction (en analyse univariée [HR = 0,69 ; IC 95 % : 0,49-0,97 ; p = 0,034] et en analyse multivariée [HR = 0,68 ; IC 95 % : 0,48-0,97 ; p = 0,03]). Le taux de survie sans métastase à trois ans (HR = 0,64 ; IC 95 % : 0,44-0,93 ; p = 0,017) était significativement plus élevé et le taux de récidive locorégionale moindre (4,8 % vs 7,0 %) dans le bras expérimental (
L’essai RAPIDO
Les patients inclus dans RAPIDO devaient avoir un cancer du rectum localement avancé défini comme à haut risque (fig. 2 ). La plupart d’entre eux ont été inclus aux Pays-Bas (39 %), en Suède (36 %) et en Espagne (13 %). Le protocole CAPOX a été administré en consolidation à la très grande majorité des patients (99 %). La tolérance était satisfaisante : 85 % des patients ont reçu l’intégralité des cycles prévus, et la dose a été réduite chez 44 % des patients. Le taux d’effets secondaires de grade supérieur ou égal à 3 pendant la séquence néoadjuvante était plus élevé dans le bras expérimental que dans le bras contrôle (48 % vs 25 %). Le nombre de personnes ayant des métastases au moment du bilan d’évaluation avant chirurgie était similaire dans les deux bras (3 vs 2). Il n’existait pas de différence significative entre les deux bras pour le type de chirurgie réalisée ou les complications postopératoires, mais les pertes sanguines peropératoires et la durée d’hospitalisation étaient significativement supérieures dans le bras expérimental et le taux de résection complète du mésorectum significativement inférieur (78 % vs 85 % ; p = 0,032).15 Une chimiothérapie adjuvante a été délivrée à 42 % des patients du bras contrôle.
Après une médiane de suivi de 55,2 mois, l’étude RAPIDO est positive pour son critère de jugement principal, avec un taux de survie sans échec du traitement lié à la maladie à trois ans significativement plus élevé dans le bras SRC + CAPOX (HR = 0,75 ; IC 95 % : 0,60-0,95 ; p = 0,019). Le taux de survie sans métastase à trois ans (HR = 0,69 ; IC 95 % : 0,54-0,90 ; p = 0,0048) était significativement plus élevé et le taux de récidive locorégionale plus élevé dans le bras SRC + CAPOX (8,3 % vs 6,0 %) [tableau 2 ].14
Après une médiane de suivi de 55,2 mois, l’étude RAPIDO est positive pour son critère de jugement principal, avec un taux de survie sans échec du traitement lié à la maladie à trois ans significativement plus élevé dans le bras SRC + CAPOX (HR = 0,75 ; IC 95 % : 0,60-0,95 ; p = 0,019). Le taux de survie sans métastase à trois ans (HR = 0,69 ; IC 95 % : 0,54-0,90 ; p = 0,0048) était significativement plus élevé et le taux de récidive locorégionale plus élevé dans le bras SRC + CAPOX (8,3 % vs 6,0 %) [
L’essai STELLAR apporte de nouvelles données
Malgré des schémas thérapeutiques très différents, les deux essais de phase III PRODIGE 23 et RAPIDO sont positifs pour leur objectif principal, avec une réduction significative du risque de récidive métastatique par l’ajout d’une chimiothérapie néoadjuvante. Les deux séquences thérapeutiques, en induction avant un schéma de chimioradiothérapie longue ou en consolidation après un schéma de radiothérapie courte, sont tolérables, avec des profils de toxicité connus et gérables. La durée de la séquence thérapeutique est globalement identique avec les deux schémas. Bien que les caractéristiques des patients inclus ne soient pas tout à fait comparables, les résultats oncologiques sont très similaires à trois ans.
Dans l’essai RAPIDO, le caractère localement très évolué des tumeurs rectales à l’inclusion et les habitudes chirurgicales des pays participants expliquent le taux d’amputation abdominopérinéale élevé (un tiers ou plus). Les taux de conversion en laparotomie, de pertes sanguines et de plaie du mésorectum significativement plus élevés dans le bras expérimental de RAPIDO suggèrent que la résection chirurgicale pourrait être plus difficile après un délai de dix-huit à vingt semaines.15
Les données de survie globale ne sont pas matures, et un recul plus important est nécessaire pour évaluer le bénéfice de ces schémas sur la survie globale.
Ces deux schémas thérapeutiques n’en constituent pas moins deux nouveaux standards thérapeutiques et sont désormais recommandés en néoadjuvant chez les patients avec un cancer du rectum localement avancé (mrT3-4 ou N+) : recommandation de grade A pour le schéma FOLFIRINOX puis chimioradiothérapie et recommandation de grade B pour le schéma radiothérapie courte, puis CAPOX ou FOLFOX.16 Tous les patients ne sont pas éligibles à FOLFIRINOX, et l’indication de l’un ou l’autre schéma thérapeutique doit être discutée en réunion de concertation pluridisciplinaire selon différentes caractéristiques (âge, comorbidités). En cas de schéma RAPIDO, les résultats de l’essai STELLAR, récemment présentés, suggèrent que le nombre de cycles de chimiothérapie en consolidation doit être respecté pour maintenir le bénéfice thérapeutique.9
Dans l’essai RAPIDO, le caractère localement très évolué des tumeurs rectales à l’inclusion et les habitudes chirurgicales des pays participants expliquent le taux d’amputation abdominopérinéale élevé (un tiers ou plus). Les taux de conversion en laparotomie, de pertes sanguines et de plaie du mésorectum significativement plus élevés dans le bras expérimental de RAPIDO suggèrent que la résection chirurgicale pourrait être plus difficile après un délai de dix-huit à vingt semaines.15
Les données de survie globale ne sont pas matures, et un recul plus important est nécessaire pour évaluer le bénéfice de ces schémas sur la survie globale.
Ces deux schémas thérapeutiques n’en constituent pas moins deux nouveaux standards thérapeutiques et sont désormais recommandés en néoadjuvant chez les patients avec un cancer du rectum localement avancé (mrT3-4 ou N+) : recommandation de grade A pour le schéma FOLFIRINOX puis chimioradiothérapie et recommandation de grade B pour le schéma radiothérapie courte, puis CAPOX ou FOLFOX.16 Tous les patients ne sont pas éligibles à FOLFIRINOX, et l’indication de l’un ou l’autre schéma thérapeutique doit être discutée en réunion de concertation pluridisciplinaire selon différentes caractéristiques (âge, comorbidités). En cas de schéma RAPIDO, les résultats de l’essai STELLAR, récemment présentés, suggèrent que le nombre de cycles de chimiothérapie en consolidation doit être respecté pour maintenir le bénéfice thérapeutique.9
Références
1. Glynne-Jones R, Wyrwicz L, Tiret E, Brown G, Rödel C, Cervantes A, et al. Rectal cancer: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol 2017;28(suppl_4):iv22-iv40.
2. Maas M, Nelemans PJ, Valentini V, Das P, Rödel C, L-J Kuo, et al. Long-term outcome in patients with a pathological complete response after chemoradiation for rectal cancer: a pooled analysis of individual patient data. Lancet Oncol 2010;11:835-44.
3. Bachet JB, Rougier P, de Gramont A, André T. Rectal cancer and adjuvant chemotherapy: which conclusions? Bull Cancer 2010;97:107-22.
4. Bachet JB, Benoist S, Mas L, Huguet F. Neoadjuvant treatment for rectal cancer. Bull Cancer 2021:108:855-67.
5. Hong YS, Nam BH, Kim KP, Kim JE, Park SJ, Park YS, et al. Oxaliplatin, fluorouracil, and leucovorin versus fluorouracil and leucovorin as adjuvant chemotherapy for locally advanced rectal cancer after preoperative chemoradiotherapy (ADORE): an open-label, multicentre, phase 2, randomised controlled trial. Lancet Oncol 2014;15:1245-53.
6. Erlandsson J, Holm T, Pettersson D, Berglund Å, Cedermark B, Radu C, et al. Optimal fractionation of preoperative radiotherapy and timing to surgery for rectal cancer (Stockholm III): a multicentre, randomised, non-blinded, phase 3, non-inferiority trial. Lancet Oncol 2017;18:336-46.
7. Lefèvre JH, Mineur L, Cachanado M, Denost Q, Rouanet P, de Chaisemartin C, et al. Does a longer waiting period after neoadjuvant radio-chemotherapy improve the oncological prognosis of rectal cancer?: Three years’ follow-up results of the Greccar-6 randomized multicenter trial. Ann Surg 2019;270:747-54.
8. Ciseł B, Pietrzak L, Michalski W, Wyrwicz L, Rutkowski A, Kosakowskaet E, al. Long-course preoperative chemoradiation versus 5 x 5 Gy and consolidation chemotherapy for clinical T4 and fixed clinical T3 rectal cancer: long-term results of the randomized Polish II study. Ann Oncol 2019;30:1298-303.
9. Jin J, Tang Y, Hu C, Cai Y, Zhu Y, Cheng G, et al. A multicenter, randomized, phase III trial of short-term radiotherapy plus chemotherapy versus long-term chemoradiotherapy in locally advanced rectal cancer (STELLAR): The final reports. J Clin Oncol 2021;39:3510.
10. Fernandez-Martos C, Garcia-Albeniz X, Pericay C, Maurel J, Aparicio J, Montagut C, et al. Chemoradiation, surgery and adjuvant chemotherapy versus induction chemotherapy followed by chemoradiation and surgery: long-term results of the Spanish GCR-3 phase II randomized trial. Ann Oncol 2015;26:1722-8.
11. Garcia-Aguilar J, Chow OS, Smith DD, Marcet JE, Cataldo PA, Varma MG, et al. Effect of adding mFOLFOX6 after neoadjuvant chemoradiation in locally advanced rectal cancer: a multicentre, phase II trial. Lancet Oncol 2015;16:957-66.
12. Fokas E, Allgäuer M, Polat B, Klautke G, Grabenbauer GG, Fietkau R, et al. Randomized phase II trial of chemoradiotherapy plus induction or consolidation chemotherapy as total neoadjuvant therapy for locally advanced rectal cancer: CAO/ARO/AIO-12. J Clin Oncol 2019;37:3212-22.
13. Conroy T, Bosset JF, Etienne PL, Rio E, François E, Mesgouez-Nebout N, et al. Neoadjuvant chemotherapy with FOLFIRINOX and preoperative chemoradiotherapy for patients with locally advanced rectal cancer (UNICANCER-PRODIGE 23): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol 2021;22:702-15.
14. Bahadoer RR, Dijkstra EA, van Etten B, Marijnen CAM, Putter H, Meershoek-Klein Kranenbarg E, et al. Short-course radiotherapy followed by chemotherapy before total mesorectal excision (TME) versus preoperative chemoradiotherapy, TME, and optional adjuvant chemotherapy in locally advanced rectal cancer (RAPIDO): a randomised, open-label, phase 3 trial. Lancet Oncol 2021;22:29-42.
15. van der Valk MJM, Marijnen CAM, van Etten B, Dijkstra EA, Hilling DE, Kranenbarg EM, et al. Compliance and tolerability of short-course radiotherapy followed by preoperative chemotherapy and surgery for high-risk rectal cancer - Results of the international randomized RAPIDO-trial. Radiother Oncol 2020;147:75-83.
16. Société nationale française de gastro-entérologie (SNFGE), Société savante des maladies et cancers de l’appareil digestif. Cancer du rectum [en ligne]. 2021. Disponible sur : https://www.snfge.org/content/5-cancer-du-rectum#ancre3248
2. Maas M, Nelemans PJ, Valentini V, Das P, Rödel C, L-J Kuo, et al. Long-term outcome in patients with a pathological complete response after chemoradiation for rectal cancer: a pooled analysis of individual patient data. Lancet Oncol 2010;11:835-44.
3. Bachet JB, Rougier P, de Gramont A, André T. Rectal cancer and adjuvant chemotherapy: which conclusions? Bull Cancer 2010;97:107-22.
4. Bachet JB, Benoist S, Mas L, Huguet F. Neoadjuvant treatment for rectal cancer. Bull Cancer 2021:108:855-67.
5. Hong YS, Nam BH, Kim KP, Kim JE, Park SJ, Park YS, et al. Oxaliplatin, fluorouracil, and leucovorin versus fluorouracil and leucovorin as adjuvant chemotherapy for locally advanced rectal cancer after preoperative chemoradiotherapy (ADORE): an open-label, multicentre, phase 2, randomised controlled trial. Lancet Oncol 2014;15:1245-53.
6. Erlandsson J, Holm T, Pettersson D, Berglund Å, Cedermark B, Radu C, et al. Optimal fractionation of preoperative radiotherapy and timing to surgery for rectal cancer (Stockholm III): a multicentre, randomised, non-blinded, phase 3, non-inferiority trial. Lancet Oncol 2017;18:336-46.
7. Lefèvre JH, Mineur L, Cachanado M, Denost Q, Rouanet P, de Chaisemartin C, et al. Does a longer waiting period after neoadjuvant radio-chemotherapy improve the oncological prognosis of rectal cancer?: Three years’ follow-up results of the Greccar-6 randomized multicenter trial. Ann Surg 2019;270:747-54.
8. Ciseł B, Pietrzak L, Michalski W, Wyrwicz L, Rutkowski A, Kosakowskaet E, al. Long-course preoperative chemoradiation versus 5 x 5 Gy and consolidation chemotherapy for clinical T4 and fixed clinical T3 rectal cancer: long-term results of the randomized Polish II study. Ann Oncol 2019;30:1298-303.
9. Jin J, Tang Y, Hu C, Cai Y, Zhu Y, Cheng G, et al. A multicenter, randomized, phase III trial of short-term radiotherapy plus chemotherapy versus long-term chemoradiotherapy in locally advanced rectal cancer (STELLAR): The final reports. J Clin Oncol 2021;39:3510.
10. Fernandez-Martos C, Garcia-Albeniz X, Pericay C, Maurel J, Aparicio J, Montagut C, et al. Chemoradiation, surgery and adjuvant chemotherapy versus induction chemotherapy followed by chemoradiation and surgery: long-term results of the Spanish GCR-3 phase II randomized trial. Ann Oncol 2015;26:1722-8.
11. Garcia-Aguilar J, Chow OS, Smith DD, Marcet JE, Cataldo PA, Varma MG, et al. Effect of adding mFOLFOX6 after neoadjuvant chemoradiation in locally advanced rectal cancer: a multicentre, phase II trial. Lancet Oncol 2015;16:957-66.
12. Fokas E, Allgäuer M, Polat B, Klautke G, Grabenbauer GG, Fietkau R, et al. Randomized phase II trial of chemoradiotherapy plus induction or consolidation chemotherapy as total neoadjuvant therapy for locally advanced rectal cancer: CAO/ARO/AIO-12. J Clin Oncol 2019;37:3212-22.
13. Conroy T, Bosset JF, Etienne PL, Rio E, François E, Mesgouez-Nebout N, et al. Neoadjuvant chemotherapy with FOLFIRINOX and preoperative chemoradiotherapy for patients with locally advanced rectal cancer (UNICANCER-PRODIGE 23): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol 2021;22:702-15.
14. Bahadoer RR, Dijkstra EA, van Etten B, Marijnen CAM, Putter H, Meershoek-Klein Kranenbarg E, et al. Short-course radiotherapy followed by chemotherapy before total mesorectal excision (TME) versus preoperative chemoradiotherapy, TME, and optional adjuvant chemotherapy in locally advanced rectal cancer (RAPIDO): a randomised, open-label, phase 3 trial. Lancet Oncol 2021;22:29-42.
15. van der Valk MJM, Marijnen CAM, van Etten B, Dijkstra EA, Hilling DE, Kranenbarg EM, et al. Compliance and tolerability of short-course radiotherapy followed by preoperative chemotherapy and surgery for high-risk rectal cancer - Results of the international randomized RAPIDO-trial. Radiother Oncol 2020;147:75-83.
16. Société nationale française de gastro-entérologie (SNFGE), Société savante des maladies et cancers de l’appareil digestif. Cancer du rectum [en ligne]. 2021. Disponible sur : https://www.snfge.org/content/5-cancer-du-rectum#ancre3248
Dans cet article
- Impact de l’allongement du délai entre radiothérapie et chirurgie
- Effet de la chimiothérapie sur la tumeur rectale
- Schéma de radiothérapie courte et chimiothérapie de consolidation
- Chimioradiothérapie et chimiothérapie d’induction ou de consolidation
- Réduction du risque de récidive métastatique dans deux études de phase III récentes
- L’essai STELLAR apporte de nouvelles données