L’artérite de Takayasu est une panartérite inflammatoire des gros vaisseaux, de cause inconnue, touchant préférentiellement l’aorte et ses branches principales, ainsi que les artères pulmonaires.1 Elle fait partie des dix vascularites primitives classées par la Conférence internationale de consensus de Chapel Hill (CHCC) de 1994, mise à jour en 2012. Son incidence est difficile à estimer en raison de sa rareté. Il n’existe pas de données récentes françaises permettant d’apprécier son incidence annuelle mais, en Europe, elle est estimée à 0,5 cas par million d’habitants en Italie du Nord (intervalle de confiance à 95 % [IC à 95 %] : 0,1-1,2)2 et à 1,5 (IC à 95 % : 1,2-2) par million d’habitants en Norvège.3 Sa prévalence peut varier selon les continents : de 4,7 par million d’habitants au Royaume-Uni4 jusqu’à 40 cas par million d’habitants au Japon.5 Il s’agit d’une maladie à prédominance féminine, avec un sex-ratio (SR) estimé à 5/1 en France.6 Les premières manifestations de la maladie surviennent généralement entre l’âge de 20 et de 35 ans,7 même s’il existe un certain nombre de patients dont les symptomes ne débutent que tardivement, comme le démontrent de récentes cohortes italiennes et françaises, qui retrouvaient respectivement 17,5 % et 31,7 % de patients pour qui les premiers symptômes se sont manifestés après l’âge de 40 ans.6,8
Deux phases possiblement intriquées
Deux phases sont classiquement décrites dans l’histoire de la maladie de Takayasu, celles-ci pouvant s’intriquer dans le temps :
– la première phase, dite préocclusive, est inflammatoire et se manifeste par des signes généraux peu spécifiques pouvant fréquemment passer inaperçus (altération de l’état général avec asthénie, amaigrissement, arthromyalgies, fièvre, céphalées ou parfois douleur sur les trajets artériels comme une carotidodynie). Sur le plan biologique, la présence d’un syndrome inflammatoire est possible ;
– la seconde phase, dite phase occlusive, est la conséquence de la première phase inflammatoire qui entraîne des lésions à type de sténose, occlusion, anévrisme des axes artériels avec un retentissement ischémique dans les territoires perfusés en aval de ces axes (claudication de membre, abolition d’un pouls, anisotension, hypertension artérielle [HTA] résistante secondaire à la sténose d’une ou des deux artères rénales, syndrome de Raynaud, etc.). Le délai médian entre le début des premiers symptômes et le diagnostic est d’environ quinze mois.8
Cliniquement, la diversité des manifestations s’explique par la topographie des territoires vascularisés par les artères atteintes. En cas d’atteinte des troncs supra-aortiques, outre la carotydonie, il peut être observé des céphalées, parfois de véritables malaises témoins d’une insuffisance vertébro-basilaire sur un vol vertébro-sous-clavier en cas de sténose sous-clavière prévertébrale. Rarement, l’artérite de Takayasu peut se compliquer d’un accident ischémique transitoire, voire d’un accident vasculaire cérébral ischémique.
L’atteinte ophtalmique comprend les manifestations propres à la rétinopathie hypertensive, le plus souvent en cas d’HTA mal contrôlée ou de découverte tardive, mais aussi de signes de rétinopathie ischémique secondaire à l’hypoperfusion rétinienne due à l’atteinte de l’artère carotide interne (développement de micro–anévrismes, d’une néovascularisation, voire de communications artérioveineuses).9
On observe des manifestations cardiaques chez environ 20 % des patients, à type de valvulopathies (12 %), notamment d’insuffisance aortique.6 L’atteinte myocardique est rare mais probablement sous-diagnostiquée.10
Certains patients développent également une atteinte pulmonaire avec des sténoses ou des anévrismes des artères pulmonaires se manifestant par des hémoptysies, une dyspnée ou une toux, et dont une complication peut être le développement d’une hypertension artérielle pulmonaire précapillaire.
Par ailleurs, l’hypertension artérielle est très fréquente chez ces patients et doit faire l’objet d’un dépistage et d’un contrôle régulier et systématique en consultation. La pression artérielle doit absolument être prise aux quatre membres afin de ne pas méconnaître une sténose artérielle de l’artère d’un membre qui donnerait une mesure de pression inférieure à sa valeur réelle. La présence d’une hypertension artérielle doit également faire rechercher une sténose bilatérale des artères rénales. La créatininémie est le plus souvent normale, parfois associée à une protéinurie.
Enfin, rarement, des lésions cutanées existent, notamment à type de pyoderma gangrenosum ou d’érythème noueux. Les lésions sont parfois présentes avant que le diagnostic d’artérite de Takayasu ne soit posé ; elles sont donc à rechercher dans les antécédents du patient.
– la première phase, dite préocclusive, est inflammatoire et se manifeste par des signes généraux peu spécifiques pouvant fréquemment passer inaperçus (altération de l’état général avec asthénie, amaigrissement, arthromyalgies, fièvre, céphalées ou parfois douleur sur les trajets artériels comme une carotidodynie). Sur le plan biologique, la présence d’un syndrome inflammatoire est possible ;
– la seconde phase, dite phase occlusive, est la conséquence de la première phase inflammatoire qui entraîne des lésions à type de sténose, occlusion, anévrisme des axes artériels avec un retentissement ischémique dans les territoires perfusés en aval de ces axes (claudication de membre, abolition d’un pouls, anisotension, hypertension artérielle [HTA] résistante secondaire à la sténose d’une ou des deux artères rénales, syndrome de Raynaud, etc.). Le délai médian entre le début des premiers symptômes et le diagnostic est d’environ quinze mois.8
Cliniquement, la diversité des manifestations s’explique par la topographie des territoires vascularisés par les artères atteintes. En cas d’atteinte des troncs supra-aortiques, outre la carotydonie, il peut être observé des céphalées, parfois de véritables malaises témoins d’une insuffisance vertébro-basilaire sur un vol vertébro-sous-clavier en cas de sténose sous-clavière prévertébrale. Rarement, l’artérite de Takayasu peut se compliquer d’un accident ischémique transitoire, voire d’un accident vasculaire cérébral ischémique.
L’atteinte ophtalmique comprend les manifestations propres à la rétinopathie hypertensive, le plus souvent en cas d’HTA mal contrôlée ou de découverte tardive, mais aussi de signes de rétinopathie ischémique secondaire à l’hypoperfusion rétinienne due à l’atteinte de l’artère carotide interne (développement de micro–anévrismes, d’une néovascularisation, voire de communications artérioveineuses).9
On observe des manifestations cardiaques chez environ 20 % des patients, à type de valvulopathies (12 %), notamment d’insuffisance aortique.6 L’atteinte myocardique est rare mais probablement sous-diagnostiquée.10
Certains patients développent également une atteinte pulmonaire avec des sténoses ou des anévrismes des artères pulmonaires se manifestant par des hémoptysies, une dyspnée ou une toux, et dont une complication peut être le développement d’une hypertension artérielle pulmonaire précapillaire.
Par ailleurs, l’hypertension artérielle est très fréquente chez ces patients et doit faire l’objet d’un dépistage et d’un contrôle régulier et systématique en consultation. La pression artérielle doit absolument être prise aux quatre membres afin de ne pas méconnaître une sténose artérielle de l’artère d’un membre qui donnerait une mesure de pression inférieure à sa valeur réelle. La présence d’une hypertension artérielle doit également faire rechercher une sténose bilatérale des artères rénales. La créatininémie est le plus souvent normale, parfois associée à une protéinurie.
Enfin, rarement, des lésions cutanées existent, notamment à type de pyoderma gangrenosum ou d’érythème noueux. Les lésions sont parfois présentes avant que le diagnostic d’artérite de Takayasu ne soit posé ; elles sont donc à rechercher dans les antécédents du patient.
Diagnostic posé sur un faisceau d’arguments
Le diagnostic d’artérite de Takayasu se pose sur la base d’un faisceau d’arguments cliniques, biologiques et morphologiques par un spécialiste formé à la maladie.
Il existe de nombreuses classifications de l’artérite de Takayasu qui peuvent aider à poser le diagnostic même s’il s’agit de critères conçus avant tout pour homogénéiser les patients inclus dans les différents essais cliniques ou études épidémiologiques. La classification développée par l’American College of Rheumatology (ACR) en 19907 (encadré ) permet de classer un patient comme atteint d’artérite de Takayasu à condition de présenter au moins trois des six critères indiqués avec une sensibilité de 90,5 % et une spécificité de 97,8 %, sur une population américaine, canadienne et mexicaine. Même s’il reste présent, le critère de l’âge n’a pas de caractère obligatoire dans cette classification, et il est important de noter que les contrôles utilisés dans l’étude étaient exclusivement composés de patients atteints d’une vascularite.
Devant la découverte d’une artérite de Takayasu, il est important d’éliminer de principe les différentes causes d’aortite, notamment au cours de la phase inflammatoire de la maladie : infections (syphilis, tuberculose, salmonelles, staphylocoques, brucellose, etc.), vascularites ou maladies auto-immunes (artérite à cellules géantes, maladie de Behçet, polychondrite, syndrome auto-inflammatoire comme le VEXAS [vacuoles, E1 enzyme, X-linked, autoinflammatory, somatic syndrome]...). Il faut également évoquer la possibilité d’une périaortite (maladie associée aux IgG4, fibrose rétropéritonéale). Si le diagnostic est le plus souvent aisé chez la femme jeune présentant un tableau typique, il peut être difficile en cas de lésions des artères rénales isolées, car la dysplasie fibromusculaire peut donner des atteintes focales difficiles à différencier d’une vascularite. De plus, lorsque, rarement, les symptômes débutent après 50 ans, il est important d’évoquer l’artérite à cellules géantes (tableau ). Par ailleurs, différencier des lésions d’athérosclérose peut également s’avérer complexe à la phase occlusive en fonction de l’anatomie des atteintes.
Il existe de nombreuses classifications de l’artérite de Takayasu qui peuvent aider à poser le diagnostic même s’il s’agit de critères conçus avant tout pour homogénéiser les patients inclus dans les différents essais cliniques ou études épidémiologiques. La classification développée par l’American College of Rheumatology (ACR) en 19907 (
Devant la découverte d’une artérite de Takayasu, il est important d’éliminer de principe les différentes causes d’aortite, notamment au cours de la phase inflammatoire de la maladie : infections (syphilis, tuberculose, salmonelles, staphylocoques, brucellose, etc.), vascularites ou maladies auto-immunes (artérite à cellules géantes, maladie de Behçet, polychondrite, syndrome auto-inflammatoire comme le VEXAS [vacuoles, E1 enzyme, X-linked, autoinflammatory, somatic syndrome]...). Il faut également évoquer la possibilité d’une périaortite (maladie associée aux IgG4, fibrose rétropéritonéale). Si le diagnostic est le plus souvent aisé chez la femme jeune présentant un tableau typique, il peut être difficile en cas de lésions des artères rénales isolées, car la dysplasie fibromusculaire peut donner des atteintes focales difficiles à différencier d’une vascularite. De plus, lorsque, rarement, les symptômes débutent après 50 ans, il est important d’évoquer l’artérite à cellules géantes (
Physiopathologie multifactorielle
La physiopathologie exacte de l’artérite de Takayasu est encore mal comprise, même si de nombreux travaux semblent s’accorder sur le caractère multifactoriel des mécanismes mêlant auto-immunité, susceptibilité génétique et facteurs environnementaux d’origine infectieuse. L’inflammation retrouvée dans les lésions d’artérite de Takayasu met en jeu des mécanismes d’auto-immunité cellulaire, notamment une réponse lymphocytaire Th17 médiée par l’interleukine 6 (IL-6).11 De nombreuses études génétiques ont mis en évidence des loci de susceptibilité dans des régions HLA pouvant également favoriser la survenue d’une artérite de Takaysu, notamment dans l’allèle HLA-B*52.12 Enfin, plusieurs travaux suggèrent que certains agents infectieux (mycobactéries notamment) ont un rôle déclencheur de l’auto-immunité observée dans l’artérite de Takayasu,13 via des mécanismes de mimétisme moléculaire.
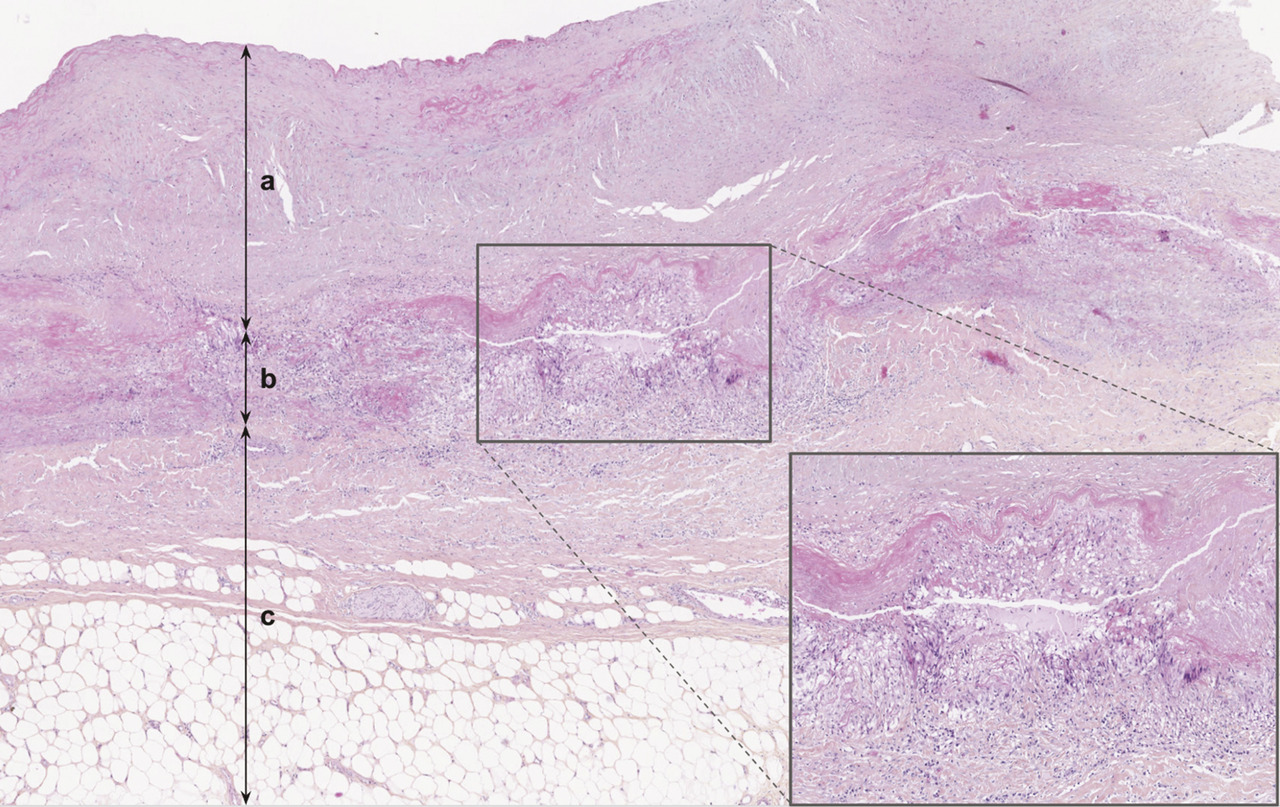
L’anatomopathologie retrouve un infiltrat inflammatoire granulomateux
Sur le plan anatomopathologique, lorsqu’une pièce opératoire est disponible, on observe, dans la forme active, une panartérite des artères de gros calibre, segmentaire et focale, caractérisée par un infiltrat inflammatoire granulomateux (ou gigantocellulaire) qui dissocie la paroi vasculaire (fig. 1 ). Cet infiltrat granulomateux est constitué par des macrophages, des cellules épithélioïdes et des cellules géantes. Des granulomes compacts peuvent être observés. S’y associe une composante lymphocytaire ou lymphoplasmocytaire. À l’inverse de l’artérite à cellules géantes (ou maladie de Horton), l’artérite de Takayasu est souvent à prédominance médio-adventicielle (avec atteinte de la partie externe de la média et de l’adventice). La limitante élastique interne est le plus souvent préservée tandis que la limitante élastique externe peut disparaître, avec fréquemment des lésions d’élastophagie et/ou d’élastolyse. L’intima est le siège d’une hyperplasie secondaire à la prolifération de myofibroblastes, pouvant réduire le calibre de la lumière artérielle. Les thromboses sont exceptionnelles.
À terme, ces lésions inflammatoires peuvent laisser place à une fibrose cicatricielle diffuse pure, caractérisée par un anneau fibreux médio-adventiciel, qui peut aider au diagnostic.14
À terme, ces lésions inflammatoires peuvent laisser place à une fibrose cicatricielle diffuse pure, caractérisée par un anneau fibreux médio-adventiciel, qui peut aider au diagnostic.14
Le rôle clé de l’imagerie dans le bilan des lésions artérielles
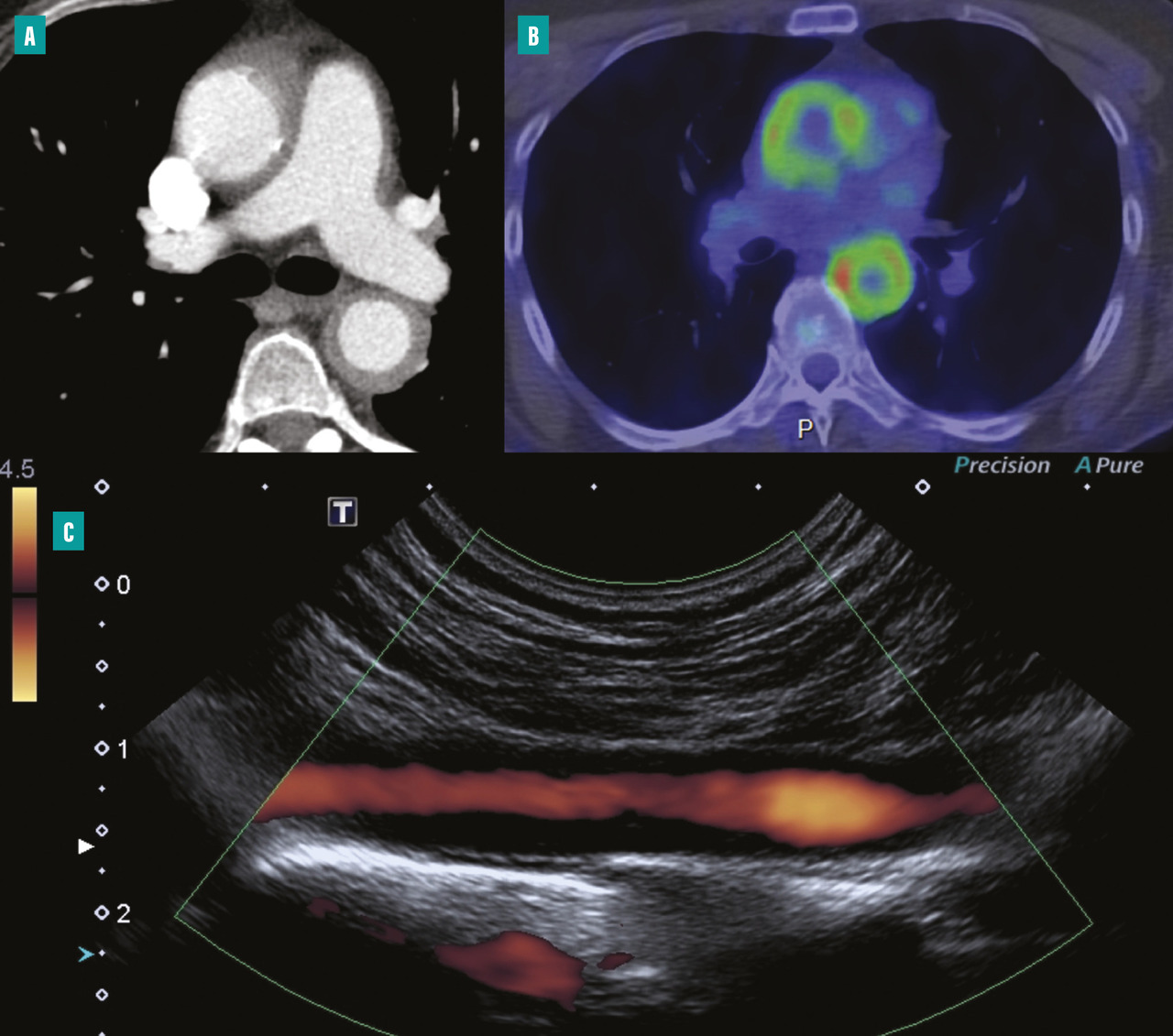
L’imagerie a un rôle majeur dans la prise en charge de l’artérite de Takayasu, que ce soit pour le diagnostic ou le suivi, puisqu’elle permet non seulement de cartographier les lésions artérielles dans le cadre du bilan d’extension mais aussi d’aider à différencier la nature inflammatoire ou fibreuse des lésions.
Échographie Doppler pour les artères des membres et les troncs supra-aortiques
L’échographie-Doppler artérielle est un examen non invasif de première intention permettant d’explorer les artères des membres et les troncs supra-aortiques.15 Elle peut mettre en évidence un épaississement circonférentiel et homogène de la paroi artérielle, une sténose artérielle et son éventuel retentissement hémodynamique d’aval, une occlusion artérielle ou un anévrisme (fig. 2 ).
Angioscanner pour l’aorte et ses branches
Par rapport à l’échographie-Doppler artérielle, l’angioscanner artériel a l’avantage de pouvoir explorer la portion thoracique de l’aorte. À la phase aiguë inflammatoire, on peut observer un épaississement pariétal supérieur à 3 mm, parfois une prise de contraste pariétale qui correspond à un rehaussement homogène au temps tardif de l’injection.16
Angiographie par résonance magnétique moins précise
L’angiographie par résonance magnétique (ARM) a l’avantage de ne pas être irradiante, mais reste moins précise que l’angioscanner dans la quantification du degré de sténose, et la présence de stent empêche l’acquisition du signal.
Tomographie par émission de positons au 18F-FDG
La tomographie par émission de positons au 18-flurodésoxyglucose (TEP 18F-FDG) a un intérêt dans le diagnostic de la maladie, notamment dans la phase active, afin d’affirmer le caractère inflammatoire d’une aortite et la localisation précise des segments atteints, notamment chez des patients porteurs d’une forme clinique fruste. La fréquence de l’atteinte artérielle en TEP oscille entre 35 et 60 % des patients selon les études.16
Dans le suivi, elle constitue également un argument supplémentaire à l’évaluation de l’activité de la maladie en cas de positivité, toujours à confronter à l’évaluation clinique et biologique du patient.
Dans le suivi, elle constitue également un argument supplémentaire à l’évaluation de l’activité de la maladie en cas de positivité, toujours à confronter à l’évaluation clinique et biologique du patient.
Difficile évaluation de l’activité de la maladie
L’une des principales difficultés dans l’artérite de Takayasu est l’évaluation de l’activité de la maladie, que ce soit au diagnostic ou au cours du suivi. La persistance du caractère inflammatoire des lésions artérielles est l’un des principaux facteurs prédictifs de rechute ou de rethrombose en cas de gestes de revascularisation.17 Les signes généraux observés à la phase inflammatoire de la maladie restent peu spécifiques, et les signes d’ischémie artérielle (claudication de membre) ne signent pas forcément une progression de la maladie mais peuvent être secondaires à des lésions fibrosantes quiescentes. Les marqueurs biologiques de l’inflammation (protéine C-réactive [C-reactiv protein [CRP], orosomucoïde, haptoglobine, fibrinogène) ne permettent pas toujours de classer de façon optimale les patients. En ce qui concerne l’évaluation inflammatoire morphologique, notamment par TEP-TDM (tomodensitométrie ou scanner), des seuils de positivité restent à évaluer pour mieux caractériser la nature inflammatoire des lésions, mais cela apporte une aide précieuse dans l’évaluation multimodale de l’activité inflammatoire de la maladie.
Plusieurs scores d’évaluation de l’activité de la maladie existent, notamment celui développé par le National Institute of Health (NIH) américain, qui reste le plus fréquemment utilisé18 et qui définit une maladie active comme ayant deux ou plus des critères suivants :19
– présence de signes ou de symptômes d’ischémie vasculaire ou d’inflammation ;
– augmentation des marqueurs de l’inflammation (vitesse de sédimentation [VS], CRP, fibrinogène, orosomucoïde, haptoglobine) ;
– présence d’anomalies angiographiques ;
– symptômes systémiques non attribuables à une autre maladie.
Plusieurs scores d’évaluation de l’activité de la maladie existent, notamment celui développé par le National Institute of Health (NIH) américain, qui reste le plus fréquemment utilisé18 et qui définit une maladie active comme ayant deux ou plus des critères suivants :19
– présence de signes ou de symptômes d’ischémie vasculaire ou d’inflammation ;
– augmentation des marqueurs de l’inflammation (vitesse de sédimentation [VS], CRP, fibrinogène, orosomucoïde, haptoglobine) ;
– présence d’anomalies angiographiques ;
– symptômes systémiques non attribuables à une autre maladie.
Une prise en charge multidisciplinaire
En l’absence de données probantes de la littérature du fait de la rareté de la maladie, le protocole national de diagnostic et de soins (PNDS) artérite de Takayasu (octobre 2019)19 propose, en première intention, dans les formes actives, un traitement par prednisone avec une dose en phase d’attaque entre 0,5 mg/kg/j pour les formes peu sévères et 0,7-1 mg/kg/j pour les formes plus sévères, pendant une durée d’au moins deux à quatre semaines, jusqu’à amélioration des symptômes et du syndrome inflammatoire biologique, puis initiation d’une décroissance lente, avec pour objectif d’atteindre une dose inférieure à 0,1 mg/kg/j au sixième mois.20 En cas de corticorésistance ou de corticodépendance, peut être associé à la corticothérapie un certain nombre d’immunosuppresseurs (méthotrexate, azathioprine, mycophénolate mofétil) ou des biothérapies ciblées (anti-TNF-α, anti-IL6R), même si ces recommandations s’appuient sur des essais prospectifs en ouvert ou des données rétrospectives.21-26
Le recours à ce type de traitement est plus fréquent que dans l’artérite à cellules géantes du fait du jeune âge des patients et du risque de complications cardiovasculaires, dont la fréquence peut être accrue par la corticothérapie prolongée.
En troisième ligne, un traitement par anti-TNF α (infliximab notamment) ou par tocilizumab, un anticorps monoclonal anti-IL-6R, peut être proposé aux patients.27
Une analyse rétrospective européenne a corroboré les résultats préliminaires français montrant l’absence de différences significatives en matière de réponse thérapeutique et de rechutes entre les patients atteints de Takayasu réfractaire traités par antagonistes du facteur de nécrose tumorale (anti-TNF) et ceux traités par tocilizumab.28,29 Un seul essai randomisé a évalué l’efficacité du tocilizumab associé à une corticothérapie par rapport à un placebo et n’a pas trouvé de différence significative, mais seuls 18 patients étaient inclus dans chaque bras.27 La première étude clinique prospective française évaluant le tocilizumab en première intention sur 13 patients naïfs de traitement en ouvert monobras montre un taux de rémission de 85 % à six mois, avec 54 % des patients ayant pu être sevrés de la corticothérapie.30 Néanmoins, le suivi dans les douze mois suivant l’arrêt du tocilizumab met en évidence un taux de rechute de 45 %.
Toutes les décisions thérapeutiques doivent se prendre après réunion de concertation pluridisciplinaire (RCP) dans un centre expert de la maladie.
De plus, la prise en charge des facteurs de risque cardiovasculaire revêt une importance majeure. En premier lieu, l’hypertension artérielle doit être régulièrement dépistée, sur un membre indemne de lésion artérielle pour ne pas fausser les mesures, et traitée dès que possible, sans jamais négliger la possibilité d’une HTA rénovasculaire.
Le tabagisme doit être proscrit et une consultation tabacologique doit être systématiquement proposée si nécessaire.
Dyslipidémie et diabète sont à dépister et à traiter selon les recommandations de la population générale afin de prévenir l’athérosclérose accélérée.
Le PNDS19 préconise de réserver la prescription d’aspirine à dose antiagrégante aux patients présentant une sténose artérielle serrée.
Le recours à ce type de traitement est plus fréquent que dans l’artérite à cellules géantes du fait du jeune âge des patients et du risque de complications cardiovasculaires, dont la fréquence peut être accrue par la corticothérapie prolongée.
En troisième ligne, un traitement par anti-TNF α (infliximab notamment) ou par tocilizumab, un anticorps monoclonal anti-IL-6R, peut être proposé aux patients.27
Une analyse rétrospective européenne a corroboré les résultats préliminaires français montrant l’absence de différences significatives en matière de réponse thérapeutique et de rechutes entre les patients atteints de Takayasu réfractaire traités par antagonistes du facteur de nécrose tumorale (anti-TNF) et ceux traités par tocilizumab.28,29 Un seul essai randomisé a évalué l’efficacité du tocilizumab associé à une corticothérapie par rapport à un placebo et n’a pas trouvé de différence significative, mais seuls 18 patients étaient inclus dans chaque bras.27 La première étude clinique prospective française évaluant le tocilizumab en première intention sur 13 patients naïfs de traitement en ouvert monobras montre un taux de rémission de 85 % à six mois, avec 54 % des patients ayant pu être sevrés de la corticothérapie.30 Néanmoins, le suivi dans les douze mois suivant l’arrêt du tocilizumab met en évidence un taux de rechute de 45 %.
Toutes les décisions thérapeutiques doivent se prendre après réunion de concertation pluridisciplinaire (RCP) dans un centre expert de la maladie.
De plus, la prise en charge des facteurs de risque cardiovasculaire revêt une importance majeure. En premier lieu, l’hypertension artérielle doit être régulièrement dépistée, sur un membre indemne de lésion artérielle pour ne pas fausser les mesures, et traitée dès que possible, sans jamais négliger la possibilité d’une HTA rénovasculaire.
Le tabagisme doit être proscrit et une consultation tabacologique doit être systématiquement proposée si nécessaire.
Dyslipidémie et diabète sont à dépister et à traiter selon les recommandations de la population générale afin de prévenir l’athérosclérose accélérée.
Le PNDS19 préconise de réserver la prescription d’aspirine à dose antiagrégante aux patients présentant une sténose artérielle serrée.
Prévenir les complications vasculaires
À plus long terme, la principale source de morbi-mortalité de l’artérite de Takayasu est le fait des complications vasculaires (sténoses et occlusions artérielles). Toute indication de revascularisation doit se discuter au cas par cas en RCP avec des chirurgiens et radiologues interventionnels experts, tout en évitant le plus possible une intervention en phase inflammatoire, le risque de resténose ou de thrombose de stent postopératoire étant multiplié par 7 dans ces conditions.17 Une surveillance rapprochée dont les modalités restent à la discrétion du clinicien est nécessaire pour dépister l’apparition de complications vasculaires.
Encadre
Critères de classification ACR (1990)
Âge au début de la maladie ≤ 40 ans
Claudication d’au moins un membre
Diminution d’au moins un pouls brachial
Asymétrie de pression artérielle > 10 mmHg
Présence d’un souffle sur une artère sous-clavière ou sur l’aorte abdominale
Anomalie artériographique : sténose ou occlusion d’une portion de l’aorte, d’une de ses branches principales ou d’une artère de gros calibre de la portion proximale d’un membre supérieur ou inférieur qui n’est pas due à de l’athérosclérose, ou dysplasie fibromusculaire
La présence d’au moins trois de ces critères permet de classer un patient comme atteint de la maladie de Takayasu avec une forte probabilité. D’après la réf. 7.
Références
1. Jennette JC, Falk RJ, Bacon PA, Basu N, Cid MC, Ferrario F, et al. 2012 revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. Arthritis Rheum 2013;65(1):1-11.
2. Muratore F, Boiardi L, Mancuso P, Restuccia G, Galli E, Marvisi C, et al. Incidence and prevalence of large vessel vasculitis in northern Italy: A population-based study. Semin Arthritis Rheum 2021;51(4):786-92.
3. Gudbrandsson B, Molberg Ø, Garen T, Palm Ø. Prevalence, incidence, and disease characteristics of Takayasu arteritis by ethnic background: Data from a large, population-based cohort resident in southern Norway. Arthritis Care & Research 2017;69(2):278-85.
4. Watts R, Al-Taiar A, Mooney J, Scott D, MacGregor A. The epidemiology of Takayasu arteritis in the UK. Rheumatology 2009;48(8):1008-11.
5. Onen F, Akkoc N. Epidemiology of Takayasu arteritis. Presse Med 2017;46(7-8 Pt 2):e197-e203.
6. Arnaud L, Haroche J, Limal N, Toledano D, Gambotti L, Costedoat Chalumeau N, et al. Takayasu arteritis in France: A single-center retrospective study of 82 cases comparing white, North African, and black patients. Medicine (Baltimore) 2010;89(1):1-17.
7. Arend WP, Michel BA, Bloch DA, Hunder GG, Calabrese LH, Edworthy SM, et al. The American College of Rheumatology 1990 criteria for the classification of takayasu arteritis. Arthritis & Rheumatism 990;33(8):1129-34.
8. Vanoli M, Daina E, Salvarani C, Sabbadini MG, Rossi C, Bacchiani G, et al. Takayasu’s arteritis: A study of 104 Italian patients. Arthritis Rheum 2005;53(1):100-7.
9. Esen F, Ergelen R, Alibaz-Öner F, Çelik G, Direskeneli H, Kazokoğlu H. Ocular findings and blood flow in patients with Takayasu arteritis: A cross-sectional study. British Journal of Ophthalmology 2019;103(7):928-32.
10. Comarmond C, Dessault O, Devaux JY, Costedoat Chalumeau N, Resche-Rigon M, Isnard R, et al. Myocardial perfusion imaging in Takayasu arteritis. J Rheumatol 2013;40(12):2052-60.
11. Saadoun D, Garrido M, Comarmond C, Desbois AC, Domont F, Savey L, et al. Th1 and Th17 cytokines drive inflammation in Takayasu arteritis. Arthritis Rheumatol 2015;67(5):1353-60.
12. Renauer P, Sawalha AH. The genetics of Takayasu arteritis. Presse Med 2017;46(7-8 Pt 2):e179-e187.
13. Espinoza JL, Ai S, Matsumura I. New insights on the pathogenesis of Takayasu arteritis: Revisiting the microbial theory. Pathogens 2018;7(3):73.
14. Fassbender HG. Vasculitides. In: Fassbender HG, ed. Pathology and Pathobiology of Rheumatic Diseases. Springer; 2002:304.
15. Cantú C, Pineda C, Barinagarrementeria F, Salgado P, Gurza A, de Pablo P, et al. Noninvasive cerebrovascular assessment of Takayasu arteritis. Stroke 2000;31(9):2197-202.
16. Mekinian A, Djelbani S, Viry F, Fain O, Soussan M. Place de l’imagerie dans l’évaluation des vascularites de gros vaisseaux. Rev Med Interne 2016;37(4):245-55.
17. Saadoun D, Lambert M, Mirault T, Resche-Rigon M, Koskas F, Cluzel P, et al. Retrospective analysis of surgery versus endovascular intervention in Takayasu arteritis: A multicenter experience. Circulation 2012;125(6):813-9.
18. Kerr GS, Hallahan CW, Giordano J, Leavitt RY, Fauci AS, Rottem M, et al. Takayasu arteritis. Ann Intern Med 1994;120(11):919-29.
19. Protocole national de diagnostic et de soins sur l’artérite de Takayasu. Octobre 2019
20. Saadoun D, Bura-Riviere A, Comarmond C, Lambert M, Redheuil A, Mirault T, et al. French recommendations for the management of Takayasu’s arteritis. Orphanet J Rare Di 2021;16(3):311.
21. Hoffman GS, Leavitt RY, Kerr GS, Rottem M, Sneller MC, Fauci AS. Treatment of glucocorticoid-resistant or relapsing takayasu arteritis with methotrexate. Arthritis & Rheumatism 1994;37(4):578-82.
22. Valsakumar AK, Valappil UC, Jorapur V, Garg N, Nityanand S, Sinha N. Role of immunosuppressive therapy on clinical, immunological, and angiographic outcome in active Takayasu’s arteritis. J Rheumatol 2003;30(8):1793-8.
23. Shinjo SK, Pereira RMR, Tizziani VAP, Radu AS, Levy-Neto M. Mycophenolate mofetil reduces disease activity and steroid dosage in Takayasu’s arteritis. Clin Rheumatol 2007;26(11):1871-5.
24. Li J, Yang Y, Zhao J, Li M, Tian X, Zeng X. The efficacy of Mycophenolate mofetil for the treatment of Chinese Takayasu’s arteritis. Sci Rep 2016;6:38687.
25. Goel R, Danda D, Mathew J, Edwin N. Mycophenolate mofetil in Takayasu’s arteritis. Clin Rheumatol 2010;29(3):329-32.
26. Mekinian A, Néel A, Sibilia J, et al. Efficacy and tolerance of infliximab in refractory Takayasu’s arteritis: French multicentre study. Rheumatology 2012;51(5):882-6.
27. Nakaoka Y, Isobe M, Takei S, Tanaka Y, Ishii T, Yokota S, et al. Efficacy and safety of tocilizumab in patients with refractory Takayasu arteritis. Ann Rheum Dis 2018;77(3):348-54.
28. Mekinian A, Biard L, Dagna L, Novikov P, Salvarani C, Espitia O, et al. Efficacy and safety of TNF-α antagonists and tocilizumab in Takayasu arteritis. Rheumatology (Oxford) 2022;61(4):1376-84.
29. Mekinian A, Comarmond C, Resche-Rigon M, Mirault T, Kahn JE, Lambert M, et al. Efficacy of biological-targeted treatments in Takayasu arteritis. Circulation 2015;132(18):1693-700.
30. Mekinian A, Saadoun D, Vicaut E, Thietart S, Lioger B, Jego P, et al. Tocilizumab in treatment-naïve patients with Takayasu arteritis. Arthritis Research & Therapy 2020;22:218.
2. Muratore F, Boiardi L, Mancuso P, Restuccia G, Galli E, Marvisi C, et al. Incidence and prevalence of large vessel vasculitis in northern Italy: A population-based study. Semin Arthritis Rheum 2021;51(4):786-92.
3. Gudbrandsson B, Molberg Ø, Garen T, Palm Ø. Prevalence, incidence, and disease characteristics of Takayasu arteritis by ethnic background: Data from a large, population-based cohort resident in southern Norway. Arthritis Care & Research 2017;69(2):278-85.
4. Watts R, Al-Taiar A, Mooney J, Scott D, MacGregor A. The epidemiology of Takayasu arteritis in the UK. Rheumatology 2009;48(8):1008-11.
5. Onen F, Akkoc N. Epidemiology of Takayasu arteritis. Presse Med 2017;46(7-8 Pt 2):e197-e203.
6. Arnaud L, Haroche J, Limal N, Toledano D, Gambotti L, Costedoat Chalumeau N, et al. Takayasu arteritis in France: A single-center retrospective study of 82 cases comparing white, North African, and black patients. Medicine (Baltimore) 2010;89(1):1-17.
7. Arend WP, Michel BA, Bloch DA, Hunder GG, Calabrese LH, Edworthy SM, et al. The American College of Rheumatology 1990 criteria for the classification of takayasu arteritis. Arthritis & Rheumatism 990;33(8):1129-34.
8. Vanoli M, Daina E, Salvarani C, Sabbadini MG, Rossi C, Bacchiani G, et al. Takayasu’s arteritis: A study of 104 Italian patients. Arthritis Rheum 2005;53(1):100-7.
9. Esen F, Ergelen R, Alibaz-Öner F, Çelik G, Direskeneli H, Kazokoğlu H. Ocular findings and blood flow in patients with Takayasu arteritis: A cross-sectional study. British Journal of Ophthalmology 2019;103(7):928-32.
10. Comarmond C, Dessault O, Devaux JY, Costedoat Chalumeau N, Resche-Rigon M, Isnard R, et al. Myocardial perfusion imaging in Takayasu arteritis. J Rheumatol 2013;40(12):2052-60.
11. Saadoun D, Garrido M, Comarmond C, Desbois AC, Domont F, Savey L, et al. Th1 and Th17 cytokines drive inflammation in Takayasu arteritis. Arthritis Rheumatol 2015;67(5):1353-60.
12. Renauer P, Sawalha AH. The genetics of Takayasu arteritis. Presse Med 2017;46(7-8 Pt 2):e179-e187.
13. Espinoza JL, Ai S, Matsumura I. New insights on the pathogenesis of Takayasu arteritis: Revisiting the microbial theory. Pathogens 2018;7(3):73.
14. Fassbender HG. Vasculitides. In: Fassbender HG, ed. Pathology and Pathobiology of Rheumatic Diseases. Springer; 2002:304.
15. Cantú C, Pineda C, Barinagarrementeria F, Salgado P, Gurza A, de Pablo P, et al. Noninvasive cerebrovascular assessment of Takayasu arteritis. Stroke 2000;31(9):2197-202.
16. Mekinian A, Djelbani S, Viry F, Fain O, Soussan M. Place de l’imagerie dans l’évaluation des vascularites de gros vaisseaux. Rev Med Interne 2016;37(4):245-55.
17. Saadoun D, Lambert M, Mirault T, Resche-Rigon M, Koskas F, Cluzel P, et al. Retrospective analysis of surgery versus endovascular intervention in Takayasu arteritis: A multicenter experience. Circulation 2012;125(6):813-9.
18. Kerr GS, Hallahan CW, Giordano J, Leavitt RY, Fauci AS, Rottem M, et al. Takayasu arteritis. Ann Intern Med 1994;120(11):919-29.
19. Protocole national de diagnostic et de soins sur l’artérite de Takayasu. Octobre 2019
20. Saadoun D, Bura-Riviere A, Comarmond C, Lambert M, Redheuil A, Mirault T, et al. French recommendations for the management of Takayasu’s arteritis. Orphanet J Rare Di 2021;16(3):311.
21. Hoffman GS, Leavitt RY, Kerr GS, Rottem M, Sneller MC, Fauci AS. Treatment of glucocorticoid-resistant or relapsing takayasu arteritis with methotrexate. Arthritis & Rheumatism 1994;37(4):578-82.
22. Valsakumar AK, Valappil UC, Jorapur V, Garg N, Nityanand S, Sinha N. Role of immunosuppressive therapy on clinical, immunological, and angiographic outcome in active Takayasu’s arteritis. J Rheumatol 2003;30(8):1793-8.
23. Shinjo SK, Pereira RMR, Tizziani VAP, Radu AS, Levy-Neto M. Mycophenolate mofetil reduces disease activity and steroid dosage in Takayasu’s arteritis. Clin Rheumatol 2007;26(11):1871-5.
24. Li J, Yang Y, Zhao J, Li M, Tian X, Zeng X. The efficacy of Mycophenolate mofetil for the treatment of Chinese Takayasu’s arteritis. Sci Rep 2016;6:38687.
25. Goel R, Danda D, Mathew J, Edwin N. Mycophenolate mofetil in Takayasu’s arteritis. Clin Rheumatol 2010;29(3):329-32.
26. Mekinian A, Néel A, Sibilia J, et al. Efficacy and tolerance of infliximab in refractory Takayasu’s arteritis: French multicentre study. Rheumatology 2012;51(5):882-6.
27. Nakaoka Y, Isobe M, Takei S, Tanaka Y, Ishii T, Yokota S, et al. Efficacy and safety of tocilizumab in patients with refractory Takayasu arteritis. Ann Rheum Dis 2018;77(3):348-54.
28. Mekinian A, Biard L, Dagna L, Novikov P, Salvarani C, Espitia O, et al. Efficacy and safety of TNF-α antagonists and tocilizumab in Takayasu arteritis. Rheumatology (Oxford) 2022;61(4):1376-84.
29. Mekinian A, Comarmond C, Resche-Rigon M, Mirault T, Kahn JE, Lambert M, et al. Efficacy of biological-targeted treatments in Takayasu arteritis. Circulation 2015;132(18):1693-700.
30. Mekinian A, Saadoun D, Vicaut E, Thietart S, Lioger B, Jego P, et al. Tocilizumab in treatment-naïve patients with Takayasu arteritis. Arthritis Research & Therapy 2020;22:218.
Dans cet article
- Deux phases possiblement intriquées
- Diagnostic posé sur un faisceau d’arguments
- Physiopathologie multifactorielle
- L’anatomopathologie retrouve un infiltrat inflammatoire granulomateux
- Le rôle clé de l’imagerie dans le bilan des lésions artérielles
- Difficile évaluation de l’activité de la maladie
- Une prise en charge multidisciplinaire
- Prévenir les complications vasculaires

 Encadrés
Encadrés