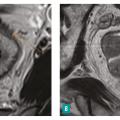
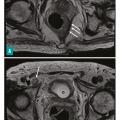
Un tiers des cancers colorectaux sont des cancers du rectum, qui font partie des cancers digestifs les plus fréquents. Un cancer du rectum peut être diagnostiqué chez un patient qui décrit des symptômes évocateurs (rectorragies, troubles du transit, syndrome rectal...) ou dans le cadre du dépistage des cancers colorectaux (test immunologique de recherche de sang dans les selles pour les patients à risque modéré ou coloscopie pour les patients à risque élevé ou très élevé). Dans tous les cas, le toucher rectal est un élément essentiel de l’examen clinique. Il permet d’apprécier la distance entre le sphincter et le pôle inférieur de la tumeur, le caractère mobile ou fixé de la lésion, et sa circonférence d’implantation. Il doit être systématique en cas de rectorragies et avant une coloscopie.
Ensuite, l’examen complémentaire de première intention pour poser le diagnostic de tumeur du rectum est la coloscopie avec biopsies. L’imagerie intervient dans un second temps, afin de préciser l’extension locorégionale, et éventuellement à distance, de la maladie, éléments qui conditionnent les modalités thérapeutiques.
Ensuite, l’examen complémentaire de première intention pour poser le diagnostic de tumeur du rectum est la coloscopie avec biopsies. L’imagerie intervient dans un second temps, afin de préciser l’extension locorégionale, et éventuellement à distance, de la maladie, éléments qui conditionnent les modalités thérapeutiques.
Endoscopies : analyse macroscopique et microscopique
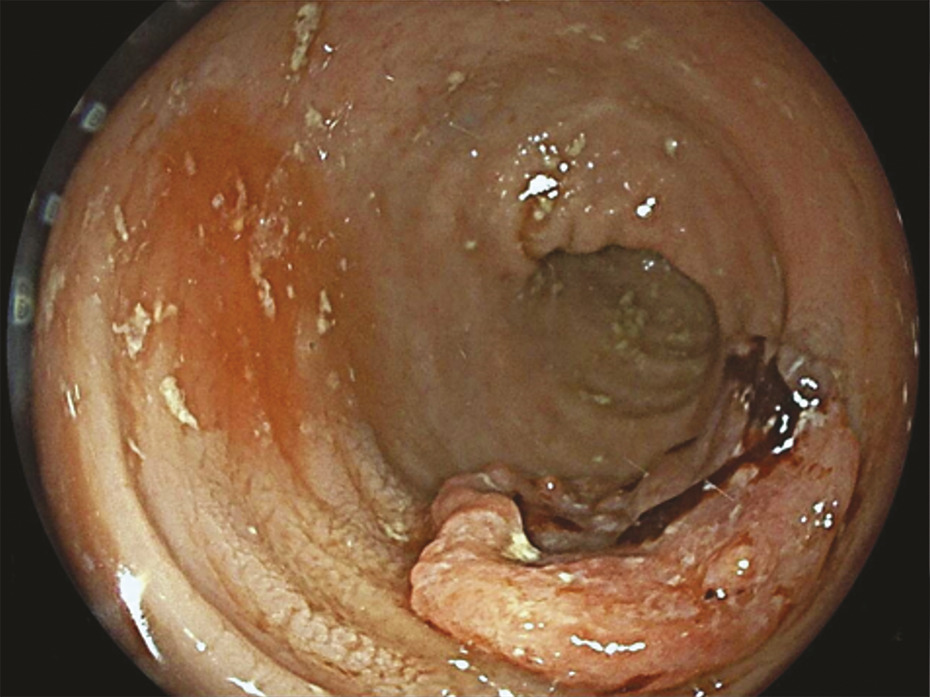
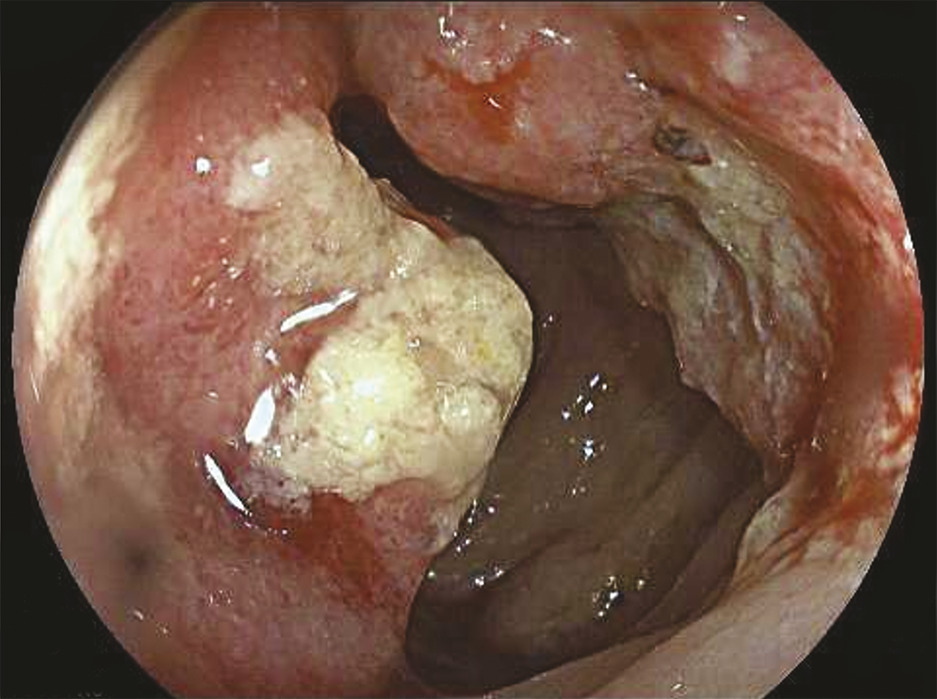
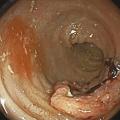
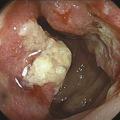
La coloscopie, sous anesthésie générale, est l’examen de première intention dans la plupart des cas de rectorragies. Si elle met en évidence une tumeur rectale, elle peut être complétée immédiatement ou dans un second temps par une rectoscopie rigide, permettant d’évaluer plus précisément la distance entre le pôle inférieur de la tumeur et la marge anale (mesure la plus reproductible) et/ou le pôle supérieur du sphincter. L’examen endoscopique permet également de décrire la lésion rectale (taille, aspect macroscopique, circonférence d’implantation) et de recueillir de multiples biopsies, indispensables au diagnostic (fig. 1 et 2 ).
Le rectum comporte trois étages : le bas rectum, de 0 à 5 cm [0-5] de la marge anale ou à 2 cm ou moins du bord supérieur du sphincter ; le moyen rectum, de 5 à 10 cm ]5-10] de la marge anale, ou de 2 à 7 cm ]2-7] du bord supérieur du sphincter ; enfin, le haut rectum, de 10 à 15 cm ]10-15] de la marge anale ou à plus de 7 cm du bord supérieur du sphincter.
Notons que les tumeurs du haut rectum sont elles-mêmes subdivisées en deux entités : celles qui sont situées sous la ligne de réflexion péritonéale, traitées comme des tumeurs du rectum, à l’inverse de celles qui sont situées au-dessus de cette ligne de réflexion, traitées comme des cancers du côlon.
La stadification du cancer du rectum est effectuée selon la classification de l’Union for International Cancer Control (UICC TNM, 8e édition, publiée en 2017)1 [tableau 1 ].
Le rectum comporte trois étages : le bas rectum, de 0 à 5 cm [0-5] de la marge anale ou à 2 cm ou moins du bord supérieur du sphincter ; le moyen rectum, de 5 à 10 cm ]5-10] de la marge anale, ou de 2 à 7 cm ]2-7] du bord supérieur du sphincter ; enfin, le haut rectum, de 10 à 15 cm ]10-15] de la marge anale ou à plus de 7 cm du bord supérieur du sphincter.
Notons que les tumeurs du haut rectum sont elles-mêmes subdivisées en deux entités : celles qui sont situées sous la ligne de réflexion péritonéale, traitées comme des tumeurs du rectum, à l’inverse de celles qui sont situées au-dessus de cette ligne de réflexion, traitées comme des cancers du côlon.
La stadification du cancer du rectum est effectuée selon la classification de l’Union for International Cancer Control (UICC TNM, 8e édition, publiée en 2017)1 [
L’écho-endoscopie rectale pour les lésions débutantes
L’écho-endoscopie rectale est indiquée si le cancer est détecté à un stade précoce. En effet, elle permet de distinguer les lésions dont l’extension se limite à la muqueuse de celles qui s’étendent jusqu’à la sous-muqueuse (respectivement T1 et T2), donc de sélectionner les tumeurs accessibles à une résection endoscopique ou chirurgicale par voie transanale (dont la microchirurgie transanale endoscopique).2 Elle s’avère plus performante que l’imagerie par résonance magnétique (IRM) dans cette situation.
Une contre-indication à l’IRM constitue la deuxième indication potentielle de l’écho-endoscopie.
Pour évaluer l’envahissement ganglionnaire, la sensibilité et la spécificité de l’écho-endoscopie et de l’IRM sont similaires.
Une contre-indication à l’IRM constitue la deuxième indication potentielle de l’écho-endoscopie.
Pour évaluer l’envahissement ganglionnaire, la sensibilité et la spécificité de l’écho-endoscopie et de l’IRM sont similaires.
IRM du rectum : quel protocole ?
En l’absence de contre-indication, l’IRM du rectum est systématique car son résultat conditionne le choix du traitement néoadjuvant. Il est recommandé d’utiliser des IRM 1,5 ou 3 teslas avec une antenne de surface.
Le protocole est adapté à la localisation de la tumeur et comprend au minimum : des coupes en pondération T2 sans saturation de la graisse dans les trois plans de l’espace (le plan coronal et le plan axial étant respectivement parallèle et perpendiculaire à l’axe de la tumeur, avec une épaisseur maximale de coupe de 3 mm) et des coupes axiales en pondération-diffusion (valeur minimale du gradient de diffusion b : 800) avec cartographie ADC (apparent diffusion coefficient). Des coupes coronales parallèles au plan du canal anal en pondération T2 doivent également être réalisées en cas de tumeur distale pour évaluer ses rapports avec l’appareil sphinctérien. Selon les centres, un lavement pré-IRM, une opacification préalable de l’ampoule rectale par du gel et l’administration d’antispasmodiques peuvent être utilisés, mais ces derniers n’ont pas fait l’objet d’un consensus lors des dernières recommandations.3
Le protocole est adapté à la localisation de la tumeur et comprend au minimum : des coupes en pondération T2 sans saturation de la graisse dans les trois plans de l’espace (le plan coronal et le plan axial étant respectivement parallèle et perpendiculaire à l’axe de la tumeur, avec une épaisseur maximale de coupe de 3 mm) et des coupes axiales en pondération-diffusion (valeur minimale du gradient de diffusion b : 800) avec cartographie ADC (apparent diffusion coefficient). Des coupes coronales parallèles au plan du canal anal en pondération T2 doivent également être réalisées en cas de tumeur distale pour évaluer ses rapports avec l’appareil sphinctérien. Selon les centres, un lavement pré-IRM, une opacification préalable de l’ampoule rectale par du gel et l’administration d’antispasmodiques peuvent être utilisés, mais ces derniers n’ont pas fait l’objet d’un consensus lors des dernières recommandations.3
Différents éléments doivent figurer au compte-rendu d’IRM3
Les paramètres d’extension locale sont :
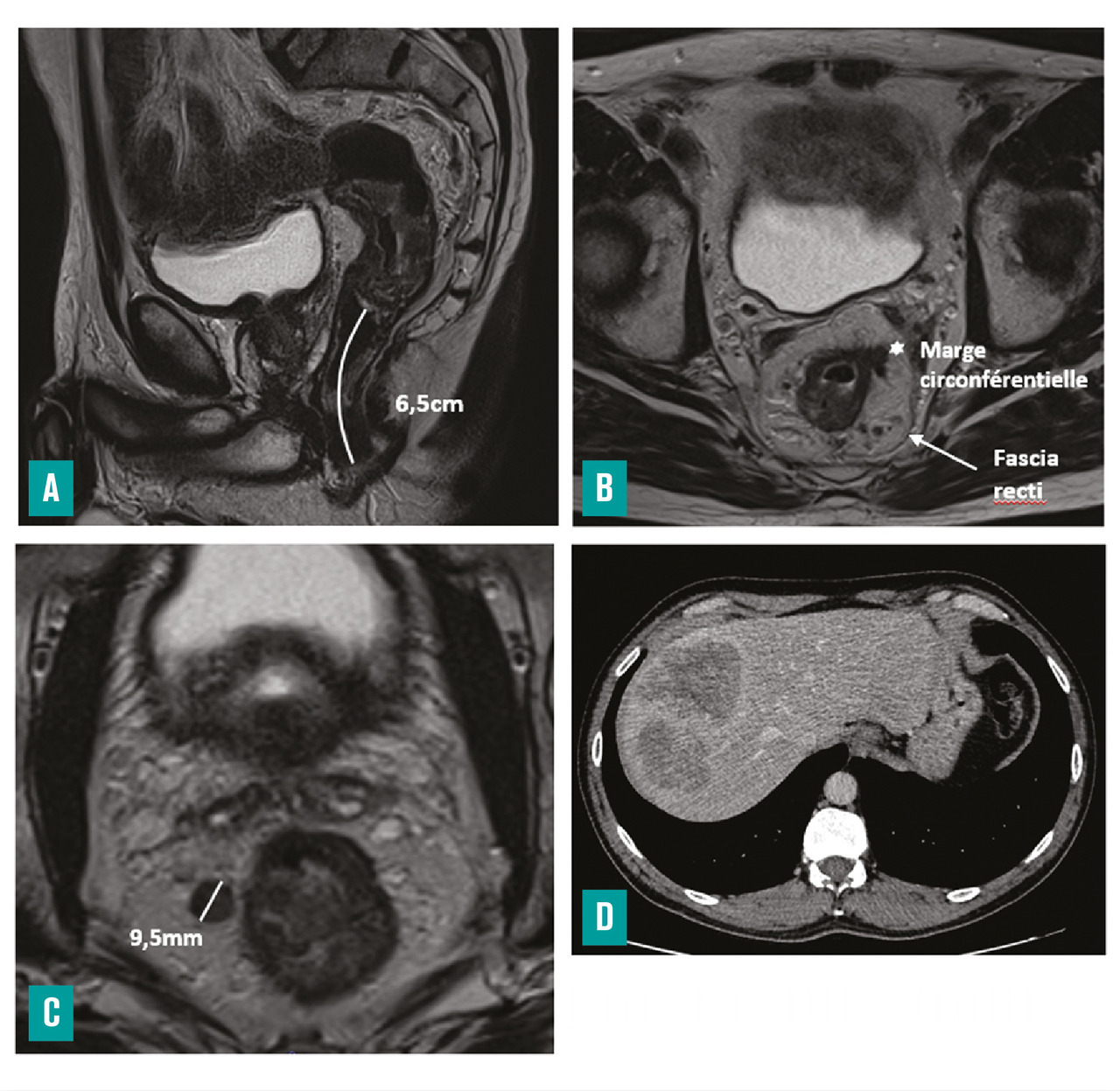
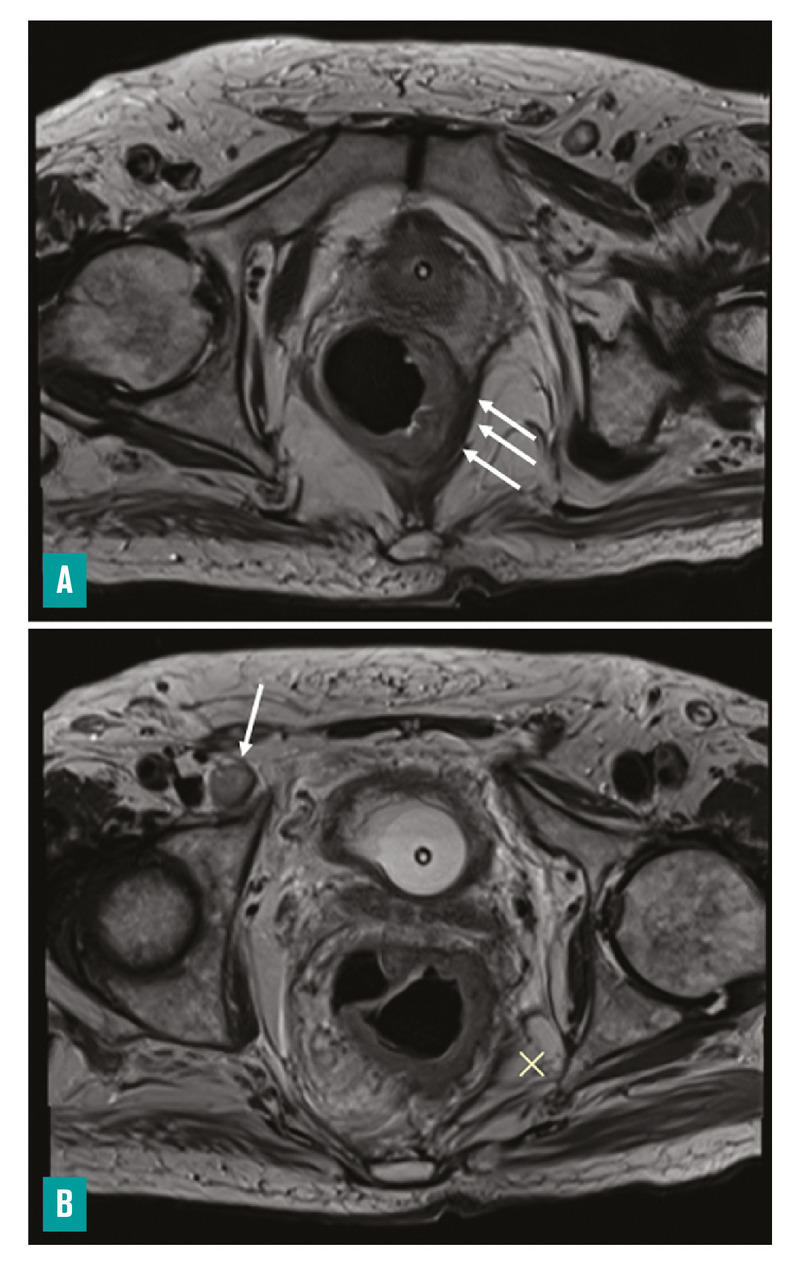
– la distance entre le pôle inférieur de la tumeur et la marge anale et/ou le bord supérieur du sphincter interne (fig. 3 ) ;
– la morphologie, la dimension de la tumeur et sa localisation sur un cadrant horaire ;
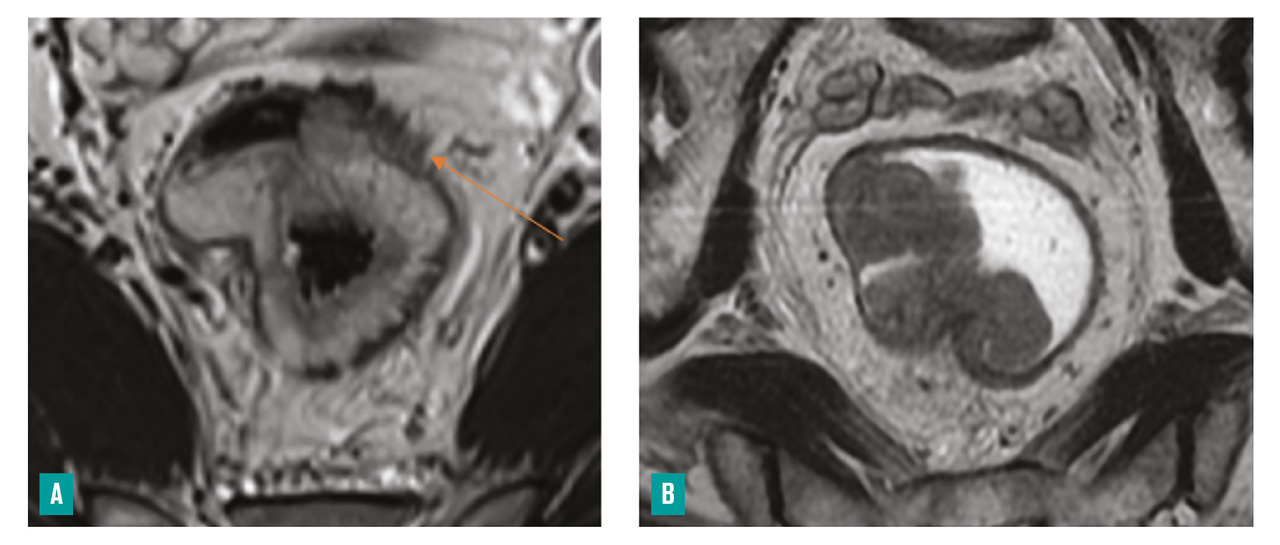
– la présence ou non d’arguments en faveur d’une histologie mucineuse, de plus mauvais pronostic (tumeur en hypersignal T2)4 [fig. 4 ] ;
– le stade T (exception faite de l’envahissement pariétal des petites tumeurs superficielles pour lesquelles l’écho-endoscopie permet de mieux différencier les stades T1 et T22, 3 et dont le résultat de l’IRM ne doit pas faire remettre en cause le stade T obtenu en écho-endoscopie en cas de discordance) ;
– pour les tumeurs bas situées, si une résection inter-sphinctérienne est envisageable : rapport avec les muscles releveurs de l’anus, le muscle puborectal et les sphincters externe/interne ainsi que la hauteur de l’envahissement potentiel du sphincter interne.
L’atteinte du mésorectum et du péritoine est caractérisée par :
– la marge circonférentielle (CRM) : distance la plus courte en millimètres entre le bord externe de la tumeur ou d’une adénopathie, d’un nodule tumoral, d’un embole vasculaire extramural et le fascia recti, ainsi que sa localisation horaire (fig. 3 ) ;
– pour les tumeurs haut situées : un éventuel envahissement de la ligne de réflexion péritonéale par la tumeur.
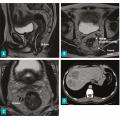
L’atteinte ganglionnaire (stade N), les dépôts tumoraux au sein du mésorectum, la présence ou l’absence d’invasion vasculaire extramurale (facteur pronostique péjoratif indépendant5) et d’éventuelles métastases, notamment les ganglions extrarégionaux (fig. 5 ), doivent également être mentionnés.
Quelques précisions :
– Concernant le stade T, le stade T3 peut être divisé en quatre sous-stades en fonction de l’extension au sein du mésorectum : T3a, inférieure à 1 mm ; T3b, de 1 à 5 mm ; T3c, de 5 à 15 mm ; T3d supérieure à 15 mm. Cette distinction intervient dans le choix du traitement selon les dernières recommandations européennes.2
– Concernant l’extension ganglionnaire, un petit axe supérieur à 8 mm est hautement prédictif d’une invasion tumorale. Cependant, la taille de plus de la moitié des ganglions atteints est inférieure à 5 mm.6 Le critère de taille isolé est donc insuffisant pour évaluer l’envahissement tumoral7, 8 ; des critères morphologiques prédictifs de malignité doivent également être pris en compte (tableau 2 ).
– la distance entre le pôle inférieur de la tumeur et la marge anale et/ou le bord supérieur du sphincter interne (
– la morphologie, la dimension de la tumeur et sa localisation sur un cadrant horaire ;
– la présence ou non d’arguments en faveur d’une histologie mucineuse, de plus mauvais pronostic (tumeur en hypersignal T2)4 [
– le stade T (exception faite de l’envahissement pariétal des petites tumeurs superficielles pour lesquelles l’écho-endoscopie permet de mieux différencier les stades T1 et T22, 3 et dont le résultat de l’IRM ne doit pas faire remettre en cause le stade T obtenu en écho-endoscopie en cas de discordance) ;
– pour les tumeurs bas situées, si une résection inter-sphinctérienne est envisageable : rapport avec les muscles releveurs de l’anus, le muscle puborectal et les sphincters externe/interne ainsi que la hauteur de l’envahissement potentiel du sphincter interne.
L’atteinte du mésorectum et du péritoine est caractérisée par :
– la marge circonférentielle (CRM) : distance la plus courte en millimètres entre le bord externe de la tumeur ou d’une adénopathie, d’un nodule tumoral, d’un embole vasculaire extramural et le fascia recti, ainsi que sa localisation horaire (
– pour les tumeurs haut situées : un éventuel envahissement de la ligne de réflexion péritonéale par la tumeur.
L’atteinte ganglionnaire (stade N), les dépôts tumoraux au sein du mésorectum, la présence ou l’absence d’invasion vasculaire extramurale (facteur pronostique péjoratif indépendant5) et d’éventuelles métastases, notamment les ganglions extrarégionaux (
Quelques précisions :
– Concernant le stade T, le stade T3 peut être divisé en quatre sous-stades en fonction de l’extension au sein du mésorectum : T3a, inférieure à 1 mm ; T3b, de 1 à 5 mm ; T3c, de 5 à 15 mm ; T3d supérieure à 15 mm. Cette distinction intervient dans le choix du traitement selon les dernières recommandations européennes.2
– Concernant l’extension ganglionnaire, un petit axe supérieur à 8 mm est hautement prédictif d’une invasion tumorale. Cependant, la taille de plus de la moitié des ganglions atteints est inférieure à 5 mm.6 Le critère de taille isolé est donc insuffisant pour évaluer l’envahissement tumoral7, 8 ; des critères morphologiques prédictifs de malignité doivent également être pris en compte (
Le scanner thoraco-abdomino-pelvien évalue l’extension à distance
Le scanner thoraco-abdomino-pelvien permet de réaliser le bilan d’extension à distance du cancer du rectum, à la recherche, en particulier, de métastases hépatiques et pulmonaires.
Il doit comporter une injection de produit de contraste iodé. En cas de contre-indication à cette injection (insuffisance rénale évoluée, par exemple), réaliser une IRM hépatique et un scanner thoracique sans injection est une alternative.9
Le scanner est nettement moins performant que l’IRM pour le bilan d’extension locale du cancer du rectum, en particulier pour les tumeurs peu avancées.10
Il doit comporter une injection de produit de contraste iodé. En cas de contre-indication à cette injection (insuffisance rénale évoluée, par exemple), réaliser une IRM hépatique et un scanner thoracique sans injection est une alternative.9
Le scanner est nettement moins performant que l’IRM pour le bilan d’extension locale du cancer du rectum, en particulier pour les tumeurs peu avancées.10
D’autres examens d’imagerie ?
L’IRM hépatique et la tomographie par émission de positons couplée au scanner avec injection de [18F]-fluorodéoxyglucose (TEP-scan au 18F-FDG) répondent à des indications particulières.
Deux cas de figure pour l’IRM hépatique
Elle peut être réalisée en cas de contre-indication à l’injection de produit de contraste iodé (v. supra) et/ou de lésion hépatique que le scanner thoraco-abdomino-pelvien n’a pas permis de caractériser, ce qui en pratique courante est souvent le cas des lésions de petite taille, infracentimétriques.
Une séquence de diffusion doit être systématique, et dans l’idéal utiliser un produit de contraste hépatospécifique. En effet, il est démontré que la combinaison de ces deux éléments est plus rentable pour le diagnostic des métastases hépatiques.11
Une séquence de diffusion doit être systématique, et dans l’idéal utiliser un produit de contraste hépatospécifique. En effet, il est démontré que la combinaison de ces deux éléments est plus rentable pour le diagnostic des métastases hépatiques.11
Un TEP-scan en cas de doute ou en préthérapeutique
Le TEP-scan au 18F-FDG est également indiqué dans deux circonstances : d’une part, en cas de doute sur la nature métastatique d’une lésion et, d’autre part, à visée préthérapeutique, en fusionnant ses données avec celles de l’IRM, avant la radiothérapie conformationnelle.9
Le TEP-scan ne permet pas de réaliser le bilan local de la lésion à lui seul. En effet, sa faible résolution spatiale limite l’appréciation du stade T, N, de la CRM et des rapports éventuels avec l’appareil sphinctérien. Il est également peu utile en cas de tumeur mucineuse, car la mucine ne capte que faiblement le traceur.12
Le TEP-scan ne permet pas de réaliser le bilan local de la lésion à lui seul. En effet, sa faible résolution spatiale limite l’appréciation du stade T, N, de la CRM et des rapports éventuels avec l’appareil sphinctérien. Il est également peu utile en cas de tumeur mucineuse, car la mucine ne capte que faiblement le traceur.12
Trois examens incontournables
Le bilan d’extension du cancer du rectum repose sur trois examens indispensables : la coloscopie pour le diagnostic positif, l’IRM rectale pour l’extension locorégionale et le scanner thoraco-abdomino-pelvien pour l’extension à distance.
La description précise de la lésion, en particulier en IRM, est un élément crucial de la prise en charge car elle conditionne les modalités du traitement local.
Les autres examens d’imagerie ne sont pas systématiques et sont discutés au cas par cas.
La description précise de la lésion, en particulier en IRM, est un élément crucial de la prise en charge car elle conditionne les modalités du traitement local.
Les autres examens d’imagerie ne sont pas systématiques et sont discutés au cas par cas.
Références
1. Union for International Cancer Control (UICC). TNM classification of malignant tumours [en ligne], 8e éd. Wiley. 2017 [cité le 10 octobre 2021]. Disponible sur : www.wiley.com/en-au/TNM+Classification+of+Malignant+Tumours%2C+8th+Edition-p-9781119263579
2. Glynne-Jones R, Wyrwicz L, Tiret E, Brown G, Rödel C, Cervantes A, et al. Rectal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2017;28:iv22‑iv40.
3. Beets-Tan RGH, Lambregts DMJ, Maas M, Bipat S, Barbaro B, Curvo-Semedo L, et al. Magnetic resonance imaging for clinical management of rectal cancer: Updated recommendations from the 2016 European Society of Gastrointestinal and Abdominal Radiology (ESGAR) consensus meeting. Eur Radiol 2018;28:1465‑75.
4. Horvat N, Hope TA, Pickhardt PJ, Petkovska I. Mucinous rectal cancer: concepts and imaging challenges. Abdom Radiol (NY) 2019;44:3569‑80.
5. Ale Ali H, Kirsch R, Razaz S, Jhaveri A, Thipphavong S, Kennedy ED, et al. Extramural venous invasion in rectal cancer: overview of imaging, histopathology, and clinical implications. Abdom Radiol (NY) 2019;44:1‑10.
6. Kim JH, Beets GL, Kim MJ, Kessels AGH, Beets-Tan RGH. High-resolution MR imaging for nodal staging in rectal cancer: are there any criteria in addition to the size? Eur J Radiol 2004;52:78‑83.
7. Brown G, Richards CJ, Bourne MW, Newcombe RG, Radcliffe AG, Dallimore NS, et al. Morphologic predictors of lymph node status in rectal cancer with use of high-spatial-resolution MR imaging with histopathologic comparison. Radiology 2003;227:371‑7.
8. Kotanagi H, Fukuoka T, Shibata Y, Yoshioka T, Aizawa O, Saito Y, et al. The size of regional lymph nodes does not correlate with the presence or absence of metastasis in lymph nodes in rectal cancer. J Surg Oncol 1993;54:252‑4.
9. Cotte E, Artru P, Bachet JB, Bibeau F, Christou N, Conroy T, et al. Cancer du rectum. Thésaurus national de cancérologie digestive [en ligne]. 2021 [cité le 10 octobre 2021]. Disponible sur : https://www.snfge.org/content/5-cancer-du-rectum
10. Muthusamy VR, Chang KJ. Optimal methods for staging rectal cancer. Clin Cancer Res 2007;13:6877s‑84s.
11. Zech CJ, Korpraphong P, Huppertz A, Denecke T, Kim MJ, Tanomkiat W, et al. Randomized multicentre trial of gadoxetic acid-enhanced MRI versus conventional MRI or CT in the staging of colorectal cancer liver metastases. Br J Surg 2014;101:613‑21.
12. Heo SH, Kim JW, Shin SS, Jeong YY, Kang H-K. Multimodal imaging evaluation in staging of rectal cancer. World J Gastroenterol 2014;20:4244‑55.
2. Glynne-Jones R, Wyrwicz L, Tiret E, Brown G, Rödel C, Cervantes A, et al. Rectal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2017;28:iv22‑iv40.
3. Beets-Tan RGH, Lambregts DMJ, Maas M, Bipat S, Barbaro B, Curvo-Semedo L, et al. Magnetic resonance imaging for clinical management of rectal cancer: Updated recommendations from the 2016 European Society of Gastrointestinal and Abdominal Radiology (ESGAR) consensus meeting. Eur Radiol 2018;28:1465‑75.
4. Horvat N, Hope TA, Pickhardt PJ, Petkovska I. Mucinous rectal cancer: concepts and imaging challenges. Abdom Radiol (NY) 2019;44:3569‑80.
5. Ale Ali H, Kirsch R, Razaz S, Jhaveri A, Thipphavong S, Kennedy ED, et al. Extramural venous invasion in rectal cancer: overview of imaging, histopathology, and clinical implications. Abdom Radiol (NY) 2019;44:1‑10.
6. Kim JH, Beets GL, Kim MJ, Kessels AGH, Beets-Tan RGH. High-resolution MR imaging for nodal staging in rectal cancer: are there any criteria in addition to the size? Eur J Radiol 2004;52:78‑83.
7. Brown G, Richards CJ, Bourne MW, Newcombe RG, Radcliffe AG, Dallimore NS, et al. Morphologic predictors of lymph node status in rectal cancer with use of high-spatial-resolution MR imaging with histopathologic comparison. Radiology 2003;227:371‑7.
8. Kotanagi H, Fukuoka T, Shibata Y, Yoshioka T, Aizawa O, Saito Y, et al. The size of regional lymph nodes does not correlate with the presence or absence of metastasis in lymph nodes in rectal cancer. J Surg Oncol 1993;54:252‑4.
9. Cotte E, Artru P, Bachet JB, Bibeau F, Christou N, Conroy T, et al. Cancer du rectum. Thésaurus national de cancérologie digestive [en ligne]. 2021 [cité le 10 octobre 2021]. Disponible sur : https://www.snfge.org/content/5-cancer-du-rectum
10. Muthusamy VR, Chang KJ. Optimal methods for staging rectal cancer. Clin Cancer Res 2007;13:6877s‑84s.
11. Zech CJ, Korpraphong P, Huppertz A, Denecke T, Kim MJ, Tanomkiat W, et al. Randomized multicentre trial of gadoxetic acid-enhanced MRI versus conventional MRI or CT in the staging of colorectal cancer liver metastases. Br J Surg 2014;101:613‑21.
12. Heo SH, Kim JW, Shin SS, Jeong YY, Kang H-K. Multimodal imaging evaluation in staging of rectal cancer. World J Gastroenterol 2014;20:4244‑55.