Les carcinomes nasopharyngés (CNP), ou cancers du cavum, sont le plus souvent diagnostiqués devant des signes rhinologiques, auditifs ou neurologiques non spécifiques, conséquences de leur évolution locorégionale ; plus rarement, des signes généraux doivent faire évoquer ce diagnostic, particulièrement si le patient est natif de la région du Sud-Est asiatique ou de la rive sud du pourtour méditerranéen (
Épidémiologie, classifications et pronostic
Les CNP appartiennent au spectre des tumeurs rares en France, qui correspond à une zone de faible incidence (environ 300 cas par an).
Ils représentent, à plusieurs titres, un cas très particulier de cancer des voies aérodigestives supérieures (VADS). En effet, cette tumeur lympho-épithéliale, le plus souvent développée aux dépens de la fossette de Rosenmüller, est un modèle de cancer ayant une composante étiologique virale, avec une épidémiologie singulière ; elle est, de plus, une des rares tumeurs des VADS pour laquelle la chirurgie n’est pas un pilier du traitement curatif ; elle survient fréquemment dans une population d’adultes jeunes (autour de 25 ans), avec un deuxième pic de fréquence autour de 50 ans dans une population n’ayant pas les mêmes comorbidités liées à l’exposition éthylotabagique que celles observées chez les patients traités pour des carcinomes épidermoïdes des VADS (CEVADS) ; enfin, son évolution métastatique est radicalement différente de celle des autres tumeurs des VADS, avec 5 à 10 % des patients métastatiques synchrones et 20 à 30 % le devenant dans les trois ans après traitement, et une dissémination fréquente au cadre osseux et ostéomédullaire, hépatique et pulmonaire.
Faible incidence en France
Son incidence mondiale et la mortalité sont globalement en diminution constante depuis quarante ans1, probablement par l’effet de modifications du mode de vie alimentaire (diminution de la consommation dans la petite enfance de substances carcinogènes - dont les nitrosamines - utilisées dans des procédés traditionnels de conservation des aliments) et l’amélioration des traitements. En France, sa faible incidence rend la prise en charge dépendante de l’expérience des centres, ainsi que de leurs possibilités d’accès à des thérapeutiques faisant partie de l’arsenal des thérapies innovantes dont la délivrance est liée à l’ouverture et à la participation à un essai clinique ou pour lesquelles les demandes d’autorisation de mise sur le marché (AMM) ne sont pas déposées par les laboratoires pharmaceutiques.
Une oncogenèse liée au virus d’Epstein-Barr
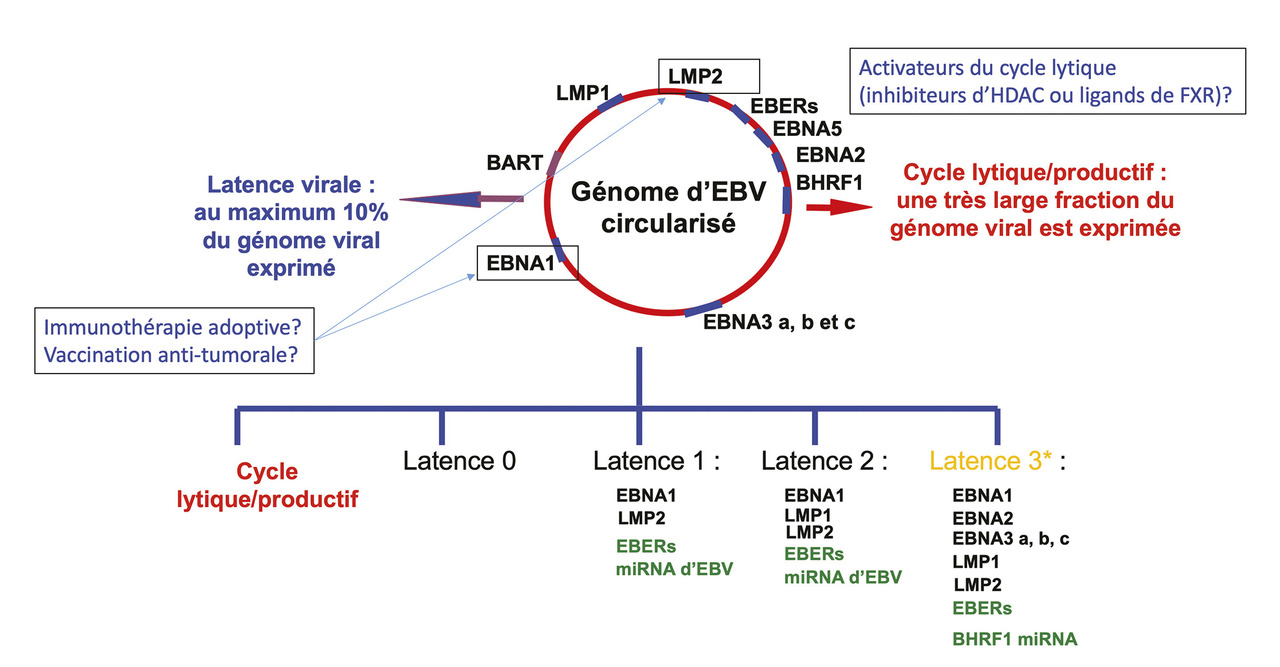
Comme les carcinomes oropharyngés induits par les papillomavirus humains (HPV pour human papillomavirus), le carcinome nasopharyngé a une oncogenèse le plus souvent liée à une infection virale répandue, le virus d’Epstein-Barr (EBV). L’ADN viral intact est contenu dans la totalité des cellules malignes. Son expression est en partie réprimée mais il code néanmoins différents produits oncogéniques viraux, à savoir des protéines telles que EBNA1, LMP1 et LMP2, et des ARN non-traduits comme les EBERs. L’association à EBV est constante dans les CNP de type II et III de la classification de l’Organisation mondiale de la santé (OMS) récemment révisée,2 correspondant aux carcinomes non kératinisants indifférenciés (type III) et différenciés (type II). En revanche, l’association à EBV est souvent absente dans les cas plus rares de carcinomes épidermoïdes kératinisants (type I) – pour lesquels un lien avec un des sérotypes du papillomavirus humain est débattu sans cependant aucune implication clinique actuellement.3 La persistance de l’EBV et son rôle carcinologique dans les CNP réside dans un subtil jeu de cache-cache avec le système immunitaire via plusieurs types d’état de latence où le virus ne se réplique pas mais reste cependant actif (
Des facteurs responsables régionaux
Cette oncogenèse virale est cependant dépendante d’autres facteurs responsables de son épidémiologie particulière, avec des zones d’endémie où l’incidence peut être élevée, comme en Chine du sud où elle atteint 30 cas pour 1 000 habitants ; cela souligne des facteurs étiologiques héréditaires – pour lesquels des stratégies de dépistage reposant sur la fibroscopie et la surveillance sérologique et plasmatique circulante de l’ADN d’EBV sont proposées par les équipes asiatiques – et environnementaux, les populations émigrées de zone d’endémie subissant une incidence moindre que celle décrite dans leur lieu de naissance.
Parmi ces facteurs héréditaires et environnementaux, on note en particulier une prédominance masculine (sex-ratio entre 2 et 3), les profils génétiques avec certains allèles du complexe HLA de classe I (favorisant probablement la présentation du virus), des mutations de BRCA2 (gène de réparation de l’ADN dont l’altération prédispose à de nombreux cancers), le tabagisme, les huiles végétales inhalées, l’exposition au formaldéhyde, le sevrage précoce en lait maternel avec relais par des aliments conservés (saumure, beurre rance, poissons séchés sans éviscération, selon des habitudes locales), les carences d’apport en fruits et légumes.
Évolution de la classification en stades
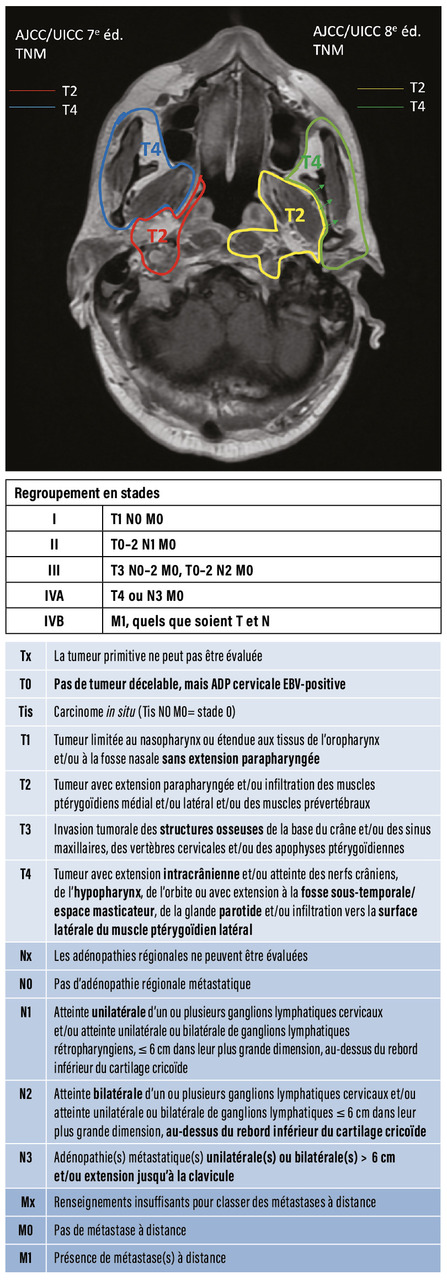
Comme pour l’ensemble des cancers des VADS, la stadification repose sur la classification internationale conjointe des sociétés UICC-AJCC (Union for International Cancer Control-American Joint Committee on Cancer), 8e édition de 2017 révisée à la lumière des progrès diagnostiques (imagerie par résonance magnétique [IRM]) et thérapeutiques (radiothérapie conformationnelle par modulation d’intensité [RCMI]-chimiothérapie).5 Par rapport à la 7e version, les modifications essentielles concernent les définitions du T2 (incluant toute extension non osseuse jusqu’au muscle ptérygoïdien latéral [
La radiothérapie, base du traitement curatif des CNP localisés
Le pilier du traitement curatif des CNP est la radiothérapie délivrée quasiment à tous les stades de la maladie (
Les doses, les volumes d’irradiation et les modalités de contourage des zones anatomiques à risque récurrent ainsi que les délais par rapport à la chimiothérapie d’induction font l’objet de recommandations spécifiques régulièrement réévaluées à la lumière des nouvelles techniques de radiothérapie ou d’imagerie.8 En effet, le risque de rechute locale – de mauvais pronostic – ainsi que les toxicités aiguës et tardives, qui ne sont pas négligeables, conduisent à faire évoluer les traitements vers une désescalade thérapeutique en fonction des facteurs pronostiques initiaux. Ainsi, les tumeurs de petite taille sont traitées par radiothérapie exclusive, sans ajout des toxicités de la chimiothérapie, tandis que dans les cas où la chimiothérapie néoadjuvante s’est imposée, la réduction des doses et volumes de radiothérapie est le nouvel objectif de plusieurs essais cliniques.
Malgré une guérison fréquente, un suivi étroit s’impose
Les probabilités de guérison en cas de CNP localisé pris en charge de manière adaptée sont élevées et, comme nous l’avons vu précédemment, certaines des rechutes sont accessibles à un traitement à visée curative.
Sur le plan des toxicités induites par le traitement, la place de l’ORL est déterminante, non seulement pour la surveillance endoscopique du rhinopharynx mais également pour le suivi et la prise en charge de l’hyposialie, du trismus, des insuffisances hypophysaires, des radioscléroses cervicales, des troubles de la déglutition, des ostéoradionécroses (nécessitant de plus un suivi dentaire adapté), des rhinites croûteuses et des fréquentes otites séromuqueuses chroniques (favorisées par l’atteinte fonctionnelle de la trompe d’Eustache adjacente) qui, conjointement à la toxicité des sels de platine, majorent le risque de handicap auditif.
Les récidives de CNP peuvent être locales et/ou métastatiques, avec une moins bonne survie pour les rechutes précoces après traitement (avant deux ans) que pour les rechutes tardives. Les taux de rechutes à trois ans des traitements des formes localisées tous stades confondus sont d’environ 16 % au niveau local et de 20 % à distance (métastases).7
Le suivi habituel des patients traités pour un cancer est essentiellement clinique et radiologique. Dans les CNP, deux modalités de suivi paracliniques doivent être de plus proposées : la tomographie à émission de positons (TEP) et la charge virale plasmatique de l’ADN de l’EBV.
La tomographie à émission de positons plus pertinente que le scanner
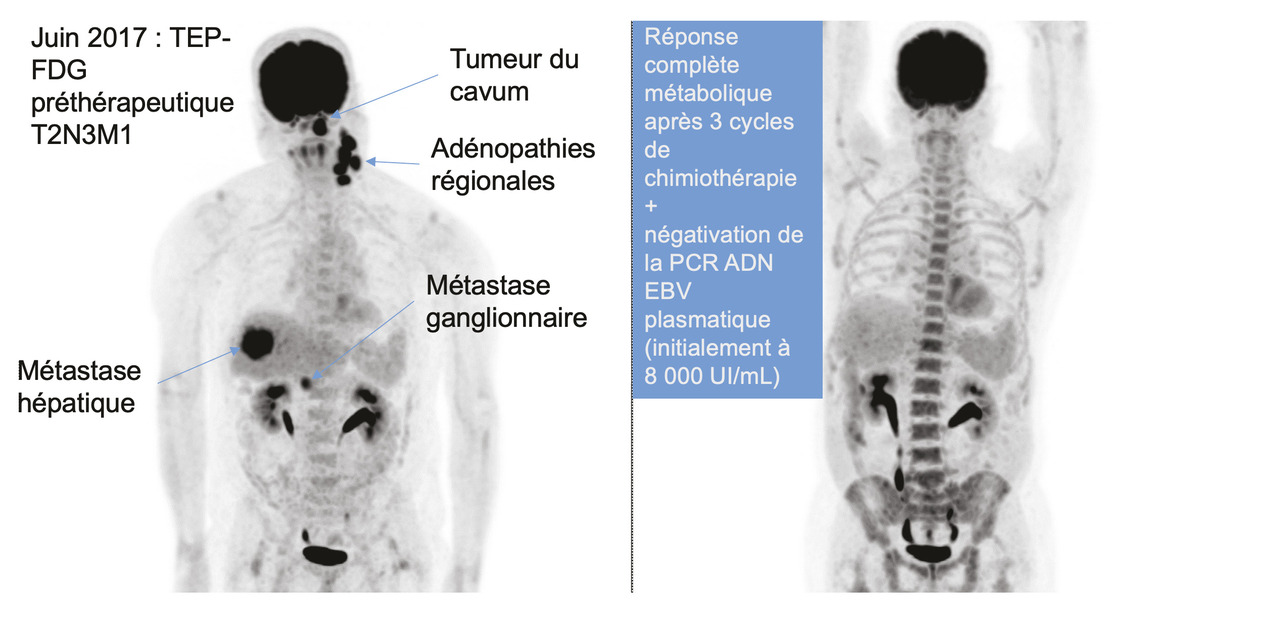
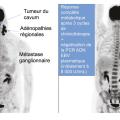
La TEP est en effet recommandée au diagnostic initial pour le bilan d’extension en raison de la fréquence de métastases synchrones découvertes au diagnostic (
Pour ces mêmes raisons, cet examen devrait faire partie du suivi, ayant démontré une capacité de diagnostic de récidive plus précoce que le scanner. Pour autant, sa fréquence de réalisation n’est pas consensuelle, en raison de l’absence de données médico-économiques probantes et de gain de survie démontré.
Mauvais pronostic des rechutes locales
Les rechutes locales sont de mauvais pronostic tant en matière de survie que de qualité de vie, car les séquelles du traitement antérieur peuvent se conjuguer aux symptômes tumoraux et à ceux induits par le traitement de rattrapage – préférentiellement en première intention chirurgical (rhinopharyngectomie en centre expert), plus rarement de type réirradiation et parfois accompagnés de traitements systémiques difficilement évaluables sur des imageries où s’intriquent remaniements post-thérapeutiques et syndrome tumoral.
Stratégies multimodales de la prise en charge à la phase métastatique
La survie globale médiane au diagnostic d’un CNP métastatique synchrone ou métachrone est largement supérieure à celle des CEVADS dans la même situation, alors même que les localisations métastatiques impliquent plus souvent des organes considérés comme plus à risque (foie, os). Il est probable que cette survie soit expliquée par le plus jeune âge médian et les moindres comorbidités des patients concernés mais aussi par la forte chimiosensibilité des CNP et les longues durées de réponse observées, alors que les immunothérapies – bien que prometteuses dans ce modèle de cancer lympho-épithélial – n’ont pas encore obtenu le niveau de preuve observé dans les CEVADS.
Cette survie globale exceptionnelle, conjointement à la fréquence des formes métastatiques synchrones, doit faire considérer une place pour des stratégies plus agressives dans une intention curative ou pour le contrôle des symptômes. En effet, c’est le seul modèle tumoral, par exemple, où le traitement de la tumeur primitive (par radiothérapie chez les patients contrôlés par la chimiothérapie initiale) a démontré, outre un contrôle des symptômes, un bénéfice en matière de survie au cours d’un essai randomisé de phase III.9 Ainsi, il peut être proposé à un patient métastatique, après une période de chimiothérapie première, une irradiation du rhinopharynx (
En pratique, les CNP sont sensibles aux sels de platine, qui sont la pierre angulaire des traitements systémiques (comme en situation localisée) et associés en première ligne à un antimétabolite, la gemcitabine. De nombreux autres cytotoxiques ont fait la preuve de leur efficacité et sont utilisés dans les lignes ultérieures en cas de résistance ou progression, que ce soit au cours d’une chimiothérapie ou en phase de pause thérapeutique (puisque les réponses peuvent être durables dans ce type tumoral, les questions de l’épargne de chimiothérapie comme celle de la réutilisation d’un traitement antérieur sont fréquentes) : en particulier les taxanes, le 5-fluoro-uracile (5-FU), les anthracyclines, le cyclophosphamide.
De nouvelles stratégies médicamenteuses s’intègrent progressivement à l’arsenal thérapeutique dans le but d’améliorer la survie globale, voire le taux de guérison et/ou la qualité de vie, par la réduction des toxicités et séquelles. Les immunothérapies inhibant les points de contrôle immunitaire (en particulier le ligand PD-1 participant à la tolérance par le système immunitaire des cellules cancéreuses) sont les plus immédiatement prêtes à prendre place dans la stratégie multimodale de prise en charge aux différents stades des CNP. Plusieurs études asiatiques de phase III (avec des molécules comme le toripalimab ou le camrélizumab10, 11 développées par des laboratoires chinois, actuellement non disponibles en Europe) ont montré des effets prometteurs sur la survie sans progression et la survie globale en première ligne métastatique en association avec la chimiothérapie. De manière étonnante, dans les lignes ultérieures, cette même classe d’anticorps a également montré des résultats intéressants mais dans les mêmes proportions (environ 30 % de patients répondeurs avec des réponses durables et une toxicité nettement moindre que celle des cytotoxiques) que dans les autres modèles tumoraux, alors que le modèle lympho-épithélial des CNP aurait laissé espérer un plus grand succès.
Des perspectives thérapeutiques avec les antiangiogéniques et autour du virus d’Epstein-Barr
L’intérêt probable, dans le traitement des CNP, de la classe des antiangiogéniques,12 qui ont montré lors de plusieurs études contrôlées des taux de réponse intéressants (seuls ou en association) sans démontrer de gain en survie jusqu’à présent, laisse surtout envisager des stratégies prometteuses en association aux immunothérapies, particulièrement en induction mais également dans les situations avancées.13
Enfin, le rôle clé joué par l’EBV dans la carcinogenèse et la tolérance immune (
Circonstances de diagnostic des carcinomes nasopharyngés
Symptômes peu spécifiques, locorégionaux le plus souvent :
- hypoacousie;
- obstruction nasale, anosmie, épistaxis ;
- trismus ;
- déficit de paires crâniennes (V, VI, III) ;
- adénopathie cervicale, sus-claviculaire, spinale (plus rarement axillaire).
Examen au fibroscope (sur point d’appel ou enquête familiale).
Symptômes liés à l’extension métastatique ou paranéoplasique (10 % des cas) :
- métastases fréquentes : pulmonaires, ganglionnaires, osseuses (douleurs rachidiennes, par exemple), hépatiques (ictère, perturbations biologiques) ;
- fièvre d’origine inconnue, hypercalcémie, réaction leucémoïde, hippocratisme digital et ostéo-arthropathie hypertrophiante pneumique.
1. Lee AW, Ng WT, Chan YH, Sze H, Chan C, Lam TH. The battle against nasopharyngeal cancer. Radiother Oncol 2012;104(3):272-8.
2. Badoual C. Update from the 5th Edition of the World Health Organization classification of head and neck tumors: Oropharynx and nasopharynx. Head Neck Pathol 2022;16(1):19-30.
3. Lin Z, Khong B, Kwok S, Cao H, West RB, Le QT, et al. Human papillomavirus 16 detected in nasopharyngeal carcinomas in white Americans but not in endemic Southern Chinese patients. Head Neck 2014;36(5):709-14.
4. Ferrand FR, Busson P. Carcinomes nasopharyngés associés au virus d’Epstein-Barr : de la biologie fondamentale aux applications diagnostiques et thérapeutiques. Correspondances en Onco-Théranostic, vol. II, n° 2, avril-mai-juin 2013.
5. Amin MB, Greene FL, Edge SB, Compton CC, Gershenwald JE, Brookland RK, et al. The Eighth Edition of American Joint Committee on Cancer (AJCC). Cancer Staging Manual: Continuing to build a bridge from a population-based to a more “personalized” approach to cancer staging, Springer: 2017. 1024 p.
6. Zhou X, Yang Y, Ou X, Xu T, Shen C, Hu C. Interplay of tumor spread, volume and Epstein-Barr virus DNA in nasopharyngeal carcinoma: Feasibility of an integrative risk stratification scheme. J Cancer 2018;9(22):4271-8.
7. Blanchard P, Lee AWM, Carmel A, Wai Tong N, Ma J, Chan AT, et al. Meta-analysis of chemotherapy in nasopharynx carcinoma (MAC-NPC): An update on 26 trials and 7080 patients. Clin Transl Radiat Oncol 2021;26;32:59-68.
8. Fu S, Li Y, Han Y, Wang H, Chen Y, Yan O, et al. Diffusion-weighted magnetic resonance imaging-guided dose painting in patients with locoregionally advanced nasopharyngeal carcinoma treated with induction chemotherapy plus concurrent chemoradiotherapy: A randomized, controlled clinical trial. Int J Radiat Oncol Biol Phys 2022;113(1):101-13.
9. You R, Liu YP, Huang PY, Zou X, Sun R, He YX, et al. Efficacy and safety of locoregional radiotherapy with chemotherapy vs chemotherapy alone in de novo metastatic nasopharyngeal carcinoma: A multicenter phase 3 randomized clinical trial. JAMA Oncol 2020;6(9):1345-52.
10. Mai HQ, Chen QY, Chen D, HU C, Yang K, Wen Jet al. Toripalimab or placebo plus chemotherapy as first-line treatment in advanced nasopharyngeal carcinoma: A multicenter randomized phase 3 trial. Nat Med 2021;27(9):1536-43.
11. Yang Y, Qu S, Li J, Hu C, Xu M, Li W, et al. Camrelizumab versus placebo in combination with gemcitabine and cisplatin as first-line treatment for recurrent or metastatic nasopharyngeal carcinoma (CAPTAIN-1st): A multicentre, randomised, double-blind, phase 3 trial. Lancet Oncol 2021;22(8):1162-74.
12. Chong WQ, Lim CM, Sinha AK, Tan CS, Chan GHJ, Huang Y et al. Integration of antiangiogenic therapy with cisplatin and gemcitabine chemotherapy in patients with nasopharyngeal carcinoma. Clin Cancer Res 2020;26(20):5320-8.
13. Xu JY, Wei XL, Wang YQ, Wang FH. Current status and advances of immunotherapy in nasopharyngeal carcinoma. Ther Adv Med Oncol 2022;14:17588359221096214.
Dans cet article
- Épidémiologie, classifications et pronostic
- La radiothérapie, base du traitement curatif des CNP localisés
- Malgré une guérison fréquente, un suivi étroit s’impose
- Stratégies multimodales de la prise en charge à la phase métastatique
- Des perspectives thérapeutiques avec les antiangiogéniques et autour du virus d’Epstein-Barr

 Encadrés
Encadrés