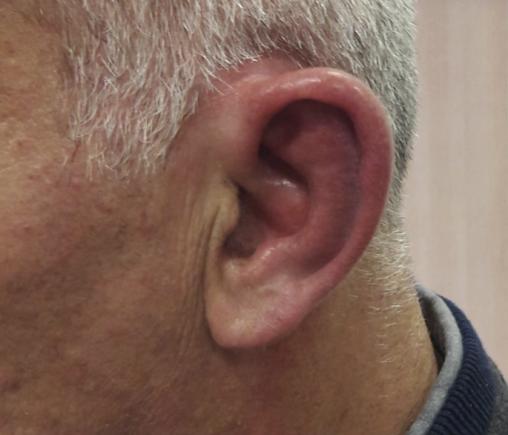
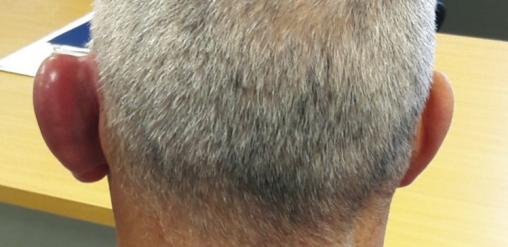
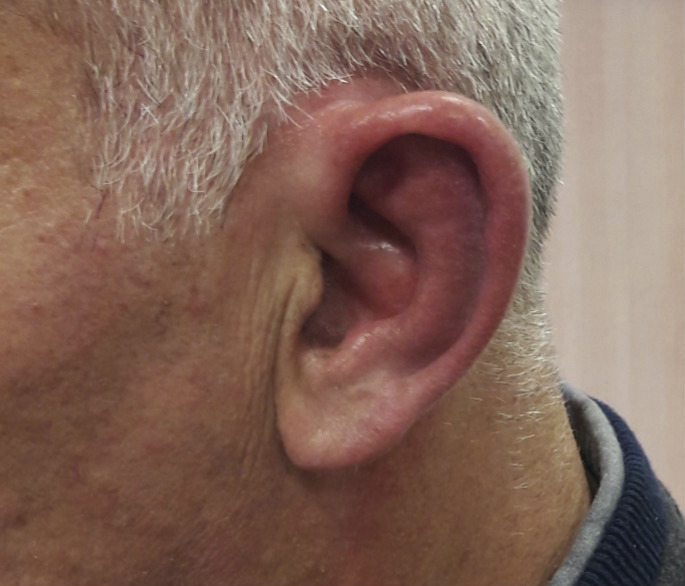
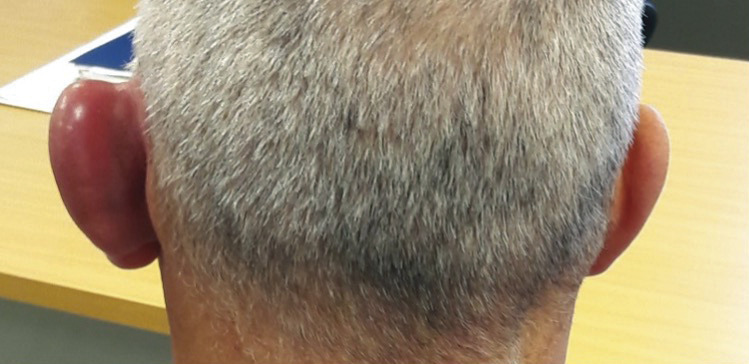
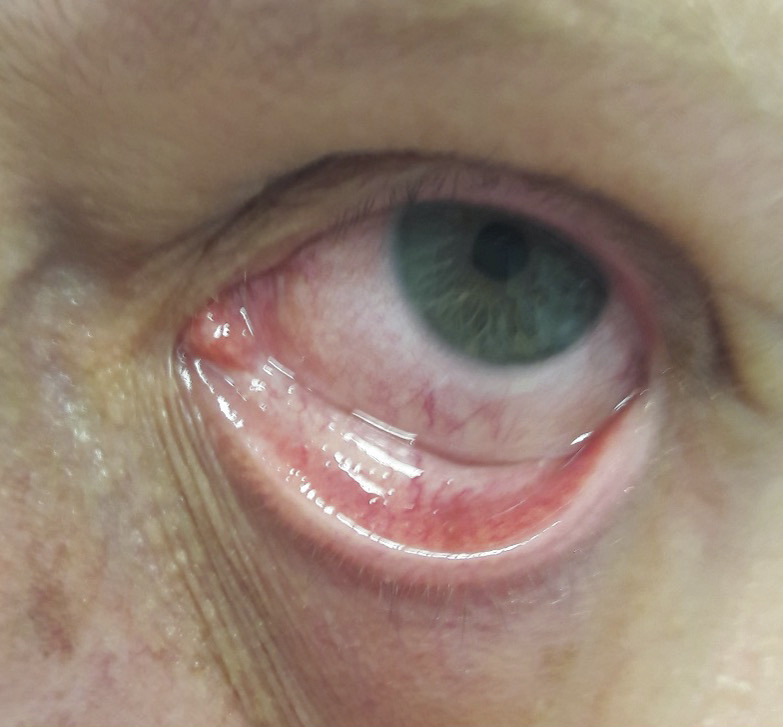
Un homme de 53 ans consulte pour une otalgie gauche associée à un décollement du pavillon de l’oreille depuis quarante-huit heures (
À l’examen, on note une tuméfaction rouge, chaude et très douloureuse du pavillon, épargnant le lobe non cartilagineux de l’oreille.
Le patient est apyrétique, et l’examen cardiopulmonaire est sans particularités. Le conduit auditif externe ainsi que le tympan sont normaux, sans baisse d’acuité auditive.
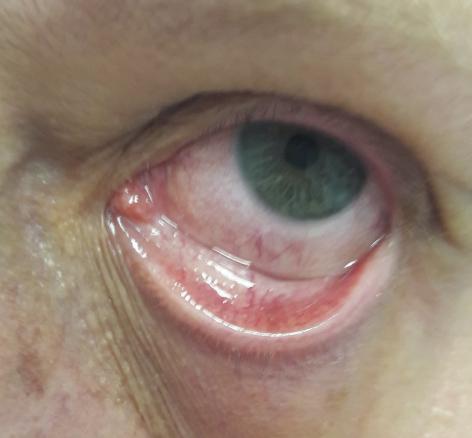
L’examen ophtalmologique est normal (vitré clair, pas d’hypertension intraoculaire, pôles antérieur et postérieur sans particularités), hormis une épisclérite associée à un chémosis inflammatoire en inférieur (
L’anamnèse ne révèle aucun antécédent médical ou chirurgical ni aucun traitement, voyage récent ou traumatisme du conduit.
Le bilan biologique est sans anomalie (glycémie normale et absence de déficit en glucose-6-phosphate déshydrogénase [G6PD]).
La nature des lésions fait évoquer une chondrite auriculaire associée à une épisclérite. L’association de la symptomatologie auriculaire et ophtalmologique permet de retenir un diagnostic de polychrondrite atrophiante.
Le patient a d’abord été traité par corticothérapie, mais devant l’apparition de nouvelles poussées sous 30 mg de solupred par jour, un traitement par dapsone est instauré. Après deux ans, le patient n’a pas eu de nouvelle poussée inflammatoire.
La surveilla
La chondrite du pavillon de l’oreille se manifeste par une tuméfaction uni- ou bilatérale, chaude, rouge et douloureuse. Toute la partie cartilagineuse de l’oreille peut être atteinte. En revanche, le lobe, non cartilagineux, est toujours respecté, ce qui différencie la chondrite d’une atteinte infectieuse. La périchondrite est, quant à elle, une infection du derme et du périchondre auriculaire se développant le plus souvent à la suite d’un traumatisme externe.
La chondrite du pavillon de l’oreille est l’atteinte la plus spécifique (85 %) de la polychondrite atrophiante (PCA).1 Cette connectivite rare (3,5 cas par million d’habitants) est caractérisée par l’inflammation récidivante de certaines structures cartilagineuses associées à des manifestations systémiques variées. Ces chondrites évoluent en deux phases : une ou plusieurs poussées inflammatoires, puis, dans certains cas, la survenue d’une atrophie définitive des pièces cartilagineuses.1
Le diagnostic est essentiellement clinique : critères diagnostiques de McAdam* et de Damiani et Levine**.
La chondrite auriculaire peut être uni- ou bilatérale, aiguë ou subaiguë. L’inflammation persiste quelques jours, voire quelques semaines, puis régresse spontanément pour réapparaître avec une fréquence et une gravité variables. Un rétrécissement du conduit auditif externe peut être observé, à l’origine d’une diminution de l’acuité auditive. Au stade d’atrophie, le pavillon prend un aspect anormalement lisse, voire flasque, lié à la disparition du relief cartilagineux normal.2
La chondrite nasale (65 % des cas) fait apparaître, au stade aigu, une tuméfaction nasale inflammatoire. Le stade d’atrophie, qui peut lui succéder ou survenir d’emblée sans inflammation préalable, entraîne une déformation acquise et définitive dite « en selle » résultant de l’effondrement de la cloison cartilagineuse.3
L’atteinte respiratoire de la PCA (20 à 50 % selon les séries) fait toute la gravité de la maladie. Elle peut parfois être la seule manifestation de la maladie et peut évoluer vers une insuffisance respiratoire chronique obstructive. L’atteinte de l’arbre respiratoire est souvent diffuse.2 Les chondrites du larynx et de la trachée s’accompagnent quasi constamment de signes cliniques. Le collapsus trachéal peut être brutal et entraîner un arrêt respiratoire mortel. L’atteinte des cartilages du larynx se traduit par des douleurs spontanées ou provoquées par la palpation, et surtout par une voix rauque ou une extinction de voix, qui ne doivent pas être banalisées.
Les chondrites des cartilages costaux (35 % des cas) provoquent des douleurs souvent responsables d’errance diagnostique ; l’atteinte articulaire est très fréquente (52 à 85 %).
Des atteintes oculaires (surtout sclérite et épisclérite), cardiaques (rares : valvulaires ou ectasie de l’aorte ascendante) et neurologiques sont également possibles.
Sur le plan biologique, une hyperleucocytose et une anémie inflammatoire sont souvent présentes. Aucun marqueur immunologique spécifique n’est connu.
Le scanner thoracique et les explorations fonctionnelles respiratoires (EFR) permettent d’évaluer l’atteinte respiratoire, la tomographie par émission de positons peut confirmer l’hypermétabolisme des zones cartilagineuses et permettre un suivi plus précis de la maladie.4
L’objectif du traitement est de limiter l’inflammation et la survenue de complications. La prise en charge de la maladie comprend deux volets :
le traitement des poussées, variable selon le type d’atteinte et le pronostic. Il peut être purement symptomatique (anti-inflammatoires non stéroïdiens et antalgiques) ou faire appel à une corticothérapie éventuellement associée aux immunosuppresseurs (méthotrexate [en prise hebdomadaire], azathioprine, mycophénolate mofétil [ou acide mycophénolique], cyclophosphamide intraveineux, léflunomide, plus rarement ciclosporine) ;4
un traitement de fond pour certains patients afin de réduire la fréquence et la sévérité des poussées, prévenir les séquelles et/ou réduire le besoin en corticoïdes. Il se discute au cas par cas en fonction des symptômes, de l’évolution, des comorbidités, des séquelles et du pronostic de la maladie. La dapsone (contre-indiquée en cas de déficit en G6PD, qu’il convient de rechercher avant de débuter le traitement),4 dispose d’une autorisation de mise sur le marché (AMM) comme traitement de fond, mais son introduction n’est pas recommandée par les auteurs du Protocole national de diagnostic et de soins de 2021.4 - le traitement des poussées, variable selon le type d’atteinte et le pronostic. Il peut être purement symptomatique (anti-inflammatoires non stéroïdiens et antalgiques) ou faire appel à une corticothérapie éventuellement associée aux immunosuppresseurs (méthotrexate [en prise hebdomadaire], azathioprine, mycophénolate mofétil [ou acide mycophénolique], cyclophosphamide intraveineux, léflunomide, plus rarement ciclosporine) ;4
- un traitement de fond pour certains patients afin de réduire la fréquence et la sévérité des poussées, prévenir les séquelles et/ou réduire le besoin en corticoïdes. Il se discute au cas par cas en fonction des symptômes, de l’évolution, des comorbidités, des séquelles et du pronostic de la maladie. La dapsone (contre-indiquée en cas de déficit en G6PD, qu’il convient de rechercher avant de débuter le traitement),4 dispose d’une autorisation de mise sur le marché (AMM) comme traitement de fond, mais son introduction n’est pas recommandée par les auteurs du Protocole national de diagnostic et de soins de 2021.4
Plusieurs thérapies ciblées, comme les anti-TNF-α et anti-IL-6, ayant une AMM pour les rhumatismes inflammatoires, ont été testées, révélant une efficacité variable et transitoire.4
La pratique de gestes locaux (trachéotomie, stent trachéobronchique ou artériel, chirurgie valvulaire ou artérielle) se discute parfois en centre spécialisé.5
La prise en charge est nécessairement multidisciplinaire (rhumatologue, pneumologue, ophtalmologue, cardiologue, chirurgien ORL ou cardiovasculaire et psychologue…) et coordonnée par un service de médecine interne habitué à la prise en charge des maladies rares inflammatoires.3
La régularité du suivi en consultation spécialisée hospitalière permet, entre autres, la prise en charge précoce des poussées. Pour les formes graves, une demande de prise en charge en affection de longue durée (ALD) est établie par le médecin traitant.
*
<?unsupported-grep character-style=CharacterStyle/References%3areferences numero_OK?>1. Michet CJ, McKenna CH, Luthra HS, et al. Relapsing polychondritis. Survival and <?unsupported-grep character-style=CharacterStyle/References%3areferences numero_OK?>predictive role of early disease manifestations. Ann Intern Med 1986;104(1):74-8<?unsupported-grep character-style=CharacterStyle/References%3areferences numero_OK?>.
<?unsupported-grep character-style=CharacterStyle/References%3areferences numero_OK?>2<?unsupported-grep character-style=CharacterStyle/References%3areferences numero_OK?>. Arlettaz L, Ribi C. La polychondrite atrophiante. Rev Med Suisse 2010<?unsupported-grep character-style=CharacterStyle/References%3areferences numero_OK?>;6(245):830-4.
<?unsupported-grep character-style=CharacterStyle/References%3areferences numero_OK?>3.<?unsupported-grep character-style=CharacterStyle/References%3areferences numero_OK?> Papo T. Polychondrite atrophiante. EMC Traité de médecine Akos 2015;10(2):1-5.
<?unsupported-grep character-style=CharacterStyle/References%3areferences numero_OK?>4. Haute Autorité de santé. Protocole national de diagnostic et de soins. Polychondrite chronique atrophiante, 2021. Disponible sur <?unsupported-grep character-style=CharacterStyle/References%3areferences numero_OK?>https://bit.ly/3Q8K38V
<?unsupported-grep character-style=CharacterStyle/References%3areferences numero_OK?>5. <?unsupported-grep character-style=CharacterStyle/References%3areferences numero_OK?>Dion J, Leroux G, Mouthon L, et al. Polychondrite atrophiante : actualités en 2017<?unsupported-grep character-style=CharacterStyle/References%3areferences numero_OK?>. Rev Med Interne 2018;39(6):400-7.
Une question, un commentaire ?