Le diabète de type 1 résulte de la destruction des cellules insulinosécrétrices (cellules β) des îlots de Langerhans du pancréas par le système immunitaire. Dans le pancréas, cette destruction est spécifique des cellules β, elle ne concerne pas les cellules α (glucagon) ni les autres cellules endocrines du pancréas, elle ne concerne pas le pancréas exocrine. Cette maladie du système immunitaire peut ne concerner que les cellules β du pancréas, ou s’étendre à d’autres organes, principalement la thyroïde (maladie de Basedow, thyroïdite de Hashimoto), l’estomac (gastrite atrophique), l’intestin grêle (maladie cœliaque) et la peau (vitiligo), dans le contexte alors de la polyendocrino- pathie auto-immune de type 2.
Épidémiologie : importance des facteurs d’environnement
On estime que le diabète de type 1 représente un peu moins de 10 % des cas de diabète. Il peut se révéler à tout âge ; la moitié des cas surviennent avant la puberté, avec un pic entre 4 ans et la puberté, mais le diabète de type 1 peut aussi débuter après 60 ans et jusqu’à plus de 90 ans. À la différence de la plupart des maladies auto-immunes, le diabète de type 1 est légèrement plus fréquent chez les garçons que chez les filles. La maladie est beaucoup plus fréquente au nord de l’Europe qu’au sud, avec un record d’incidence en Finlande, plus de 60 nouveaux cas pour 100 000 individus par an chez l’enfant ; elle est rare en Asie et en Afrique, avec une incidence de 0,1 cas pour 100 000 par an.1 Mais les migrants des régions de faible prévalence acquièrent rapidement le risque des populations d’accueil. À l’intérieur de l’Europe, des anomalies sont frappantes : l’incidence du diabète est beaucoup plus faible en Russie ou dans les pays baltes qu’en Finlande, elle est élevée en Sardaigne. Les dernières décennies ont vu une augmentation considérable de l’incidence chez l’enfant, augmentation de l’ordre de 2 à 3 % par an, et l’apparition de cette maladie chez des enfants plus jeunes et dont le terrain génétique est moins caractéristique.2 Toutes ces données soulignent l’importance des facteurs d’environnement dans le déterminisme de la maladie.
Présentation clinique
Le diabète de type 1 rend compte de la majorité des cas de diabète insulinodépendant, c’est-à-dire des diabètes dont l’histoire naturelle conduit à une carence absolue en insuline et à l’acidocétose. Mais cette dernière n’est pas l’apanage du seul diabète de type 1.3
Dans sa présentation habituelle, la symptomatologie débute par un syndrome polyuro-polydipsique, témoignant d’une hyperglycémie franche, à laquelle se joignent les signes de carence en insuline : amaigrissement malgré une polyphagie, réalisant le syndrome cardinal. Chez l’enfant s’écoulent en moyenne quatre semaines entre les premiers signes et l’acidocétose, qui est le mode d’entrée habituel dans la maladie. Chez l’adulte, l’évolution est plus lente, les symptômes de l’hyperglycémie moins francs, les signes de carence en insuline moins marqués, l’acidocétose est moins fréquente, et les adultes gardent souvent une insulinosécrétion résiduelle, suggérant un processus d’installation plus lent.4 La maladie peut s’installer encore plus insidieusement chez un adulte, parfois obèse, et être alors prise pour un diabète de type 2 et traité comme tel,5 ce qui peut conduire à des prises en charge inadéquates, avec en particulier un retard à l’instauration de l’insuline. Cette forme, le latent autoimmunediabetes in adults (LADA), est aussi appelée diabète de type 1 « lent » ou diabète de type 1 s’avançant sous un masque de diabète de type 2.6 À l’extrême, des complications rétiniennes peuvent être présentes d’emblée, témoignant d’un retard au diagnostic. La grossesse peut aussi être le moment de révélation d’un diabète de type 1, avec des conséquences parfois dramatiques.7
Dans sa présentation habituelle, la symptomatologie débute par un syndrome polyuro-polydipsique, témoignant d’une hyperglycémie franche, à laquelle se joignent les signes de carence en insuline : amaigrissement malgré une polyphagie, réalisant le syndrome cardinal. Chez l’enfant s’écoulent en moyenne quatre semaines entre les premiers signes et l’acidocétose, qui est le mode d’entrée habituel dans la maladie. Chez l’adulte, l’évolution est plus lente, les symptômes de l’hyperglycémie moins francs, les signes de carence en insuline moins marqués, l’acidocétose est moins fréquente, et les adultes gardent souvent une insulinosécrétion résiduelle, suggérant un processus d’installation plus lent.4 La maladie peut s’installer encore plus insidieusement chez un adulte, parfois obèse, et être alors prise pour un diabète de type 2 et traité comme tel,5 ce qui peut conduire à des prises en charge inadéquates, avec en particulier un retard à l’instauration de l’insuline. Cette forme, le latent autoimmunediabetes in adults (LADA), est aussi appelée diabète de type 1 « lent » ou diabète de type 1 s’avançant sous un masque de diabète de type 2.6 À l’extrême, des complications rétiniennes peuvent être présentes d’emblée, témoignant d’un retard au diagnostic. La grossesse peut aussi être le moment de révélation d’un diabète de type 1, avec des conséquences parfois dramatiques.7
Formes cliniques, diagnostic différentiel
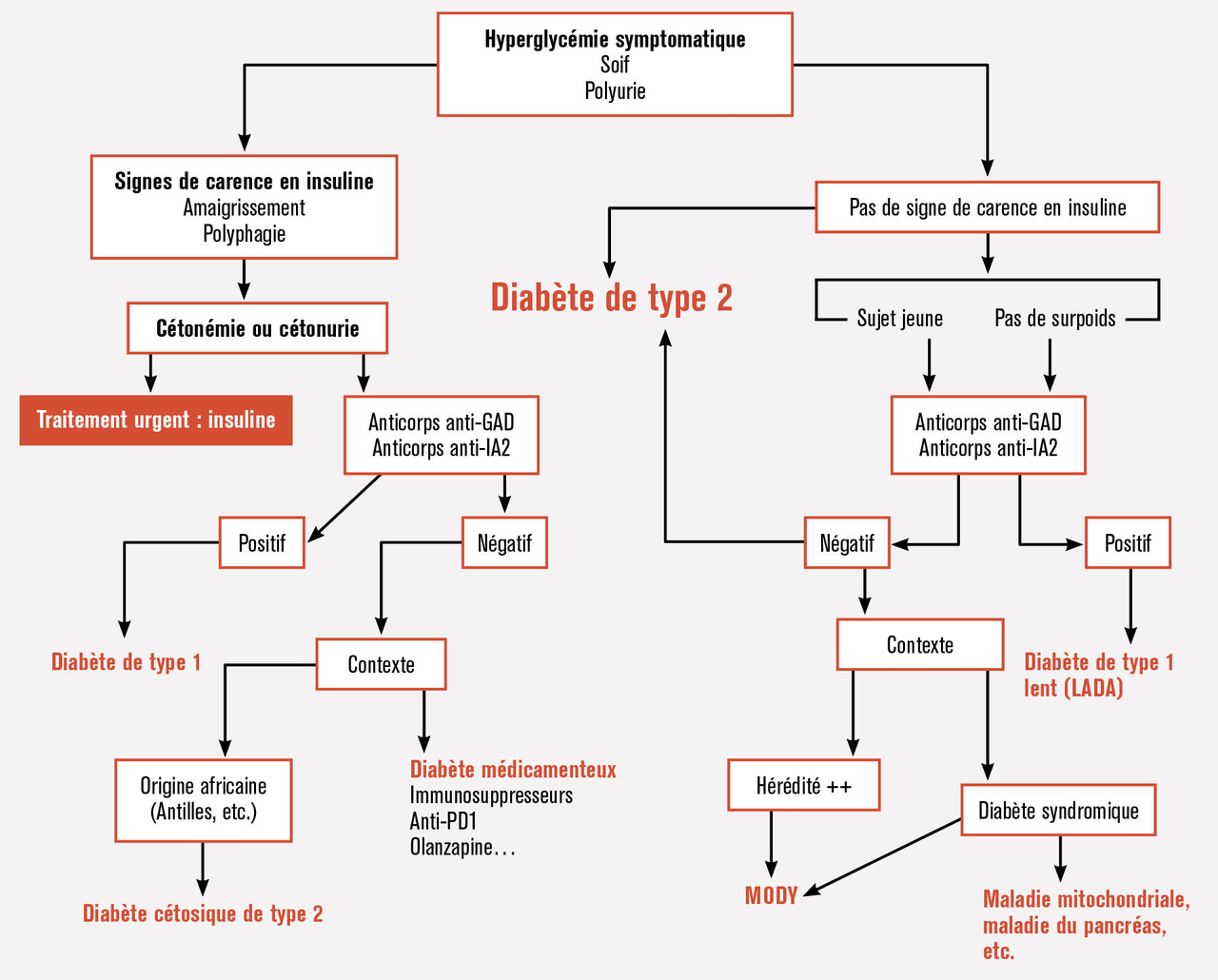
Il est important devant un patient, quelle que soit la présentation initiale, avec ou sans acidocétose, avec ou sans signes de carence en insuline, de pouvoir affirmer de manière positive le diagnostic de diabète de type 1, et exclure ainsi d’autres causes de diabète (v. figure). Si le National Institute for Health and Care Excellence (NICE) ne recommande* la recherche systématique des anticorps qu’en présence d’atypie, il nous semble important de documenter aussi souvent que possible le diag- nostic initial par la recherche des anticorps spécifiques, anti-GAD (anti-glutamic acid decarboxylase) et anti-IA2 (les anticorps anti-IA2 sont dirigés contre une phosphatase membranaire des cellules β). La négativation fréquente possible de ces anticorps après quelques années d’évolution de la maladie clinique rend le diagnostic de certitude rétrospectif plus aléatoire. L’absence d’anticorps lors du diagnostic peut amener à discuter d’autres types de diabète, tels les diabètes monogéniques dont la présentation clinique initiale peut être proche. De plus, affirmer la maladie auto-immune permet de dépister d’autres maladies fréquemment associées, potentiellement graves, par exemple la maladie cœliaque.
Diabète de type 1 avec maladie auto-immune associée
Dans environ 10 % des cas, le diabète de type 1 s’inscrit dans le cadre d’une maladie auto-immune plus large. À la différence du diabète de type 1 isolé, il y a une nette prédominance de femmes, avec un rapport de 3/1 dans la polyendocrinopathie. L’incidence est maximale dans la troisième ou quatrième décennie. Dans près de la moitié des cas, le diabète est la première manifestation de polyendocrinopathie. La maladie de Basedow et la thyroïdite de Hashimoto sont la première maladie dans près de 20 % des cas chacune.8 On doit souligner l’importance du diagnostic précoce de la maladie cœliaque qui, outre ses propres complications, est source de grandes difficultés pour la gestion du diabète, aussi bien avant le diagnostic de maladie cœliaque (hypoglycémies fréquentes, sévères) qu’après celui-ci (contraintes du régime). La maladie d’Addison doit être évoquée lorsqu’apparaissent les signes cliniques et biologiques, chez tout patient perdant du poids de manière inexpliquée ou qui a une asthénie inhabituelle et/ou des hypoglycémies itératives malgré la réduction des doses d’insuline (on cherchera alors à la fois la maladie cœliaque et la maladie d’Addison).
Diabète de type 1 sans auto-anticorps
Le diabète de type 1 sans auto-anticorps aussi appelé « idiopathique » est une entité mal définie.
On ne peut parler de diabète de type 1 sans auto- anticorps qu’au moment du diagnostic de diabète, car il est habituel que les auto-anticorps disparaissent pendant la phase clinique de la maladie.9 Ainsi, chez un patient vu pour la première fois plus de 10 ans après le diagnostic, seule la présence d’anticorps permet d’affirmer rétro- spectivement le diagnostic de diabète de type 1, son absence ne permet pas de conclure.
On a longtemps assimilé le diabète de type 1 idiopathique à ce qu’on appelle aujourd’hui le diabète de type 2 à tendance cétosique (v. infra).
Enfin, on a longtemps porté par excès le diagnostic de type 1 chez tous les individus déclarant un diabète, avec ou sans cétose, pendant l’enfance. Les connaissances actuelles permettent de reclasser certains de ces diabètes en diabète monogénique ou maturity onset diabetes of the young (MODY), ce qui permet de rectifier le diagnostic, et parfois le traitement, certains de ces diabètes pouvant être traités par sulfonylurée ; c’est dire l’importance d’un diagnostic précis dès la découverte du diabète, les formes sans anticorps devant attirer l’attention du clinicien.10 D’autres formes de diabète où la carence en insuline est profonde ne doivent, de même, pas être confondues avec le diabète de type 1 ; c’est le cas de la pancréatite chronique, dans sa forme idiopathique ou dans une forme auto-immune, lorsque la séquence habituelle avec poussées de pancréatite aiguë n’a pas eu lieu, ou des diabètes par dysfonction mitochondriale. Dans ces cas, ce sont le contexte syndromique et/ou les signes de la malabsorption digestive qui doivent rectifier le diagnostic.
On ne peut parler de diabète de type 1 sans auto- anticorps qu’au moment du diagnostic de diabète, car il est habituel que les auto-anticorps disparaissent pendant la phase clinique de la maladie.9 Ainsi, chez un patient vu pour la première fois plus de 10 ans après le diagnostic, seule la présence d’anticorps permet d’affirmer rétro- spectivement le diagnostic de diabète de type 1, son absence ne permet pas de conclure.
On a longtemps assimilé le diabète de type 1 idiopathique à ce qu’on appelle aujourd’hui le diabète de type 2 à tendance cétosique (v. infra).
Enfin, on a longtemps porté par excès le diagnostic de type 1 chez tous les individus déclarant un diabète, avec ou sans cétose, pendant l’enfance. Les connaissances actuelles permettent de reclasser certains de ces diabètes en diabète monogénique ou maturity onset diabetes of the young (MODY), ce qui permet de rectifier le diagnostic, et parfois le traitement, certains de ces diabètes pouvant être traités par sulfonylurée ; c’est dire l’importance d’un diagnostic précis dès la découverte du diabète, les formes sans anticorps devant attirer l’attention du clinicien.10 D’autres formes de diabète où la carence en insuline est profonde ne doivent, de même, pas être confondues avec le diabète de type 1 ; c’est le cas de la pancréatite chronique, dans sa forme idiopathique ou dans une forme auto-immune, lorsque la séquence habituelle avec poussées de pancréatite aiguë n’a pas eu lieu, ou des diabètes par dysfonction mitochondriale. Dans ces cas, ce sont le contexte syndromique et/ou les signes de la malabsorption digestive qui doivent rectifier le diagnostic.
Diabète de type 1 à marche lente
Lorsque le diabète de type 1 débute à l’âge adulte, la perte de sécrétion de l’insuline peut s’installer très progressivement, la maladie pouvant alors débuter par une hyperglycémie très modérée, qui va évoluer progressivement, plus ou moins vite, vers une carence en insuline. Lors du diagnostic, la maladie est alors souvent prise pour un diabète de type 2. Le diagnostic peut être rectifié par la découverte des auto-anticorps associés au diabète de type 1, plus souvent les anti-GAD que les autres auto- anticorps. C’est ce qu’on appelle le diabète auto-immun latent de l’adulte (LADA) ou diabète de type 1 à marche lente. Sans qu’il y ait de réel consensus, c’est un diagnostic que l’on porte généralement chez des individus âgés de plus de 30 ans au diagnostic et n’ayant pas besoin d’insuline pour contrôler les glycémies pendant au moins 6 mois.11 Ces patients ont en général une glycémie plus élevée lors du diagnostic et sont moins souvent obèses que les patients ayant un diabète de type 2. C’est de fait la présence d’auto-anticorps qui fait la différence. Cependant, dans le contexte de l’United Kingdom Prospective Diabetes Study (étude UKPDS), il a été montré que la valeur pronostique des auto-anticorps vis-à-vis du besoin d’insuline 6 ans après le diagnostic n’est bonne que pour les individus dont le diagnostic est porté à un âge jeune, et diminue avec l’âge au diagnostic.12 Il n’y a aucun argument clair en faveur de l’utilisation d’un traitement plutôt qu’un autre dans les phases précoces de la maladie, lorsqu’un traitement oral peut permettre de contrôler la maladie.
Diabète de type 2 à tendance cétosique
Depuis les années 1990, on a rapporté un nombre croissant d’épisodes d’acidocétose sans facteur déclenchant apparent chez des patients que l’on qualifie a posteriori de diabétiques de type 2 en l’absence des anticorps du diabète de type 1 et surtout au vu de la rémission prolongée de l’insulinodépendance. Cette forme de diabète pourrait concerner la moitié des patients originaires d’Afrique ou d’Asie qui ont des antécédents d’acidocétose sans les marqueurs de diabète de type 1. C’est cette forme de diabète aussi autrefois appelée diabète de type 1 idiopathique, diabète de type 1 ½ ou « flatbush diabetes » que l’on appelle maintenant diabète de type 2 à tendance cétosique. Il ne se cantonne pas aux sujets originaires d’Asie ou d’Afrique ; il a été aussi décrit, bien qu’y apparaissant plus rarement, chez des Caucasiens. Ces sujets sont profondément insulinopéniques et résistants à l’insuline pendant les épisodes aigus et récupèrent une sécrétion significative au décours, de sorte qu’à 10 ans 40 % sont toujours traités sans insuline.13 La physiopathologie de cette forme de diabète reste mystérieuse, et les causes des décompensations aiguës, parfois itératives, également. Elles sont souvent précédées d’une prise de poids et d’une réascension de l’hémoglobine glyquée (HbA1c). Pendant les périodes intercritiques, ces patients sont facilement contrôlés par la metformine et/ou de petites doses de sulfonylurées.
Diabète fulminant
Le diabète fulminant est une entité récemment décrite, initialement au Japon, de survenue spontanée, et plus récemment dans plusieurs contextes iatrogènes : complication des syndromes DRESS (drug-induced hypersensitivity syndrome ; drug reaction with eosinophilia and systemic symptoms) et des immunothérapies anticancéreuses. Ce diabète est appelé fulminant à cause de la brutalité de son installation, hyperglycémie majeure et acidocétose sévère après quelques jours seulement d’hyperglycémie, ce dont témoigne la quasi-normalité de l’HbA1c lors du diag- nostic. Il s’agit d’une forme particulièrement grave de la maladie, d’autant plus qu’elle survient dans sa forme spontanée fréquemment pendant une grossesse, avec des risques mortels tant pour la mère que pour le fœtus.
La Société japonaise de diabétologie a établi des critères de diabète fulminant :14
– survenue d’une cétose ou acidocétose diabétique peu de temps (habituellement 7 jours) après l’installation d’une polyurie ;
– glycémie supérieure à 18 mmol/L (290 mg/dL) et HbA1c < 8,7 % au diagnostic ;
– peptide C urinaire < 10 µg/j ou peptide C plasmatique < 0,1 nmol/L avant et < 0,5 nmol/L après injection de 1 mg de glucagon ou en post-prandial.
Ces critères définissent donc un diabète insulinoprive d’installation très brutale, attesté par la relative normalité de l’HbA1c au diagnostic ; l’HbA1c étant en moyenne à 6,8 % au moment du diagnostic dans les séries japonaises.
À ces critères s’ajoutent des observations habituelles dans cette forme de diabète :
– absence des anticorps associés au diabète de type 1 : anti-GAD, anti-IA2, anti-insuline ;
– durée des symptômes avant le diagnostic plus longue, de 1 à 2 semaines ;
– élévation des enzymes pancréatiques, amylase, lipase ou élastase-1 dans 98 % des cas ;
– symptômes grippaux ou gastro-intestinaux avant l’installation de la maladie dans 70 % des cas ;
– association de la maladie à la grossesse et au post-partum ;
– association de la maladie à la présence de HLA-DQB 04 :01.
Plus récemment a été décrite à de multiples reprises l’apparition de diabètes fulminants associés aux immunothérapies anticancéreuses : anti-PD1 seul ou en association avec des anticorps anti-CTLA4, dans certains cas associés à une séroconversion pour les anticorps anti- GAD. Plusieurs cas de diabète fulminant ont été rap- portés en complication du syndrome DRESS avec une prévalence estimée à 5 cas dans une série récente de 145 patients ayant un diabète fulminant.15
Cependant, dans sa forme spontanée, en dehors de très exceptionnels cas chez des sujets caucasiens, et en dehors des diabètes fulminants iatrogènes, tous les cas spontanés ont été décrits chez des sujets originaires de l’Extrême-Orient et de l’Asie du Sud-Est (Japon, Chine, Corée, Philippines, Vietnam, Thaïlande).
La Société japonaise de diabétologie a établi des critères de diabète fulminant :14
– survenue d’une cétose ou acidocétose diabétique peu de temps (habituellement 7 jours) après l’installation d’une polyurie ;
– glycémie supérieure à 18 mmol/L (290 mg/dL) et HbA1c < 8,7 % au diagnostic ;
– peptide C urinaire < 10 µg/j ou peptide C plasmatique < 0,1 nmol/L avant et < 0,5 nmol/L après injection de 1 mg de glucagon ou en post-prandial.
Ces critères définissent donc un diabète insulinoprive d’installation très brutale, attesté par la relative normalité de l’HbA1c au diagnostic ; l’HbA1c étant en moyenne à 6,8 % au moment du diagnostic dans les séries japonaises.
À ces critères s’ajoutent des observations habituelles dans cette forme de diabète :
– absence des anticorps associés au diabète de type 1 : anti-GAD, anti-IA2, anti-insuline ;
– durée des symptômes avant le diagnostic plus longue, de 1 à 2 semaines ;
– élévation des enzymes pancréatiques, amylase, lipase ou élastase-1 dans 98 % des cas ;
– symptômes grippaux ou gastro-intestinaux avant l’installation de la maladie dans 70 % des cas ;
– association de la maladie à la grossesse et au post-partum ;
– association de la maladie à la présence de HLA-DQB 04 :01.
Plus récemment a été décrite à de multiples reprises l’apparition de diabètes fulminants associés aux immunothérapies anticancéreuses : anti-PD1 seul ou en association avec des anticorps anti-CTLA4, dans certains cas associés à une séroconversion pour les anticorps anti- GAD. Plusieurs cas de diabète fulminant ont été rap- portés en complication du syndrome DRESS avec une prévalence estimée à 5 cas dans une série récente de 145 patients ayant un diabète fulminant.15
Cependant, dans sa forme spontanée, en dehors de très exceptionnels cas chez des sujets caucasiens, et en dehors des diabètes fulminants iatrogènes, tous les cas spontanés ont été décrits chez des sujets originaires de l’Extrême-Orient et de l’Asie du Sud-Est (Japon, Chine, Corée, Philippines, Vietnam, Thaïlande).
Cétose et acidocétose en dehors du diabète de type 1
L’acidocétose n’est pas l’apanage du diabète de type 1. Des acidocétoses normoglycémiques peuvent s’observer en dehors du diabète : l’acidocétose alcoolique et de très rares acidocétoses sous régime cétogène (Atkins) ou au cours de la grossesse et de l’allaitement.
Cependant, toute forme de diabète peut se compliquer d’acidocétose, c’est le cas en particulier du diabète de type 2 cétosique, on l’a vu, mais toute situation de stress majeur (infarctus du myocarde, chirurgie, etc.) est susceptible de décompenser tout type de diabète vers une acidocétose. L’acidocétose est un possible mode de révélation du diabète MODY par mutation du gène HNF1-α. Enfin, les médicaments de la classe des inhibiteurs du cotransporteur de sodium-glucose de type 2 (SGLT2), qui pourraient arriver très prochainement en France, dont le mécanisme d’action essentiel est l’inhibition de la réabsorption du glucose par le tubule contourné proximal du rein, ont été récemment la cause d’un nombre important d’acidocétoses chez des patients diabétiques de type 2, souvent traités par l’insuline. Il est probable qu’il s’agisse de la conséquence d’une stimulation de la sécrétion de glucagon, effet direct de ces médicaments sur les cellules α du pancréas endocrine.
À l’inverse, l’acidocétose est rare chez les patients qui ont un diabète insulinodépendant dans le contexte d’une pancréatite chronique, les décompensations aiguës se faisant plus souvent sur le mode hyperosmolaire, probablement par défaut de sécrétion du glucagon.
Cependant, toute forme de diabète peut se compliquer d’acidocétose, c’est le cas en particulier du diabète de type 2 cétosique, on l’a vu, mais toute situation de stress majeur (infarctus du myocarde, chirurgie, etc.) est susceptible de décompenser tout type de diabète vers une acidocétose. L’acidocétose est un possible mode de révélation du diabète MODY par mutation du gène HNF1-α. Enfin, les médicaments de la classe des inhibiteurs du cotransporteur de sodium-glucose de type 2 (SGLT2), qui pourraient arriver très prochainement en France, dont le mécanisme d’action essentiel est l’inhibition de la réabsorption du glucose par le tubule contourné proximal du rein, ont été récemment la cause d’un nombre important d’acidocétoses chez des patients diabétiques de type 2, souvent traités par l’insuline. Il est probable qu’il s’agisse de la conséquence d’une stimulation de la sécrétion de glucagon, effet direct de ces médicaments sur les cellules α du pancréas endocrine.
À l’inverse, l’acidocétose est rare chez les patients qui ont un diabète insulinodépendant dans le contexte d’une pancréatite chronique, les décompensations aiguës se faisant plus souvent sur le mode hyperosmolaire, probablement par défaut de sécrétion du glucagon.
Références
1. David M Maahs, Nancy A West, Jean M. Lawrence, Mayer-Davis EJ. Epidemiology of type 1 diabetes. Endocrinol Metab Clin North Am 2010;39:481-97.
2. Atkinson MA, Eisenbarth GS, Michels AW. Type 1 diabetes. Lancet 2014;383:69-82.
3. Larger E, Lemoine A, Samaké M, Koubar S, Faucher P. Actualités sur la cétoacidose. J Eur Urg Reanim 2013;25 :163-9. doi:10.1016/j.jeurea.2013.07.001.
4. Karjalainen J, Salmela P, Ilonen J, et al. A comparison of childhood and adult type I diabetes mellitus. N Engl J Med 1989;320:881-6.
5. Chiang JL, Kirkman MS, Laffel LMB, Peters AL. Type 1 diabetes through the life span: A position statement of the American Diabetes Association. Diabetes Care 2014;37:2034-54.
6. Leslie RD, Pozzilli P. Type I diabetes masquerading as type II diabetes. Possible implications for prevention and treatment. Diabetes Care 1994;17:1214-9.
7. Wucher H, Lepercq J, Carette C, et al. Poor prognosis of pregnancy in women with autoimmune type 1 diabetes mellitus masquerading as gestational diabetes. Diabetes Metab 2011;37:47-51.
8. Hansen MP, Matheis N, Kahaly GJ. Type 1 diabetes and polyglandular autoimmune syndrome: A review. World J Diabetes 2015;6:67-79.
9. Wilmot-Roussel H, Lévy DJ, Carette C, et al. Factors associated with the presence of glutamic acid decarboxylase and islet antigen-2 autoantibodies in patients with long-standing type 1 diabetes. Diabetes Metab 2013;39:244-9.
10. Timsit J, Saint-Martin C, Dubois-Laforgue D, Bellanné-Chantelot C. Searching for Maturity-Onset Diabetes of the Young (MODY): When and what for? Can J Diabetes 2016;40:455-61.
11. Østergaard JA, Laugesen E, Leslie RD. Should there be concern about autoimmune diabetes in adults? Current evidence and controversies. Curr Diab Rep 2016;16:82.
12. Turner R, Stratton I, Horton V, et al. UKPDS 25: Autoantibodies to islet-cell cytoplasm and glutamic acid decarboxylase for prediction of insulin requirement in type 2 diabetes. Lancet 1997;350:1288-93.
13. Mauvais-Jarvis F, Sobngwi E, Porcher R, et al. Ketosis-prone type 2 diabetes in patients of sub-saharian african origin: clinical pathophysiology and natural history of beta-cell dysfunction and insulin resistance. Diabetes 2004;53:645-53.
14. Imagawa A, Hanafusa T, Awata T, et al. Report of the Committee of the Japan Diabetes Society on the research of fulminant and acute-onset type 1 diabetes mellitus: New diagnostic criteria of fulminant type 1 diabetes mellitus (2012). J Diabetes Investig 2012;3:536-9.
15. Kano Y, Tohyama M, Aihara M, et al. Sequelae in 145 patients with drug-induced hypersensitivity syndrome/drug reaction with eosinophilia and systemic symptoms: Survey conducted by the Asian Research Committee on Severe Cutaneous Adverse Reactions (ASCAR). J Dermatol 2015;42:276-82
2. Atkinson MA, Eisenbarth GS, Michels AW. Type 1 diabetes. Lancet 2014;383:69-82.
3. Larger E, Lemoine A, Samaké M, Koubar S, Faucher P. Actualités sur la cétoacidose. J Eur Urg Reanim 2013;25 :163-9. doi:10.1016/j.jeurea.2013.07.001.
4. Karjalainen J, Salmela P, Ilonen J, et al. A comparison of childhood and adult type I diabetes mellitus. N Engl J Med 1989;320:881-6.
5. Chiang JL, Kirkman MS, Laffel LMB, Peters AL. Type 1 diabetes through the life span: A position statement of the American Diabetes Association. Diabetes Care 2014;37:2034-54.
6. Leslie RD, Pozzilli P. Type I diabetes masquerading as type II diabetes. Possible implications for prevention and treatment. Diabetes Care 1994;17:1214-9.
7. Wucher H, Lepercq J, Carette C, et al. Poor prognosis of pregnancy in women with autoimmune type 1 diabetes mellitus masquerading as gestational diabetes. Diabetes Metab 2011;37:47-51.
8. Hansen MP, Matheis N, Kahaly GJ. Type 1 diabetes and polyglandular autoimmune syndrome: A review. World J Diabetes 2015;6:67-79.
9. Wilmot-Roussel H, Lévy DJ, Carette C, et al. Factors associated with the presence of glutamic acid decarboxylase and islet antigen-2 autoantibodies in patients with long-standing type 1 diabetes. Diabetes Metab 2013;39:244-9.
10. Timsit J, Saint-Martin C, Dubois-Laforgue D, Bellanné-Chantelot C. Searching for Maturity-Onset Diabetes of the Young (MODY): When and what for? Can J Diabetes 2016;40:455-61.
11. Østergaard JA, Laugesen E, Leslie RD. Should there be concern about autoimmune diabetes in adults? Current evidence and controversies. Curr Diab Rep 2016;16:82.
12. Turner R, Stratton I, Horton V, et al. UKPDS 25: Autoantibodies to islet-cell cytoplasm and glutamic acid decarboxylase for prediction of insulin requirement in type 2 diabetes. Lancet 1997;350:1288-93.
13. Mauvais-Jarvis F, Sobngwi E, Porcher R, et al. Ketosis-prone type 2 diabetes in patients of sub-saharian african origin: clinical pathophysiology and natural history of beta-cell dysfunction and insulin resistance. Diabetes 2004;53:645-53.
14. Imagawa A, Hanafusa T, Awata T, et al. Report of the Committee of the Japan Diabetes Society on the research of fulminant and acute-onset type 1 diabetes mellitus: New diagnostic criteria of fulminant type 1 diabetes mellitus (2012). J Diabetes Investig 2012;3:536-9.
15. Kano Y, Tohyama M, Aihara M, et al. Sequelae in 145 patients with drug-induced hypersensitivity syndrome/drug reaction with eosinophilia and systemic symptoms: Survey conducted by the Asian Research Committee on Severe Cutaneous Adverse Reactions (ASCAR). J Dermatol 2015;42:276-82