Les recommandations de prise en charge de l’insuffisance cardiaque émises en 2016 par la Société européenne de cardiologie1 ont amené à distinguer trois différentes classes d’insuffisance cardiaque selon le niveau de fraction d’éjection du ventricule gauche (FEVG) [tableau 1]. Les patients avec une FEVG inférieure à 40 % ont une insuffisance cardiaque dite à fraction d’éjection altérée, ceux avec une FEVG comprise entre 40 et 50 % ont une insuffisance cardiaque à fraction d’éjection modérément altérée, et ceux avec une FEVG supérieure à 50 % (donc dans les limites de la normale) ont une insuffisance cardiaque dite à fraction d’éjection préservée. Cette nouvelle classification a fait couler beaucoup d’encre, notamment en raison de seuils définis de manière un peu arbitraire et qui ne permettent peut-être pas de faire des distinctions très fines entre les classes. Cela est notamment vrai pour la classe intermédiaire (fraction d’éjection modérément altérée), pour lesquels la FEVG est discrètement abaissée mais qui s’apparente très probablement aux patients avec une FEVG plus basse. En clair, on pourrait peut-être simplifier en deux classes : soit la fraction d’éjection est basse (et même plus ou moins basse), soit elle est normale ! Et se pose alors la question du seuil de la normalité, car on peut se demander si 50 %, ce n’est pas déjà en fait un peu bas ? Plusieurs études de population parlent plutôt de bornes inférieures de la normalité vers 52 ou 54 %, d’autres études de 57 %.2 Et d’ailleurs, que dire aussi des valeurs supranormales (> 70 %) qui distinguent probablement des cardiopathies hyperkinétiques qui sont souvent la première manifestation de certaines cardiomyopathies génétiques comme les cardiomyopathies hypertrophiques ?2 Voici donc comment une simple proposition peut générer beaucoup de débats passionnants au sein de la communauté cardiologique. Mais ces débats ne doivent pas masquer le message le plus important : l’insuffisance cardiaque, autrefois perçue comme une maladie homogène, est devenue un syndrome hétérogène au sein duquel se distinguent plusieurs formes d’insuffisance cardiaque !
Et ceci est justifié à trois niveaux :
– d’un point de vue épidémiologique, l’insuffisance cardiaque à fraction d’éjection altérée, qui était la forme prédominante, tend à devenir moins fréquente, au profit de celle à fraction d’éjection préservée, qui est de plus en plus souvent observée suivant le vieillissement progressif des populations. Aujourd’hui, plusieurs études montrent que l’insuffisance cardiaque à fraction d’éjection altérée représente environ 45 % des formes d’insuffisance cardiaque, celle à fraction d’éjection préservée représente elle aussi 45 % des cas et la classe intermédiaire (fraction d’éjection modérément altérée) les derniers 10 %. La reconnaissance de ces différentes classes, et notamment de l’insuffisance cardiaque à fraction d’éjection préservée, est donc un message fort, qui dit que la communauté cardiologique s’est essentiellement intéressée à la moitié du problème et qu’elle doit maintenant aussi s’ouvrir aux autres formes d’insuffisance cardiaque ;
– car d’un point de vue pharmacologique, tous les traitements actuels s’adressent à l’insuffisance cardiaque à fraction d’éjection altérée et, à l’heure actuelle, il n’existe a contrario aucun traitement efficace pour celle à fraction d’éjection préservée ! De nouvelles études (
– et tout cela provient probablement d’une mauvaise perception des mécanismes physiopathologiques impliqués dans ces différentes formes d’insuffisance cardiaque. Beaucoup d’études ont montré que l’insuffisance cardiaque à fraction d’éjection altérée provient d’une dysfonction contractile responsable d’une déficience systolique qui active en retour des systèmes neuro-hormonaux (le SRAA et le système adrénergique) compensateurs à court terme, mais délétères à long terme. Ce concept a soutenu pendant près de deux décennies les développements thérapeutiques dans l’insuffisance cardiaque à fraction d’éjection altérée. Il y a fort à penser que ces mécanismes physiopathologiques sont aussi retrouvés à plus ou moins grande échelle dans l’insuffisance cardiaque à fraction d’éjection modérément altérée. Mais l’absence de bénéfices thérapeutiques dans l’insuffisance cardiaque à fraction d’éjection préservée sous-entend que des mécanismes physiopathologiques fort différents interviennent dans cette forme d’insuffisance cardiaque. D’ailleurs, s’agit-il d’un seul mécanisme unificateur qui mène l’insuffisance cardiaque à fraction d’éjection préservée ou de plusieurs mécanismes qui conduisent à une insuffisance cardiaque, et notre incapacité à savoir les distinguer nous amène à observer une insuffisance cardiaque avec une FEVG normale ?3 Autrement dit, notre appréhension difficile de ces mécanismes impliqués dans l’insuffisance cardiaque à fraction d’éjection préservée nous amène encore en 2020 à la définir comme « une insuffisance cardiaque qui n’est pas à FEVG réduite »… Un peu comme quand on définissait autrefois la tuberculose et les autres maladies infectieuses comme des « non-tuberculoses ».
Conséquences sur la démarche étiologique
Comment intégrer cela dans notre pratique clinique ? Tout d’abord, même si on peut débattre sur sa pertinence et sa valeur, l’évaluation de la FEVG reste la première chose à faire. Si elle est altérée (< 50 %), on entre dans un domaine assez bien connu et assez bien balisé, avec un algorithme de prise en charge thérapeutique qui repose sur des études solides,1 et l’arrivée de plusieurs nouveautés thérapeutiques (
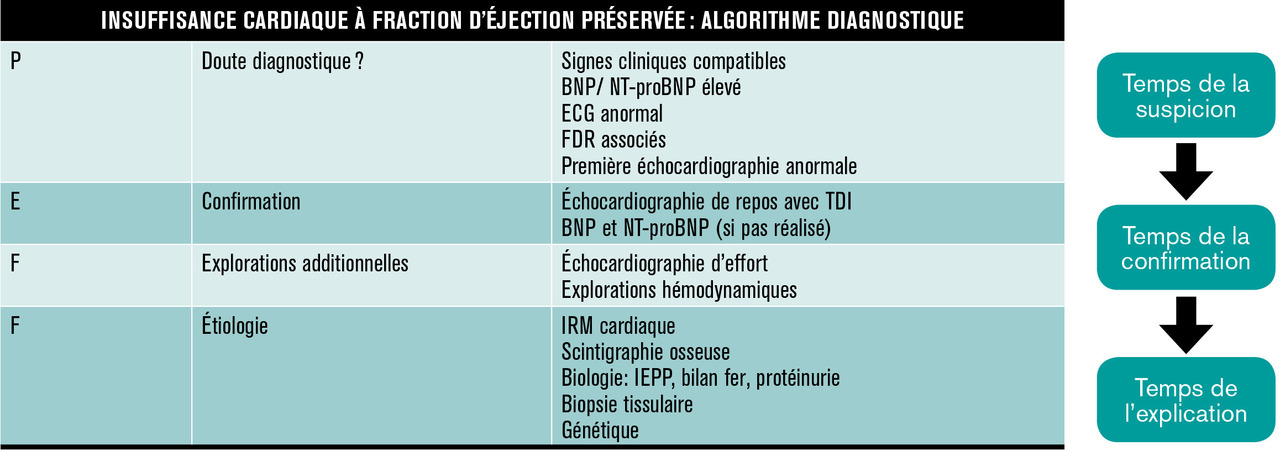
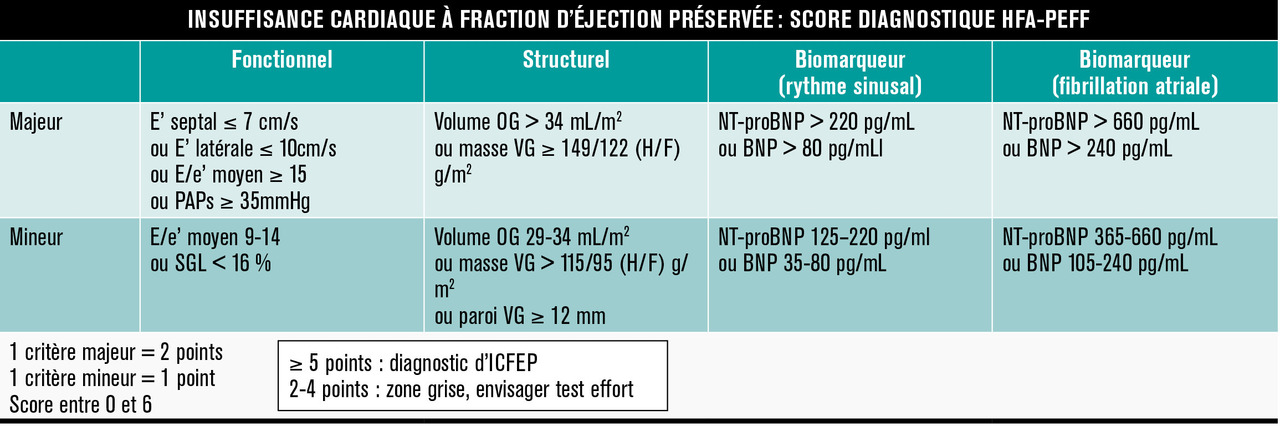
Mais si elle est normale (> 50 %), on ne peut plus écarter aussi simplement que par le passé l’existence d’une insuffisance cardiaque. Pour s’y retrouver, le groupe de travail sur l’insuffisance cardiaque de la Société européenne de cardiologie a proposé en 2019 une nouvelle approche diagnostique et étiologique (
Le diagnostic étant maintenant posé, vient le temps de l’explication, c’est-à-dire la recherche d’une cause particulière menant à l’insuffisance cardiaque à fraction d’éjection préservée. Et il s’agit d’une démarche très nouvelle qui est fondée sur la reconnaissance de maladies particulières qui peuvent se traduire par cette forme d’insuffisance cardiaque et qui peuvent bénéficier de thérapies ciblées. C’est particulièrement le cas des amyloses cardiaques (
L’insuffisance cardiaque à fraction d’éjection préservée devient donc une forme d’insuffisance cardiaque qui justifie une démarche diagnostique et étiologique spécifique qui s’étend au-delà du cœur afin de dépister des maladies systémiques dont le retentissement cardiaque était jusqu’ici sous-estimé. Une vision plus « interniste » de la cardiologie ! D’autant plus que ces patients ont souvent de nombreuses comorbidités associées : insuffisance rénale et/ou respiratoire, obésité ou diabète, qui nécessitent aussi une prise en charge multidisciplinaire.
Conclusion
L’insuffisance cardiaque à fraction d’éjection préservée devient donc une forme d’insuffisance cardiaque qui justifie une démarche diagnostique et étiologique spécifique qui s’étend au-delà du cœur, afin de dépister des maladies systémiques dont le retentissement cardiaque était jusqu’ici sous-estimé. Une vision plus « interniste » de la cardiologie ! D’autant plus que ces patients ont souvent de nombreuses comorbidités associées : insuffisance rénale et/ou respiratoire, obésité ou diabète, qui nécessitent aussi une prise en charge multidisciplinaire.
Amylose cardiaque
Classification de l’amylose
Il existe trois types d’amylose :
– l’amylose AL : provenant d’une prolifération plasmocytaire anormale ;
– l’amylose à transthyrétine (TTR), qui comprend deux formes :
l une forme dite sauvage ou « sénile » car souvent vue chez les personnes plus âgées ;
l une forme héréditaire car d’origine génétique (transmission dominante) et donc avec un contexte familial ;
– l’amylose AA, survenant dans le cadre de maladies inflammatoires chroniques.
Les amyloses AL et TTR peuvent atteindre le cœur et s’exprimer par une insuffisance cardiaque avec ou sans altération de la FEVG. Le mécanisme correspond à des dépôts amyloïdes au niveau de la matrice extracellulaire du muscle cardiaque, ce qui empêche son fonctionnement normal.
Diagnostic de l’amylose cardiaque
Le profil typique est celui d’un patient ayant une insuffisance cardiaque à fraction d’éjection préservée avec une hypertrophie ventriculaire gauche. L’échographie cardiaque retrouve souvent une altération du strain longitudinal (2D strain global) avec un aspect en cocarde correspondant à une atteinte prédominante sur les territoires basaux. L’IRM cardiaque permet d’observer des plages de rehaussement correspondant aux dépôts, mais elle ne permet pas de faire la différence entre les différents types d’amylose. La scintigraphie osseuse montre une hyperfixation dans l’aire cardiaque en cas d’amylose TTR. Le diagnostic final est porté par l’histologie, notamment sur une biopsie des glandes salivaires mais parfois d’autres organes (rein, foie, plus rarement cardiaque).
Traitement de l’amylose cardiaque
Dans l’amylose TTR, les nombreux progrès thérapeutiques récents ont permis l’arrivée en 2018 d’un stabilisateur de la transthyrétine, qui réduit les dépôts dans les organes (dont le cœur), améliore significativement le pronostic et réduit les hospitalisations ; cette molécule est actuellement en recommandation temporaire d’utilisation (RTU) dans le traitement de l’amylose cardiaque à TTR de forme sénile ou héréditaire. Deux autres traitements avec des mécanismes d’action différents pourraient être disponibles à terme.
L’amylose AL nécessite une chimiothérapie antiplasmocytaire ou lymphoplasmocytaire.
1. Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: the task force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC)Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J 2016;37:2129-200.
2. Wehner GJ, Jing L, Haggerty CM, et al. Routinely reported ejection fraction and mortality in clinical practice: where does the nadir of risk lie? Eur Heart J 2020;41:1249-57.
3. Lewis GA, Schelbert EB, Williams SG, et al. Biological phenotypes of heart failure with preserved ejection fraction. J Am Coll Cardiol 2017;70:2186-200.
4. Pieske B, Tschöpe C, de Boer RA, et al. How to diagnose heart failure with preserved ejection fraction: the HFA-PEFF diagnostic algorithm: a consensus recommendation from the Heart Failure Association (HFA) of the European Society of Cardiology (ESC). Eur Heart J 2019;40:3297-317.

 Encadrés
Encadrés