Le traitement anticancéreux, un facteur de risque cardiovasculaire supplémentaire
Les traitements modernes des cancers ont permisune amélioration considérable de la survie des patients et ont parfois transformé une maladie mortelle en maladie chronique. La prise en charge cardiovasculaire des patients touchés par un cancer représente donc un défi majeur car cancer et maladies cardiovasculaires coexistent souvent, et les traitements anticancéreux peuvent être à l’origine d’une toxicité cardiaque ou vasculaire. De plus, l’âge médian des patients traités pour un cancer ayant augmenté, l’exposition au traitement potentiellement toxique s’associe à celle des facteurs de risque cardiovasculaire standard dont la prévalence est plus importante dans cette population. Ainsi, le risque de développer des événements cardiovasculaires peut parfois être plus important que celui de récidive tumorale et donc atténuer le bénéfice global attendu à long terme.
Il est donc capital d’organiser spécifiquement le suivi cardiovasculaire des patients devant recevoir un traitement potentiellement toxique pour le système cardiovasculaire. C’est dans ce contexte qu’a émergé la cardio-oncologie, dont l’objectif principal est de prévenir, dépister et prendre en charge les maladies cardiovasculaires associées ou secondaires au traitement anticancéreux sans en compromettre l’efficacité.1 Elle nécessite donc une bonne connaissance des traitements anticancéreux et de leurs toxicités, ainsi qu’une collaboration étroite entre cardiologues et oncologues. Des programmes de surveillance ont ainsi été établis à partir de diverses recommandations, même si leur niveau de preuve reste faible.2, 3 Cette surveillance doit entrer dans le cadre du parcours de soins des patients dès l’annonce du diagnostic de cancer, et se poursuivre à long terme même après guérison.
Il est donc capital d’organiser spécifiquement le suivi cardiovasculaire des patients devant recevoir un traitement potentiellement toxique pour le système cardiovasculaire. C’est dans ce contexte qu’a émergé la cardio-oncologie, dont l’objectif principal est de prévenir, dépister et prendre en charge les maladies cardiovasculaires associées ou secondaires au traitement anticancéreux sans en compromettre l’efficacité.1 Elle nécessite donc une bonne connaissance des traitements anticancéreux et de leurs toxicités, ainsi qu’une collaboration étroite entre cardiologues et oncologues. Des programmes de surveillance ont ainsi été établis à partir de diverses recommandations, même si leur niveau de preuve reste faible.2, 3 Cette surveillance doit entrer dans le cadre du parcours de soins des patients dès l’annonce du diagnostic de cancer, et se poursuivre à long terme même après guérison.
Quel bilan cardiovasculaire initial ?
Récemment, les sociétés savantes européennes et américaines de cardiologie et d’oncologie ont souligné l’importance d’identifier très tôt les patients à risque de complications cardiovasculaires dès le diagnostic de cancer.2, 3 Ce risque dépend tout d’abord du caractère toxique du traitement envisagé mais également des antécédents cardiovasculaires des patients. En effet, les toxicités sont plus fréquentes en cas d’utilisation de certaines molécules comme les anthracyclines, les anti-HER2 (trastuzumab, pertuzumab), les antiangiogéniques ou d’autres thérapies ciblées spécifiques. Cependant, quel que soit le traitement administré, le risque de toxicité est également plus important chez les patients ayant des facteurs de risque ou déjà atteints d’une maladie cardiovasculaire.4 Par exemple, l’hypertension artérielle est la comorbidité la plus fréquente chez les patients cancéreux et peut contribuer à l’apparition d’une insuffisance cardiaque.5, 6 Il a également été démontré que la probabilité d’une insuffisance cardiaque causée par les anthracyclines et le trastuzumab était significativement plus élevée avec l’augmentation de l’âge, la présence d’une artériopathie périphérique ou coronarienne, le diabète et l’hypertension artérielle.7 Ainsi, le risque cardiovasculaire basal doit systématiquement, avant tout traitement, faire l’objet d’une évaluation clinique (recherche d’antécédents, de facteurs de risque, de symptômes et de signes cardiovasculaires), d’un électrocardiogramme (ECG), d’une estimation du débit de filtration glomérulaire, d’une mesure du taux de cholestérol sérique, des triglycérides et de la glycémie. L’estimation de ce risque peut s’envisager en utilisant certains scores validés comme le HeartScore*. Le dépistage d’une protéinurie doit également être effectué lorsque la prescription d’antiangiogéniques est envisagée.1
Cette première évaluation peut être effectuée très tôt ; elle permet d’identifier les patients à risque élevé d’événements cardiovasculaires sous traitement anticancéreux, afin de mieux les prendre en charge. Dans les recommandations américaines3, ces patients sont ceux dont le traitement comprend : de fortes doses d’anthracyclines (≥ 250 mg/m2 d’équivalent doxorubicine) ; de fortes doses de radiothérapie thoracique (≥ 30 Gy) ; une association anthracyclines et radiothérapie thoracique, quelle que soit la dose ; une association anthracyclines et trastuzumab ; de faibles doses d’anthracyclines ou trastuzumab sans anthracyclines associées à au moins un des facteurs suivants : plus de deux facteurs de risque cardiovasculaire (tabac, diabète, hypertension, dyslipidémie, obésité), sujet de 60 ans ou plus, existence d’une cardiopathie sous-jacente.
Dans les recommandations européennes,2 c’est le jugement clinique global du médecin qui détermine si le patient est considéré à risque élevé ou non. Cette démarche paraît plus adaptée car elle est plus individualisée et englobe les nouvelles molécules potentiellement cardiotoxiques comme certains inhibiteurs des tyrosine kinases, les inhibiteurs du protéasome, les immunothérapies ou les antiandrogéniques. De plus, des toxicités sous faibles doses d’anthracyclines ont été décrites en raison d’une susceptibilité génétique variant d’une personne à l’autre.
Lorsqu’un patient est considéré à risque à l’issue de cette première étape, il doit être adressé à un cardiologue qui dispose, si possible, de compétences en cardio- oncologie. Ce dernier doit alors effectuer une évaluation cardiovasculaire plus complète (clinique, électrocardiogramme, échographie cardiaque, biomarqueurs) qui servira de référence lors du suivi sous traitement. Il déterminera ensuite la fréquence des consultations. Il est donc préférable que ce soit le même praticien qui revoie le patient à chaque consultation de suivi et que l’évaluation de la fonction cardiaque soit réalisée toujours par la même technique d’imagerie. Enfin, en amont du traitement anticancéreux, l’optimisation du traitement des facteurs de risque et des comorbidités cardiovasculaires est une étape cruciale qui doit permettre de réduire le risque de toxicité sévère. En effet, sous prétexte d’un diagnostic de cancer, la prise en charge des facteurs de risque et des maladies cardiovasculaires préexistantes ne doit pas être négligée, bien au contraire.
La figure 1 résume le bilan cardiovasculaire initial qui peut être proposé.
Cette première évaluation peut être effectuée très tôt ; elle permet d’identifier les patients à risque élevé d’événements cardiovasculaires sous traitement anticancéreux, afin de mieux les prendre en charge. Dans les recommandations américaines3, ces patients sont ceux dont le traitement comprend : de fortes doses d’anthracyclines (≥ 250 mg/m2 d’équivalent doxorubicine) ; de fortes doses de radiothérapie thoracique (≥ 30 Gy) ; une association anthracyclines et radiothérapie thoracique, quelle que soit la dose ; une association anthracyclines et trastuzumab ; de faibles doses d’anthracyclines ou trastuzumab sans anthracyclines associées à au moins un des facteurs suivants : plus de deux facteurs de risque cardiovasculaire (tabac, diabète, hypertension, dyslipidémie, obésité), sujet de 60 ans ou plus, existence d’une cardiopathie sous-jacente.
Dans les recommandations européennes,2 c’est le jugement clinique global du médecin qui détermine si le patient est considéré à risque élevé ou non. Cette démarche paraît plus adaptée car elle est plus individualisée et englobe les nouvelles molécules potentiellement cardiotoxiques comme certains inhibiteurs des tyrosine kinases, les inhibiteurs du protéasome, les immunothérapies ou les antiandrogéniques. De plus, des toxicités sous faibles doses d’anthracyclines ont été décrites en raison d’une susceptibilité génétique variant d’une personne à l’autre.
Lorsqu’un patient est considéré à risque à l’issue de cette première étape, il doit être adressé à un cardiologue qui dispose, si possible, de compétences en cardio- oncologie. Ce dernier doit alors effectuer une évaluation cardiovasculaire plus complète (clinique, électrocardiogramme, échographie cardiaque, biomarqueurs) qui servira de référence lors du suivi sous traitement. Il déterminera ensuite la fréquence des consultations. Il est donc préférable que ce soit le même praticien qui revoie le patient à chaque consultation de suivi et que l’évaluation de la fonction cardiaque soit réalisée toujours par la même technique d’imagerie. Enfin, en amont du traitement anticancéreux, l’optimisation du traitement des facteurs de risque et des comorbidités cardiovasculaires est une étape cruciale qui doit permettre de réduire le risque de toxicité sévère. En effet, sous prétexte d’un diagnostic de cancer, la prise en charge des facteurs de risque et des maladies cardiovasculaires préexistantes ne doit pas être négligée, bien au contraire.
La
Quel suivi pendant le traitement anticancéreux ?
Ce suivi a été essentiellement défini pour les patients considérés à risque, c’est-à-dire ceux recevant des anthracyclines, certaines thérapies ciblées ou une radiothérapie thoracique, d’autant plus qu’ils ont un risque cardiovasculaire de base augmenté. Quel que soit le traitement anticancéreux prescrit, la surveillance ne doit pas se restreindre à la seule mesure régulière de la fraction d’éjection du ventricule gauche, comme cela a été fait pendant longtemps, car il s’agit d’un paramètre tardif de toxicité. En effet, la surveillance nécessite une évaluation cardiovasculaire globale régulière au cours des consultations de cardio(onco)logie incluant au minimum l’interrogatoire, l’examen physique, l’électrocardiogramme et l’échographie cardiaque. De plus, plusieurs études suggèrent l’intérêt d’une surveillance régulière de biomarqueurs cardiaques lors de l’administration de certains traitements. Ainsi, le dosage de la troponine avant traitement et après chaque injection d’anthracyclines, voire de trastuzumab, peut être utilisé pour dépister précocement une toxicité myocardique. En effet, une élévation sous traitement prédirait la baisse future de la fraction d’éjection ventriculaire gauche et la survenue d’événements cardiovasculaires. Cette stratégie figure dans les recommandations même si les modalités (type de troponine, moment du prélèvement) restent à préciser.2 Néanmoins, il est important de noter que les différents dosages doivent toujours être effectués par le même laboratoire. En cas d’élévation de la troponine, une surveillance rapprochée et un traitement cardioprotecteur (inhibiteurs de l’enzyme de conversion, bêtabloquants) peuvent être indiqués.
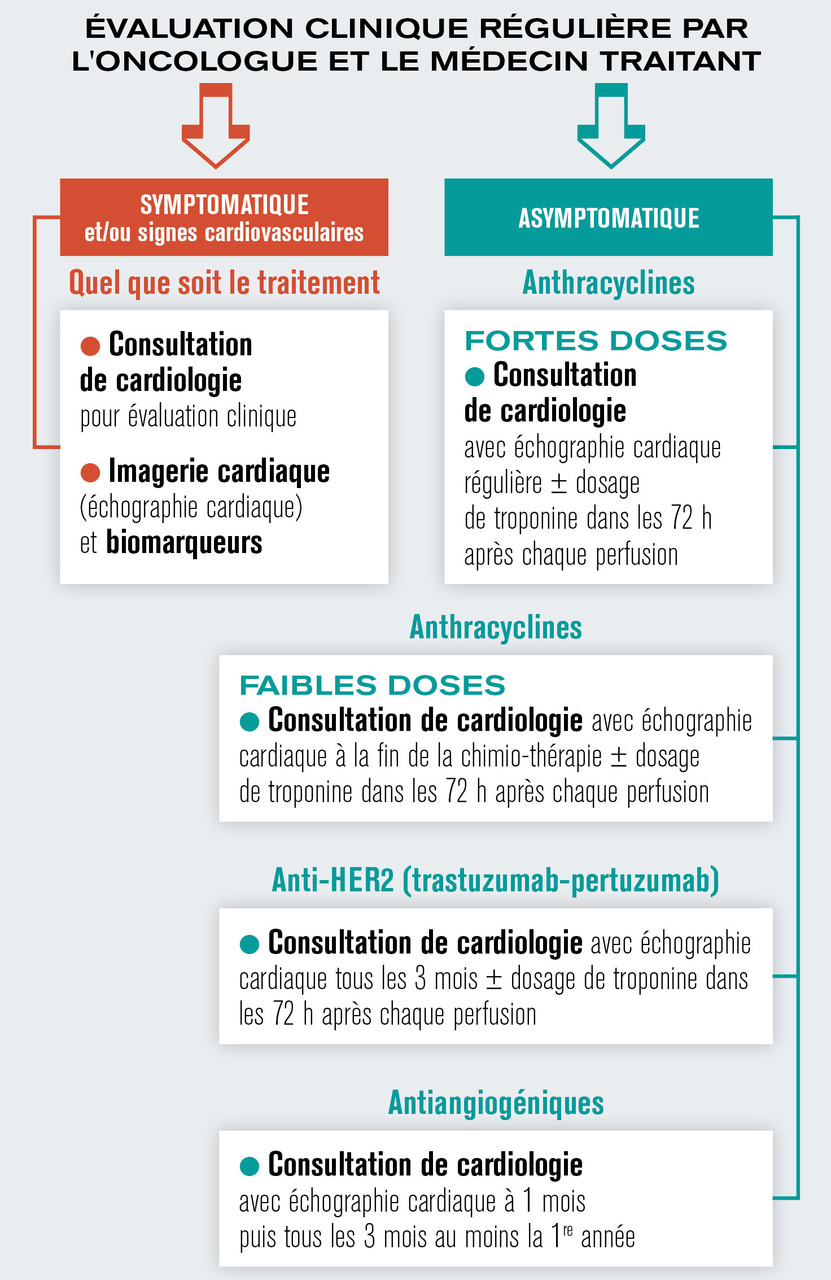
Au cours des consultations de suivi, il est crucial d’optimiser le traitement des comorbidités cardiovasculaires et d’inciter les patients à une bonne hygiène de vie incluant si possible l’activité physique. Les modalités précises de suivi dépendent de l’apparition ou non de symptômes et/ou de signes cardiovasculaires, ainsi que du traitement anticancéreux administré, comme cela est résumé dans lafigure 2 . En cas de suspicion de toxicité cardiovasculaire, la prise en charge thérapeutique doit être précoce, et une discussion entre oncologues et cardiologues doit intervenir rapidement afin de déterminer la pertinence de la poursuite ou non du traitement anticancéreux en tenant compte du rapport bénéfices- risques.
Certains centres traitant des patients ayant un cancer commencent à disposer d’équipes de cardio-oncologie dédiées, qui permettent de faciliter le suivi des patients tout au long de leur traitement, à partir de protocoles standardisés.1 Notre centre propose, par exemple, la mise à disposition de ces protocoles à l’attention des médecins, sur une application gratuite utilisable sur un téléphone portable (application GMEDICO).
Au cours des consultations de suivi, il est crucial d’optimiser le traitement des comorbidités cardiovasculaires et d’inciter les patients à une bonne hygiène de vie incluant si possible l’activité physique. Les modalités précises de suivi dépendent de l’apparition ou non de symptômes et/ou de signes cardiovasculaires, ainsi que du traitement anticancéreux administré, comme cela est résumé dans la
Certains centres traitant des patients ayant un cancer commencent à disposer d’équipes de cardio-oncologie dédiées, qui permettent de faciliter le suivi des patients tout au long de leur traitement, à partir de protocoles standardisés.1 Notre centre propose, par exemple, la mise à disposition de ces protocoles à l’attention des médecins, sur une application gratuite utilisable sur un téléphone portable (application GMEDICO).
Quel suivi après le traitement anticancéreux ?
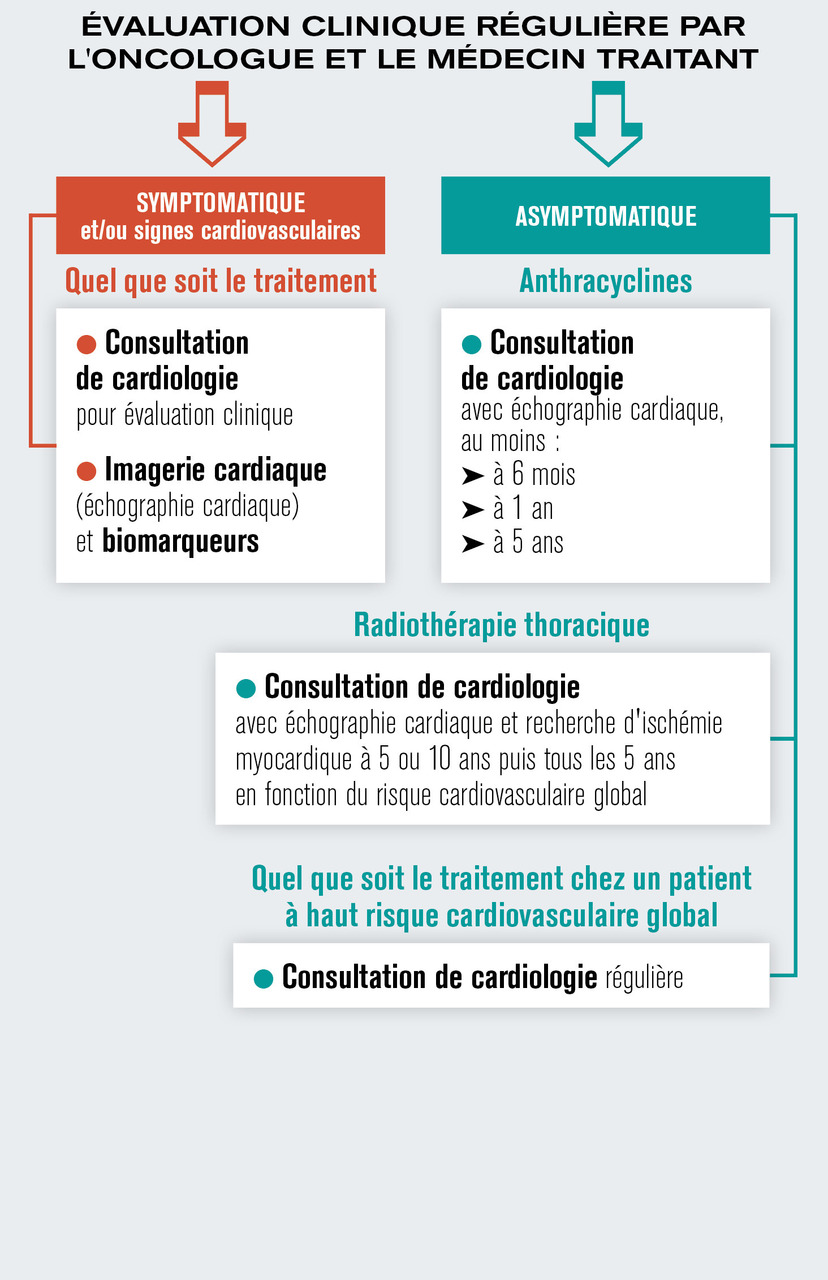
La population de patients ayant survécu à un cancer est en constante augmentation, conséquence des progrès thérapeutiques. Néanmoins, elle présente un risque plus élevé d’événements cardiovasculaires en raison de l’interaction entre l’exposition plus ou moins prolongée à la thérapie anticancéreuse et les facteurs de risque traditionnels dont la prévalence augmente avec l’âge. Nous pouvons donc considérer le traitement anticancéreux comme un facteur de risque cardiovasculaire supplémentaire, au même titre que l’hypertension artérielle ou le diabète. Ainsi, ces patients ont un risque cardiovasculaire plus élevé que la population générale,8 et doivent être surveillés par leur médecin traitant et leur cardiologue en parallèle du suivi oncologique. Si cette surveillance est surtout précisée pour les patients asymptomatiques ayant reçu des anthracyclines et/ou une radiothérapie thoracique (fig. 3 ), il est évident que toute apparition de symptômes et/ou de signes cardiovasculaires doit conduire à une consultation spécialisée de cardiologie quel que soit le traitement préalablement reçu.
Diminuer l’impact sur le pronostic global
Une évaluation cardiovasculaire doit être faite avant le traitement puis poursuivie dans le programme de soins de tous les patients cancéreux considérés à risque d’événements cardiovasculaires. Ce risque est estimé en fonction de la thérapeutique anticancéreuse envisagée et des antécédents cardiovasculaires. Le suivi cardiovasculaire est alors effectué en parallèle du suivi oncologique lors de consultations de cardio-oncologie incluant au moins un examen clinique complet, un électrocardiogramme et une imagerie cardiaque. Cette prise en charge interdisciplinaire a pour objectif de limiter l’impact péjoratif des effets indésirables cardiovasculaires des traitements oncologiques sur le pronostic global des patients.
Références
1. Cautela J, Lalevee N, Ammar C, et al. Management and research in cancer treatment-related cardiovascular toxicity: Challenges and perspectives. Int J Cardiol 2016;224:366-75.
2. Zamorano JL, Lancellotti P, Rodriguez Munoz D, et al. 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines: The Task Force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC). Eur Heart J 2016;37:2768-801.
3. Armenian SH, Lacchetti C, Barac A, et al. Prevention and monitoring of cardiac dysfunction in survivors of adult cancers: American Society of Clinical Oncology clinical practice guideline. J Clin Oncol 2017:35:893-911.
4. Lal H, Kolaja KL, Force T. Cancer genetics and the cardiotoxicity of the therapeutics. J Am Coll Cardiol 2013;61:267-74.
5. Witteles RM, Bosch X. Myocardial protection during cardiotoxic chemotherapy. Circulation 2015;132:1835-45.
6. Siegel R, Ma J, Zou Z, Jemal A. Cancer statistics, 2014. CA Cancer J Clin 2014;64:9-29.
7. Ezaz G, Long JB, Gross CP, Chen J. Risk prediction model for heart failure and cardiomyopathy after adjuvant trastuzumab therapy for breast cancer. J Am Heart Assoc 2014;3:e000472.
8. Armstrong GT, Oeffinger KC, Chen Y, et al. Modifiable risk factors and major cardiac events among adult survivors of childhood cancer. J Clin Oncol 2013;31:3673-80.
2. Zamorano JL, Lancellotti P, Rodriguez Munoz D, et al. 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines: The Task Force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC). Eur Heart J 2016;37:2768-801.
3. Armenian SH, Lacchetti C, Barac A, et al. Prevention and monitoring of cardiac dysfunction in survivors of adult cancers: American Society of Clinical Oncology clinical practice guideline. J Clin Oncol 2017:35:893-911.
4. Lal H, Kolaja KL, Force T. Cancer genetics and the cardiotoxicity of the therapeutics. J Am Coll Cardiol 2013;61:267-74.
5. Witteles RM, Bosch X. Myocardial protection during cardiotoxic chemotherapy. Circulation 2015;132:1835-45.
6. Siegel R, Ma J, Zou Z, Jemal A. Cancer statistics, 2014. CA Cancer J Clin 2014;64:9-29.
7. Ezaz G, Long JB, Gross CP, Chen J. Risk prediction model for heart failure and cardiomyopathy after adjuvant trastuzumab therapy for breast cancer. J Am Heart Assoc 2014;3:e000472.
8. Armstrong GT, Oeffinger KC, Chen Y, et al. Modifiable risk factors and major cardiac events among adult survivors of childhood cancer. J Clin Oncol 2013;31:3673-80.