Bien qu’elle bénéficie de moyens diagnostiques performants et d’un panel thérapeutique diversifié, l’endocardite infectieuse (EI) garde un pronostic sombre, avec une mortalité hospitalière d’environ 20 %.1,2 Les complications de l’EI sont donc responsables d’une morbi-mortalité importante ; elles sont essentiellement liées à l’insuffisance cardiaque, aux embolies septiques (en particulier cérébrales) et à l’absence de contrôle de l’infection sous traitement antibiotique. L’identification de ces complications permet de sélectionner rapidement les patients à haut risque nécessitant une prise en charge chirurgicale précoce. Un diagnostic et un traitement précoces sont en effet essentiels pour diminuer la fréquence de ces complications. La prise en charge doit être discutée au sein d’une équipe pluridisciplinaire médico-chirurgicale (endocarditis team des Anglo-Saxons) dont le rôle est capital pour améliorer le pronostic.1,2
Complications cardiaques
Les complications cardiaques diffèrent selon qu’elles concernent le cœur gauche et les prothèses valvulaires, ou le cœur droit et les sondes de pacemaker ou de défibrillateur.
Complications de l’EI du cœur gauche et sur prothèses valvulaires
Insuffisance cardiaque
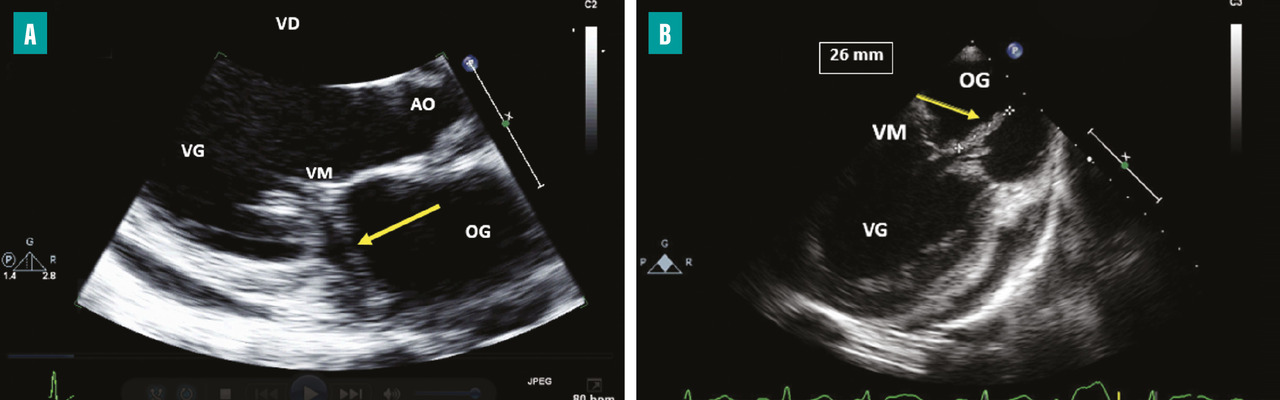
L’insuffisance cardiaque est la complication la plus fréquente (50 à 60 %) et la première cause de mortalité dans l’EI.3Un délabrement valvulaire important peut entraîner une fuite valvulaire sévère (
La surveillance de l’apparition ou de l’aggravation de signes d’insuffisance cardiaque au cours de l’évolution de l’EI est primordiale. L’auscultation cardiopulmonaire quotidienne fait partie des éléments clés de la surveillance. Les échographies transthoracique (ETT) et transœsophagienne (ETO) restent les examens de référence pour le diagnostic et la surveillance de l’évolution des lésions valvulaires.2
La recherche de signes de mauvaise tolérance échographique de la fuite (élévation de la pression télédiastolique du ventricule gauche, hypertension artérielle pulmonaire…) doit amener à discuter la chirurgie même si l’insuffisance cardiaque est cliniquement bien tolérée ou stable. Les indications opératoires pour insuffisance cardiaque sont discutées au sein de l’équipe pluridisciplinaire qui doit sélectionner les patients à opérer et planifier cette chirurgie en prenant également en compte les risques liés à l’intervention.4
L’insuffisance cardiaque dans l’EI sur valve native ou sur prothèse valvulaire est ainsi la première indication de la chirurgie en urgence :4
– une chirurgie très urgente (dans les vingt-quatre heures) est préconisée pour une fuite mitrale ou aortique sévère sur valve native ou sur prothèse valvulaire, en cas d’OAP ou de choc cardiogénique (recommandation de classe IB) ;
– une chirurgie en urgence (dans la semaine) est indiquée en cas de fuite sévère sur valve native ou sur prothèse valvulaire ou en cas d’obstruction valvulaire, à l’origine de symptômes d’insuffisance cardiaque ou de signes échographiques de mauvaise tolérance hémodynamique (recommandation de classe IB) ;
– la chirurgie est souvent reportée après sept à quinze jours de traitement antibiotique en cas de fuite valvulaire ou prothétique sévère et bien tolérée (stade I ou II de la New York Heart Association [NYHA]) avec une surveillance clinique et échocardiographique rapprochée. L’indication opératoire est de nouveau discutée au sein de l’équipe pluridisciplinaire en fonction de l’évolution de la fuite valvulaire et de sa tolérance.
Autres complications
Abcès périvalvulaires
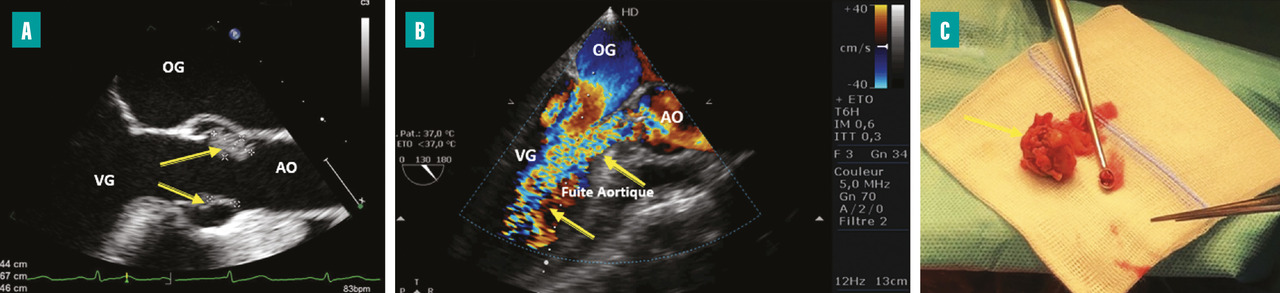
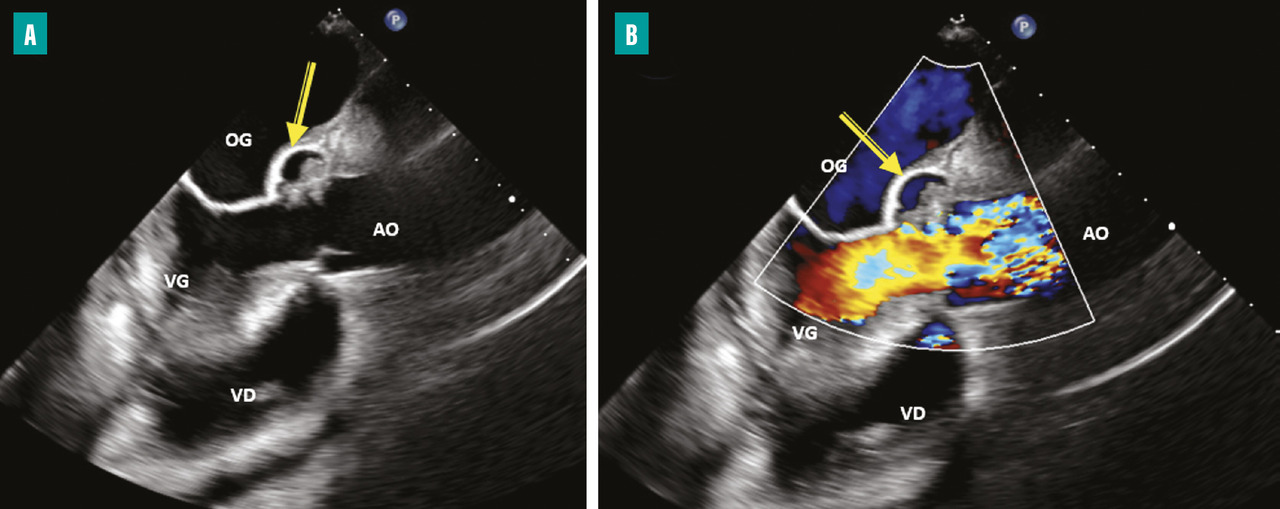
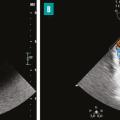
L’apparition à l’échographie cardiaque d’un abcès périvalvulaire ou périprothétique aortique (fig. 3 ) ou mitral est une complication grave de l’EI. L’abcès est plus fréquent dans les EI sur prothèses valvulaires (50 à 80 % contre 10 à 40 % sur valves natives). L’ETO est plus sensible que l’ETT pour ce diagnostic (notamment pour les localisations postérieures)2 et le scanner cardiaque est très performant pour la recherche d’abcès sur prothèse. La détersion de l’abcès peut être à l’origine de fistules entre les différentes cavités cardiaques (fig. 4 ). La fistulisation se fait le plus souvent dans la chambre de chasse du ventricule gauche. Les fistules intracardiaques dans l’oreillette gauche ou droite peuvent être à l’origine d’un tableau d’insuffisance cardiaque et compliquent le geste chirurgical.
Troubles de la conduction auriculoventriculaire
En position aortique, l’extension de l’abcès vers le septum interventriculaire membraneux peut entraîner des troubles conductifs (10 % des EI) par atteinte du faisceau de His, allant d’un simple allongement de l’espace PR jusqu’au bloc auriculoventriculaire complet. En cas d’endocardite aortique, un électrocardiogramme (ECG) quotidien (ou, mieux, une surveillance par télémétrie) à la recherche de ces troubles conductifs doit être systématiquement réalisé. Inversement, la persistance du syndrome infectieux associé à des troubles conductifs doit faire suspecter un abcès périvalvulaire ou périprothétique.
Péricardites
Les épanchements péricardiques sont peu fréquents et concernent les formes graves. Ils peuvent être purulents, hémorragiques ou inflammatoires.
Syndromes coronaires aigus
Les syndromes coronaires aigus sont exceptionnels et surviennent par embolisation d’une partie de la végétation dans une artère coronaire. La coronarographie est, en effet, parfois compliquée à réaliser dans le contexte d’EI aortique, avec le risque de mobiliser les végétations. Le scanner coronarien peut être utile dans cette indication.5
Complications des EI valvulaires du cœur droit et sur sondes de pacemaker ou de défibrillateur
EI valvulaires du cœur droit
Elles représentent 5 à 10 % des EI. L’atteinte de la valve tricuspide est largement prédominante. Le germe isolé est Staphylococcus aureus dans 60 à 80 % des cas. L’EI du cœur droit a un pronostic moins sévère que celle du cœur gauche et sa mortalité n’excède pas 7 à 10 %.4 Elle survient le plus souvent sur terrain de toxicomanie par voie intraveineuse ou chez des patients immunodéprimés (virus de l’immunodéficience humaine [VIH]). Le diagnostic clinique est plus difficile car la fuite tricuspide (insuffisance tricuspide [IT]) est mieux tolérée sur le plan hémodynamique et l’insuffisance cardiaque droite apparaît tardivement. L’embolisation des végétations entraîne une symptomatologie pulmonaire fébrile. L’ETT, complétée si besoin par l’ETO, est l’examen de référence pour le diagnostic. Le scanner thoracique avec injection peut montrer des images d’infarctus, voire d’abcès pulmonaires. La chirurgie est réservée aux situations suivantes :4– bactériémie persistante après sept jours de traitement antibiotique adapté (recommandation de classe IIaC) ;
– EI du cœur gauche associée à opérer (recommandation de classe IC) ;
– persistance de végétations tricuspides de plus de 20 mm après une embolisation pulmonaire septique (recommandation de classe IC) ;
– insuffisance cardiaque droite secondaire à une IT sévère malgré un traitement diurétique (recommandation de classe IB) ;
– emboles septiques pulmonaires responsables d’une insuffisance respiratoire sous ventilation mécanique (recommandation de classe IB).
EI sur sondes de pacemaker ou de défibrillateur
Toute fièvre inexpliquée chez des patients porteurs de sondes de pacemaker (PM) ou de défibrillateur automatique implantable (DAI) doit faire suspecter le diagnostic d’EI et conduire à la réalisation d’hémocultures. Les signes locaux d’infection ou d’extériorisation de boîtier orientent vers le diagnostic. Staphylococcus aureus est retrouvé dans 90 % des cas. Après l’ETT, l’ETO doit être réalisée pour rechercher des végétations sur les sondes. Une ETO normale n’élimine cependant pas le diagnostic d’endocardite sur sondes. Il faut alors compléter le bilan par une tomographie par émission de positons (TEP-scan) et/ou une scintigraphie aux leucocytes marqués. Le scanner thoracique est réalisé, à la recherche d’emboles septiques pulmonaires.Le traitement repose sur une antibiothérapie au long cours ; l’extraction du matériel est toujours discutée,4 en tenant compte de la dépendance du patient au stimulateur, du terrain, des facteurs de comorbidité ou de la présence de Staphylococcus aureus. La voie endocavitaire est privilégiée. L’ablation des sondes s’effectue par voie chirurgicale en cas de végétations de grande taille (supérieures à 20 mm), d’échec de la voie percutanée ou si une chirurgie valvulaire est indiquée pour une insuffisance tricuspide sévère ou une atteinte associée des valves du cœur gauche.
Le traitement antibiotique est prolongé de quatre à six semaines après l’ablation du matériel en cas d’emboles septiques ou de présence d’une prothèse valvulaire.4
Complications extracardiaques
Accidents emboliques
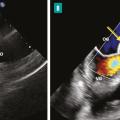
Les accidents emboliques représentent la deuxième cause de mortalité de l’EI. Leur incidence est estimée entre 10 et 50 %.6,7 Ils sont en rapport avec la fragmentation et la migration d’une partie d’une végétation dans la circulation artérielle pour les EI du cœur gauche et dans la circulation pulmonaire pour les EI du cœur droit. Ils sont dominés par les accidents neurologiques, suivis des embolies spléniques, rénales et pulmonaires. Le risque embolique est maximal au début du traitement antibiotique, puis diminue progressivement dans les deux premières semaines de traitement pour devenir minime ensuite.8,9 Dans environ 20 % des cas, l’embolie est cliniquement silencieuse et mise en évidence uniquement sur l’imagerie. Les facteurs prédictifs d’un haut risque embolique dans l’EI sont : la taille de la végétation (haut risque si supérieur à 10-15 mm [fig. 1 ]), sa mobilité et sa localisation sur la valve mitrale, l’EI à Staphylococcus aureus et la non-réduction de la taille des végétations sous traitement antibiotique.6
Les indications de la chirurgie en prévention des accidents emboliques sont précisées dans les recommandations européennes de 2023 :4
– en présence d’une végétation de plus de 10 mm sur valve native ou sur prothèse valvulaire ayant embolisé malgré une antibiothérapie adaptée (recommandation de classe IB) ;
– en l’absence d’embolisation mais avec une végétation de plus 10 mm associée à une autre indication chirurgicale (insuffisance cardiaque, par exemple) [recommandation de classe IC] ;
– à discuter en présence d’une végétation de plus de 10 mm sans dysfonction valvulaire sévère ni accident embolique et d’un faible risque opératoire (recommandation de classe IIbB).
Les indications de la chirurgie en prévention des accidents emboliques sont précisées dans les recommandations européennes de 2023 :4
– en présence d’une végétation de plus de 10 mm sur valve native ou sur prothèse valvulaire ayant embolisé malgré une antibiothérapie adaptée (recommandation de classe IB) ;
– en l’absence d’embolisation mais avec une végétation de plus 10 mm associée à une autre indication chirurgicale (insuffisance cardiaque, par exemple) [recommandation de classe IC] ;
– à discuter en présence d’une végétation de plus de 10 mm sans dysfonction valvulaire sévère ni accident embolique et d’un faible risque opératoire (recommandation de classe IIbB).
Complications neurologiques
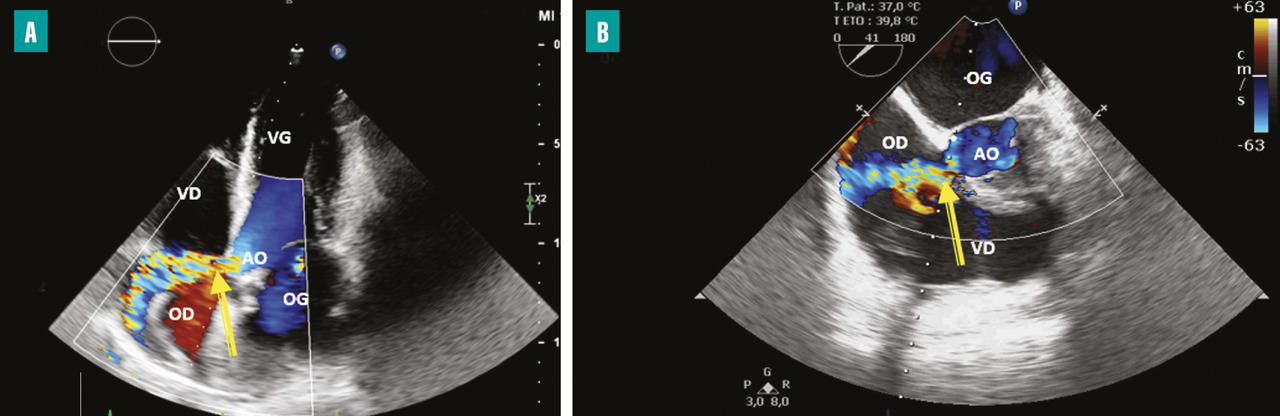
Les complications neurologiques surviennent dans 15 à 30 % des cas et entraînent une franche augmentation de la morbi-mortalité. C’est la deuxième cause de mortalité dans l’EI, après l’insuffisance cardiaque. La moitié de ces accidents emboliques intéressent le cerveau. Ces complications peuvent être révélatrices de l’EI ou apparaître au cours de l’évolution.
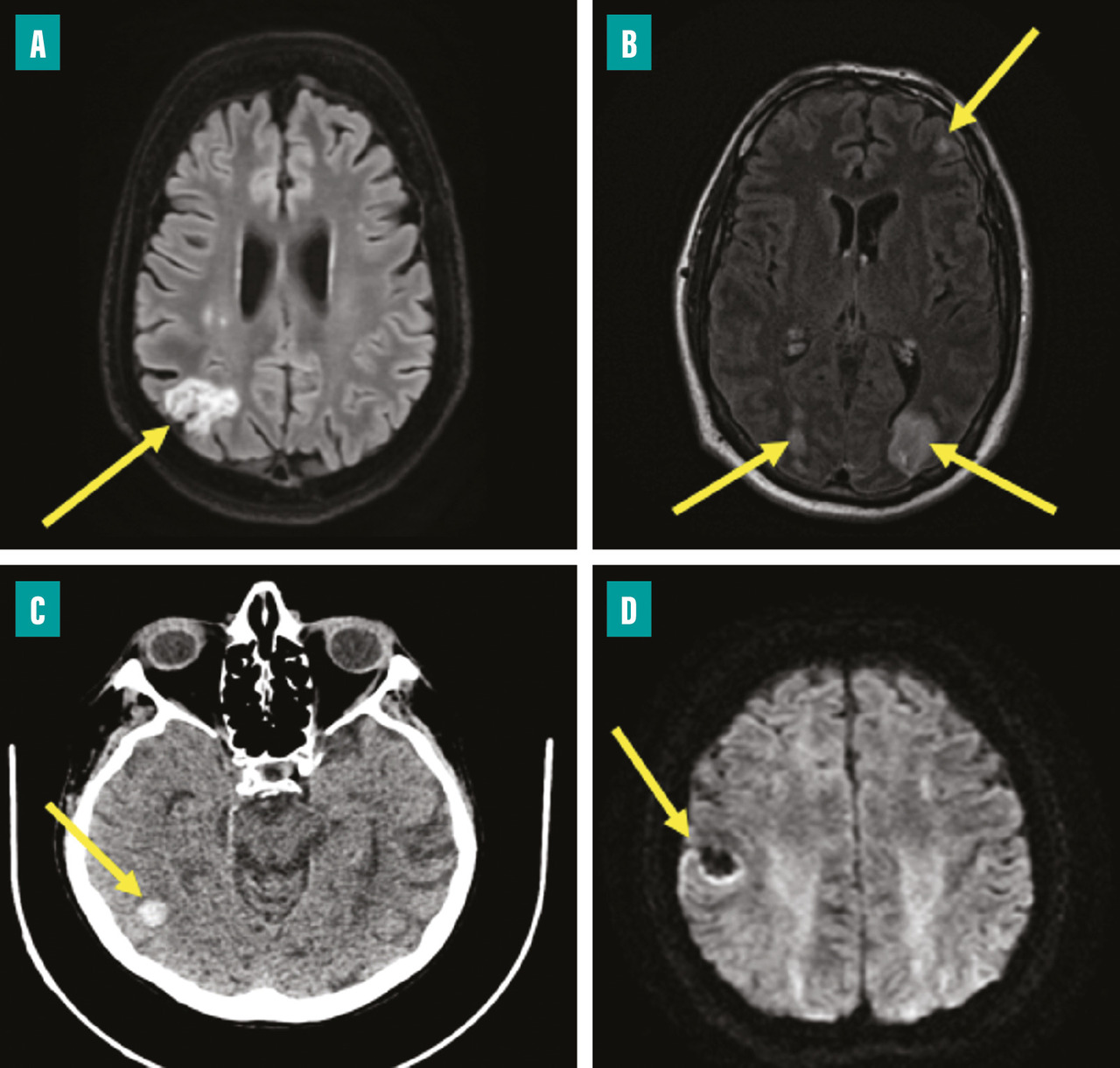
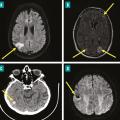
L’atteinte neurologique peut être de plusieurs formes (fig. 5 ) :6,7
– accident vasculaire cérébral (AVC) ischémique (25 à 50 %) ;
– AVC hémorragique (12 à 30 %) ;
– méningite (4 à 8 %) ;
– abcès cérébral (3 à 5 %) ;
– anévrysme mycotique (3 à 10 %).
Les signes révélant les accidents neurologiques sont multiples : déficit focal isolé, AVC fébrile, convulsions ou encore état comateux. L’AVC peut être cliniquement silencieux dans 20 à 30 % des cas, d’où l’importance d’une imagerie cérébrale systématique dans l’EI.7,10
Un scanner cérébral avec injection doit être réalisé devant tout trouble neurologique. Le bilan est complété par une angio-IRM (imagerie par résonance magnétique) cérébrale qui permet de mieux préciser la nature des lésions (abcès, anévrysmes mycotiques…) et de mettre en évidence des lésions de petite taille, parfois non visibles au scanner. Ces examens permettent de rechercher une éventuelle rupture de la barrière hémato-encéphalique dont la présence est une contre-indication à la chirurgie valvulaire en urgence. L’artériographie cérébrale est réalisée, en complément de l’IRM s’il existe un anévrysme mycotique pour discuter son éventuelle exclusion par voie endovasculaire.
En cas de complications neurologiques, l’indication opératoire doit être discutée au cas par cas dans le cadre des réunions de l’équipe pluridisciplinaire, pour une évaluation des bénéfices de la chirurgie et des risques d’aggravation de la lésion neurologique par les anticoagulants durant la circulation extracorporelle (CEC) et en postopératoire.11 Les risques d’aggravation des complications neurologiques par la CEC semblent faibles en dehors des AVC hémorragiques étendus avec troubles de la conscience ou de franche rupture de la barrière hémato-encéphalique sur l’imagerie cérébrale.11
Les indications de la chirurgie valvulaire se discutent en fonction de l’atteinte neurologique.4 Elle est recommandée :
– dans les plus brefs délais en cas d’accident ischémique transitoire ou d’AVC silencieux ;
– rapidement en cas d’insuffisance cardiaque, de sepsis non contrôlé ou d’abcès périvalvulaire, après un AVC, sans troubles de la conscience et après exclusion d’un saignement cérébral par un scanner ou une IRM ;
– la chirurgie est reportée de deux à quatre semaines en cas d’hémorragie cérébrale avec rupture de la barrière hémato-encéphalique avec une évaluation clinique et par imagerie au sein de l’équipe pluridisciplinaire ;
– en présence d’un anévrysme mycotique avec risque de rupture, le traitement endovasculaire ou neurochirurgical est préconisé avant la chirurgie valvulaire.
L’atteinte neurologique peut être de plusieurs formes (
– accident vasculaire cérébral (AVC) ischémique (25 à 50 %) ;
– AVC hémorragique (12 à 30 %) ;
– méningite (4 à 8 %) ;
– abcès cérébral (3 à 5 %) ;
– anévrysme mycotique (3 à 10 %).
Les signes révélant les accidents neurologiques sont multiples : déficit focal isolé, AVC fébrile, convulsions ou encore état comateux. L’AVC peut être cliniquement silencieux dans 20 à 30 % des cas, d’où l’importance d’une imagerie cérébrale systématique dans l’EI.7,10
Un scanner cérébral avec injection doit être réalisé devant tout trouble neurologique. Le bilan est complété par une angio-IRM (imagerie par résonance magnétique) cérébrale qui permet de mieux préciser la nature des lésions (abcès, anévrysmes mycotiques…) et de mettre en évidence des lésions de petite taille, parfois non visibles au scanner. Ces examens permettent de rechercher une éventuelle rupture de la barrière hémato-encéphalique dont la présence est une contre-indication à la chirurgie valvulaire en urgence. L’artériographie cérébrale est réalisée, en complément de l’IRM s’il existe un anévrysme mycotique pour discuter son éventuelle exclusion par voie endovasculaire.
En cas de complications neurologiques, l’indication opératoire doit être discutée au cas par cas dans le cadre des réunions de l’équipe pluridisciplinaire, pour une évaluation des bénéfices de la chirurgie et des risques d’aggravation de la lésion neurologique par les anticoagulants durant la circulation extracorporelle (CEC) et en postopératoire.11 Les risques d’aggravation des complications neurologiques par la CEC semblent faibles en dehors des AVC hémorragiques étendus avec troubles de la conscience ou de franche rupture de la barrière hémato-encéphalique sur l’imagerie cérébrale.11
Les indications de la chirurgie valvulaire se discutent en fonction de l’atteinte neurologique.4 Elle est recommandée :
– dans les plus brefs délais en cas d’accident ischémique transitoire ou d’AVC silencieux ;
– rapidement en cas d’insuffisance cardiaque, de sepsis non contrôlé ou d’abcès périvalvulaire, après un AVC, sans troubles de la conscience et après exclusion d’un saignement cérébral par un scanner ou une IRM ;
– la chirurgie est reportée de deux à quatre semaines en cas d’hémorragie cérébrale avec rupture de la barrière hémato-encéphalique avec une évaluation clinique et par imagerie au sein de l’équipe pluridisciplinaire ;
– en présence d’un anévrysme mycotique avec risque de rupture, le traitement endovasculaire ou neurochirurgical est préconisé avant la chirurgie valvulaire.
Complications spléniques
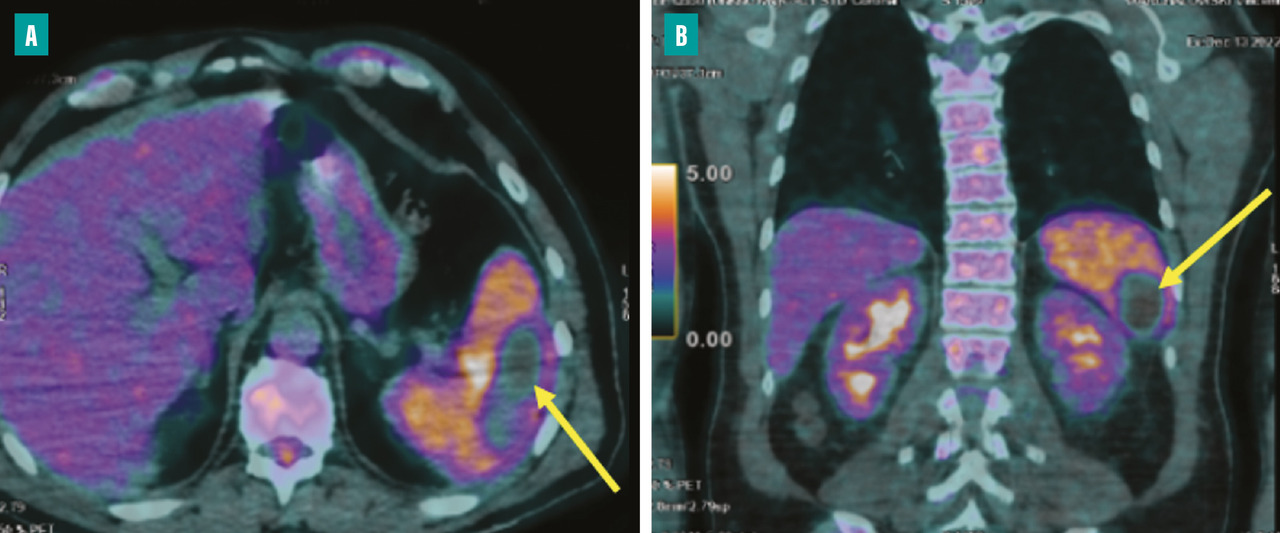
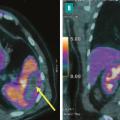
C’est la deuxième localisation embolique de l’EI, son incidence est variable entre 28 et 35 %.8,9 L’embole obstructif de l’artère splénique entraîne un infarctus splénique qui peut s’infecter ou s’abcéder. Cette embolisation est souvent silencieuse, découverte sur le scanner ou le TEP-scan (fig. 6 ). L’apparition d’un syndrome fébrile fait craindre un abcès splénique. Le traitement de l’abcès splénique est habituellement conservateur, mais en présence d’un abcès volumineux, une ponction sous scanner est discutée. La chirurgie est réservée aux ruptures de l’abcès.
Complications rénales
L’infarctus rénal est souvent silencieux, son incidence est variable entre 6 et 30 % en fonction des moyens diagnostiques utilisés.4,8 Il existe de nombreuses causes potentielles d’insuffisance rénale aiguë dans l’EI : en dehors de l’infarctus rénal, il peut s’agir d’une glomérulonéphrite, d’un bas débit en cas d’insuffisance cardiaque (syndrome cardiorénal), d’une toxicité des antibiotiques ou des produits de contraste.
Complications ostéo-articulaires
Il s’agit d’embolies septiques par voie hématogène responsables de foyers infectieux ostéoarticulaires secondaires qui se manifestent cliniquement par des arthralgies (10 %), des myalgies (15 %) ou des dorsolombalgies (13 %).4,9 L’EI se complique d’une spondylodiscite dans 3 à 5 % des cas. Elle est fréquemment de siège lombaire et peut être révélatrice de l’EI. Des lombalgies aiguës fébriles doivent faire évoquer le diagnostic d’EI.12
Non-contrôle de l’infection
Le non-contrôle de l’infection se définit comme la persistance de la fièvre ou des hémocultures toujours positives sept jours après le début d’une antibiothérapie adaptée.13,14
Il peut être lié :
– à la non-maîtrise de l’infection par les antibiotiques en rapport avec une antibiothérapie non adaptée, des germes résistants (Candida, Aspergillus, staphylocoque multirésistant...) ou à des complications emboliques extracardiaques de l’EI telles qu’un abcès splénique, cérébral ou rénal ;
– à l’évolution locale de l’infection par une extension périvalvulaire ou périprothétique des lésions et la formation d’un abcès (fig. 3 ) ou d’une fistule intracardiaque (fig. 4 ).
En cas de sepsis non contrôlé, il est impératif de refaire des hémocultures, de réaliser une surveillance rapprochée en ETT et en ETO, à la recherche d’un abcès périvalvulaire ou périprothétique. Un scanner thoraco-abdomino-pelvien et cérébral ou un TEP-scan est demandé, à la recherche d’un foyer infectieux embolique.
La chirurgie valvulaire est retenue en cas d’infection non contrôlée par le traitement devant :4,14
– la persistance d’hémocultures positives après une semaine sous traitement antibiotique adapté (recommandation de classe IIaB) ;
– une évolution de l’infection locale avec un abcès périvalvulaire ou périprothétique, l’apparition d’un faux anévrysme ou d’une fistule intracardiaque, une augmentation de la taille des végétations sous traitement antibiotique adapté, des signes de désinsertion de prothèse ou la survenue d’un bloc auriculoventriculaire (recommandation de classe IB) ;
– une EI fungique ou à germe multirésistant (recommandation de classe IC) ;
– une EI à Staphylococcus aureus sur prothèse valvulaire (recommandation de classe IIaC).
Il peut être lié :
– à la non-maîtrise de l’infection par les antibiotiques en rapport avec une antibiothérapie non adaptée, des germes résistants (Candida, Aspergillus, staphylocoque multirésistant...) ou à des complications emboliques extracardiaques de l’EI telles qu’un abcès splénique, cérébral ou rénal ;
– à l’évolution locale de l’infection par une extension périvalvulaire ou périprothétique des lésions et la formation d’un abcès (
En cas de sepsis non contrôlé, il est impératif de refaire des hémocultures, de réaliser une surveillance rapprochée en ETT et en ETO, à la recherche d’un abcès périvalvulaire ou périprothétique. Un scanner thoraco-abdomino-pelvien et cérébral ou un TEP-scan est demandé, à la recherche d’un foyer infectieux embolique.
La chirurgie valvulaire est retenue en cas d’infection non contrôlée par le traitement devant :4,14
– la persistance d’hémocultures positives après une semaine sous traitement antibiotique adapté (recommandation de classe IIaB) ;
– une évolution de l’infection locale avec un abcès périvalvulaire ou périprothétique, l’apparition d’un faux anévrysme ou d’une fistule intracardiaque, une augmentation de la taille des végétations sous traitement antibiotique adapté, des signes de désinsertion de prothèse ou la survenue d’un bloc auriculoventriculaire (recommandation de classe IB) ;
– une EI fungique ou à germe multirésistant (recommandation de classe IC) ;
– une EI à Staphylococcus aureus sur prothèse valvulaire (recommandation de classe IIaC).
Surveillance de l’évolution
À la phase aiguë, la surveillance de l’évolution de l’EI doit être étroite et rapprochée pour détecter l’apparition ou l’aggravation des signes d’insuffisance cardiaque, de troubles neurologiques ou en cas d’ascension thermique.
Surveillance clinique et biologique
Certains patients avec une EI présentant des complications vitales sont d’emblée hospitalisés en unité de soins intensifs cardiologique ou dans un service de réanimation.
La température, la pression artérielle, la fréquence cardiaque et la saturation en oxygène sont relevées deux fois par jour. Un examen clinique quotidien est réalisé, avec en particulier une auscultation cardiopulmonaire attentive et un examen neurologique minutieux. Un ECG est demandé quotidiennement, à la recherche de troubles conductifs, en particulier dans les EI aortiques. En cas d’ascension thermique, la réalisation d’hémocultures est systématique et une extension locale ou embolique est recherchée. Un bilan biologique pour la surveillance de la fonction rénale et du syndrome inflammatoire est régulièrement réalisé en fonction de l’évolution. Le dosage des antibiotiques (aminosides, vancomycine, amoxicilline…) est demandé même en l’absence d’insuffisance rénale. Le dosage du brain natriuretic peptide(BNP) peut aider au diagnostic et à la surveillance de l’insuffisance cardiaque.
La température, la pression artérielle, la fréquence cardiaque et la saturation en oxygène sont relevées deux fois par jour. Un examen clinique quotidien est réalisé, avec en particulier une auscultation cardiopulmonaire attentive et un examen neurologique minutieux. Un ECG est demandé quotidiennement, à la recherche de troubles conductifs, en particulier dans les EI aortiques. En cas d’ascension thermique, la réalisation d’hémocultures est systématique et une extension locale ou embolique est recherchée. Un bilan biologique pour la surveillance de la fonction rénale et du syndrome inflammatoire est régulièrement réalisé en fonction de l’évolution. Le dosage des antibiotiques (aminosides, vancomycine, amoxicilline…) est demandé même en l’absence d’insuffisance rénale. Le dosage du brain natriuretic peptide(BNP) peut aider au diagnostic et à la surveillance de l’insuffisance cardiaque.
Imagerie
Après un bilan d’imagerie bien codifié à la phase initiale, la surveillance de l’évolution se fait par l’ETT complétée par l’ETO. L’ETT doit être répétée en cas d’insuffisance cardiaque ou de sepsis.2,4 En cas de complications neurologiques, la surveillance est plutôt réalisée par angio-IRM cérébrale, plus sensible que le scanner. Le bilan est complété en cas d’anévrysme mycotique par une artériographie cérébrale, pour discuter un traitement endovasculaire.
À la fin du traitement antibiotique, un contrôle clinique et échographique est programmé, ainsi qu’une consultation avec l’infectiologue. Le suivi ultérieur est assuré par le cardiologue référent.
À la fin du traitement antibiotique, un contrôle clinique et échographique est programmé, ainsi qu’une consultation avec l’infectiologue. Le suivi ultérieur est assuré par le cardiologue référent.
Traitement anticoagulant dans l’EI
Anticoagulants
Il n’y a pas d’indication à un traitement anticoagulant pour prévenir les risques emboliques dans l’EI, même en présence d’un AVC ischémique.
Chez les patients traités par antivitamines K (AVK) au long cours, par exemple en raison d’une prothèse mécanique ou d’une fibrillation atriale, le risque hémorragique est majoré. Les AVK augmentent le risque de transformation hémorragique d’un AVC ischémique à la phase aiguë d’une EI.7
En présence de complications neurologiques, le traitement anticoagulant est discuté et adapté à la nature de l’atteinte cérébrale :4
– en cas d’AVC ischémique, les anticoagulants oraux sont remplacés par l’héparine non fractionnée (HNF) pendant deux semaines ;
– en l’absence d’AVC, les anticoagulants oraux sont relayés par l’héparine non fractionnée (HNF) si une chirurgie est prévisible ;
– en présence d’une hémorragie cérébrale ou d’un anévrysme mycotique, les anticoagulants sont arrêtés ;
– en cas d’hémorragie cérébrale avec une prothèse mécanique, les anticoagulants oraux sont interrompus et relayés par l’HNF dès que possible (discussion au cas par cas au sein de l’équipe pluridisciplinaire) ;
– en l’absence d’AVC, les anticoagulants sont relayés par l’HNF dans les EI à Staphylococcus aureus pendant une à deux semaines ;
– en raison d’un risque hémorragique accru, la thrombolyse pour un AVC ischémique n’est pas recommandée en cas d’EI ;
– la thrombectomie peut être discutée en cas d’AVC embolique compliquant une EI.
Chez les patients traités par antivitamines K (AVK) au long cours, par exemple en raison d’une prothèse mécanique ou d’une fibrillation atriale, le risque hémorragique est majoré. Les AVK augmentent le risque de transformation hémorragique d’un AVC ischémique à la phase aiguë d’une EI.7
En présence de complications neurologiques, le traitement anticoagulant est discuté et adapté à la nature de l’atteinte cérébrale :4
– en cas d’AVC ischémique, les anticoagulants oraux sont remplacés par l’héparine non fractionnée (HNF) pendant deux semaines ;
– en l’absence d’AVC, les anticoagulants oraux sont relayés par l’héparine non fractionnée (HNF) si une chirurgie est prévisible ;
– en présence d’une hémorragie cérébrale ou d’un anévrysme mycotique, les anticoagulants sont arrêtés ;
– en cas d’hémorragie cérébrale avec une prothèse mécanique, les anticoagulants oraux sont interrompus et relayés par l’HNF dès que possible (discussion au cas par cas au sein de l’équipe pluridisciplinaire) ;
– en l’absence d’AVC, les anticoagulants sont relayés par l’HNF dans les EI à Staphylococcus aureus pendant une à deux semaines ;
– en raison d’un risque hémorragique accru, la thrombolyse pour un AVC ischémique n’est pas recommandée en cas d’EI ;
– la thrombectomie peut être discutée en cas d’AVC embolique compliquant une EI.
Antiagrégants plaquettaires
Il n’y a pas d’indication à introduire un traitement antiagrégant plaquettaire pour réduire les risques emboliques dans l’EI, même en cas d’AVC ; la prévention repose sur une antibiothérapie adaptée et une chirurgie précoce.
Il ne faut pas arrêter un traitement antiagrégant plaquettaire en cours, sauf en cas d’événement hémorragique majeur.4,7
L’aspirine ne réduit pas la taille des végétations et ne diminue pas le risque embolique dans l’EI, et ce traitement a tendance à majorer le risque hémorragique au niveau cérébral.15
Il ne faut pas arrêter un traitement antiagrégant plaquettaire en cours, sauf en cas d’événement hémorragique majeur.4,7
L’aspirine ne réduit pas la taille des végétations et ne diminue pas le risque embolique dans l’EI, et ce traitement a tendance à majorer le risque hémorragique au niveau cérébral.15
Chirurgie nécessaire pour la moitié des patients
Le diagnostic et la gestion des complications de l’EI sont des étapes essentielles dans la prise en charge globale de cette pathologie. L’insuffisance cardiaque — quand l’atteinte valvulaire est sévère —, les complications neurologiques emboliques et le sepsis non contrôlé représentent les principales complications. L’échocardiographie, l’imagerie de coupe et le TEP-scan sont des examens essentiels pour discuter de la prise en charge, idéalement dans le cadre d’une réunion pluridisciplinaire. Une indication chirurgicale, parfois en urgence, est retenue pour environ la moitié des patients.
Références
1. Chambers J, Sandoe J, Ray S, Prendergast B, Taggart D, Westaby S, et al. The infective endocarditis team: Recommendations from an international working group. Heart 2014;100(7):524-7.
2. Habib G, Lancellotti P, Antunes MJ, Bongiorni MG, Casalta JP, Del Zotti F, et al. 2015 ESC Guidelines for the management of infective endocarditis: The Task Force for the management of infective endocarditis of the European Society of Cardiology (ESC). Eur Heart J 2015;36(44):3075-128.
3. Bohbot Y, Habib G, Laroche C, Stöhr E, Chirouze C, Hernandez-Meneses M, et al. Characteristics, management and outcomes of patients with left-sided infective endocarditis complicated by heart failure: A substudy of the ESC-EORP EURO-ENDO (European infective endocarditis) registry. Eur J Heart Fail 2022;24(7):1253-65.
4. Delgado V, Ajmone Marsan N, De Waha S, Bonaros N, Brida M, Burri H, et al. 2023 ESC Guidelines for the management of endocarditis. Eur Heart J 2023: 44(39):3498-4042.
5. Roux V, Salaun E, Tribouilloy C, Hubert S, Bohbot Y, Casalta JP, et al. Coronary events complicating infective endocarditis. Heart 2017;103(23):1906-10.
6. Thuny F, Avierinos JF, Tribouilloy C, Giorgi R, Casalta JP, Milandre L, et al. Impact of cerebrovascular complications on mortality and neurologic outcome during infective endocarditis: A prospective multicentre study. Eur Heart J 2007;28(9):1155-61.
7. Garcia-Cabrera E, Fernandez-Hidalgo N, Almirante B, Ivanova-Georgieva R, Nourredine M, Plata A, et al. Neurological complications of infective endocarditis: Risk factors, outcome, and impact of surgery: A multicenter observational study. Circulation 2013;127(23):2272-84.
8. Vilacosta I, Graupner C, San Roman JA, Sarria C, Ronderos R, Fernandez C, et al. Risk of embolization after institution of antibiotic therapy for infective endocarditis. J Am Coll Cardiol 2002;39(9):1489-95.
9. Sanfilippo AJ, Picard MH, Newell JB, Rosas E, Davidoff R, Thomas JD, et al. Echocardiographic assessment of patients with infectious endocarditis: Prediction of risk for complications. J Am Coll Cardiol 1991;18(5):1191-9.
10. Hubert S, Thuny F, Resseguier N, Giorgi R, Tribouilloy C, Le Dolley Y, et al. Prediction of symptomatic embolism in infective endocarditis: Construction and validation of a risk calculator in a multicenter cohort. J Am Coll Cardiol 2013;62(15):1384-92.
11. Kang DH, Kim YJ, Kim SH, Sun BJ, Kim DH, Yun SC, et al. Early surgery versus conventional treatment for infective endocarditis. N Engl J Med 2012;366(26):2466-73.
12. Carbone A, Lieu A, Mouhat B, Santelli F, Philip M, Bohbot Y, et al. Spondylodiscitis complicating infective endocarditis. Heart 2020;106(24):1914-18.
13. Arregle F, Martel H, Philip M, Gouriet F, Casalta JP, Riberi A, et al. Endocardite infectieuse avec complications neurologiques : le report de la chirurgie cardiaque est associé à une évolution plus défavorable. Arch Cardiovasc Dis 2021;114(8-9):527-36.
14. Lopez J, Sevilla T, Vilacosta I, Sarria C, Revilla A, Ortiz C, et al. Prognostic role of persistent positive blood cultures after initiation of antibiotic therapy in left side infective endocarditis. Eur Heart J 2013;34(23):1749-54.
15. Chan KL, Tam J, Dumesnil JG, Cujec B, Sanfilippo AJ, Jue J, et al. Effect of long-term aspirin use on embolic events in infective endocarditis. Clin Infect Dis 2008;46(1):37-41.
2. Habib G, Lancellotti P, Antunes MJ, Bongiorni MG, Casalta JP, Del Zotti F, et al. 2015 ESC Guidelines for the management of infective endocarditis: The Task Force for the management of infective endocarditis of the European Society of Cardiology (ESC). Eur Heart J 2015;36(44):3075-128.
3. Bohbot Y, Habib G, Laroche C, Stöhr E, Chirouze C, Hernandez-Meneses M, et al. Characteristics, management and outcomes of patients with left-sided infective endocarditis complicated by heart failure: A substudy of the ESC-EORP EURO-ENDO (European infective endocarditis) registry. Eur J Heart Fail 2022;24(7):1253-65.
4. Delgado V, Ajmone Marsan N, De Waha S, Bonaros N, Brida M, Burri H, et al. 2023 ESC Guidelines for the management of endocarditis. Eur Heart J 2023: 44(39):3498-4042.
5. Roux V, Salaun E, Tribouilloy C, Hubert S, Bohbot Y, Casalta JP, et al. Coronary events complicating infective endocarditis. Heart 2017;103(23):1906-10.
6. Thuny F, Avierinos JF, Tribouilloy C, Giorgi R, Casalta JP, Milandre L, et al. Impact of cerebrovascular complications on mortality and neurologic outcome during infective endocarditis: A prospective multicentre study. Eur Heart J 2007;28(9):1155-61.
7. Garcia-Cabrera E, Fernandez-Hidalgo N, Almirante B, Ivanova-Georgieva R, Nourredine M, Plata A, et al. Neurological complications of infective endocarditis: Risk factors, outcome, and impact of surgery: A multicenter observational study. Circulation 2013;127(23):2272-84.
8. Vilacosta I, Graupner C, San Roman JA, Sarria C, Ronderos R, Fernandez C, et al. Risk of embolization after institution of antibiotic therapy for infective endocarditis. J Am Coll Cardiol 2002;39(9):1489-95.
9. Sanfilippo AJ, Picard MH, Newell JB, Rosas E, Davidoff R, Thomas JD, et al. Echocardiographic assessment of patients with infectious endocarditis: Prediction of risk for complications. J Am Coll Cardiol 1991;18(5):1191-9.
10. Hubert S, Thuny F, Resseguier N, Giorgi R, Tribouilloy C, Le Dolley Y, et al. Prediction of symptomatic embolism in infective endocarditis: Construction and validation of a risk calculator in a multicenter cohort. J Am Coll Cardiol 2013;62(15):1384-92.
11. Kang DH, Kim YJ, Kim SH, Sun BJ, Kim DH, Yun SC, et al. Early surgery versus conventional treatment for infective endocarditis. N Engl J Med 2012;366(26):2466-73.
12. Carbone A, Lieu A, Mouhat B, Santelli F, Philip M, Bohbot Y, et al. Spondylodiscitis complicating infective endocarditis. Heart 2020;106(24):1914-18.
13. Arregle F, Martel H, Philip M, Gouriet F, Casalta JP, Riberi A, et al. Endocardite infectieuse avec complications neurologiques : le report de la chirurgie cardiaque est associé à une évolution plus défavorable. Arch Cardiovasc Dis 2021;114(8-9):527-36.
14. Lopez J, Sevilla T, Vilacosta I, Sarria C, Revilla A, Ortiz C, et al. Prognostic role of persistent positive blood cultures after initiation of antibiotic therapy in left side infective endocarditis. Eur Heart J 2013;34(23):1749-54.
15. Chan KL, Tam J, Dumesnil JG, Cujec B, Sanfilippo AJ, Jue J, et al. Effect of long-term aspirin use on embolic events in infective endocarditis. Clin Infect Dis 2008;46(1):37-41.