L’incidence du cancer du rein localisé et de petite taille est en permanente augmentation depuis plusieurs décennies. Cela s’explique en partie par l’essor de l’imagerie médicale puisque plus des deux tiers des cancers du rein sont découverts fortuitement au cours d’un examen d’ima- gerie réalisé pour une autre raison.1, 2 Le traitement de référence de ces petites tumeurs rénales de stade T1a (< 4 cm) est la chirurgie lorsqu’elle est possible. Le nombre de petites tumeurs traitées par néphrectomie élargie est en nette diminution, au profit de la néphrectomie partielle et des ablations percutanées.3 Cependant, la néphrectomie partielle n’est pas dénuée de compli- cations et reste complexe pour certaines tumeurs, en particulier les tumeurs centrales. Les techniques ablatives percutanées sont une option thérapeutique intéressante chez les patients qui ne sont pas de bons candidats à la chirurgie : lésions difficilement extirpables, patients les plus fragiles. Elles ont pour objectif de traiter les patients en diminuant la morbidité liée à une chirurgie conventionnelle. Elles consistent en la destruction du tissu tumoral in situ soit par échauf- fement (radiofréquence ou micro-ondes), soit par refroidissement tissulaire (cryoablation). Une des limites de ces traitements ablatifs par le chaud est leur caractère douloureux, nécessitant leur réalisation sous sédation consciente, voire sous anesthésie générale. La cryoablation percutanée permet, en revanche, de traiter les patients avec une anesthésie locale exclusive.
Critères d’inclusion
Tous les patients éligibles à la cryothérapie sont présentés en réunion de concertation pluridisciplinaire réunissant urologues, radiologues et oncologues afin de valider l’indication de la procédure. La place des traitements ablatifs a été rappelée dans les dernières recomman- dations de l’Association française d’urologie ; ils sont recommandés :4– pour les patients ayant des petites tumeurs rénales (< 4 cm) et plusieurs facteurs de comorbidité (dont l’âge) ;– lorsqu’il y a une contre-indication à la chirurgie ;– dans certaines situations de cancer du rein héréditaire avec des tumeurs multiples de volume limité ;– dans les situations impératives (rein unique ou insuffisance rénale préexistante) avec risque d’insuffisance rénale terminale après néphrectomie partielle.Pour la cryothérapie, on peut rajouter les contre- indications à l’anesthésie générale ou à la sédation profonde puisque le geste peut être réalisé sous anes- thésie locale.5 Il n’y a pas d’âge seuil mais, classiquement, la cryothérapie est réservée à des patients ayant plus de 75 ans ou des comorbidités importantes.Contrairement à la chirurgie au cours de laquelle on procède à l’exérèse de la tumeur qui est ensuite analysée en anatomopathologie, la cryothérapie laisse en place une tumeur présumée détruite. Il est donc fondamental de disposer au préalable d’une biopsie de la lésion afin de connaître sa nature précise. Idéalement, la biopsie doit être réalisée dans une autre session, avant la cryothérapie, afin de disposer du résultat le jour du traitement. Si certaines équipes réalisent la biopsie dans le même temps que la cryothérapie, il existe toujours un risque de biopsie négative. Enfin, le fait de réaliser la biopsie sous tomodensitométrie dans la position de traitement sert de répétition et à identifier les éventuelles difficultés (proximité d’une structure vitale, variante anatomique) et de vérifier la bonne tolérance et le degré de coopération du patient.
Procédure
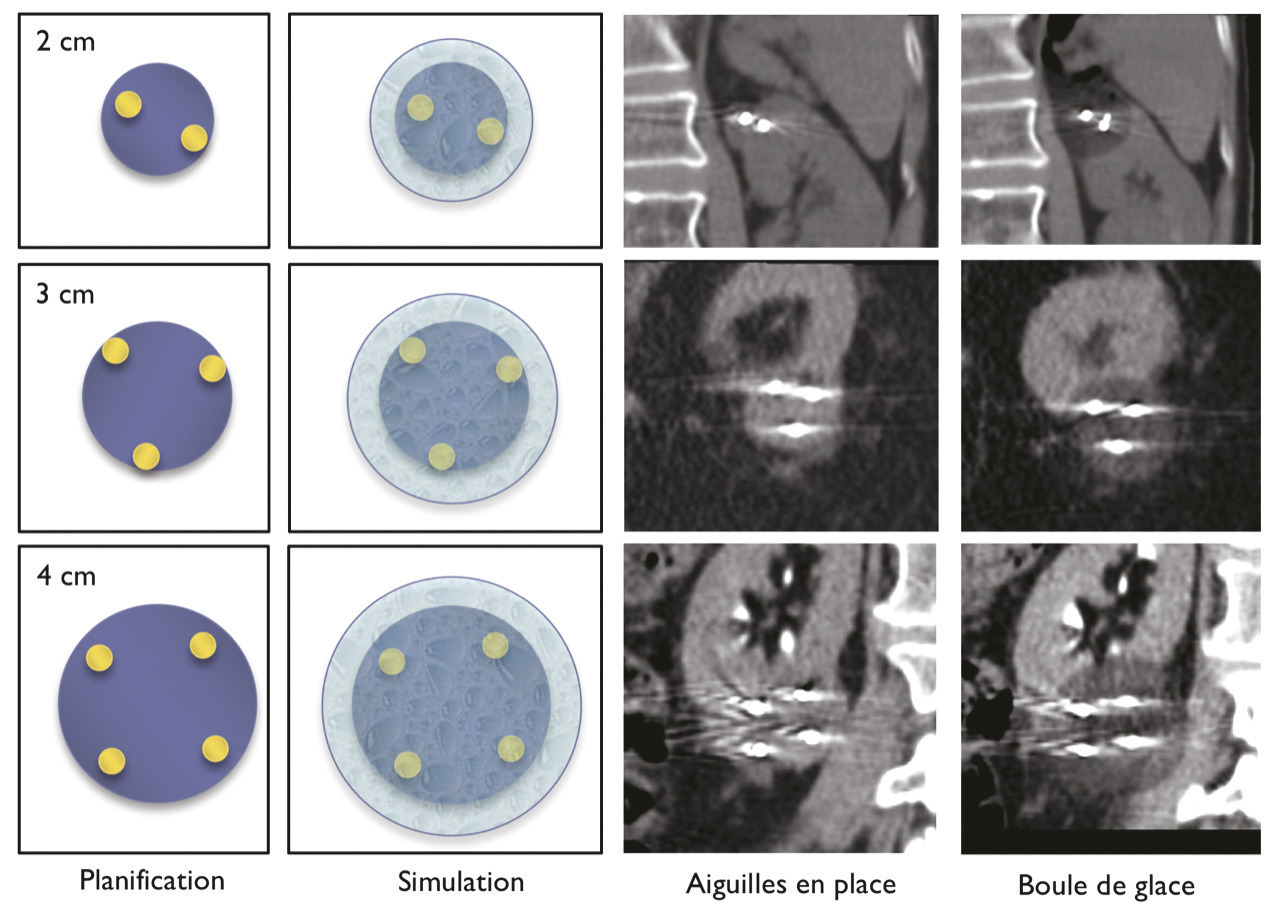
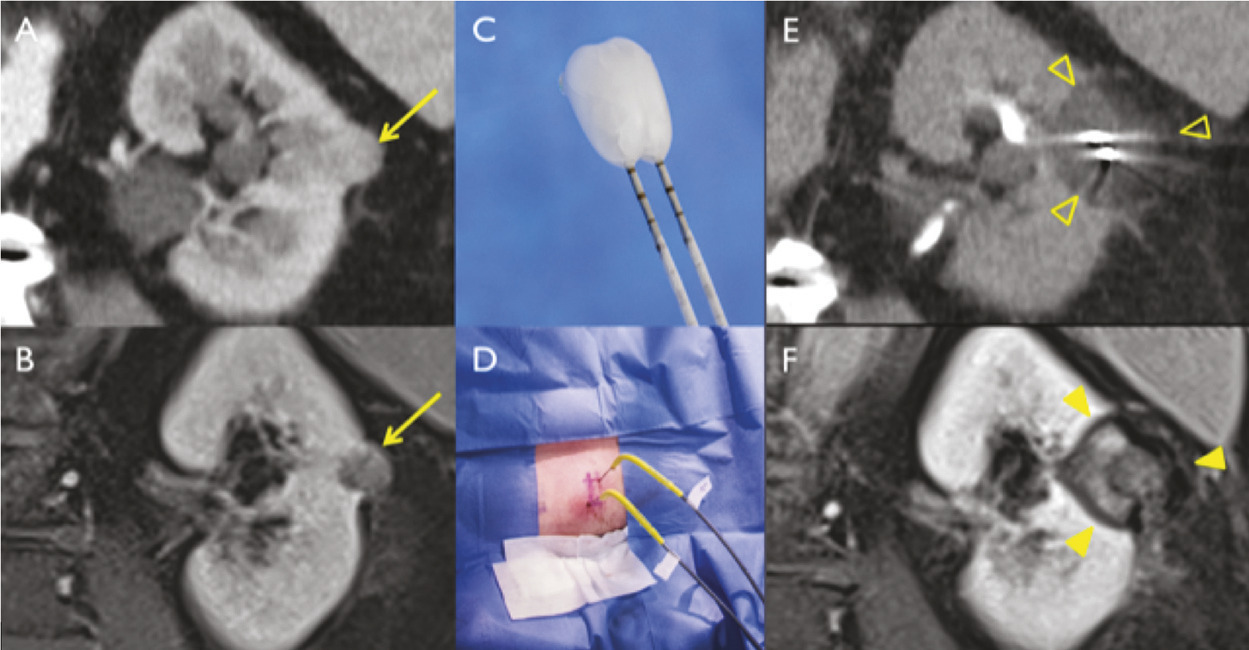
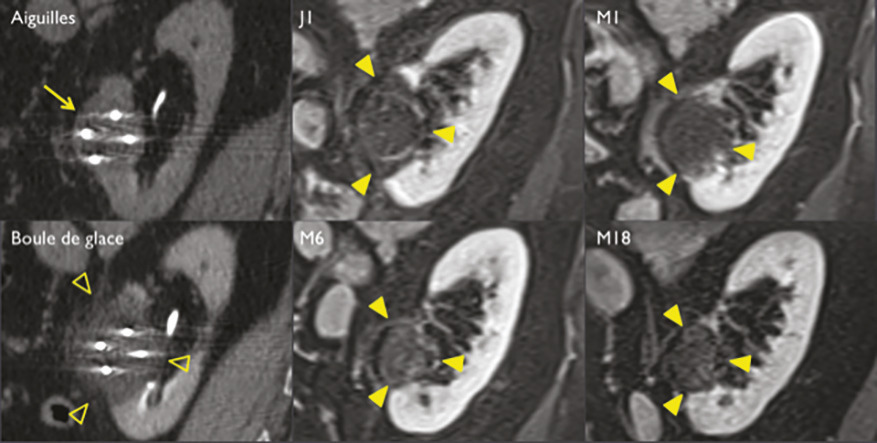
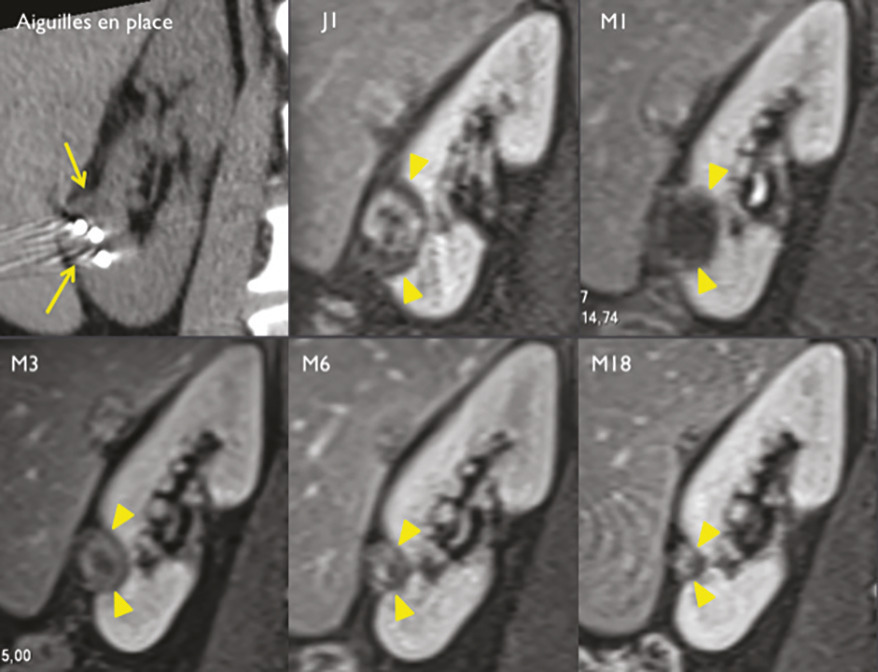
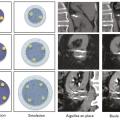
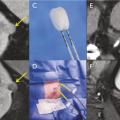
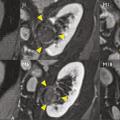
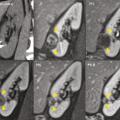
Pour chaque patient, un bilan d’hémostase est systématiquement réalisé avant la procédure. Pour les patients prenant des anticoagulants oraux, un relais par héparine de bas poids moléculaire est réalisé. Pour les antiagrégants plaquettaires, seul le clopidogrel doit être interrompu 5 jours avant. Le patient reçoit une prémédication par 1 g de paracétamol intraveineux 30 minutes avant la procédure. Il reste hospitalisé une nuit, mais une prise en charge ambulatoire est possible.La cryothérapie est réalisée sous anesthésie locale à l’aide d’un mélange de lidocaïne et de ropivacaïne. Contrairement à la radiofréquence ou aux micro-ondes où une seule électrode est insérée, la cryothérapie nécessite de mettre en place plusieurs aiguilles (cryoprobes) espacées au maximum de 15 mm afin de couvrir la totalité de la tumeur (fig. 1 ). Plus la tumeur est grosse, plus le nombre d’aiguilles à introduire est important. Il existe des abaques permettant de déterminer le nombre d’aiguilles optimal en fonction de la taille de la tumeur. Néanmoins, l’indication principale étant des tumeurs de stade T1a (< 4 cm de diamètre), le nombre moyen d’aiguilles est de 3, avec des extrêmes entre 2 et 5. Une injection de CO2 (carbodissection) ou de sérum physiologique (hydrodissection) est parfois nécessaire entre le rein et les organes adjacents afin de les éloigner de la zone d’ablation et les protéger.Les aiguilles sont mises en place sous tomodensitométrie et on vérifie leur bon positionnement. La dose délivrée lors d’une cryoablation rénale est inférieure aux niveaux de référence de dose recommandés pour une tomodensitométrie abdominale. Le traitement consiste en deux phases de cryoablation de 10 minutes entrecoupées d’une phase de réchauffement passif de 10 minutes également. L’effet cryogénique est obtenu par expansion d’un gaz (l’argon) dans une chambre de décompression de 2 à 4 cm de long située à l’extrémité de l’aiguille. Les températures minimales obtenues au contact de l’aiguille sont proches de -100 °C, en sachant qu’en moyenne la température de la tumeur se situe à -40 °C. La tomodensitométrie permet une excellente visualisation de la boule de glace, ce qui permet de monitorer l’ablation tout au long de la procédure. La boule de glace ainsi créée doit englober en totalité la tumeur et la dépasser de 5 mm afin d’avoir des marges de sécurité (fig. 2 ).6 En effet, le bord de la boule de glace est à l’isotherme 0 °C, qui n’est pas létal pour les tissus.Après traitement, le suivi des patients s’effectue par tomodensitométrie ou par imagerie par résonance magnétique (IRM), typiquement à 1 mois, 3 mois, 6 mois et 1 an, puis tous les ans. La zone d’ablation se rétracte progressivement et se fibrose, sans tumeur résiduelle visible (fig. 3 ). Pour les tumeurs de moins de 2 cm, le zone d’ablation disparaît parfois en totalité, laissant juste une encoche à la surface du rein (fig. 4 ). Les effets secondaires sont rares, la cryoablation étant mieux tolérée que les techniques d’ablation fondées sur le chauffage des lésions, en particulier pour les lésions proches de la voie excrétrice.7
Résultats
Si la néphrectomie partielle reste le traitement de référence des petites tumeurs du rein, la cryoablation peut être proposée pour le traitement des petites masses rénales chez les patients âgés ayant de multiples comorbidités.4 Le taux de traitement incomplet ou de récidive locale à distance de la cryothérapie (5 %) est supérieur à celui de la chirurgie partielle (3 %) mais semble inférieur à celui de la radiofréquence (13 %).4, 7 La cryoablation génère moins d’événements morbides que la radiofréquence ou la chirurgie partielle.4, 8, 9
Concernant le risque de récidive ou de traitement incomplet, les facteurs favorisants notés dans la littérature sont le type histologique, la taille de la tumeur et les marges d’ablation insuffisantes. Ainsi, les tumeurs à cellules claires, surtout de grades 2 et 3 de Furhman seraient associées à un risque de récidive plus élevé que les autres types de tumeurs.10 L’explication pourrait être le caractère très hypervasculaire de ces lésions qu’il serait plus difficile de refroidir, l’effet de la cryoablation étant contrebalancé par une perfusion tumorale importante. Les chances de succès diminuent avec la taille de la lésion, puisqu’il a été montré que les lésions de plus de 4 cm, surtout de localisation centrale, récidivaient plus souvent.11 Les lésions centrales sont au contact du pédicule rénal et de la voie excrétrice qui exercent un effet de réchauffement de la tumeur. En revanche, la cryothérapie présente l’avantage de préserver la matrice collagénique de la voie excrétrice et expose à moins de complications de type fistule ou sténose que la radiofréquence ou les micro-ondes. Enfin, des marges d’ablation inférieures à 5 mm seraient associées également à un risque de récidive plus élevé.12
La cryoablation percutanée sous tomodensitométrie est une bonne alternative à la chirurgie partielle ou à la surveillance simple pour les petites tumeurs du rein de stade T1a chez les patients à risque. À la différence de la radiofréquence ou des micro-ondes, elle est parfaitement réalisable sous anesthésie locale exclusive au prix d’une faible morbidité, puisque cette technique diminue les risques opératoires et anesthésiques.
Concernant le risque de récidive ou de traitement incomplet, les facteurs favorisants notés dans la littérature sont le type histologique, la taille de la tumeur et les marges d’ablation insuffisantes. Ainsi, les tumeurs à cellules claires, surtout de grades 2 et 3 de Furhman seraient associées à un risque de récidive plus élevé que les autres types de tumeurs.10 L’explication pourrait être le caractère très hypervasculaire de ces lésions qu’il serait plus difficile de refroidir, l’effet de la cryoablation étant contrebalancé par une perfusion tumorale importante. Les chances de succès diminuent avec la taille de la lésion, puisqu’il a été montré que les lésions de plus de 4 cm, surtout de localisation centrale, récidivaient plus souvent.11 Les lésions centrales sont au contact du pédicule rénal et de la voie excrétrice qui exercent un effet de réchauffement de la tumeur. En revanche, la cryothérapie présente l’avantage de préserver la matrice collagénique de la voie excrétrice et expose à moins de complications de type fistule ou sténose que la radiofréquence ou les micro-ondes. Enfin, des marges d’ablation inférieures à 5 mm seraient associées également à un risque de récidive plus élevé.12
La cryoablation percutanée sous tomodensitométrie est une bonne alternative à la chirurgie partielle ou à la surveillance simple pour les petites tumeurs du rein de stade T1a chez les patients à risque. À la différence de la radiofréquence ou des micro-ondes, elle est parfaitement réalisable sous anesthésie locale exclusive au prix d’une faible morbidité, puisque cette technique diminue les risques opératoires et anesthésiques.
Références
1. Lipworth L, Tarone RE, McLaughlin JK. The epidemiology of renal cell carcinoma. J Urol 2006;176:2353-8.
2. Luciani LG, Cestari R, Tallarigo C. Incidental renal cell carcinoma-age and stage characterization and clinical implications: study of 1092 patients (1982-1997). Urology 2000;56:58-62.
3. Moskowitz D, Chang J, Ziogas A, Anton-Culver H, Clayman RV. Adult urology oncology: adrenal/renal/upper tract/bladder treatment for t1a renal cancer substratified by size: “Less is more”. J Urol 2016;196:1000-7.
4. Bensalah K, Albiges L, Bernhard JC, et al. Recommandations en onco-urologie 2016-2018 du CCAFU : Cancer du rein. Prog Urol 2016;27:S27-S51.
5. de Kerviler E, de Margerie-Mellon C, Coffin A, et al. The feasibility of percutaneous renal cryoablation under local anaesthesia. Cardiovasc Intervent Radiol 2014;38:672-7.
6. Krokidis ME, Orsi F, Katsanos K, Helmberger T, Adam A. CIRSE guidelines on percutaneous ablation of small renal cell carcinoma. Cardiovasc Intervent Radiol 2017;40:177-91.
7. Kunkle DA, Uzzo RG. Cryoablation or radiofrequency ablation of the small renal mass. Cancer 2008;113:2671-80.
8. Atwell TD, Carter RE, Schmit GD, et al. Complications following 573 percutaneous renal radiofrequency and cryoablation procedures. J Vasc Interv Radiol 2012;23:48-54.
9. Georgiades CS, Rodriguez R. Efficacy and safety of percutaneous cryoablation for stage 1a/b renal cell carcinoma: results of a prospective, single-arm, 5-year study. Cardiovasc Intervent Radiol 2014;37:1494-9.
10. Beksac AT, Rivera-Sanfeliz G, Dufour CA, et al. Impact of tumor histology and grade on treatment success of percutaneous renal cryoablation. World J Urol 2017;35:633-40.
11. Breen DJ, Bryant TJ, Abbas A, et al. Percutaneous cryoablation of renal tumours: outcomes from 171 tumours in 147 patients. BJU Int 2013;112:758-65.
12. Yamanaka T, Yamakado K, Yamada T, et al. CT-guided percutaneous cryoablation in renal cell carcinoma_ factors affecting local tumor control. J Vasc Interv Radiol 2015;26:1147-53.
2. Luciani LG, Cestari R, Tallarigo C. Incidental renal cell carcinoma-age and stage characterization and clinical implications: study of 1092 patients (1982-1997). Urology 2000;56:58-62.
3. Moskowitz D, Chang J, Ziogas A, Anton-Culver H, Clayman RV. Adult urology oncology: adrenal/renal/upper tract/bladder treatment for t1a renal cancer substratified by size: “Less is more”. J Urol 2016;196:1000-7.
4. Bensalah K, Albiges L, Bernhard JC, et al. Recommandations en onco-urologie 2016-2018 du CCAFU : Cancer du rein. Prog Urol 2016;27:S27-S51.
5. de Kerviler E, de Margerie-Mellon C, Coffin A, et al. The feasibility of percutaneous renal cryoablation under local anaesthesia. Cardiovasc Intervent Radiol 2014;38:672-7.
6. Krokidis ME, Orsi F, Katsanos K, Helmberger T, Adam A. CIRSE guidelines on percutaneous ablation of small renal cell carcinoma. Cardiovasc Intervent Radiol 2017;40:177-91.
7. Kunkle DA, Uzzo RG. Cryoablation or radiofrequency ablation of the small renal mass. Cancer 2008;113:2671-80.
8. Atwell TD, Carter RE, Schmit GD, et al. Complications following 573 percutaneous renal radiofrequency and cryoablation procedures. J Vasc Interv Radiol 2012;23:48-54.
9. Georgiades CS, Rodriguez R. Efficacy and safety of percutaneous cryoablation for stage 1a/b renal cell carcinoma: results of a prospective, single-arm, 5-year study. Cardiovasc Intervent Radiol 2014;37:1494-9.
10. Beksac AT, Rivera-Sanfeliz G, Dufour CA, et al. Impact of tumor histology and grade on treatment success of percutaneous renal cryoablation. World J Urol 2017;35:633-40.
11. Breen DJ, Bryant TJ, Abbas A, et al. Percutaneous cryoablation of renal tumours: outcomes from 171 tumours in 147 patients. BJU Int 2013;112:758-65.
12. Yamanaka T, Yamakado K, Yamada T, et al. CT-guided percutaneous cryoablation in renal cell carcinoma_ factors affecting local tumor control. J Vasc Interv Radiol 2015;26:1147-53.