Le déficit en mévalonate kinase (MKD) est une maladie autosomique récessive rare liée à des mutations dans le gène MVK, caractérisée par des épisodes fébriles et inflammatoires récurrents tout au long de la vie. Son diagnostic et sa prise en charge ont fait l’objet d’un protocole national de diagnostic et de soins (PNDS).1
Le déficit en mévalonate kinase a été décrit pour la première fois aux Pays-Bas et en France, mais il touche des patients du monde entier.2 Les premiers symptômes surviennent tôt, généralement au cours de la première année de vie. Le nombre de cas en France est estimé à moins de 300.
Le déficit en mévalonate kinase a été décrit pour la première fois aux Pays-Bas et en France, mais il touche des patients du monde entier.2 Les premiers symptômes surviennent tôt, généralement au cours de la première année de vie. Le nombre de cas en France est estimé à moins de 300.
Inflammation due à une production excessive d’interleukine 1
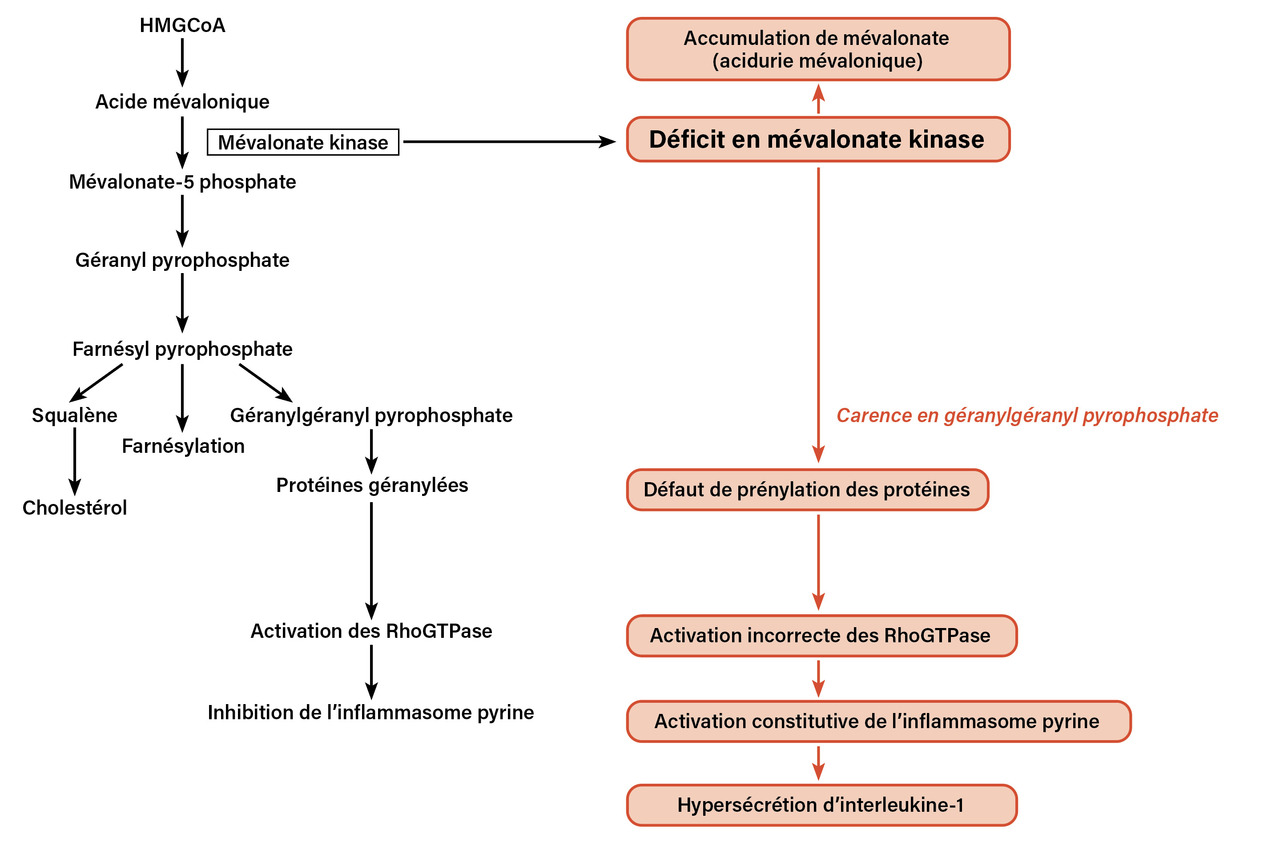
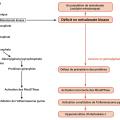
Le MKD est lié à des mutations dans le gène MVK codant pour la mévalonate kinase, une enzyme située sur la voie de synthèse du cholestérol et des isoprénoïdes non stérols (fig. 1 ).3 Des études ont montré que la pénurie temporaire de géranylgéranyl pyrophosphate, causée par le blocage (temporaire) de leur synthèse, affecte la prénylation (farnésylation et géranylgéranylation) des protéines dans le MKD.4 Le groupe le plus important de protéines prénylées est constitué par les petites protéines G (GTPases de la famille RAS/RHO). Des études ont établi un lien entre l’altération de la géranylgéranylation des petites GTPases dans le MKD et l’activation de la pyrine.5 L’activation de l’inflammasome de la pyrine entraîne l’activation de la caspase 1 et la libération ultérieure d’interleukine 1β (IL-1β) et d’IL-18 actives.
Les caractéristiques inflammatoires du MKD sont causées par une production excessive d’IL-1, mais les symptômes neurologiques ou oculaires observés dans l’acidurie mévalonique (AM) sont moins bien compris. L’acide mévalonique pourrait être toxique.
Les caractéristiques inflammatoires du MKD sont causées par une production excessive d’IL-1, mais les symptômes neurologiques ou oculaires observés dans l’acidurie mévalonique (AM) sont moins bien compris. L’acide mévalonique pourrait être toxique.
Symptomatologie variable selon l’ampleur du déficit en mévalonate kinase
Le spectre clinique variable et continu dépend en partie de l’activité résiduelle de la mévalonate kinase, allant du syndrome hyper-IgD (HIDS ; déficit partiel) à l’AM (déficit complet).2,6 Il n’est pas toujours aisé de distinguer le HIDS et l’AM. Le délai diagnostique peut être long. Néanmoins, il tend à diminuer. En effet, dans le registre Eurofever, le délai diagnostique était de 2,5 ans (0,1-8,3).6
Déficit partiel en MK
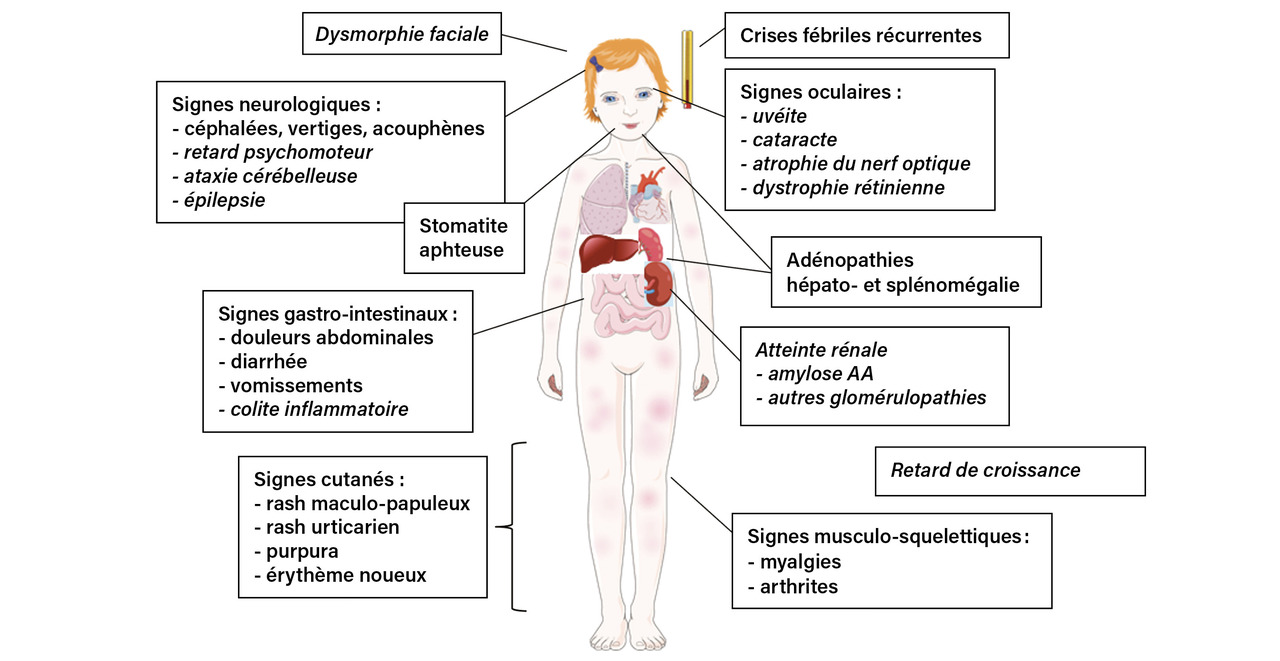
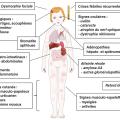
Le HIDS se manifeste le plus souvent avant l’âge de 1 an par des épisodes de fièvre élevée pouvant être déclenchés par la fatigue, une vaccination et le stress, et qui surviennent régulièrement toutes les deux à huit semaines. La fièvre dure typiquement entre trois et sept jours et s’accompagne d’adénopathies cervicales douloureuses, d’aphtes buccaux, de douleurs abdominales avec splénomégalie, de diarrhée et vomissements.7 Des arthralgies ou arthrites des grosses articulations, une éruption cutanée polymorphe (maculopapuleuse, urticarienne, à type d’érythème noueux ou de purpura) aspécifique et des céphalées sont fréquemment associés (fig. 2 ).6,7
Le diagnostic différentiel principal du MKD est le syndrome PFAPA (fièvre périodique, aphtes, pharyngite, adénopathies) qui est le syndrome le plus fréquent de fièvre récurrente et qui touche le plus souvent les enfants de moins de 5 ans (voir « Syndrome de Marshall. Évolution bénigne mais possible impact sur la qualité de vie »,page 838 ).
Le diagnostic différentiel principal du MKD est le syndrome PFAPA (fièvre périodique, aphtes, pharyngite, adénopathies) qui est le syndrome le plus fréquent de fièvre récurrente et qui touche le plus souvent les enfants de moins de 5 ans (voir « Syndrome de Marshall. Évolution bénigne mais possible impact sur la qualité de vie »,
Acidurie mévalonique
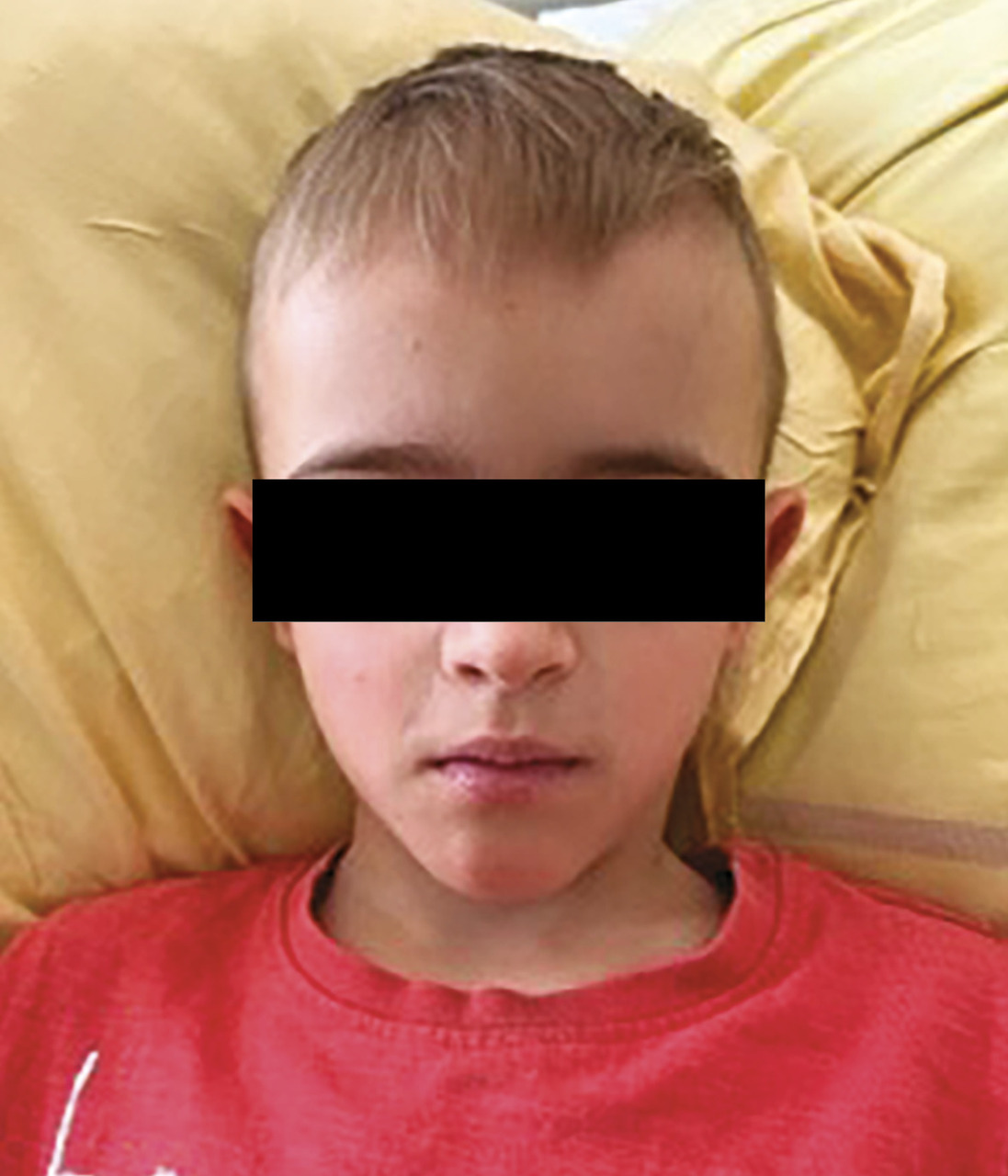
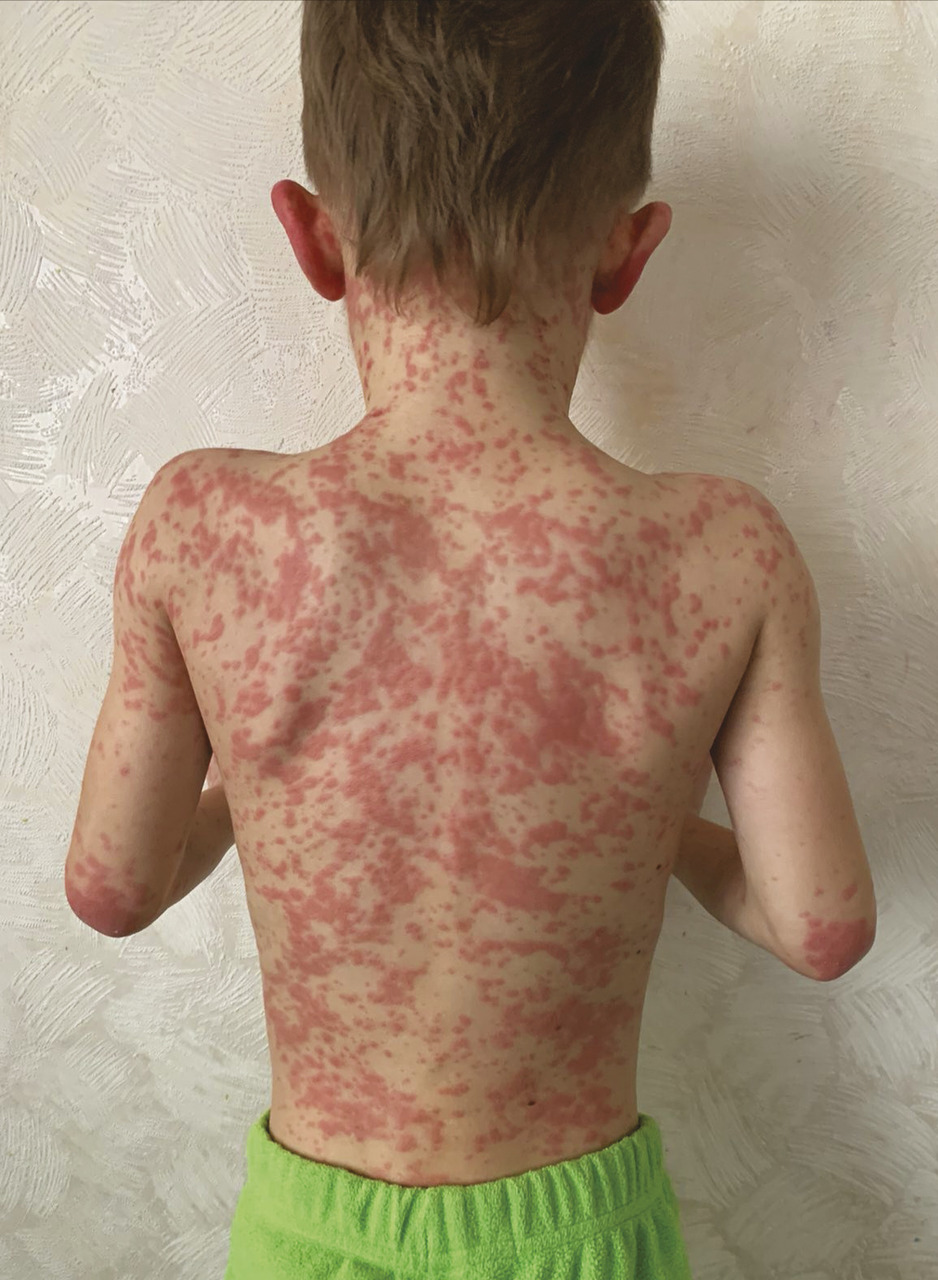
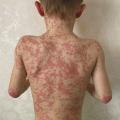
Au cours de l’AM, il existe, en plus des manifestations inflammatoires, un retard staturo-pondéral, un syndrome dysmorphique comprenant notamment un visage triangulaire avec des bosses frontales proéminentes (fig. 3 ) et des manifestations neurologiques diverses : retard psychomoteur, épilepsie, ataxie cérébelleuse progressive, baisse de l’acuité visuelle, voire cécité par cataracte, uvéite, atrophie du nerf optique ou rétinite pigmentaire. Les patients ont des crises fréquentes associant de la fièvre, des vomissements, une diarrhée pouvant être sanglante (des colites inflammatoires sévères sont rarement décrites), des arthralgies et un rash morbiliforme ou urticarien (fig. 4 ). Quelques cas d’amylose AA ont été rapportés,8 ainsi que d’autres glomérulopathies.2 Les formes graves d’AM conduisent au décès de l’enfant avant l’âge de 2 ans, du fait d’une insuffisance hépatique, d’un syndrome d’activation macrophagique et/ou d’infection sévère, notamment pneumococcique,2 en l’absence de prise en charge thérapeutique adéquate.
Rechercher un syndrome inflammatoire biologique et l’acidurie métabolique dans les urines
Il existe un syndrome inflammatoire marqué lors des pics fébriles (protéine C-réactive [CRP]), protéine sérum amyloïde A [SAA], globules blancs et plaquettes élevés ainsi qu’une anémie inflammatoire). La CRP peut rester élevée en dehors des pics de fièvre dans les formes les plus sévères de MKD. La concentration élevée d’immunoglobulines D (IgD) n’est ni sensible ni spécifique dans cette maladie.
Dans le HIDS, les patients ont une activité résiduelle de mévalonate kinase de 1 à 12 %. Cela conduit à une excrétion modérée d’AM dans les urines (souvent inférieure à 30 mmol/L de créatinine) en période de fièvre, car l’activité résiduelle de la MVK est thermosensible.
En revanche, chez les patients avec une AM, l’activité de la MVK est inférieure à 1 % de celle retrouvée chez les contrôles, l’excrétion rénale d’AM étant en permanence beaucoup plus élevée (entre 1 000 et 56 000 mmol/L de créatinine).9
En cas de suspicion de MKD, il convient donc de rechercher un syndrome inflammatoire et de doser l’AM sur des urines congelées recueillies en période inflammatoire. Le diagnostic est confirmé par la mise en évidence de mutations homozygotes ou hétérozygotes composites pathogènes. Le dosage d’IgD n’est pas recommandé. Actuellement, il est possible, en cas de forte suspicion clinique, de faire directement cette étude génétique sans dosage urinaire (encadré ).
Dans le HIDS, les patients ont une activité résiduelle de mévalonate kinase de 1 à 12 %. Cela conduit à une excrétion modérée d’AM dans les urines (souvent inférieure à 30 mmol/L de créatinine) en période de fièvre, car l’activité résiduelle de la MVK est thermosensible.
En revanche, chez les patients avec une AM, l’activité de la MVK est inférieure à 1 % de celle retrouvée chez les contrôles, l’excrétion rénale d’AM étant en permanence beaucoup plus élevée (entre 1 000 et 56 000 mmol/L de créatinine).9
En cas de suspicion de MKD, il convient donc de rechercher un syndrome inflammatoire et de doser l’AM sur des urines congelées recueillies en période inflammatoire. Le diagnostic est confirmé par la mise en évidence de mutations homozygotes ou hétérozygotes composites pathogènes. Le dosage d’IgD n’est pas recommandé. Actuellement, il est possible, en cas de forte suspicion clinique, de faire directement cette étude génétique sans dosage urinaire (
Prise en charge adaptée selon la sévérité
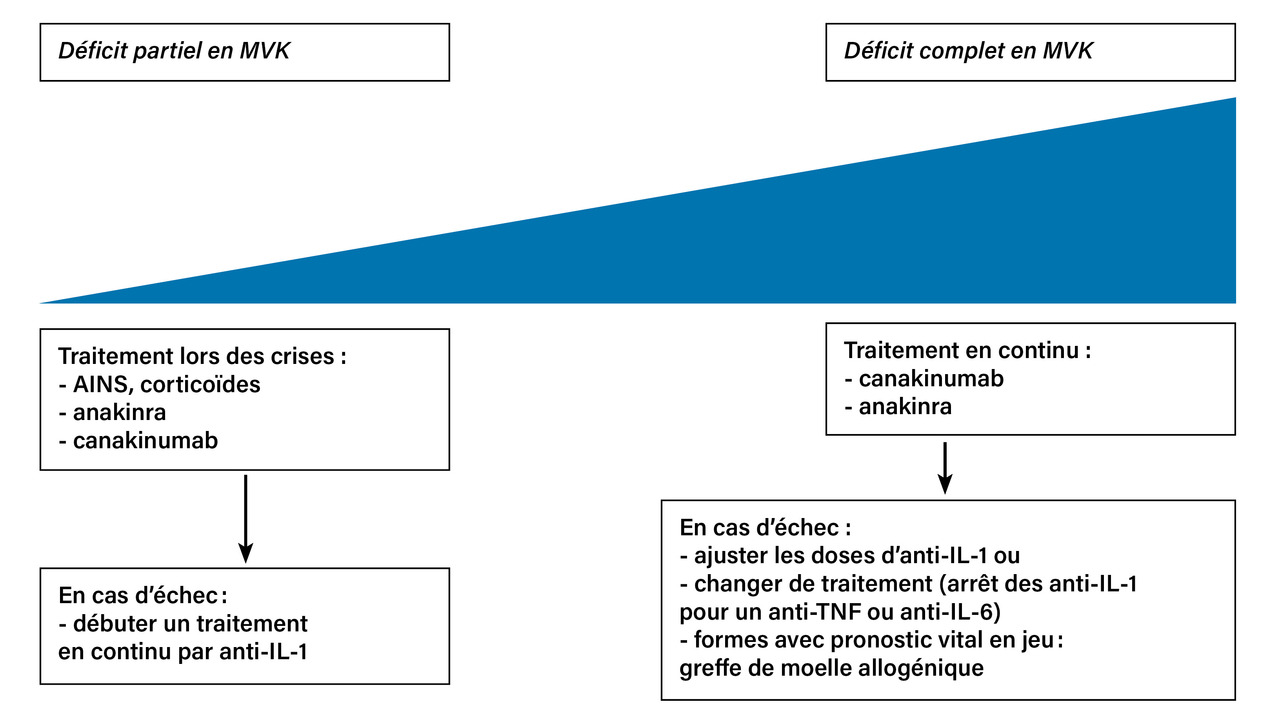
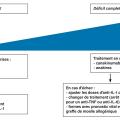
Les modalités de prise en charge varient en fonction du déficit en MVK (fig. 5 ).
Anti-inflammatoires lors des crises
Les anti-inflammatoires non stéroïdiens (AINS) et les corticoïdes sont administrés au moment des crises fébriles (fig. 5 ). L’anakinra peut être utilisé à la demande, lors des accès fébriles.10,11
Traitement de fond des formes sévères : efficacité des biothérapies
Les biothérapies doivent être réservées aux patients ayant des formes sévères ou en cas d’échec des AINS et des corticoïdes (fig. 5 ). Les deux antagonistes de l’IL-1 utilisés en France sont l’anakinra, forme recombinante de l’ILRa, un antagoniste endogène des récepteurs de l’IL-1, et le canakinumab, anticorps monoclonal dirigé contre l’IL-1β.
L’efficacité des inhibiteurs de l’interleukine 1 chez les patients atteints de MKD/HIDS a été démontrée et a conduit à l’obtention d’une autorisation de mise sur le marché (AMM) pour le canakinumab. En effet, l’étude CLUSTER a montré que le traitement par canakinumab, à la dose de 150 mg (ou 2 mg/kg chez les enfants de moins de 40 kg) toutes les quatre semaines, conduit à une rémission complète chez 35 % des patients après seize semaines, contre 6 % chez les patients recevant un placebo. Une dose de 300 mg (ou 4 mg/kg chez les enfants de moins de 40 kg) toutes les quatre semaines a encore augmenté l’effet à 57 %.12
L’anakinra est utilisé hors AMM dans le déficit en mévalonate kinase, soit à la demande, soit au long cours.10,11
Dans certains cas, une réponse au traitement par des inhibiteurs du TNF-α ou de l’IL-6 a été rapportée.11
Dans les cas graves et en cas de mauvaise qualité de vie, une greffe de cellules souches hématopoïétiques allogènes (HSCT) peut être envisagée.11
L’efficacité des inhibiteurs de l’interleukine 1 chez les patients atteints de MKD/HIDS a été démontrée et a conduit à l’obtention d’une autorisation de mise sur le marché (AMM) pour le canakinumab. En effet, l’étude CLUSTER a montré que le traitement par canakinumab, à la dose de 150 mg (ou 2 mg/kg chez les enfants de moins de 40 kg) toutes les quatre semaines, conduit à une rémission complète chez 35 % des patients après seize semaines, contre 6 % chez les patients recevant un placebo. Une dose de 300 mg (ou 4 mg/kg chez les enfants de moins de 40 kg) toutes les quatre semaines a encore augmenté l’effet à 57 %.12
L’anakinra est utilisé hors AMM dans le déficit en mévalonate kinase, soit à la demande, soit au long cours.10,11
Dans certains cas, une réponse au traitement par des inhibiteurs du TNF-α ou de l’IL-6 a été rapportée.11
Dans les cas graves et en cas de mauvaise qualité de vie, une greffe de cellules souches hématopoïétiques allogènes (HSCT) peut être envisagée.11
Surveillance individualisée nécessaire
Le suivi clinique doit être multidisciplinaire et dépend des manifestations propres à chaque patient. Il est effectué en moyenne tous les six mois dans un centre de référence ou de compétence pour les patients sous biothérapie et dont la maladie est correctement contrôlée, et une fois par an pour les patients bien équilibrés sans biothérapie. Il comprend un examen clinique complet, avec la surveillance de la croissance staturo-pondérale chez l’enfant, la mesure de l’activité de la maladie : application MAImoris-e, score AIDAI (Auto-inflammatory Disease Activity Index).
Les examens complémentaires de suivi du MKD comportent les éléments suivants :
– hémogramme, CRP, protéine SAA (au minimum une fois par an, plus fréquent en période d’équilibration d’un traitement) ;
– bilan hépatique, fonction rénale, bandelette urinaire (une fois tous les 6 mois), dosage une fois par an du rapport protéinurie/créatininurie ;
– consultation ophtalmologique annuelle.
D’autres examens peuvent être nécessaires, selon les atteintes cliniques et les traitements.
Les examens complémentaires de suivi du MKD comportent les éléments suivants :
– hémogramme, CRP, protéine SAA (au minimum une fois par an, plus fréquent en période d’équilibration d’un traitement) ;
– bilan hépatique, fonction rénale, bandelette urinaire (une fois tous les 6 mois), dosage une fois par an du rapport protéinurie/créatininurie ;
– consultation ophtalmologique annuelle.
D’autres examens peuvent être nécessaires, selon les atteintes cliniques et les traitements.
Impact important sur la qualité de vie
La fréquence des accès fébriles diminue avec le temps chez certaines personnes. Néanmoins, cette maladie affecte la vie des patients, en provoquant des retards scolaires, en induisant une difficulté à travailler et en affectant négativement de multiples aspects de la vie. Le MKD à l’âge adulte est, dans les phénotypes les plus sévères, dominé par le handicap neurologique et sensoriel. Rarement, une amylose systémique AA peut survenir.2,8
Encadre
Critères de classification Eurofever/PRINTO du déficit en mévalonate kinase
Présence de mutation homozygote ou hétérozygote composite du gène MVK et au moins l’un des trois critères suivants :
– symptômes gastro-intestinaux,
– adénopathies cervicales,
– stomatite aphteuse.
Références
1. Protocole national de diagnostic et de soins (PNDS). Déficit en mévalonate kinase (MKD). Haute Autorité de santé. Juillet 2015. https://vu.fr/qguDk
2. Bader-Meunier B, Florkin B, Sibilia J, Acquaviva C, Hachulla E, Grateau G, et al. Mevalonate kinase deficiency: A survey of 50 patients. Pediatrics 2011;128(1):e152-9.
3. Houten SM, Kuis W, Duran M, de Koning TJ, van Royen-Kerkhof A, Romeijn GJ, et al. Mutations in MVK, encoding mevalonate kinase, cause hyperimmunoglobulinaemia D and periodic fever syndrome. Nature Genetics 1999;22(2):175-7.
4. Frenkel J, Rijkers GT, Mandey SH, Buurman SW, Houten SM, Wanders RJ, et al. Lack of isoprenoid products raises ex vivo interleukin-1beta secretion in hyperimmunoglobulinemia D and periodic fever syndrome. Arthritis & Rheumatism 2002;46(10):2794-803.
5. Park YH, Wood G, Kastner DL, Chae JJ. Pyrin inflammasome activation and RhoA signaling in the autoinflammatory diseases FMF and HIDS. Nature Immunology 2016;17(8):914-21.
6. Ter Haar NM, Jeyaratnam J, Lachmann HJ, Simon A, Brogan PA, Doglio M, et al. The phenotype and genotype of mevalonate kinase deficiency: A series of 114 cases from the Eurofever Registry. Arthritis Rheumatol 2016; 68(11):2795-805.
7. Gattorno M, Hofer M, Federici S, Vanoni D, Bovis F, Aksentijevich, et al. Classification criteria for autoinflammatory recurrent fevers. Ann Rheum Dis 2019;78(8):1025-32.
8. Rodrigues F, Philit JB, Giurgea I, Anglicheau D, Roux JJ, Hoyeau N,et al. AA amyloidosis revealing mevalonate kinase deficiency: A report of 20 cases including two new French cases and a comprehensive review of literature. Semin Arthritis Rheum 2020;50(6):1370-73.
9. Jeyaratnam J, Ter Haar NM, de Sain-van der Velden MG, Waterham HR, van Gijn ME, Frenkel J. Diagnostic value of urinary mevalonic acid excretion in patients with a clinical suspicion of mevalonate kinase deficiency (MKD). JIMD Rep 2016;27:33-8.
10. Bodar EJ, Kuijk LM, Drenth JP, Van der Meer JW, Simon A, Frenkel J. On-demand anakinra treatment is effective in mevalonate kinase deficiency. Annals of the Rheumatic Diseases 2011;70(12):2155-8.
11. Ter Haar N, Lachmann H, Ozen S, Woo P, Uziel Y, Modesto C, et al. Treatment of autoinflammatory diseases: Results from the Eurofever Registry and a literature review. Annals of the Rheumatic Diseases 2013;72(5):678-85.
12. De Benedetti F, Gattorno M, Anton J, Ben Chetrit, Frenkel J, Hoffman HM, et al. Canakinumab for the treatment of autoinflammatory recurrent fever syndromes. N Engl J Med 2018;378(20):1908-19.
13. Romano M, Arici ZS, Piskin D, Alehashemi S, Aletaha D, Barron KS, et al. The 2021 EULAR/American college of Rheumatology points to consider for diagnosis, management and monitoring of the interleukin-1 mediated autoinflammatory diseases: Cryopyrin-associated periodic syndromes, tumour necrosis factor receptor-associated periodic syndrome, mevalonate kinase deficiency, and deficiency of the interleukin-1 receptor antagonist. Ann Rheum Dis 2022;81(7):907-21.
2. Bader-Meunier B, Florkin B, Sibilia J, Acquaviva C, Hachulla E, Grateau G, et al. Mevalonate kinase deficiency: A survey of 50 patients. Pediatrics 2011;128(1):e152-9.
3. Houten SM, Kuis W, Duran M, de Koning TJ, van Royen-Kerkhof A, Romeijn GJ, et al. Mutations in MVK, encoding mevalonate kinase, cause hyperimmunoglobulinaemia D and periodic fever syndrome. Nature Genetics 1999;22(2):175-7.
4. Frenkel J, Rijkers GT, Mandey SH, Buurman SW, Houten SM, Wanders RJ, et al. Lack of isoprenoid products raises ex vivo interleukin-1beta secretion in hyperimmunoglobulinemia D and periodic fever syndrome. Arthritis & Rheumatism 2002;46(10):2794-803.
5. Park YH, Wood G, Kastner DL, Chae JJ. Pyrin inflammasome activation and RhoA signaling in the autoinflammatory diseases FMF and HIDS. Nature Immunology 2016;17(8):914-21.
6. Ter Haar NM, Jeyaratnam J, Lachmann HJ, Simon A, Brogan PA, Doglio M, et al. The phenotype and genotype of mevalonate kinase deficiency: A series of 114 cases from the Eurofever Registry. Arthritis Rheumatol 2016; 68(11):2795-805.
7. Gattorno M, Hofer M, Federici S, Vanoni D, Bovis F, Aksentijevich, et al. Classification criteria for autoinflammatory recurrent fevers. Ann Rheum Dis 2019;78(8):1025-32.
8. Rodrigues F, Philit JB, Giurgea I, Anglicheau D, Roux JJ, Hoyeau N,et al. AA amyloidosis revealing mevalonate kinase deficiency: A report of 20 cases including two new French cases and a comprehensive review of literature. Semin Arthritis Rheum 2020;50(6):1370-73.
9. Jeyaratnam J, Ter Haar NM, de Sain-van der Velden MG, Waterham HR, van Gijn ME, Frenkel J. Diagnostic value of urinary mevalonic acid excretion in patients with a clinical suspicion of mevalonate kinase deficiency (MKD). JIMD Rep 2016;27:33-8.
10. Bodar EJ, Kuijk LM, Drenth JP, Van der Meer JW, Simon A, Frenkel J. On-demand anakinra treatment is effective in mevalonate kinase deficiency. Annals of the Rheumatic Diseases 2011;70(12):2155-8.
11. Ter Haar N, Lachmann H, Ozen S, Woo P, Uziel Y, Modesto C, et al. Treatment of autoinflammatory diseases: Results from the Eurofever Registry and a literature review. Annals of the Rheumatic Diseases 2013;72(5):678-85.
12. De Benedetti F, Gattorno M, Anton J, Ben Chetrit, Frenkel J, Hoffman HM, et al. Canakinumab for the treatment of autoinflammatory recurrent fever syndromes. N Engl J Med 2018;378(20):1908-19.
13. Romano M, Arici ZS, Piskin D, Alehashemi S, Aletaha D, Barron KS, et al. The 2021 EULAR/American college of Rheumatology points to consider for diagnosis, management and monitoring of the interleukin-1 mediated autoinflammatory diseases: Cryopyrin-associated periodic syndromes, tumour necrosis factor receptor-associated periodic syndrome, mevalonate kinase deficiency, and deficiency of the interleukin-1 receptor antagonist. Ann Rheum Dis 2022;81(7):907-21.
Dans cet article
- Inflammation due à une production excessive d’interleukine 1
- Symptomatologie variable selon l’ampleur du déficit en mévalonate kinase
- Rechercher un syndrome inflammatoire biologique et l’acidurie métabolique dans les urines
- Prise en charge adaptée selon la sévérité
- Surveillance individualisée nécessaire
- Impact important sur la qualité de vie

 Encadrés
Encadrés