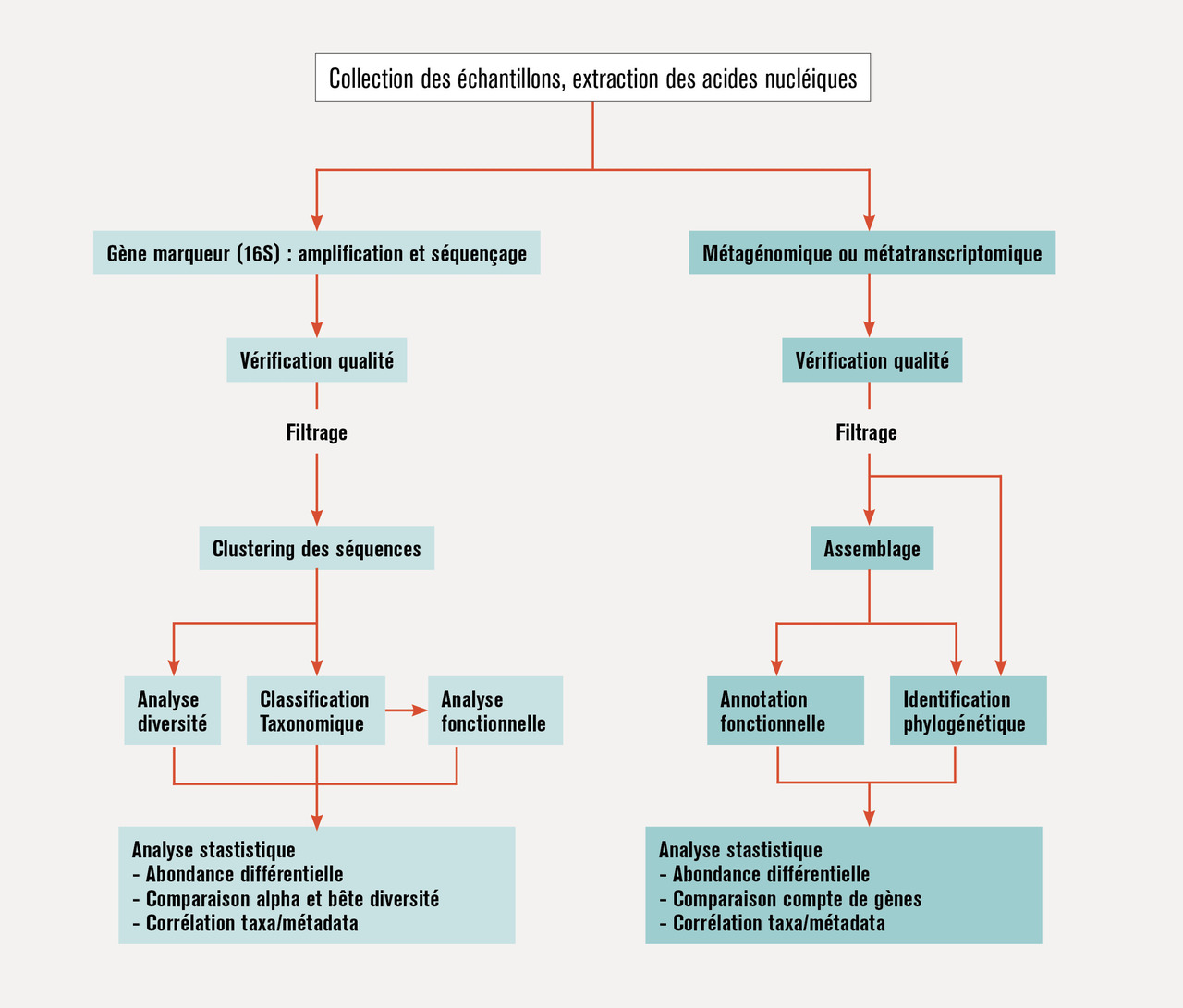
La classification des êtres vivants comporte plusieurs niveaux. Le règne (Procaryotae) est le premier niveau de classification. Vient ensuite le domaine (Bacteria), le phylum, la classe, l’ordre, la famille, le genre et l’espèce. Les bactéries ont longtemps été classées (taxonomie) selon des critères morphologiques et fonctionnels (capacités à utiliser les différents types de sucres, par exemple). Cependant, ce type de classification est totalement inadapté à l’étude du microbiote intestinal car elle nécessite la culture in vitro des bactéries, alors qu’à peine 30 % des bactéries de ce microbiote sont cultivables par les techniques classiques. Plus récemment, une taxonomie fondée sur la séquence nucléique de certaines molécules a été développée. Cette taxonomie phylogénétique est fondée sur la distance génétique qui existe entre les différentes espèces bactériennes et reflète les liens de parenté évolutive entre les micro-organismes. Pour l’analyse phylogénétique des bactéries, c’est un gène marqueur, celui codant la petite sous-unité du ribosome bactérien (ARNr16S), qui est universellement utilisé. En comparant les séquences étudiées à des bases de données, on peut identifier les bactéries en question. Il est également possible de séquencer l’ensemble de l’ADN microbien du microbiote afin de déterminer les gènes microbiens qui le composent et donc de mieux caractériser les micro-organismes présents et leurs fonctions (on parle de métagénomique) [fig. 1 ]. À côté de l’ADN, il est aussi possible d’étudier l’ensemble de l’ARN (métatranscriptome), des protéines (métaprotéome) et des métabolites (métabolome) du microbiote.
De quoi est composé le microbiote intestinal ?
Le microbiote intestinal représente l’ensemble des micro-organismes vivant dans le tractus digestif humain, principalement localisé au niveau de l’intestin grêle et du côlon, l’acidité gastrique freinant la colonisation de l’estomac. Environ 1013 micro-organismes sont hébergés, avec une répartition suivant un gradient de concentration de proximal en distal, la densité étant maximale au niveau du côlon distal, avec de l’ordre de 1011 micro-organismes par gramme de contenu.
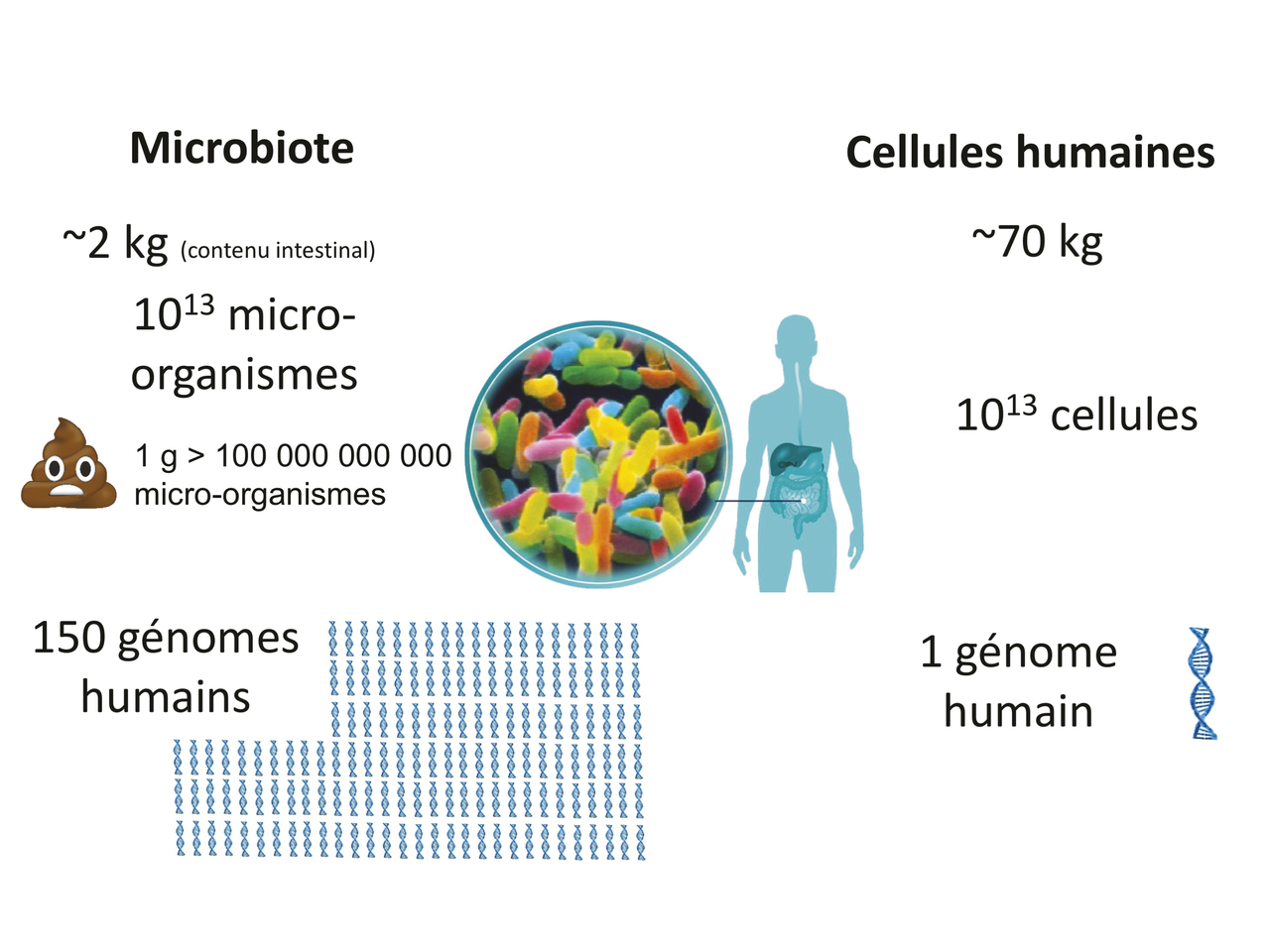
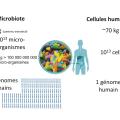
Chaque individu héberge plusieurs centaines d’espèces bactériennes différentes. Le microbiome (ensemble des gènes du microbiote) représente ainsi une très grande diversité estimée à environ 100 à 150 fois le génome humain (fig. 2 ). Vivant dans un environnement très spécifique, ces bactéries sont difficilement cultivables en laboratoire. Les progrès en biologie moléculaire ont permis d’étudier la composition du microbiote intestinal bactérien. Quatre phyla dominent : les Firmicutes (60 à 75 % des bactéries du microbiote), les Bacteroidetes (10 à 40 %), les Actinobacteria (3 %) et les Proteobacteria. Coexistent également, mais à des taux bien plus bas, des Fusobacteria et des Verrucomicrobia.
À côté des bactéries, qui sont les plus étudiées, d’autres types de micro-organismes sont présents dans le microbiote intestinal. Les champignons sont numériquement bien moins représentés que les bactéries, avec 105 à 106 champignons par gramme de selles, mais ils sont en général 100 fois plus volumineux que les bactéries, et leur complexité est également bien supérieure, suggérant qu’ils sont aussi des acteurs importants de l’écologie intestinale. Les phages, virus ciblant les bactéries, sont présents en grand nombre dans l’intestin et ils pourraient, comme ils le font dans les écosystèmes océaniques, y réguler les populations bactériennes. Enfin, des Archeae et des Protistes participent également à l’équilibre de cet écosystème intestinal complexe.
Il existe une très forte variabilité interindividuelle en termes de composition, et chaque individu a un microbiote intestinal qui lui est propre. En revanche, le microbiote ne s’organise pas de manière aléatoire, et trois grands types d’organisation du microbiote ont été décrits chez l’homme, appelés « entérotypes ».1 On sait aujourd’hui que ces entérotypes ne sont pas figés et qu’un individu peut en changer s’il modifie son mode de vie et notamment son alimentation.
Chaque individu héberge plusieurs centaines d’espèces bactériennes différentes. Le microbiome (ensemble des gènes du microbiote) représente ainsi une très grande diversité estimée à environ 100 à 150 fois le génome humain (
À côté des bactéries, qui sont les plus étudiées, d’autres types de micro-organismes sont présents dans le microbiote intestinal. Les champignons sont numériquement bien moins représentés que les bactéries, avec 105 à 106 champignons par gramme de selles, mais ils sont en général 100 fois plus volumineux que les bactéries, et leur complexité est également bien supérieure, suggérant qu’ils sont aussi des acteurs importants de l’écologie intestinale. Les phages, virus ciblant les bactéries, sont présents en grand nombre dans l’intestin et ils pourraient, comme ils le font dans les écosystèmes océaniques, y réguler les populations bactériennes. Enfin, des Archeae et des Protistes participent également à l’équilibre de cet écosystème intestinal complexe.
Il existe une très forte variabilité interindividuelle en termes de composition, et chaque individu a un microbiote intestinal qui lui est propre. En revanche, le microbiote ne s’organise pas de manière aléatoire, et trois grands types d’organisation du microbiote ont été décrits chez l’homme, appelés « entérotypes ».1 On sait aujourd’hui que ces entérotypes ne sont pas figés et qu’un individu peut en changer s’il modifie son mode de vie et notamment son alimentation.
Comment évolue le microbiote au cours de la vie ?
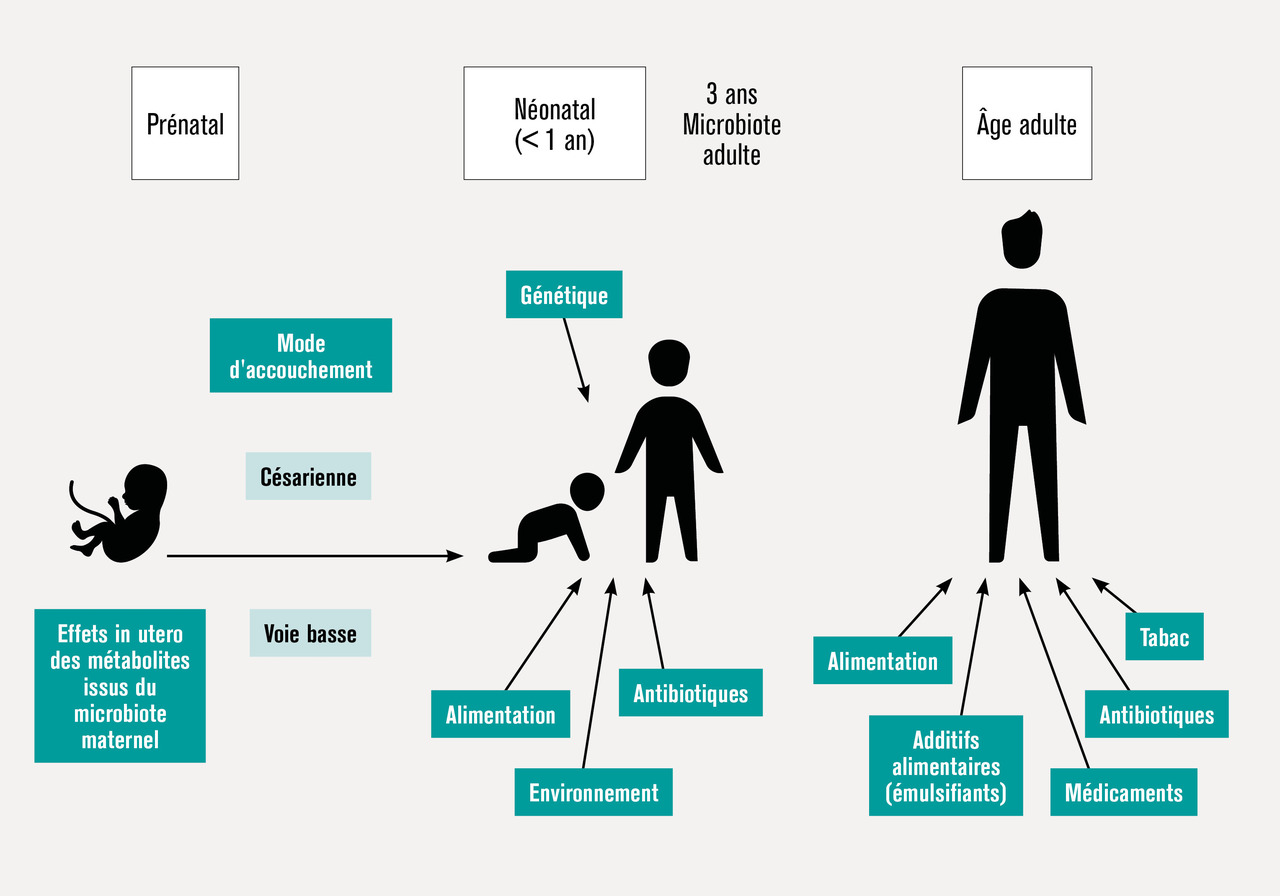
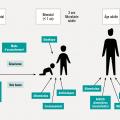
À la naissance, le tube digestif du nourrisson est stérile, et sa colonisation débute dès l’accouchement. Le tube digestif du nouveau-né est particulièrement permissif, et les niveaux de population y atteignent rapidement 1011 bactéries par gramme de selles. Les différents groupes bactériens colonisent l’intestin selon un schéma relativement organisé, et la maturation du microbiote est parallèle à celle du système immunitaire. Le microbiote est considéré adulte lorsqu’il atteint une stabilité fonctionnelle, vers l’âge de 3 ans. Néanmoins, toute cette séquence complexe d’événements aboutissant à un microbiote adulte peut être modulée ou perturbée par de nombreux paramètres.2 En prénatal tout d’abord, des données récentes suggèrent que des métabolites issus du microbiote maternel peuvent avoir des effets in utero. Le mode d’accouchement est ensuite déterminant quant aux premiers micro-organismes rencontrés par le nouveau-né, des micro-organismes vaginaux et périnéaux dans le cadre d’un accouchement par voie basse, et des micro-organismes cutanés et de la salle d’opération en cas de césarienne. Le mode d’alimentation du nourrisson (allaitement ou lait maternisé), l’exposition à des antibiotiques et à d’autres facteurs environnementaux ont également un effet sur le microbiote en développement (fig. 3 ). Même si, passé les premiers mois de vie, il est souvent impossible de distinguer par l’analyse du microbiote les enfants ayant subi ce type de perturbations, celles-ci pourraient avoir des effets à long terme sur la santé. Cela suggère que les premières interactions avec les micro-organismes pourraient réaliser une forme « d’empreinte » sur la physiologie humaine, modulant le risque de développer, à l’âge adulte, certaines maladies immunitaires, métaboliques et, peut-être même, neuro-psychiatriques.3 La génétique de l’hôte module également ces phénomènes.
À partir de l’âge de 3 ans, le microbiote adulte peut être perturbé par de nombreux facteurs environnementaux, comme la prise d’antibiotiques ou d’autres médicaments (comme les inhibiteurs de la pompe à protons ou les antidiabétiques oraux, par exemple), les changements de régime alimentaire, la consommation de produits transformés contenant des additifs alimentaires (comme certains émulsifiants et édulcorants), ou encore le tabac.4-6 Enfin, le microbiote a tendance à se modifier avec le grand âge, notamment avec une diminution de sa diversité.
Après une agression, par exemple une prise d’antibiotiques, le microbiote va avoir tendance à revenir à son état initial. C’est ce que l’on appelle la résilience du microbiote. Néanmoins, cette capacité du microbiote à « encaisser » des chocs est variable d’un sujet à l’autre avec, chez certains patients, des altérations définitives après quelques prises d’antibiotiques.7
À partir de l’âge de 3 ans, le microbiote adulte peut être perturbé par de nombreux facteurs environnementaux, comme la prise d’antibiotiques ou d’autres médicaments (comme les inhibiteurs de la pompe à protons ou les antidiabétiques oraux, par exemple), les changements de régime alimentaire, la consommation de produits transformés contenant des additifs alimentaires (comme certains émulsifiants et édulcorants), ou encore le tabac.4-6 Enfin, le microbiote a tendance à se modifier avec le grand âge, notamment avec une diminution de sa diversité.
Après une agression, par exemple une prise d’antibiotiques, le microbiote va avoir tendance à revenir à son état initial. C’est ce que l’on appelle la résilience du microbiote. Néanmoins, cette capacité du microbiote à « encaisser » des chocs est variable d’un sujet à l’autre avec, chez certains patients, des altérations définitives après quelques prises d’antibiotiques.7
À quoi sert le microbiote intestinal ?
Le microbiote intestinal a un nombre considérable de fonctions potentielles dont certaines ont un impact direct bénéfique sur notre physiologie. Parmi les grandes fonctions du microbiote, la fermentation des substrats disponibles au niveau du côlon, le rôle de barrière à la colonisation par les micro-organismes pathogènes, le développement et la maturation du système immunitaire intestinal et les interactions avec les cellules épithéliales ont des rôles essentiels pour le maintien de la santé de l’hôte.
Fonction de protection et de barrière
L’effet de barrière est un effet protecteur du microbiote intestinal essentiellement vis-à-vis des bactéries pathogènes exogènes. Les mécanismes impliqués sont multiples : une compétition pour les nutriments et les sites d’adhérence épithéliaux entre pathogènes et bactéries commensales ; l’induction par le microbiote de la production de peptides antimicrobiens (jouant un rôle majeur dans la défense contre les agents pathogènes) par les cellules épithéliales ; la production par les bactéries du microbiote de bactériocines détruisant les bactéries pathogènes ; la stimulation de la production des immuno-globulines de type A sécrétoires ; et le bon fonctionnement des jonctions serrées entre les cellules épithéliales. En cas d’altération du microbiote intestinal, par exemple au décours d’une antibiothérapie, ces processus sont altérés, ce qui augmente la susceptibilité aux pathogènes intestinaux et possiblement à d’autres pathologies impliquant une hyperperméabilité intestinale.
Fonctions métaboliques
L’influence principale du microbiote sur le métabolisme de l’hôte provient du métabolisme bactérien des composés présents dans le côlon et en particulier du méta-bolisme des sucres, des gaz et des protéines.
Les bactéries « fibrolytiques » assurent la première étape d’hydrolyse des polymères glucidiques en fragments de petite taille (oses, oligosides…) grâce à des hydrolases (polysaccaridase, glycosidase…) non produites par les cellules eucaryotes humaines. Les bactéries glycolytiques prennent ensuite le relais en transformant les glucides produits majoritairement par la glycolyse. Les glucides sont ainsi transformés en pyruvate, qui sera lui-même transformé en produits finaux de la fermentation, les acides gras à chaîne courte (acétate, propionate, butyrate). Les acides gras à chaîne courte sont rapidement absorbés par l’épithélium colique. L’acétate passe dans le sang et fournit de l’énergie à l’ensemble de l’organisme. Le butyrate est le principal nutriment des côlonocytes ; il exerce des propriétés d’immunomodulation locale et a aussi des effets à distance. Les acides gras à chaîne courte participent également au maintien de l’homéostasie intestinale en stimulant les lymphocytes T régulateurs dans la muqueuse intestinale.
Les acides biliaires sont issus de la transformation du cholestérol par le foie ; 95 % des acides biliaires sécrétés dans la bile sont réabsorbés dans l’iléon terminal par des transporteurs actifs spécifiques, puis retournent au foie via le système porte, avant d’être à nouveau sécrétés dans la bile (cycle entérohépatique des acides biliaires). Seuls 5 % des acides biliaires sécrétés dans la bile parviennent donc au côlon et sont métabolisés (déconjugaison, oxydation, épimérisation…) par les bactéries du microbiote en acides biliaires secondaires. La déconjugaison rend les acides biliaires plus hydrophobes, ce qui favorise leur absorption passive.
Métabolisme des glucides
La quantité de glucides fermentescibles (présents dans les céréales, les fruits et les légumes) arrivant au côlon varie de 10 à 60 g par jour selon les individus et leur régime alimentaire. Différents groupes bactériens du microbiote colique humain participent à la dégradation anaérobie de ces substrats. Les groupes bactériens ont des activités complémentaires leur permettant de former une chaîne trophique conduisant à la transformation des polyosides en métabolites fermentaires.Les bactéries « fibrolytiques » assurent la première étape d’hydrolyse des polymères glucidiques en fragments de petite taille (oses, oligosides…) grâce à des hydrolases (polysaccaridase, glycosidase…) non produites par les cellules eucaryotes humaines. Les bactéries glycolytiques prennent ensuite le relais en transformant les glucides produits majoritairement par la glycolyse. Les glucides sont ainsi transformés en pyruvate, qui sera lui-même transformé en produits finaux de la fermentation, les acides gras à chaîne courte (acétate, propionate, butyrate). Les acides gras à chaîne courte sont rapidement absorbés par l’épithélium colique. L’acétate passe dans le sang et fournit de l’énergie à l’ensemble de l’organisme. Le butyrate est le principal nutriment des côlonocytes ; il exerce des propriétés d’immunomodulation locale et a aussi des effets à distance. Les acides gras à chaîne courte participent également au maintien de l’homéostasie intestinale en stimulant les lymphocytes T régulateurs dans la muqueuse intestinale.
Métabolisme des gaz
Il se forme une grande quantité de gaz de manière quotidienne dans le côlon. L’hydrogène, formé par la fermentation, est ensuite éliminé de plusieurs manières. Son excrétion est possible par l’émission de gaz rectaux ou par voie pulmonaire, mais la plus grande partie est transformée in situ par des bactéries du microbiote colique. Trois principaux types de transformation sont possibles : une transformation en méthane par les Archaea méthanogènes (présents chez 30 à 50 % des adultes) ; en acétate par les bactéries acétogènes ; et enfin en sulfures au potentiel délétère pour le côlonocyte par les bactéries sulfatoréductrices.Métabolisme des protéines
Le métabolisme des protéines est quantitativement moins important que celui des glucides mais est fondamental dans le côlon. Les protéines représentent en effet la principale source d’azote pour les bactéries coliques et elles doivent donc être capables de les hydrolyser pour disposer de l’azote et du carbone qui leur sont nécessaires. L’hydrolyse des protéines en peptides se fait par une activité protéasique présente chez un grand nombre de bactéries coliques. Ces peptides peuvent ensuite être directement métabolisés par certaines espèces permettant la libération d’acides aminés libres qui seront utilisés par d’autres bactéries. Les acides aminés peuvent être utilisés par certaines bactéries comme source d’énergie principale à la place des glucides alors que d’autres les utilisent uniquement comme sources d’azote. La fermentation des acides aminés aboutit principalement à la formation d’acides gras à chaîne courte et d’ammoniac. L’ammoniac est également absorbé dans le côlon, il passe dans la circulation portale pour atteindre le foie où il est transformé en urée qui est éliminée par voie urinaire. L’ammoniac est aussi une source majeure d’azote pour les bactéries du microbiote colique qui l’utilisent pour la synthèse d’acides aminés. Certaines bactéries du microbiote sont capables de métaboliser le tryptophane, acide aminé essentiel, en dérivés indoles, qui ont des effets importants sur l’hôte. Plusieurs de ces dérivés sont des agonistes du récepteur d’aryl d’hydrocarbone (AhR) qui, une fois activé, va jouer un rôle majeur dans l’homéostasie intestinale.8, 9Métabolisme des lipides
Les lipides de la lumière colique proviennent de trois origines : le tractus intestinal d’amont, la desquamation des cellules épithéliales coliques, et les lipides bactériens. Les acides gras non absorbés dans l’intestin grêle sont transformés dans le côlon par les bactéries du microbiote. Le cholestérol colique, qui provient pour la majorité de la bile et pour le reste de l’alimentation et de la desquamation des cellules épithéliales, est transformé en coprostanol par le microbiote, avec une efficacité interindividuelle très variable, avant d’être éliminé dans les selles.Les acides biliaires sont issus de la transformation du cholestérol par le foie ; 95 % des acides biliaires sécrétés dans la bile sont réabsorbés dans l’iléon terminal par des transporteurs actifs spécifiques, puis retournent au foie via le système porte, avant d’être à nouveau sécrétés dans la bile (cycle entérohépatique des acides biliaires). Seuls 5 % des acides biliaires sécrétés dans la bile parviennent donc au côlon et sont métabolisés (déconjugaison, oxydation, épimérisation…) par les bactéries du microbiote en acides biliaires secondaires. La déconjugaison rend les acides biliaires plus hydrophobes, ce qui favorise leur absorption passive.
Fonctions immunitaires
La grande majorité des informations sur les fonctions immunitaires du microbiote proviennent des études comparatives entre des souris axéniques (stériles, sans microbiote) et leurs homologues élevées classiquement en animalerie. Ces travaux ont démontré le rôle essentiel joué par le microbiote dans le développement, la maturation et les fonctions du système immunitaire aussi bien localement dans l’intestin qu’au niveau systémique (rate, moelle osseuse). Un grand nombre de populations cellulaires immunitaires sont concernées, dont les lymphocytes B et T, et notamment l’équilibre entre les cellules T effectrices (notamment Th17) et régulatrices. À côté des fonctions globales du microbiote, il semble que certaines espèces bactériennes particulières aient des propriétés spécifiques.
Modulation des fonctions cérébrales
Aussi extravagant que cela puisse paraître, des données récentes montrent que le microbiote intestinal a des effets à distance, notamment sur le cerveau.
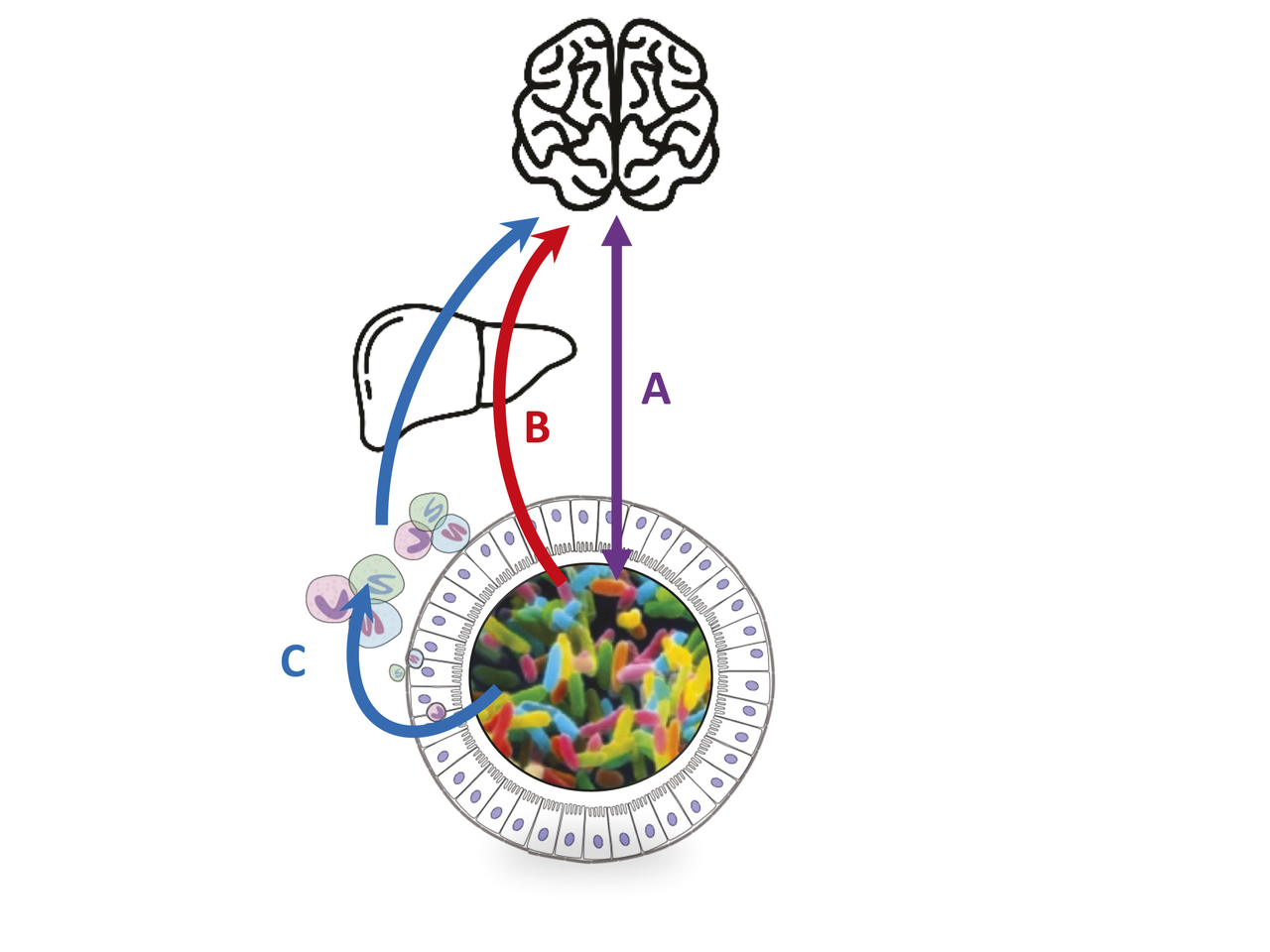
Il existe trois grands types de mécanisme par lesquels le microbiote agit :
– on connaît les connections nerveuses qui existent, via le nerf vague notamment, entre le cerveau et l’intestin. Ces connections vont du cerveau vers l’intestin (symptômes digestifs liés au stress, par exemple) mais vont également de l’intestin vers le cerveau. Le microbiote peut ainsi agir sur les afférences nerveuses et donc modifier les signaux en direction du cerveau ;10
– le deuxième mécanisme concerne la grande quantité et diversité de molécules produites par le microbiote dans l’intestin (par exemple les acides gras à chaîne courte et les métabolites du tryptophane [v. supra]). Ces molécules étant produites dans un organe fait pour « absorber », un grand nombre d’entre elles se retrouvent dans la circulation porte puis atteignent le foie qu’elles peuvent traverser et rejoindre la circulation générale ou y être transformées ou encore détruites. Ces molécules dérivées du microbiote se retrouvent en grand nombre dans la circulation générale et peuvent donc atteindre tous les organes et, pour certaines d’entre elles, passer la barrière hémato-encéphalique et agir directement sur le cerveau ;
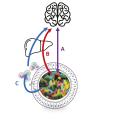
– enfin, le troisième mécanisme est lié à l’effet du microbiote sur la production par nos propres cellules de molécules agissant sur les afférences nerveuses ou directement sur le cerveau (fig. 4 ). C’est le cas par exemple avec la production de cytokines localement dans l’intestin ou avec la production de précurseurs de la sérotonine dans l’intestin et qui peuvent agir dans le cerveau.
Il existe trois grands types de mécanisme par lesquels le microbiote agit :
– on connaît les connections nerveuses qui existent, via le nerf vague notamment, entre le cerveau et l’intestin. Ces connections vont du cerveau vers l’intestin (symptômes digestifs liés au stress, par exemple) mais vont également de l’intestin vers le cerveau. Le microbiote peut ainsi agir sur les afférences nerveuses et donc modifier les signaux en direction du cerveau ;10
– le deuxième mécanisme concerne la grande quantité et diversité de molécules produites par le microbiote dans l’intestin (par exemple les acides gras à chaîne courte et les métabolites du tryptophane [v. supra]). Ces molécules étant produites dans un organe fait pour « absorber », un grand nombre d’entre elles se retrouvent dans la circulation porte puis atteignent le foie qu’elles peuvent traverser et rejoindre la circulation générale ou y être transformées ou encore détruites. Ces molécules dérivées du microbiote se retrouvent en grand nombre dans la circulation générale et peuvent donc atteindre tous les organes et, pour certaines d’entre elles, passer la barrière hémato-encéphalique et agir directement sur le cerveau ;
– enfin, le troisième mécanisme est lié à l’effet du microbiote sur la production par nos propres cellules de molécules agissant sur les afférences nerveuses ou directement sur le cerveau (
Quelles sont les premières applications ?
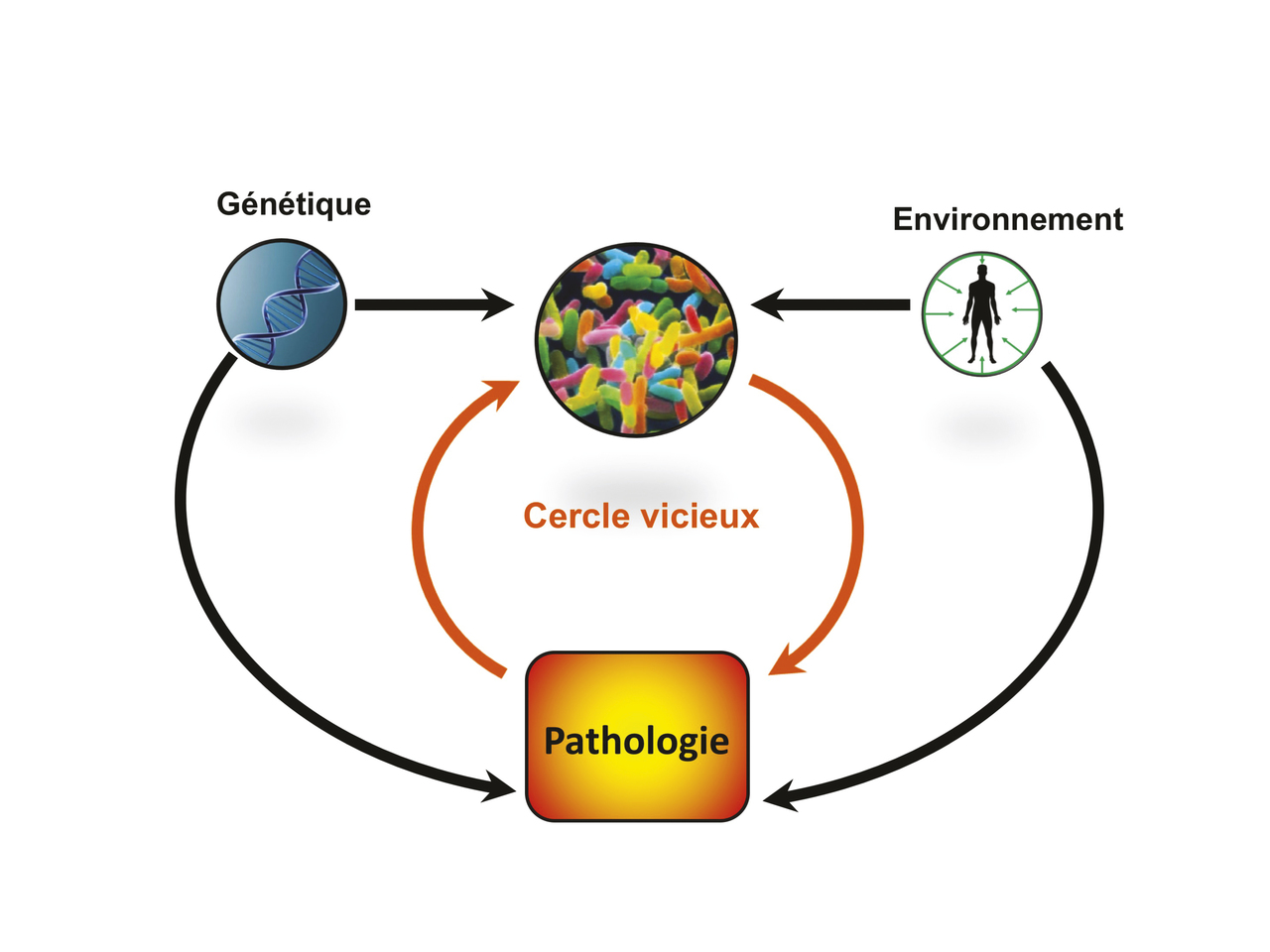
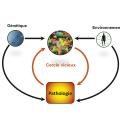
Le microbiote intestinal est un acteur majeur de la santé humaine. L’étude de sa complexité ne s’est massivement développée qu’à l’avènement des technologies de biologie moléculaire au début des années 2000. Ces approches ont permis de montrer la grande diversité et la variabilité interindividuelle du microbiote. Étant donné le rôle clé du microbiote dans de nombreuses fonctions physio-logiques, il n’est pas étonnant qu’il puisse être impliqué dans le développement de certaines pathologies lorsqu’il est déséquilibré en termes de composition ou de fonction (dysbiose). Ces dernières années, de nombreuses études ont ainsi démontré le rôle d’une dysbiose intestinale dans le développement et/ou la sévérité de pathologies intestinales ou extra-intestinales, avec toutefois un poids inégal d’une maladie à l’autre. La question de la causalité des anomalies du microbiote s’est posée dès la mise en évidence des premières dysbioses dans les pathologies intestinales. En effet, il paraît clair que les modifications du microbiote au cours des pathologies sont liées à des facteurs environnementaux (incluant la pathologie elle-même) et à la génétique de l’hôte. Néanmoins, une fois le microbiote altéré, il peut jouer un rôle dans la chroni-cité et la sévérité de la pathologie en question, entraînant un cercle vicieux et faisant émerger le concept de causalité circulaire (fig. 5 ).11
De nombreux développements sont en cours afin d’appliquer la connaissance du microbiote à la médecine. Les premières applications pourraient porter sur des biomarqueurs diagnostiques ou pronostiques, voire la prédiction de la réponse (toxicité et efficacité) aux traitements. Enfin, le microbiote est déjà considéré comme une cible ou un outil thérapeutique, avec le développement de la transplantation de microbiote fécal,12 de probiotiques de nouvelle génération (micro-organismes issus du microbiote intestinal et sélectionnés de manière rationnelle pour leurs effets sur la santé), de post-biotiques (molécules thérapeutiques issues des micro-organismes intestinaux) ou de molécules non anti-biotiques ciblant des micro-organismes délétères.
De nombreux développements sont en cours afin d’appliquer la connaissance du microbiote à la médecine. Les premières applications pourraient porter sur des biomarqueurs diagnostiques ou pronostiques, voire la prédiction de la réponse (toxicité et efficacité) aux traitements. Enfin, le microbiote est déjà considéré comme une cible ou un outil thérapeutique, avec le développement de la transplantation de microbiote fécal,12 de probiotiques de nouvelle génération (micro-organismes issus du microbiote intestinal et sélectionnés de manière rationnelle pour leurs effets sur la santé), de post-biotiques (molécules thérapeutiques issues des micro-organismes intestinaux) ou de molécules non anti-biotiques ciblant des micro-organismes délétères.
Références
1. Arumugam M, Raes J, Pelletier E, et al. Enterotypes of the human gut microbiome. Nature 2011;473:174-80.
2. Tamburini S, Shen N, Wu HC, et al. The microbiome in early life: implications for health outcomes. Nature Medicine 2016;22:713-22.
3. Al Nabhani Z, Dulauroy S, Marques R, et al. A weaning reaction to microbiota is required for resistance to immunopathologies in the adult. Immunity 2019;50:1276-88.
4. Chassaing B, Koren O, Goodrich JK, et al. Dietary emulsifiers impact the mouse gut microbiota promoting colitis and metabolic syndrome. Nature 2015;519:92-6.
5. Imhann F, Bonder MJ, Vich Vila A, et al. Proton pump inhibitors affect the gut microbiome. Gut 2016;65:740-8.
6. Biedermann L, Brülisauer K, Zeitz J, et al. Smoking cessation alters intestinal microbiota: insights from quantitative investigations on human fecal samples using FISH. Inflamm Bowel Dis 2014;20:1496-501.
7. Dethlefsen L, Relman DA. Incomplete recovery and individualized responses of the human distal gut microbiota to repeated antibiotic perturbation. Proc Natl Acad Sci USA 2011;108 (Suppl 1):4554-61.
8. Agus A, Planchais J, Sokol H. Gut microbiota regulation of tryptophan metabolism in health and disease. Cell Host Microbe 2018;23:716-24.
9. Lamas B, Natividad JM, Sokol H. Aryl hydrocarbon receptor and intestinal immunity. Mucosal Immunol 2018;11:1024-38.
10. Collins SM, Surette M, Bercik P. The interplay between the intestinal microbiota and the brain. Nat Rev Microbiol 2012;10:735-42.
11. Lamas B, Richard ML, Leducq V, et al. CARD9 impacts colitis by altering gut microbiota metabolism of tryptophan into aryl hydrocarbon receptor ligands. Nat Med 2016;22:598-605.
12. Pigneur B, Sokol H. Fecal microbiota transplantation in inflammatory bowel disease: the quest for the holy grail. Mucosal Immunol 2016;9:1360-5.
2. Tamburini S, Shen N, Wu HC, et al. The microbiome in early life: implications for health outcomes. Nature Medicine 2016;22:713-22.
3. Al Nabhani Z, Dulauroy S, Marques R, et al. A weaning reaction to microbiota is required for resistance to immunopathologies in the adult. Immunity 2019;50:1276-88.
4. Chassaing B, Koren O, Goodrich JK, et al. Dietary emulsifiers impact the mouse gut microbiota promoting colitis and metabolic syndrome. Nature 2015;519:92-6.
5. Imhann F, Bonder MJ, Vich Vila A, et al. Proton pump inhibitors affect the gut microbiome. Gut 2016;65:740-8.
6. Biedermann L, Brülisauer K, Zeitz J, et al. Smoking cessation alters intestinal microbiota: insights from quantitative investigations on human fecal samples using FISH. Inflamm Bowel Dis 2014;20:1496-501.
7. Dethlefsen L, Relman DA. Incomplete recovery and individualized responses of the human distal gut microbiota to repeated antibiotic perturbation. Proc Natl Acad Sci USA 2011;108 (Suppl 1):4554-61.
8. Agus A, Planchais J, Sokol H. Gut microbiota regulation of tryptophan metabolism in health and disease. Cell Host Microbe 2018;23:716-24.
9. Lamas B, Natividad JM, Sokol H. Aryl hydrocarbon receptor and intestinal immunity. Mucosal Immunol 2018;11:1024-38.
10. Collins SM, Surette M, Bercik P. The interplay between the intestinal microbiota and the brain. Nat Rev Microbiol 2012;10:735-42.
11. Lamas B, Richard ML, Leducq V, et al. CARD9 impacts colitis by altering gut microbiota metabolism of tryptophan into aryl hydrocarbon receptor ligands. Nat Med 2016;22:598-605.
12. Pigneur B, Sokol H. Fecal microbiota transplantation in inflammatory bowel disease: the quest for the holy grail. Mucosal Immunol 2016;9:1360-5.