Différentes circonstances peuvent conduire à la découverte d’une surdité chez l’enfant : dépistage néonatal, doute parental, suivi scolaire, examen systématique… Une fois établie, il faut en évaluer la sévérité, la caractériser en tant que surdité de transmission (correspondant à une pathologie de l’oreille externe ou moyenne) ou surdité de perception (atteinte neurosensorielle de l’oreille interne) puis identifier sa cause, laquelle conditionne la suite de la prise en charge tant au plan oto-rhino-laryngé (ORL) que général.
La surdité de l’enfant est ainsi un vaste sujet que nous ne pouvons aborder ici que schématiquement.
La surdité de l’enfant est ainsi un vaste sujet que nous ne pouvons aborder ici que schématiquement.
Évaluation de la perte auditive
Audiométrie subjective
Tonale ou vocale, elle doit être adaptée à l’âge, au comportement et à d’éventuels troubles neurologiques associés.
De 1 à 3 ans, on utilise le réflexe d’orientation conditionnée (ROC). L’enfant est conditionné à orienter sa tête vers une source sonore placée près d’une niche contenant un objet ludique (peluche, etc.) que l’on illumine simultanément à l’envoi d’un son. Cet éclairage devient alors une récompense. En utilisant des stimulations de fréquences différentes et d’intensités de plus en plus faibles, on recherche la réaction synchrone et répétée au stimulus. Ce test est fait sans casque permettant de tester les oreilles séparément, il ne teste donc que la meilleure oreille.
Entre 3 et 5 ans, l’enfant est testé par un « peep-show » (en champ libre par haut-parleur ou au casque). Quand il entend le signal, il appuie sur une touche qui déclenche une récompense telle que la mise en route d’un train électrique ou d’une vidéo.
À plus de 5 ans, l’examen se déroule comme chez l’adulte au casque en conduction aérienne et à l’aide d’un vibrateur mastoïdien pour tester en conduction osseuse. La différence entre le seuil auditif en conduction osseuse et aérienne définit la surdité de transmission. La baisse du seuil auditif en conduction osseuse définit la surdité de perception.
Test d’intelligibilité : l’enfant doit répéter une liste de 10 mots. On établit ainsi les seuils de discrimination (100 % des mots corrects) et d’intelligibilité (50 %).
Test d’images : l’enfant doit désigner une série d’images
Test phonétique de Lafon : l’enfant doit répéter une liste de mots de 3 phonèmes chacun, émis à un niveau de voix faible (40 dB), moyen (55 dB) ou fort (70 dB). Ce test est plus fin que le test d’intelligibilité, car il permet d’apprécier plus finement les confusions phonétiques.
Audiométrie tonale
Avant 1 an, on ne peut qu’étudier les réactions de l’enfant vis-à-vis de sons purs ou complexes tels que les jouets calibrés de Moatti, les clochettes, les cymbales...De 1 à 3 ans, on utilise le réflexe d’orientation conditionnée (ROC). L’enfant est conditionné à orienter sa tête vers une source sonore placée près d’une niche contenant un objet ludique (peluche, etc.) que l’on illumine simultanément à l’envoi d’un son. Cet éclairage devient alors une récompense. En utilisant des stimulations de fréquences différentes et d’intensités de plus en plus faibles, on recherche la réaction synchrone et répétée au stimulus. Ce test est fait sans casque permettant de tester les oreilles séparément, il ne teste donc que la meilleure oreille.
Entre 3 et 5 ans, l’enfant est testé par un « peep-show » (en champ libre par haut-parleur ou au casque). Quand il entend le signal, il appuie sur une touche qui déclenche une récompense telle que la mise en route d’un train électrique ou d’une vidéo.
À plus de 5 ans, l’examen se déroule comme chez l’adulte au casque en conduction aérienne et à l’aide d’un vibrateur mastoïdien pour tester en conduction osseuse. La différence entre le seuil auditif en conduction osseuse et aérienne définit la surdité de transmission. La baisse du seuil auditif en conduction osseuse définit la surdité de perception.
Audiométrie vocale
L’enfant doit répéter des phonèmes (syllabes, mots ou phrases) émis par l’opérateur ou par un CD et transmis à différentes intensités au casque ou en champ libre selon l’âge.Test d’intelligibilité : l’enfant doit répéter une liste de 10 mots. On établit ainsi les seuils de discrimination (100 % des mots corrects) et d’intelligibilité (50 %).
Test d’images : l’enfant doit désigner une série d’images
Test phonétique de Lafon : l’enfant doit répéter une liste de mots de 3 phonèmes chacun, émis à un niveau de voix faible (40 dB), moyen (55 dB) ou fort (70 dB). Ce test est plus fin que le test d’intelligibilité, car il permet d’apprécier plus finement les confusions phonétiques.
Audiométrie objective
Les techniques d’audiométrie objective permettent d’évaluer le seuil auditif quand le jeune âge ou l’état neurologique de l’enfant ne lui permet pas de participer.
Les otoémissions acoustiques constituent un bon test de dépistage mais ne peuvent constituer un test de certitude. Elles permettent, quand elles sont présentes, d’affirmer que le seuil auditif est inférieur à 30-35 dB mais, absentes, ne préjugent pas d’une éventuelle atteinte neurosensorielle.
Les potentiels évoqués auditifs évaluent le seuil auditif sur les fréquences aiguës (2 000-4 000 Hz) mais nécessitent du temps et un enfant calme, voire endormi.
Depuis quelques années, les ASSR (auditory steady state response) permettent d’effectuer un audiogramme objectif, fréquence par fréquence, mais sont encore peu diffusés.
Au terme de ce bilan, le seuil auditif est défini soit directement, tel que le seuil obtenu pour les potentiels évoqués auditifs, soit par le calcul de la moyenne des seuils obtenus sur les fréquences 500, 1 000, 2 000 et 4 000 Hz à l’audiogramme. Cela permet ensuite de classer la surdité en fonction de sa sévérité (tableau 1).
Les otoémissions acoustiques constituent un bon test de dépistage mais ne peuvent constituer un test de certitude. Elles permettent, quand elles sont présentes, d’affirmer que le seuil auditif est inférieur à 30-35 dB mais, absentes, ne préjugent pas d’une éventuelle atteinte neurosensorielle.
Les potentiels évoqués auditifs évaluent le seuil auditif sur les fréquences aiguës (2 000-4 000 Hz) mais nécessitent du temps et un enfant calme, voire endormi.
Depuis quelques années, les ASSR (auditory steady state response) permettent d’effectuer un audiogramme objectif, fréquence par fréquence, mais sont encore peu diffusés.
Au terme de ce bilan, le seuil auditif est défini soit directement, tel que le seuil obtenu pour les potentiels évoqués auditifs, soit par le calcul de la moyenne des seuils obtenus sur les fréquences 500, 1 000, 2 000 et 4 000 Hz à l’audiogramme. Cela permet ensuite de classer la surdité en fonction de sa sévérité (tableau 1).
Identifier une cause
Orientée par les résultats audiométriques qui permettent de définir s’il s’agit d’une surdité de transmission ou d’une surdité de perception, l’enquête étiologique comprend un examen clinique du pavillon et du tympan puis crânio-facial. En fonction des éléments recueillis, le bilan paraclinique fait appel à des examens d’imagerie, un électrocardiogramme (ECG), des tests urinaires ou encore un avis génétique (tableaux 2 et 3).
En cas de surdité de transmission
Une surdité de transmission peut être la conséquence d’une malformation du pavillon, du conduit auditif externe, d’une pathologie du tympan et/ou de l’oreille moyenne.
– le syndrome otomandibulaire avec hypoplasie mandibulaire ;
– le syndrome de Franceschetti ou Treacher-Collins (1 nouveau-né sur 50 000 [www.orpha.net]), associant de façon bilatérale hypoplasie des branches montantes mandibulaires et des os malaires, obliquité des fentes palpébrales, colobome palpébral inférieur, parfois fente vélopalatine ;
– le syndrome de Goldenhar ou dysplasie facio-auriculo-vertébrale associant hypoplasie mandibulaire, macrostomie, malformation vertébrale, kyste épibulbaire, paralysie du voile, paralysie faciale.
Devant une malformation du pavillon, il faut donc effectuer un examen ophtalmologique, une radiographie du rachis cervical, un ECG et une échographie cardiaque, et une échographie rénale.
Si le tympan est normal, il faut évoquer une aplasie mineure correspondant à une malformation ou à une lyse ossiculaire consécutive à une otite chronique, ce que confirme une tomodensitométrie des rochers. Devant une opacité de l’oreille moyenne à la tomodensitométrie et un hypersignal sur l’imagerie par résonance magnétique (IRM) avec séquence de diffusion, on évoque un cholestéatome.
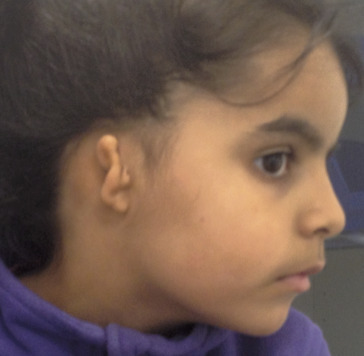
Malformation du pavillon de l’oreille
Une malformation du pavillon évoque une aplasie majeure associant dans sa forme complète une agénésie du conduit auditif externe et une malformation des osselets (fig. 1). La surdité peut atteindre 60-70 dB. Cette malformation peut être isolée ou entrer dans le cadre d’un syndrome malformatif dont les trois principaux sont :– le syndrome otomandibulaire avec hypoplasie mandibulaire ;
– le syndrome de Franceschetti ou Treacher-Collins (1 nouveau-né sur 50 000 [www.orpha.net]), associant de façon bilatérale hypoplasie des branches montantes mandibulaires et des os malaires, obliquité des fentes palpébrales, colobome palpébral inférieur, parfois fente vélopalatine ;
– le syndrome de Goldenhar ou dysplasie facio-auriculo-vertébrale associant hypoplasie mandibulaire, macrostomie, malformation vertébrale, kyste épibulbaire, paralysie du voile, paralysie faciale.
Devant une malformation du pavillon, il faut donc effectuer un examen ophtalmologique, une radiographie du rachis cervical, un ECG et une échographie cardiaque, et une échographie rénale.
Pathologies du tympan et/ou de l’oreille moyenne
L’otoscopie permet d’identifier aisément une otite séreuse, une perforation du tympan, une tympanosclérose, une poche de rétraction tympanique, voire un cholestéatome.Si le tympan est normal, il faut évoquer une aplasie mineure correspondant à une malformation ou à une lyse ossiculaire consécutive à une otite chronique, ce que confirme une tomodensitométrie des rochers. Devant une opacité de l’oreille moyenne à la tomodensitométrie et un hypersignal sur l’imagerie par résonance magnétique (IRM) avec séquence de diffusion, on évoque un cholestéatome.
En cas de surdité de perception
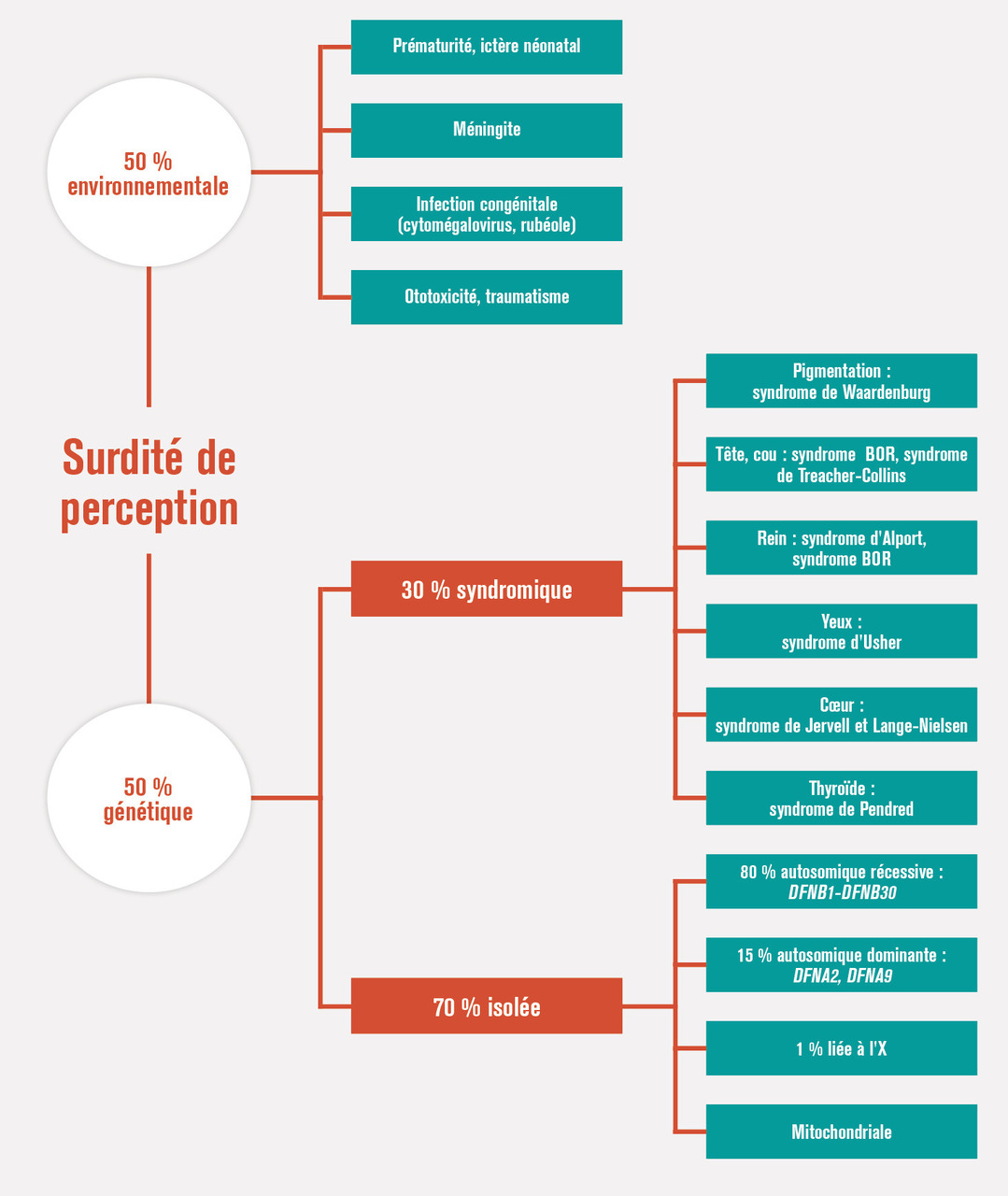
Trois grandes causes doivent être recherchées (tableaux 2, 3 et fig. 2).
Les surdités non syndromiques isolées. La mutation de la connexine 26 (gène GJB2), responsable de 50 % des surdités non syndromiques récessives et de 30-40 % des surdités de perception génétiques entraîne une surdité congénitale, peu ou pas progressive ; l’imagerie est normale. D’autres connexines peuvent être incriminées 30, 31. La mutation de l’otoferline (gène OTOF) est responsable d’une surdité de perception isolée par neuropathie auditive.
Les surdités non syndromiques avec malformation de l’oreille interne. Le syndrome de « surdité mixte liée à l’X avec geyser-labyrinthe » associe une surdité, moyenne à sévère, une ectasie du conduit auditif interne et une malformation cochléaire. Le gène responsable de cette forme rare de surdité a été identifié, facteur de transcription POU3F4. D’autres malformations d’origine toxique (thalidomide, vitamine A) consistent en une dilatation de l’aqueduc du vestibule, ou une hypoplasie/dilatation cochléaire et/ou vestibulaire comme dans la dysplasie de Mondini. Il peut ici exister une communication anormale entre les liquides périlymphatique et cérébrospinal, justifiant une vaccination anti-Haemophilus et anti-pneumococcique.
Les surdités syndromiques dont les principales causes et les atteintes du principal autre organe cible sont décrites dans les tableaux 4 et 5.
Les surdités congénitales virales ou bactériennes
Cytomégalovirus. L’infection congénitale par le cytomégalovirus (CMV) concerne de 0,5 à 1 % des grossesses et serait responsable de 1 surdité sur 2 000 naissances. L’expression et le profil évolutif de la surdité sont corrélés à la charge virale et au mode de présentation, symptomatique (retard de croissance, microcéphalie, ictère néonatal, pétéchies, lésions intracérébrales ou digestives – le risque de surdité y est de 33 %) ou asymptomatique (le risque de surdité est de 10 %).
L’immunisation préalable de la mère contre le CMV ne confère pas une protection efficace contre le virus. En effet, faute d’immunité croisée, la mère peut être en contact avec un nouveau sérotype en cours de grossesse ou présenter une réactivation virale.
La responsabilité du CMV ne peut s'affirmer uniquement sur la sérologie ; celle-ci n'a de valeur que si négative pour infirmer son rôle. Elle repose alors habituellement sur la recherche du virus par polymerase chain reaction (PCR) (tableau 6) :
– chez l’enfant de moins de 3 semaines, dans les urines, la salive ou le sang, elle confirme la nature congénitale de l'infection ;
– entre 3 semaines et 2 ans, si la recherche de CMV dans la salive ou les urines1 est positive ou si l’on possède des arguments en faveur de la responsabilité du virus, la recherche du CMV sur Guthrie peut être demandée pour rechercher la présence du virus dans les premiers jours confirmant ainsi l'infection anténatale. Cet examen peut cependant être pris en défaut chez les enfants asymptomatiques à la naissance et/ou de faible charge virale ;:
– au-delà de 2 ans, il est souvent impossible d’imputer la responsabilité d’une surdité de perception au CMV.
Rubéole. Depuis la vaccination systématique des jeunes filles en France, l’incidence de cette infection virale en cours de grossesse a fortement chuté. Il convient d’évoquer cette cause lorsque coexistent cardiopathie, atteintes ophtalmologiques, microcéphalies, anomalies dentaires, retards de croissance ou mental.
Une étude a montré que la surdité de perception qui en résulte ne touche pas de fréquence préférentielle, elle peut être bilatérale, parfois asymétrique et est habituellement stable dans le temps.3
Herpès simplex virus 1 et 2 (HSV). Contrairement à la forte incidence des infections maternelles (les anticorps sont retrouvés positifs chez 30 % des femmes enceintes), l’infection in utero et néonatale, le plus souvent par HSV2, reste peu fréquente. Elle est associée à un risque de surdité de perception congénitale permanente, de survenue secondaire ou progressive4 et serait davantage la conséquence de la prématurité ou de l’asphyxie/hypoxie que du virus lui-même.
Toxoplasmose. En France, l’incidence de la séroconversion à la bactérie Toxoplasma gondii en cours de grossesse est estimée à 1,9/1 000 femmes.5 Le risque de passage transplacentaire précoce est estimé entre 30 et 50 %. La surdité peut concerner 28 % des enfants infectés non traités, alors qu’elle peut être évitée si le traitement est pris de manière rigoureuse pendant 1 an.
Syphilis. Le passage transplacentaire du Treponema pallidum est d’autant plus fréquent que la syphilis est primaire ou secondaire précoce mais n’est possible qu’à partir du 5e mois de grossesse. L’atteinte congénitale peut être parlante (pemphigus palmo-plantaire, syphilides érythémato-pultacées, ostéochondrite des coudes, etc.), se caractériser par la classique triade de Hutchinson (kératite interstitielle, anomalies dentaires et surdité) ou ne se traduire que par la surdité. Un traitement précoce peut prévenir l’installation d’une surdité. Exceptionnellement chez l’enfant, la syphilis peut être acquise.
Les surdités acquises post-natales
Plusieurs causes peuvent être incriminées.
Causes périnatales
De nombreux facteurs de risque sont établis : séjour de plus de 5 jours en réanimation néonatale en particulier chez les enfants ayant un poids inférieur 1 500 g, une asphyxie néonatale ou un score d’APGAR à 5 minutes inférieur à 4 ou sous ventilation mécanique prolongée à haute fréquence ; traitements ototoxiques ou par diurétiques de l’anse, encéphalopathie hypoxique, échange transfusionnel pour hyperbilirubinémie (la surdité est de type neuropathie auditive, la photothérapie intensive diminue les séquelles).
Causes virales
Oreillons. Après une incubation de 18 à 21 jours, le paramyxovirus ourlien se manifeste cliniquement par une phase de prodromes (céphalées, fatigue, myalgies et fièvre) suivie par une parotidite uni- ou bilatérale précédée d’otalgie, plus rarement par une orchite (2 ‰) ou une pancréatite (0,4 ‰) ; cependant, l’infection peut passer inaperçue dans 20 à 30 % des cas.
L’incidence de la surdité de perception après oreillons est estimée entre 1/1 000 et 1/30 000.6 Elle est habituellement unilatérale et réversible mais peut être sévère et permanente. Son incidence a diminué depuis la vaccination systématique des nourrissons.
Rougeole. La rougeole est liée elle aussi à un paramyxovirus à simple brin d’ARN encapsulé. L’infection se caractérise par un syndrome pseudogrippal de 3 à 4 jours. Deux semaines plus tard débute une éruption cutanée maculopapuleuse d’une dizaine de jours ; le signe de Koplik au niveau de la muqueuse buccale est pathognomonique. La surdité de perception est une complication classique de la rougeole : elle correspondait à 5 à 10 % des surdités profondes avant la vaccination, était alors souvent bilatérale, modérée à profonde, et pouvait faire suite à une encéphalite. Par ailleurs, la rougeole est responsable d’une forte incidence d’otites moyennes aiguës responsables d’une surdité de transmission surajoutée. Dans la majorité des pays développés, la surdité a quasiment disparu : 0,9 cas/100 000 dans les pays où la couverture vaccinale est d’au moins 90 %.7
Varicelle et zona. Le virus habituellement quiescent au sein des nerfs peut se réactiver à l’occasion d’une immunodépression. Lorsque celle-ci survient au sein du ganglion géniculé, provoquant une éruption de la zone de Ramsay-Hunt et une paralysie faciale, il peut exister une diffusion virale vers le nerf cochléo-vestibulaire à l’origine d’un vertige ou d’une surdité de perception brusque, légère à modérée. La récupération auditive est souvent meilleure que la récupération faciale sous traitement antiviral et corticoïdes. La perte auditive des fréquences conversationnelles est de mauvais pronostic alors que la perte des hautes fréquences est souvent associée à une récupération complète.8
Virus de l’immunodéficience humaine (VIH). La surdité peut revêtir tous les aspects : unilatérale ou bilatérale, progressive ou brusque, de transmission, de perception ou mixte. De plus, elle peut être liée au virus lui-même ou aux atteintes opportunistes (CMV, syphilis, tuberculose, méningite à cryptocoques) ou à leur traitement ototoxique : il est donc parfois difficile d’identifier le facteur causal de la surdité. Il semble que les atteintes cochléo- vestibulaires augmentent avec la durée d’infection par le VIH, le taux bas de lymphocytes CD4 et la charge virale ; la prévention de la surdité passe par un contrôle de la maladie par un traitement antiviral.
Causes bactériennes
Méningites. La surdité est une complication reconnue des méningites bactériennes (pneumocoque, Haemophilus influenzae, méningocoque). Elle est consécutive soit à une labyrinthite séreuse ou toxique, soit à une thrombophlébite, à un embole des vaisseaux labyrinthiques ou encore à une hypoxie/anoxie du nerf cochléo-vestibulaire et des voies auditives centrales.7 La surdité survient en moyenne dans les 3 mois qui suivent la méningite10 justifiant une surveillance de l’audition rapprochée durant cette période. La particularité de cette cause est qu’elle entraîne une ossification de la cochlée dans un délai de 4 à 8 semaines. Devant l’apparition d’une surdité de perception post-méningitique, une imagerie de l’oreille interne doit donc être effectuée par tomodensitométrie pour montrer une éventuelle ossification mais idéalement par une IRM recherchant une disparition du signal liquidien en séquences T2 évoquant une fibrose débutante. L’IRM permet aussi d’évaluer les éventuelles atteintes centrales consécutives à la méningite. Ces deux examens sont donc complémentaires. Une surdité de perception sévère ou profonde bilatérale constitue actuellement une indication reconnue d’implantation bilatérale rapide, compte tenu du risque d’évolution vers une labyrinthite ossifiante.
Maladie de Lyme. Dans cette infection par la bactérie Borrelia burgdorferi, la survenue d’une surdité est rare et se manifeste plutôt par une surdité de perception brusque.11 Le contexte, une éventuelle paralysie faciale associée justifient la pratique d’une sérologie.
Otite moyenne aiguë. Une surdité de perception permanente et irréversible peut être observée dans le cadre d’une labyrinthite aiguë purulente associée ou non à un cholestéatome.
Traumatismes et toxicité
Fracture du rocher. Les enfants sont particulièrement exposés à des fractures des rochers suite à des accidents de la voie publique, de vélo, de skate, ou encore de chute de lits superposés. Selon le siège du trait de fracture, on peut observer une surdité de perception ou de transmission.12
Traumatisme acoustique. Les jeunes sont particulièrement exposés à des bruits intenses en raison de l’utilisation de dispositifs musicaux avec écouteurs et des concerts (le volume de sortie qui peut atteindre 120 dB !). Ces traumatismes sonores sont majorés par l’administration d’aminosides, de chimiothérapies, une prédisposition génétique… La surdité de perception qui en résulte affecte les hautes fréquences, réalisant le classique scotome sur la fréquence 4 000 Hz.
Médicaments ototoxiques. De nombreux médicaments peuvent entraîner une atteinte des cellules ciliées externes : les aminosides, les dérivés du cisplatine, l’érythromycine, la vancomycine, le furosémide (diurétiques de l’anse), la quinine, l’aspirine. Une susceptibilité génétique aux aminosides liée à la mutation A1555G de l’ADN mitochondrial a été identifiée : la surdité qui en résulte est de sévérité variable et d’évolution progressive. Par ailleurs, il faut être particulièrement vigilant sur un tympan ouvert et proscrire l’utilisation de gouttes ototoxiques contentant des aminosides.
Surdités auto-immunes et inflammatoires
Cette cause, peu fréquente chez l’enfant, peut être évoquée lorsque la surdité de perception s’inscrit dans le cadre d’affections telles que le syndrome de Cogan (kératite interstitielle, surdité, atteinte vestibulaire, positivité des anticorps anti-Cogan ou anti-HSP70), la sarcoïdose, ou la granulomatose de Wegener.
La surdité de perception est progressive, bilatérale, souvent associée à des signes vestibulaires. On constate souvent une bonne sensibilité au traitement corticoïde. Différents anticorps peuvent être recherchés : anti-Cogan, anti-connexine 26, anti-DEPA/CD148, anti-reovirus.13
Surdités génétiques
Cinquante à 60 % des surdités de perception de l’enfant seraient d’origine génétique. On en distingue trois types.Les surdités non syndromiques isolées. La mutation de la connexine 26 (gène GJB2), responsable de 50 % des surdités non syndromiques récessives et de 30-40 % des surdités de perception génétiques entraîne une surdité congénitale, peu ou pas progressive ; l’imagerie est normale. D’autres connexines peuvent être incriminées 30, 31. La mutation de l’otoferline (gène OTOF) est responsable d’une surdité de perception isolée par neuropathie auditive.
Les surdités non syndromiques avec malformation de l’oreille interne. Le syndrome de « surdité mixte liée à l’X avec geyser-labyrinthe » associe une surdité, moyenne à sévère, une ectasie du conduit auditif interne et une malformation cochléaire. Le gène responsable de cette forme rare de surdité a été identifié, facteur de transcription POU3F4. D’autres malformations d’origine toxique (thalidomide, vitamine A) consistent en une dilatation de l’aqueduc du vestibule, ou une hypoplasie/dilatation cochléaire et/ou vestibulaire comme dans la dysplasie de Mondini. Il peut ici exister une communication anormale entre les liquides périlymphatique et cérébrospinal, justifiant une vaccination anti-Haemophilus et anti-pneumococcique.
Les surdités syndromiques dont les principales causes et les atteintes du principal autre organe cible sont décrites dans les tableaux 4 et 5.
Surdité de causes extrinsèques
Elles concernent 20 à 30 % des surdités de perception et peuvent être congénitales ou acquises.Les surdités congénitales virales ou bactériennes
Cytomégalovirus. L’infection congénitale par le cytomégalovirus (CMV) concerne de 0,5 à 1 % des grossesses et serait responsable de 1 surdité sur 2 000 naissances. L’expression et le profil évolutif de la surdité sont corrélés à la charge virale et au mode de présentation, symptomatique (retard de croissance, microcéphalie, ictère néonatal, pétéchies, lésions intracérébrales ou digestives – le risque de surdité y est de 33 %) ou asymptomatique (le risque de surdité est de 10 %).
L’immunisation préalable de la mère contre le CMV ne confère pas une protection efficace contre le virus. En effet, faute d’immunité croisée, la mère peut être en contact avec un nouveau sérotype en cours de grossesse ou présenter une réactivation virale.
La responsabilité du CMV ne peut s'affirmer uniquement sur la sérologie ; celle-ci n'a de valeur que si négative pour infirmer son rôle. Elle repose alors habituellement sur la recherche du virus par polymerase chain reaction (PCR) (tableau 6) :
– chez l’enfant de moins de 3 semaines, dans les urines, la salive ou le sang, elle confirme la nature congénitale de l'infection ;
– entre 3 semaines et 2 ans, si la recherche de CMV dans la salive ou les urines1 est positive ou si l’on possède des arguments en faveur de la responsabilité du virus, la recherche du CMV sur Guthrie peut être demandée pour rechercher la présence du virus dans les premiers jours confirmant ainsi l'infection anténatale. Cet examen peut cependant être pris en défaut chez les enfants asymptomatiques à la naissance et/ou de faible charge virale ;:
– au-delà de 2 ans, il est souvent impossible d’imputer la responsabilité d’une surdité de perception au CMV.
Rubéole. Depuis la vaccination systématique des jeunes filles en France, l’incidence de cette infection virale en cours de grossesse a fortement chuté. Il convient d’évoquer cette cause lorsque coexistent cardiopathie, atteintes ophtalmologiques, microcéphalies, anomalies dentaires, retards de croissance ou mental.
Une étude a montré que la surdité de perception qui en résulte ne touche pas de fréquence préférentielle, elle peut être bilatérale, parfois asymétrique et est habituellement stable dans le temps.3
Herpès simplex virus 1 et 2 (HSV). Contrairement à la forte incidence des infections maternelles (les anticorps sont retrouvés positifs chez 30 % des femmes enceintes), l’infection in utero et néonatale, le plus souvent par HSV2, reste peu fréquente. Elle est associée à un risque de surdité de perception congénitale permanente, de survenue secondaire ou progressive4 et serait davantage la conséquence de la prématurité ou de l’asphyxie/hypoxie que du virus lui-même.
Toxoplasmose. En France, l’incidence de la séroconversion à la bactérie Toxoplasma gondii en cours de grossesse est estimée à 1,9/1 000 femmes.5 Le risque de passage transplacentaire précoce est estimé entre 30 et 50 %. La surdité peut concerner 28 % des enfants infectés non traités, alors qu’elle peut être évitée si le traitement est pris de manière rigoureuse pendant 1 an.
Syphilis. Le passage transplacentaire du Treponema pallidum est d’autant plus fréquent que la syphilis est primaire ou secondaire précoce mais n’est possible qu’à partir du 5e mois de grossesse. L’atteinte congénitale peut être parlante (pemphigus palmo-plantaire, syphilides érythémato-pultacées, ostéochondrite des coudes, etc.), se caractériser par la classique triade de Hutchinson (kératite interstitielle, anomalies dentaires et surdité) ou ne se traduire que par la surdité. Un traitement précoce peut prévenir l’installation d’une surdité. Exceptionnellement chez l’enfant, la syphilis peut être acquise.
Les surdités acquises post-natales
Plusieurs causes peuvent être incriminées.
Causes périnatales
De nombreux facteurs de risque sont établis : séjour de plus de 5 jours en réanimation néonatale en particulier chez les enfants ayant un poids inférieur 1 500 g, une asphyxie néonatale ou un score d’APGAR à 5 minutes inférieur à 4 ou sous ventilation mécanique prolongée à haute fréquence ; traitements ototoxiques ou par diurétiques de l’anse, encéphalopathie hypoxique, échange transfusionnel pour hyperbilirubinémie (la surdité est de type neuropathie auditive, la photothérapie intensive diminue les séquelles).
Causes virales
Oreillons. Après une incubation de 18 à 21 jours, le paramyxovirus ourlien se manifeste cliniquement par une phase de prodromes (céphalées, fatigue, myalgies et fièvre) suivie par une parotidite uni- ou bilatérale précédée d’otalgie, plus rarement par une orchite (2 ‰) ou une pancréatite (0,4 ‰) ; cependant, l’infection peut passer inaperçue dans 20 à 30 % des cas.
L’incidence de la surdité de perception après oreillons est estimée entre 1/1 000 et 1/30 000.6 Elle est habituellement unilatérale et réversible mais peut être sévère et permanente. Son incidence a diminué depuis la vaccination systématique des nourrissons.
Rougeole. La rougeole est liée elle aussi à un paramyxovirus à simple brin d’ARN encapsulé. L’infection se caractérise par un syndrome pseudogrippal de 3 à 4 jours. Deux semaines plus tard débute une éruption cutanée maculopapuleuse d’une dizaine de jours ; le signe de Koplik au niveau de la muqueuse buccale est pathognomonique. La surdité de perception est une complication classique de la rougeole : elle correspondait à 5 à 10 % des surdités profondes avant la vaccination, était alors souvent bilatérale, modérée à profonde, et pouvait faire suite à une encéphalite. Par ailleurs, la rougeole est responsable d’une forte incidence d’otites moyennes aiguës responsables d’une surdité de transmission surajoutée. Dans la majorité des pays développés, la surdité a quasiment disparu : 0,9 cas/100 000 dans les pays où la couverture vaccinale est d’au moins 90 %.7
Varicelle et zona. Le virus habituellement quiescent au sein des nerfs peut se réactiver à l’occasion d’une immunodépression. Lorsque celle-ci survient au sein du ganglion géniculé, provoquant une éruption de la zone de Ramsay-Hunt et une paralysie faciale, il peut exister une diffusion virale vers le nerf cochléo-vestibulaire à l’origine d’un vertige ou d’une surdité de perception brusque, légère à modérée. La récupération auditive est souvent meilleure que la récupération faciale sous traitement antiviral et corticoïdes. La perte auditive des fréquences conversationnelles est de mauvais pronostic alors que la perte des hautes fréquences est souvent associée à une récupération complète.8
Virus de l’immunodéficience humaine (VIH). La surdité peut revêtir tous les aspects : unilatérale ou bilatérale, progressive ou brusque, de transmission, de perception ou mixte. De plus, elle peut être liée au virus lui-même ou aux atteintes opportunistes (CMV, syphilis, tuberculose, méningite à cryptocoques) ou à leur traitement ototoxique : il est donc parfois difficile d’identifier le facteur causal de la surdité. Il semble que les atteintes cochléo- vestibulaires augmentent avec la durée d’infection par le VIH, le taux bas de lymphocytes CD4 et la charge virale ; la prévention de la surdité passe par un contrôle de la maladie par un traitement antiviral.
Causes bactériennes
Méningites. La surdité est une complication reconnue des méningites bactériennes (pneumocoque, Haemophilus influenzae, méningocoque). Elle est consécutive soit à une labyrinthite séreuse ou toxique, soit à une thrombophlébite, à un embole des vaisseaux labyrinthiques ou encore à une hypoxie/anoxie du nerf cochléo-vestibulaire et des voies auditives centrales.7 La surdité survient en moyenne dans les 3 mois qui suivent la méningite10 justifiant une surveillance de l’audition rapprochée durant cette période. La particularité de cette cause est qu’elle entraîne une ossification de la cochlée dans un délai de 4 à 8 semaines. Devant l’apparition d’une surdité de perception post-méningitique, une imagerie de l’oreille interne doit donc être effectuée par tomodensitométrie pour montrer une éventuelle ossification mais idéalement par une IRM recherchant une disparition du signal liquidien en séquences T2 évoquant une fibrose débutante. L’IRM permet aussi d’évaluer les éventuelles atteintes centrales consécutives à la méningite. Ces deux examens sont donc complémentaires. Une surdité de perception sévère ou profonde bilatérale constitue actuellement une indication reconnue d’implantation bilatérale rapide, compte tenu du risque d’évolution vers une labyrinthite ossifiante.
Maladie de Lyme. Dans cette infection par la bactérie Borrelia burgdorferi, la survenue d’une surdité est rare et se manifeste plutôt par une surdité de perception brusque.11 Le contexte, une éventuelle paralysie faciale associée justifient la pratique d’une sérologie.
Otite moyenne aiguë. Une surdité de perception permanente et irréversible peut être observée dans le cadre d’une labyrinthite aiguë purulente associée ou non à un cholestéatome.
Traumatismes et toxicité
Fracture du rocher. Les enfants sont particulièrement exposés à des fractures des rochers suite à des accidents de la voie publique, de vélo, de skate, ou encore de chute de lits superposés. Selon le siège du trait de fracture, on peut observer une surdité de perception ou de transmission.12
Traumatisme acoustique. Les jeunes sont particulièrement exposés à des bruits intenses en raison de l’utilisation de dispositifs musicaux avec écouteurs et des concerts (le volume de sortie qui peut atteindre 120 dB !). Ces traumatismes sonores sont majorés par l’administration d’aminosides, de chimiothérapies, une prédisposition génétique… La surdité de perception qui en résulte affecte les hautes fréquences, réalisant le classique scotome sur la fréquence 4 000 Hz.
Médicaments ototoxiques. De nombreux médicaments peuvent entraîner une atteinte des cellules ciliées externes : les aminosides, les dérivés du cisplatine, l’érythromycine, la vancomycine, le furosémide (diurétiques de l’anse), la quinine, l’aspirine. Une susceptibilité génétique aux aminosides liée à la mutation A1555G de l’ADN mitochondrial a été identifiée : la surdité qui en résulte est de sévérité variable et d’évolution progressive. Par ailleurs, il faut être particulièrement vigilant sur un tympan ouvert et proscrire l’utilisation de gouttes ototoxiques contentant des aminosides.
Surdités auto-immunes et inflammatoires
Cette cause, peu fréquente chez l’enfant, peut être évoquée lorsque la surdité de perception s’inscrit dans le cadre d’affections telles que le syndrome de Cogan (kératite interstitielle, surdité, atteinte vestibulaire, positivité des anticorps anti-Cogan ou anti-HSP70), la sarcoïdose, ou la granulomatose de Wegener.
La surdité de perception est progressive, bilatérale, souvent associée à des signes vestibulaires. On constate souvent une bonne sensibilité au traitement corticoïde. Différents anticorps peuvent être recherchés : anti-Cogan, anti-connexine 26, anti-DEPA/CD148, anti-reovirus.13
Priorité au développement du langage
L’annonce d’une surdité permanente chez un enfant peut être perçue comme un traumatisme. Il faut donc être très prudent dans les termes utilisés, savoir renouveler les entretiens et être à l’écoute des parents. Un accompagnement psychologique peut aider à l’acceptation du diagnostic et de ses répercussions. La prise en charge de la perte auditive repose sur la mise en place d’un appareillage, une chirurgie ou un implant cochléaire et le soutien orthophonique. La priorité doit être mise sur le développement du langage, qu’il soit parlé ou signé, et l’insertion dans un projet éducatif adapté. L’identification de la cause peut permettre de rassurer les parents, donner des éléments pronostiques tant sur l’évolution que sur la prise en charge, évaluer le risque de récurrence dans la fratrie et aider aux choix thérapeutiques. Cependant, les bilans étiologiques ne doivent pas ralentir la prise en charge, en particulier pour les surdités de perception ; en effet, les tests génétiques peuvent nécessiter du temps.
Références
1. Forner G, Abate D, Mengoli C, Palu G, Gussetti N. High Cytomegalovirus (CMV) DNAemia Predicts CMV Sequelae in Asymptomatic Congenitally Infected Newborns Born to Women With Primary Infection During Pregnancy. J Infect Dis 2015;212:67-71.
2. Ross SA, Ahmed A, Palmer AL, et al. Newborn dried blood spot polymerase chain reaction to identify infants with congenital cytomegalovirus-associated sensorineural hearing loss. J Pediatr 2017;184:57-61.e1.
3. Wild NJ, Sheppard S, Smithells RW, Holzel H, Jones G. Onset and severity of hearing loss due to congenital rubella infection. Arch Dis Childhood 1989;64:1280-3.
4. Westerberg BD, Atashband S, Kozak FK. A systematic review of the incidence of sensorineural hearing loss in neonates exposed to Herpes simplex virus (HSV). Int J Pediatr Otorhinolaryngol 2008;72:931-7.
5. Villard O, Cimon B, L'Ollivier C, et al. Serological diagnosis of Toxoplasma gondii infection: recommendations from the French National Reference Center for Toxoplasmosis. Diagn Microbiol Infect Dis 2016;84:22-33.
6. Cohen BE, Durstenfeld A, Roehm PC. Viral causes of hearing loss: a review for hearing health professionals. Trends Hear 2014;18. pii: 2331216514541361.
7. Kenna MA. Acquired hearing loss in children. Otolaryngol Clin North America 2015;48:933-53.
8. Wayman DM, Pham HN, Byl FM, Adour KK. Audiological manifestations of Ramsay Hunt syndrome. J Laryngol Otology 1990;104:104-8.
9. van der Westhuizen Y, Swanepoel de W, Heinze B, Hofmeyr LM. Auditory and otological manifestations in adults with HIV/AIDS. Int J Audiol 2013;52:37-43.
10. Teissier N, Doehring I, Noel-Petroff N, et al. Implants cochléaires dans les surdités après méningite bactérienne: suivi audiologique de 16 enfants. Arch Pediatr 2013;20:616-23.
11. Peeters N, van der Kolk BY, Thijsen SF, Colnot DR. Lyme disease associated with sudden sensorineural hearing loss: case report and literature review. Otol Neurotol 2013;34:832-7.
12. Dunklebarger J, Branstetter Bt, Lincoln A, et al. Pediatric temporal bone fractures: current trends and comparison of classification schemes. Laryngoscope 2014;124:781-4.
13. Berti E, Vannucci G, Lunardi C, et al. Identification of autoantibodies against inner ear antigens in a cohort of children with idiopathic sensorineural hearing loss. Autoimmunity 2013;46:525-30.
14. American Academy of Pediatrics, Joint Committee on Infant Hearing. Year 2007 position statement: Principles and guidelines for early hearing detection and intervention programs. Pediatrics 2007;120:898-921.
15. Leruez-Ville M, Magny JF, Couderc S, et al. Risk factors for congenital cytomegalovirus infection following primary and nonprimary maternal infection: a prospective neonatal screening study using polymerase chain reaction in saliva. Clin Infect Dis 2017;65:398-404.
2. Ross SA, Ahmed A, Palmer AL, et al. Newborn dried blood spot polymerase chain reaction to identify infants with congenital cytomegalovirus-associated sensorineural hearing loss. J Pediatr 2017;184:57-61.e1.
3. Wild NJ, Sheppard S, Smithells RW, Holzel H, Jones G. Onset and severity of hearing loss due to congenital rubella infection. Arch Dis Childhood 1989;64:1280-3.
4. Westerberg BD, Atashband S, Kozak FK. A systematic review of the incidence of sensorineural hearing loss in neonates exposed to Herpes simplex virus (HSV). Int J Pediatr Otorhinolaryngol 2008;72:931-7.
5. Villard O, Cimon B, L'Ollivier C, et al. Serological diagnosis of Toxoplasma gondii infection: recommendations from the French National Reference Center for Toxoplasmosis. Diagn Microbiol Infect Dis 2016;84:22-33.
6. Cohen BE, Durstenfeld A, Roehm PC. Viral causes of hearing loss: a review for hearing health professionals. Trends Hear 2014;18. pii: 2331216514541361.
7. Kenna MA. Acquired hearing loss in children. Otolaryngol Clin North America 2015;48:933-53.
8. Wayman DM, Pham HN, Byl FM, Adour KK. Audiological manifestations of Ramsay Hunt syndrome. J Laryngol Otology 1990;104:104-8.
9. van der Westhuizen Y, Swanepoel de W, Heinze B, Hofmeyr LM. Auditory and otological manifestations in adults with HIV/AIDS. Int J Audiol 2013;52:37-43.
10. Teissier N, Doehring I, Noel-Petroff N, et al. Implants cochléaires dans les surdités après méningite bactérienne: suivi audiologique de 16 enfants. Arch Pediatr 2013;20:616-23.
11. Peeters N, van der Kolk BY, Thijsen SF, Colnot DR. Lyme disease associated with sudden sensorineural hearing loss: case report and literature review. Otol Neurotol 2013;34:832-7.
12. Dunklebarger J, Branstetter Bt, Lincoln A, et al. Pediatric temporal bone fractures: current trends and comparison of classification schemes. Laryngoscope 2014;124:781-4.
13. Berti E, Vannucci G, Lunardi C, et al. Identification of autoantibodies against inner ear antigens in a cohort of children with idiopathic sensorineural hearing loss. Autoimmunity 2013;46:525-30.
14. American Academy of Pediatrics, Joint Committee on Infant Hearing. Year 2007 position statement: Principles and guidelines for early hearing detection and intervention programs. Pediatrics 2007;120:898-921.
15. Leruez-Ville M, Magny JF, Couderc S, et al. Risk factors for congenital cytomegalovirus infection following primary and nonprimary maternal infection: a prospective neonatal screening study using polymerase chain reaction in saliva. Clin Infect Dis 2017;65:398-404.