Les critères diagnostiques de l’artérite à cellules géantes (ACG), publiés par l’American College of Rheumatology en 19901, ont été mis à jour en 2022 (tableau ).2 Y apparaissent les signes de pseudopolyarthrite rhizomélique (PPR), les manifestations ophtalmologiques de l’ACG et les résultats de l’imagerie vasculaire (échographie-Doppler des artères temporales et recherche d’une aortite par tomographie par émission de positons [TEP-scan]). Cependant, ces critères restent des critères de classification et non de diagnostic. Leur performance a été évaluée pour distinguer l’ACG des autres types de vascularites.
En pratique clinique, le diagnostic d’ACG repose sur l’association de signes d’ACG ou de PPR, d’un syndrome inflammatoire biologique, qui est quasi constant, et d’une preuve de vascularite des gros vaisseaux apportée par l’analyse histologique d’une artère de gros calibre (généralement l’artère temporale) et/ou par l’imagerie vasculaire. La réponse au traitement par corticoïdes est également un élément majeur du diagnostic car ils sont toujours efficaces sur les symptômes et le syndrome inflammatoire, le plus souvent en 48 heures. Une corticorésistance doit ainsi faire remettre en cause le diagnostic.
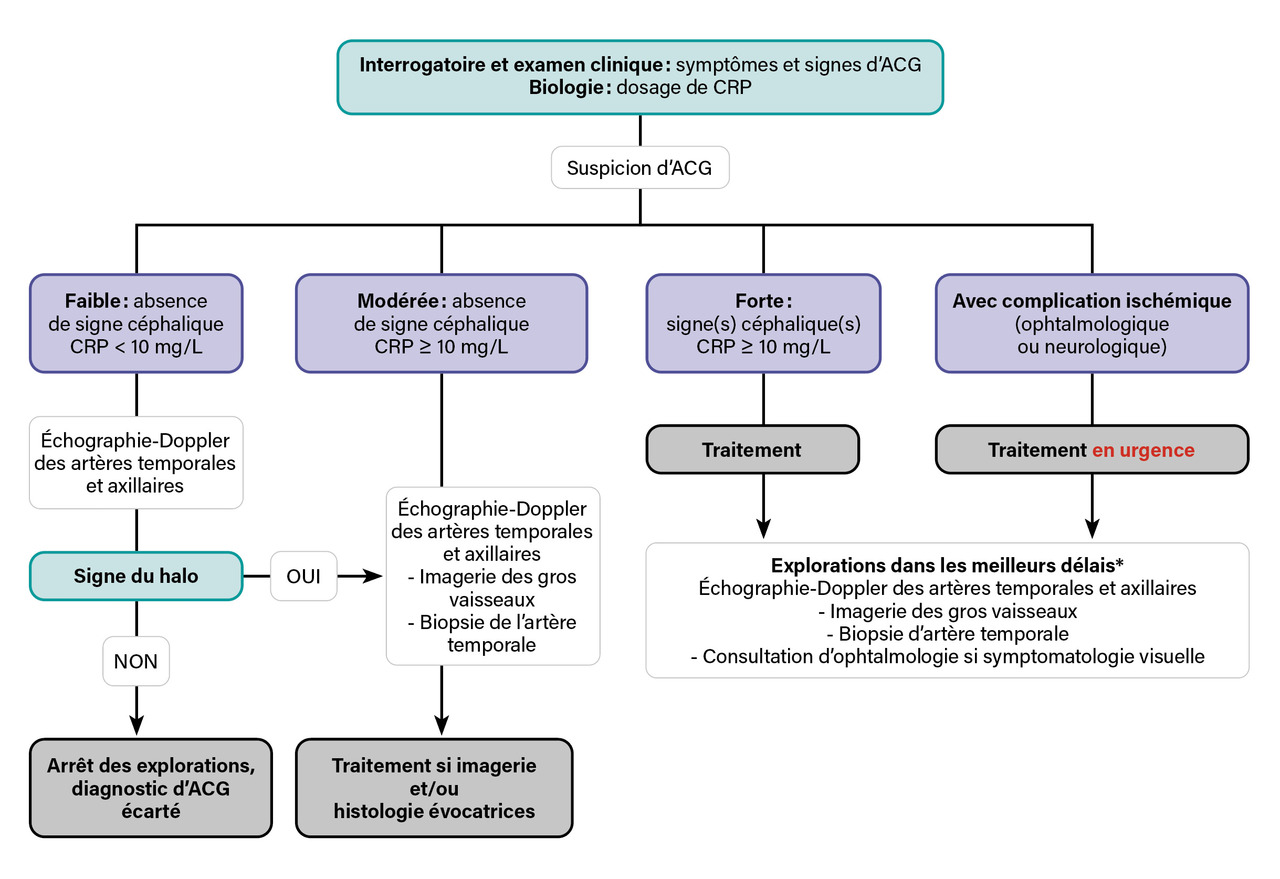
Dans la mesure où le traitement de l’ACG est prolongé (généralement plus de 12 mois) et peut faire appel à l’utilisation de traitements immunosuppresseurs et/ou de thérapeutiques ciblées, le diagnostic doit être posé avec un haut niveau de certitude. Même s’il est parfois nécessaire de débuter le traitement rapidement pour éviter les complications ischémiques, il est donc capital que les explorations visant à confirmer le diagnostic d’ACG soient réalisées dans les meilleurs délais. L’adressage des patients à des services spécialisés disposant de filières de type « fast track » permet d’optimiser leur prise en charge, d’accélérer l’accès à un traitement adapté et aux examens spécialisés, donc de diminuer le risque de complication ischémique.3 L’organisation de ces structures repose sur une consultation auprès d’un médecin expert, suivie de la réalisation d’un bilan biologique comprenant un dosage de la protéine C-réactive (C reactive protein [CRP]) et une échographie-Doppler des artères temporales qui permet de déterminer la probabilité diagnostique d’ACG et d’organiser la suite de la prise en charge (fig. 1 ).
En pratique clinique, le diagnostic d’ACG repose sur l’association de signes d’ACG ou de PPR, d’un syndrome inflammatoire biologique, qui est quasi constant, et d’une preuve de vascularite des gros vaisseaux apportée par l’analyse histologique d’une artère de gros calibre (généralement l’artère temporale) et/ou par l’imagerie vasculaire. La réponse au traitement par corticoïdes est également un élément majeur du diagnostic car ils sont toujours efficaces sur les symptômes et le syndrome inflammatoire, le plus souvent en 48 heures. Une corticorésistance doit ainsi faire remettre en cause le diagnostic.
Dans la mesure où le traitement de l’ACG est prolongé (généralement plus de 12 mois) et peut faire appel à l’utilisation de traitements immunosuppresseurs et/ou de thérapeutiques ciblées, le diagnostic doit être posé avec un haut niveau de certitude. Même s’il est parfois nécessaire de débuter le traitement rapidement pour éviter les complications ischémiques, il est donc capital que les explorations visant à confirmer le diagnostic d’ACG soient réalisées dans les meilleurs délais. L’adressage des patients à des services spécialisés disposant de filières de type « fast track » permet d’optimiser leur prise en charge, d’accélérer l’accès à un traitement adapté et aux examens spécialisés, donc de diminuer le risque de complication ischémique.3 L’organisation de ces structures repose sur une consultation auprès d’un médecin expert, suivie de la réalisation d’un bilan biologique comprenant un dosage de la protéine C-réactive (C reactive protein [CRP]) et une échographie-Doppler des artères temporales qui permet de déterminer la probabilité diagnostique d’ACG et d’organiser la suite de la prise en charge (
Deux types de manifestations cliniques
Les symptômes de l’ACG sont de deux types : inflammatoires et ischémiques.
Les symptômes inflammatoires sont liés à la réponse inflammatoire systémique, qui est quasi constante et qui est liée à la production d’interleukine 6 (IL-6) dont la concentration sérique est corrélée à l’activité de la maladie et aux marqueurs du syndrome inflammatoire (CRP, fibrinogène).4
Les manifestations ischémiques dépendent de la topographie des artères atteintes et sont la conséquence du processus de remodelage vasculaire qui aboutit à un épaississement de la paroi vasculaire et, in fine, à une sténose, voire une occlusion, des vaisseaux atteints. L’ACG touche avec prédilection les artères du système carotidien externe. Ainsi, les symptômes les plus fréquents concernent la sphère céphalique.
Les symptômes inflammatoires sont liés à la réponse inflammatoire systémique, qui est quasi constante et qui est liée à la production d’interleukine 6 (IL-6) dont la concentration sérique est corrélée à l’activité de la maladie et aux marqueurs du syndrome inflammatoire (CRP, fibrinogène).4
Les manifestations ischémiques dépendent de la topographie des artères atteintes et sont la conséquence du processus de remodelage vasculaire qui aboutit à un épaississement de la paroi vasculaire et, in fine, à une sténose, voire une occlusion, des vaisseaux atteints. L’ACG touche avec prédilection les artères du système carotidien externe. Ainsi, les symptômes les plus fréquents concernent la sphère céphalique.
Signes généraux inflammatoires
Ils sont liés à la réponse inflammatoire systémique. L’asthénie est quasi constante et s’accompagne parfois d’un amaigrissement, d’une anorexie et de fièvre. La fièvre est retrouvée dans 10 à 50 % des cas, selon les séries. Elle ne dépasse habituellement pas 39 °C, ne s’accompagne pas de frissons mais peut être parfois associée à des sueurs nocturnes.4
Manifestations céphaliques, le principal symptôme
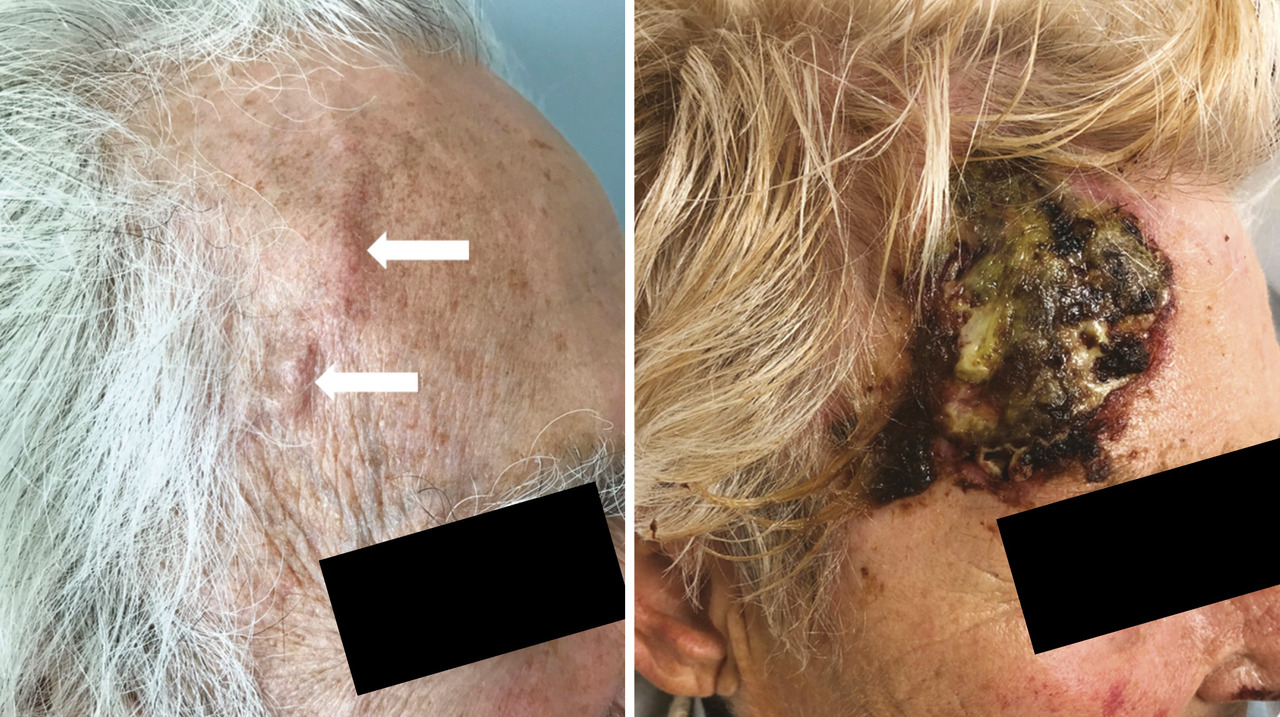
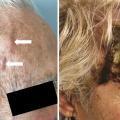
Les céphalées sont le principal symptôme de l’ACG et sont souvent de localisation temporale ou fronto-temporale, uni- ou bilatérales. Parfois, les céphalées sont de localisation occipitale, faciale ou rétro-orbitaire. Elles sont typiquement récentes (moins de 3 semaines). Leur intensité est variable. Elles peuvent être déclenchées par le froid ou le contact et s’associer à une hyperesthésie du cuir chevelu. L’examen clinique peut révéler une artère temporale visible formant un cordon saillant, induré et tortueux, qui peut être dur, sensible et épaissi à la palpation (fig. 2A ). Les pouls temporaux peuvent être diminués ou abolis. La peau en regard de l’artère temporale peut être normale, œdématiée ou inflammatoire.4 Cette atteinte peut rarement se compliquer de nécrose du scalp (fig. 2B ).
L’atteinte des artères maxillaires provoque une claudication des mâchoires. Il s’agit d’une douleur, à type de crampe douloureuse, qui apparaît au niveau des masséters lors de la mastication. Ce signe ne doit pas être confondu avec des douleurs et/ou des sensations de craquement au niveau de l’articulation temporo-mandibulaire, qui doivent plutôt faire évoquer un syndrome algodysfonctionnel de l’appareil manducateur (SADAM).
L’atteinte de l’artère linguale peut provoquer une claudication de la langue et, beaucoup plus rarement, une nécrose de la langue.
L’atteinte des artères maxillaires provoque une claudication des mâchoires. Il s’agit d’une douleur, à type de crampe douloureuse, qui apparaît au niveau des masséters lors de la mastication. Ce signe ne doit pas être confondu avec des douleurs et/ou des sensations de craquement au niveau de l’articulation temporo-mandibulaire, qui doivent plutôt faire évoquer un syndrome algodysfonctionnel de l’appareil manducateur (SADAM).
L’atteinte de l’artère linguale peut provoquer une claudication de la langue et, beaucoup plus rarement, une nécrose de la langue.
Manifestations ophtalmologiques : un risque de séquelles irréversibles
Les complications ophtalmologiques font toute la gravité de l’ACG du fait du risque de séquelles visuelles irréversibles. Avant l’utilisation des corticoïdes, plus de 25 % des patients présentaient une cécité. Depuis leur utilisation, ce chiffre est désormais d’environ 10 %, et il pourrait encore baisser avec la généralisation des filières fast track.3
Les complications ischémiques visuelles surviennent presque exclusivement au diagnostic d’ACG, de préférence chez des patients ayant un phénotype d’ACG céphalique, dans 96 % des cas avant l’instauration des corticoïdes et dans 90 % des cas moins de trois mois après l’apparition des premiers symptômes. Leur fréquence est inférieure à 1 % en cas de rechute d’ACG.
L’ACG peut provoquer quatre types d’atteintes ophtalmologiques :
– une diplopie binoculaire (6 % des atteintes ophtalmologiques) par atteinte ischémique des muscles oculomoteurs ou des paires crâniennes, en particulier la IIIe paire crânienne. Cette atteinte est habituellement réversible sous traitement, parfois en plusieurs semaines ;
– une névrite optique ischémique antérieure aiguë (NOIAA). C’est l’atteinte ophtalmologique la plus fréquente au cours de l’ACG (de 77 à 92 % des manifestations ophtalmologiques). L’atteinte visuelle est habituellement très sévère et définitive. Le traitement, qui doit être instauré en urgence, vise à prévenir la bilatéralisation de la NOIAA et n’a malheureusement aucun effet sur la récupération de l’œil atteint ;
– une occlusion de l’artère centrale de la rétine (OACR ; de 4 à 21 %). Elle doit faire évoquer une ACG, surtout si elle est associée à une NOIAA ou à d’autres signes cliniques d’ACG ;
– une névrite optique ischémique postérieure (NOIP). Il s’agit de l’atteinte la plus rare (6 %). Elle peut s’associer à la NOIAA. Sa sémiologie ophtalmologique est proche de la névrite optique rétrobulbaire (NORB), mais sa cause est ischémique et non démyélinisante.
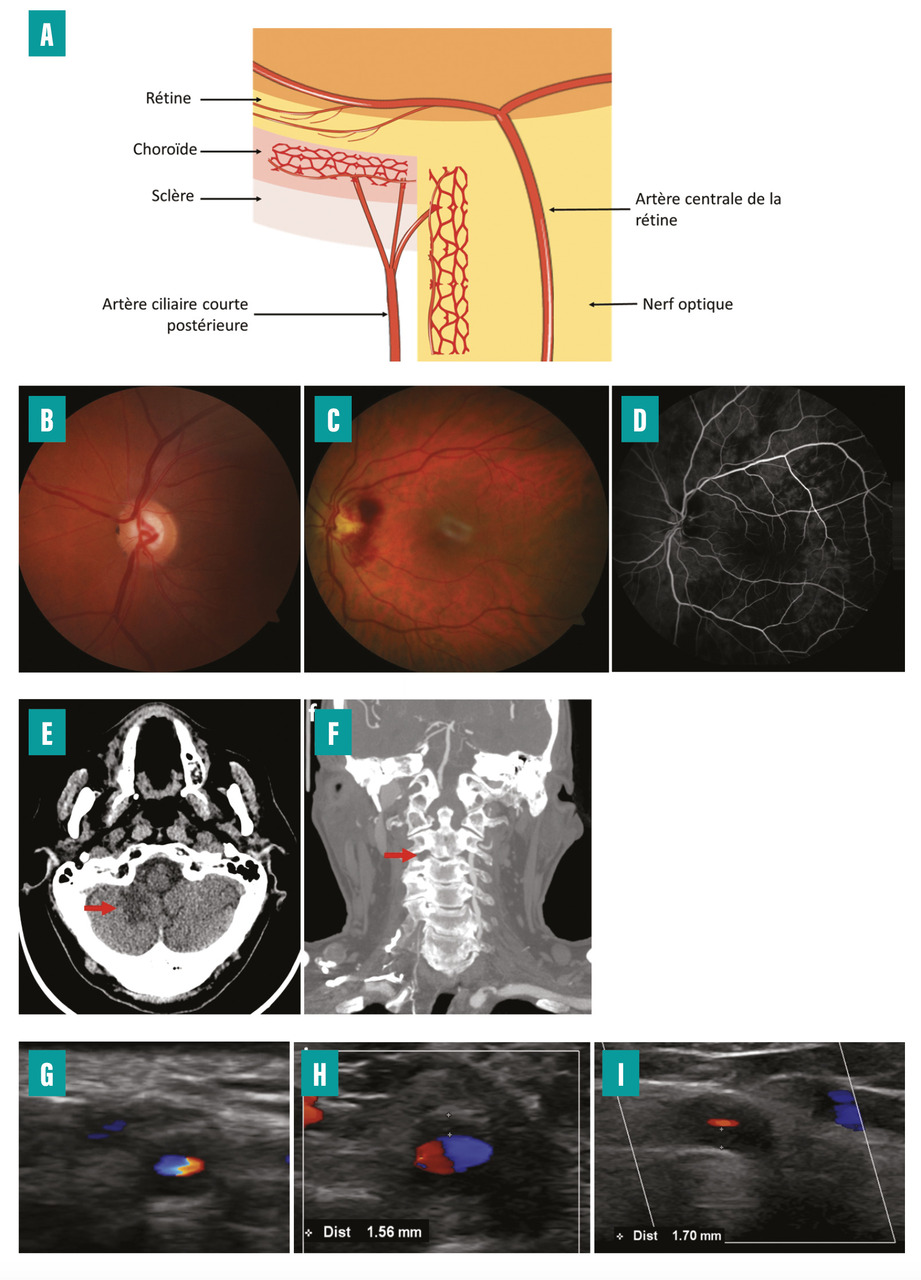
La NOIAA est la conséquence d’une occlusion des artères ciliaires courtes postérieures qui vascularisent la tête du nerf optique dans la portion qui traverse la région laminaire et prélaminaire (prolongement de la sclère et la choroïde). De plus, ces artères vascularisent la choroïde, qui est une couche vasculaire située sous la rétine qui irrigue la macula, laquelle est à l’origine de 90 % de l’acuité visuelle.
Il existe deux types de NOIAA :
– d’une part, la NOIAA artéritique (10 % des cas), liée à l’ACG et qui, outre l’ischémie de la tête du nerf optique, provoque une ischémie choroïdienne à l’origine d’une baisse d’acuité visuelle très profonde. L’atteinte définitive peut être précédée d’épisodes d’amaurose de quelques secondes à quelques minutes, qui correspondent à une ischémie transitoire de la choroïde ;
– d’autre part, la NOIAA « non artéritique » (90 % des cas), qui correspond à une ischémie plus limitée à la tête du nerf optique avec une baisse d’acuité visuelle moins profonde et des troubles du champ visuel évocateurs (déficit altitudinal). Ces NOIAA non artéritiques sont généralement liées à un syndrome d’apnées du sommeil, à des hypotensions artérielles nocturnes chez des patients à risque : petite papille étroite, terrain à haut risque cardiovasculaire.
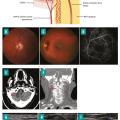
Au cours de la NOIAA, quelle qu’en soit la cause, l’examen ophtalmologique montre un œdème papillaire laissant ensuite place à une papille atrophique en environ huit semaines et parfois des hémorragies rétiniennes à prédominance péripapillaire. L’angiographie rétinienne à la fluorescéine et au vert d’indocyanine est utile pour rechercher un retard choroïdien, très spécifique de la NOIAA artéritique (fig. 3 A-D).5
En cas de NOIAA non artéritique, il n’existe pas de signe clinique d’ACG ni de syndrome inflammatoire mais il faut rester prudent car 20 % des cas de NOIAA artéritiques sont isolées et, chez ces patients, le syndrome inflammatoire est moins marqué que chez ceux ayant une ACG sans complication visuelle.5
Les complications ischémiques visuelles surviennent presque exclusivement au diagnostic d’ACG, de préférence chez des patients ayant un phénotype d’ACG céphalique, dans 96 % des cas avant l’instauration des corticoïdes et dans 90 % des cas moins de trois mois après l’apparition des premiers symptômes. Leur fréquence est inférieure à 1 % en cas de rechute d’ACG.
L’ACG peut provoquer quatre types d’atteintes ophtalmologiques :
– une diplopie binoculaire (6 % des atteintes ophtalmologiques) par atteinte ischémique des muscles oculomoteurs ou des paires crâniennes, en particulier la IIIe paire crânienne. Cette atteinte est habituellement réversible sous traitement, parfois en plusieurs semaines ;
– une névrite optique ischémique antérieure aiguë (NOIAA). C’est l’atteinte ophtalmologique la plus fréquente au cours de l’ACG (de 77 à 92 % des manifestations ophtalmologiques). L’atteinte visuelle est habituellement très sévère et définitive. Le traitement, qui doit être instauré en urgence, vise à prévenir la bilatéralisation de la NOIAA et n’a malheureusement aucun effet sur la récupération de l’œil atteint ;
– une occlusion de l’artère centrale de la rétine (OACR ; de 4 à 21 %). Elle doit faire évoquer une ACG, surtout si elle est associée à une NOIAA ou à d’autres signes cliniques d’ACG ;
– une névrite optique ischémique postérieure (NOIP). Il s’agit de l’atteinte la plus rare (6 %). Elle peut s’associer à la NOIAA. Sa sémiologie ophtalmologique est proche de la névrite optique rétrobulbaire (NORB), mais sa cause est ischémique et non démyélinisante.
La NOIAA est la conséquence d’une occlusion des artères ciliaires courtes postérieures qui vascularisent la tête du nerf optique dans la portion qui traverse la région laminaire et prélaminaire (prolongement de la sclère et la choroïde). De plus, ces artères vascularisent la choroïde, qui est une couche vasculaire située sous la rétine qui irrigue la macula, laquelle est à l’origine de 90 % de l’acuité visuelle.
Il existe deux types de NOIAA :
– d’une part, la NOIAA artéritique (10 % des cas), liée à l’ACG et qui, outre l’ischémie de la tête du nerf optique, provoque une ischémie choroïdienne à l’origine d’une baisse d’acuité visuelle très profonde. L’atteinte définitive peut être précédée d’épisodes d’amaurose de quelques secondes à quelques minutes, qui correspondent à une ischémie transitoire de la choroïde ;
– d’autre part, la NOIAA « non artéritique » (90 % des cas), qui correspond à une ischémie plus limitée à la tête du nerf optique avec une baisse d’acuité visuelle moins profonde et des troubles du champ visuel évocateurs (déficit altitudinal). Ces NOIAA non artéritiques sont généralement liées à un syndrome d’apnées du sommeil, à des hypotensions artérielles nocturnes chez des patients à risque : petite papille étroite, terrain à haut risque cardiovasculaire.
Au cours de la NOIAA, quelle qu’en soit la cause, l’examen ophtalmologique montre un œdème papillaire laissant ensuite place à une papille atrophique en environ huit semaines et parfois des hémorragies rétiniennes à prédominance péripapillaire. L’angiographie rétinienne à la fluorescéine et au vert d’indocyanine est utile pour rechercher un retard choroïdien, très spécifique de la NOIAA artéritique (
En cas de NOIAA non artéritique, il n’existe pas de signe clinique d’ACG ni de syndrome inflammatoire mais il faut rester prudent car 20 % des cas de NOIAA artéritiques sont isolées et, chez ces patients, le syndrome inflammatoire est moins marqué que chez ceux ayant une ACG sans complication visuelle.5
Manifestations neurologiques : 7 % des patients ont un AVC au diagnostic
Environ 7 % des patients ont un accident vasculaire cérébral (AVC) au moment du diagnostic d’ACG. Ces AVC représentent la première cause de décès au cours de l’ACG. Ils concernent généralement le territoire vertébro-basilaire (70 % des cas) et sont soit la conséquence d’une atteinte directe des artères vertébrales par la vascularite, soit celle d’un bas débit au niveau des artères vertébrales du fait d’une sténose des artères sous-clavières avant la naissance des artères vertébrales (fig. 3 E, F ).6
Atteintes de l’aorte et des gros vaisseaux
Selon les séries, un à deux tiers des patients ont une atteinte des gros vaisseaux. La plus fréquente concerne l’aorte suivie des artères sous-clavières.7,8
L’atteinte aortique, ou « aortite », est généralement asymptomatique, ou associée à des signes non spécifiques : asthénie, toux sèche, sueurs nocturnes, fièvre modérée, douleur dorsale ou thoracique et syndrome inflammatoire. Plus rarement, elle se complique de dissection aortique à la phase aiguë ou de dilatation anévrismale à long terme, en moyenne trois à dix ans après le diagnostic. Ce risque de dilatation aortique requiert une surveillance régulière des patients ayant un antécédent d’aortite et peut, à terme, nécessiter une prise en charge chirurgicale. L’atteinte de l’aorte thoracique est plus fréquente que celle de l’aorte abdominale. On recommande actuellement de rechercher systématiquement une atteinte des gros vaisseaux (aorte et ses branches) au diagnostic d’ACG, car c’est un marqueur de risque de dilatation artérielle,9 de survenue d’événement cardiovasculaire majeur,10 de rechute,11 et même de décès.7
L’atteinte des gros vaisseaux des membres, plus fréquente aux membres supérieurs qu’inférieurs, est généralement asymptomatique mais peut parfois provoquer une claudication de membre, l’abolition d’un pouls, la survenue d’un souffle vasculaire, une asymétrie tensionnelle, voire des complications trophiques.
L’atteinte aortique, ou « aortite », est généralement asymptomatique, ou associée à des signes non spécifiques : asthénie, toux sèche, sueurs nocturnes, fièvre modérée, douleur dorsale ou thoracique et syndrome inflammatoire. Plus rarement, elle se complique de dissection aortique à la phase aiguë ou de dilatation anévrismale à long terme, en moyenne trois à dix ans après le diagnostic. Ce risque de dilatation aortique requiert une surveillance régulière des patients ayant un antécédent d’aortite et peut, à terme, nécessiter une prise en charge chirurgicale. L’atteinte de l’aorte thoracique est plus fréquente que celle de l’aorte abdominale. On recommande actuellement de rechercher systématiquement une atteinte des gros vaisseaux (aorte et ses branches) au diagnostic d’ACG, car c’est un marqueur de risque de dilatation artérielle,9 de survenue d’événement cardiovasculaire majeur,10 de rechute,11 et même de décès.7
L’atteinte des gros vaisseaux des membres, plus fréquente aux membres supérieurs qu’inférieurs, est généralement asymptomatique mais peut parfois provoquer une claudication de membre, l’abolition d’un pouls, la survenue d’un souffle vasculaire, une asymétrie tensionnelle, voire des complications trophiques.
Pseudopolyarthrite rhizomélique
Dans 27 à 56 % des cas, l’ACG s’associe à une pseudopolyarthrite rhizomélique (PPR), qui se caractérise par une raideur et des douleurs d’horaire inflammatoire au niveau des ceintures scapulaire et pelvienne mais aussi au niveau cervical et parfois lombaire. La PPR est due à une bursite au niveau des bourses séreuses sous-acromiales, trochantériennes ou au niveau des bourses interépineuses cervicales ou lombaires.4
Deux phénotypes de la maladie
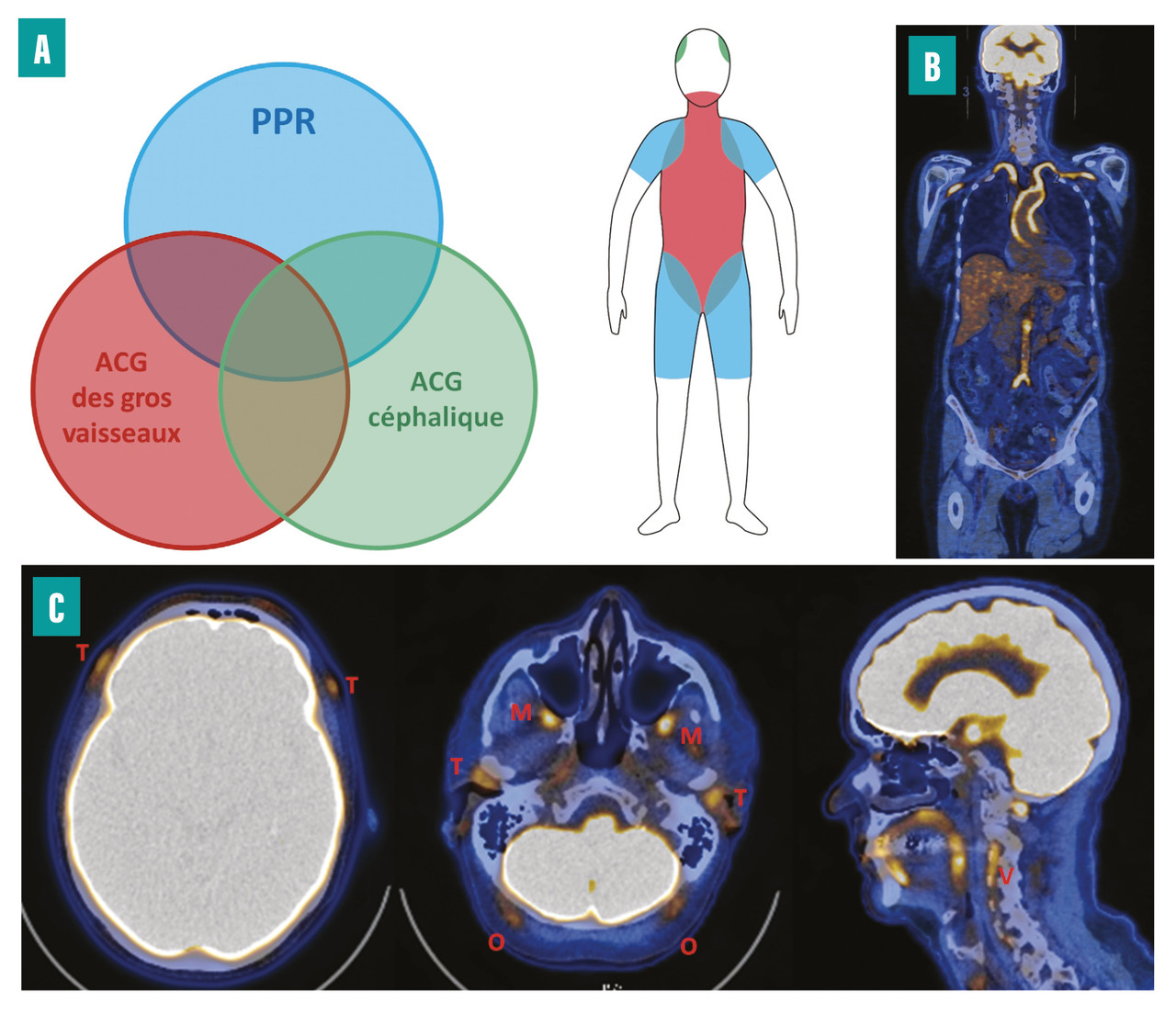
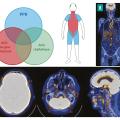
On distingue deux phénotypes de la maladie : l’ACG céphalique, qui atteint avec prédilection les artères temporales et d’autres branches de l’artère carotide externe, et l’ACG extracéphalique, dans laquelle l’atteinte prédomine sur les gros vaisseaux, notamment l’aorte et les axes artériels subclavio-axillaires. Ces deux phénotypes peuvent coexister (fig. 4 ).12
Examens biologiques : pas de spécificité
Il n’existe pas de marqueur biologique spécifique de l’ACG. De façon quasi constante, les patients ont un syndrome inflammatoire. La vitesse de sédimentation (VS) est en moyenne à 93 ± 23 mm/h, la CRP à 94 ± 63 mg/L. La CRP est normale (inférieure à 6 mg/L) dans moins de 5 % des cas. Une anémie (hémoglobine inférieure à 12 g/dL) inflammatoire est observée dans 54,6 % des cas et une thrombocytose dans 48,8 % des cas.13 Néanmoins, la VS peut être inférieure à 50 mm/h dans 10,8 % des cas14, et sa normalité n’exclut donc pas le diagnostic.
Examens pour confirmer le diagnostic de vascularite
Le diagnostic d’ACG nécessite de confirmer l’existence d’une vascularite des gros vaisseaux, soit au niveau des artères céphaliques (généralement l’artère temporale), soit au niveau de l’aorte et de ses branches.
Le choix des examens à réaliser doit tenir compte :
– du phénotype supposé de la maladie (ACG céphalique ou extracéphalique) ;
– de la disponibilité des examens, de leur coût et de leur caractère invasif ou irradiant ;
– de leurs avantages et limites, en particulier leur caractère opérateur-dépendant et l’évolution de leur performance après que le traitement par corticoïdes a été débuté.
Le choix des examens à réaliser doit tenir compte :
– du phénotype supposé de la maladie (ACG céphalique ou extracéphalique) ;
– de la disponibilité des examens, de leur coût et de leur caractère invasif ou irradiant ;
– de leurs avantages et limites, en particulier leur caractère opérateur-dépendant et l’évolution de leur performance après que le traitement par corticoïdes a été débuté.
Biopsie d’artère temporale, l’examen de référence
La biopsie de l’artère temporale (BAT) est l’examen de référence permettant de confirmer avec le plus de spécificité le diagnostic d’ACG.
Le prélèvement se fait sous anesthésie locale, au bloc opératoire.
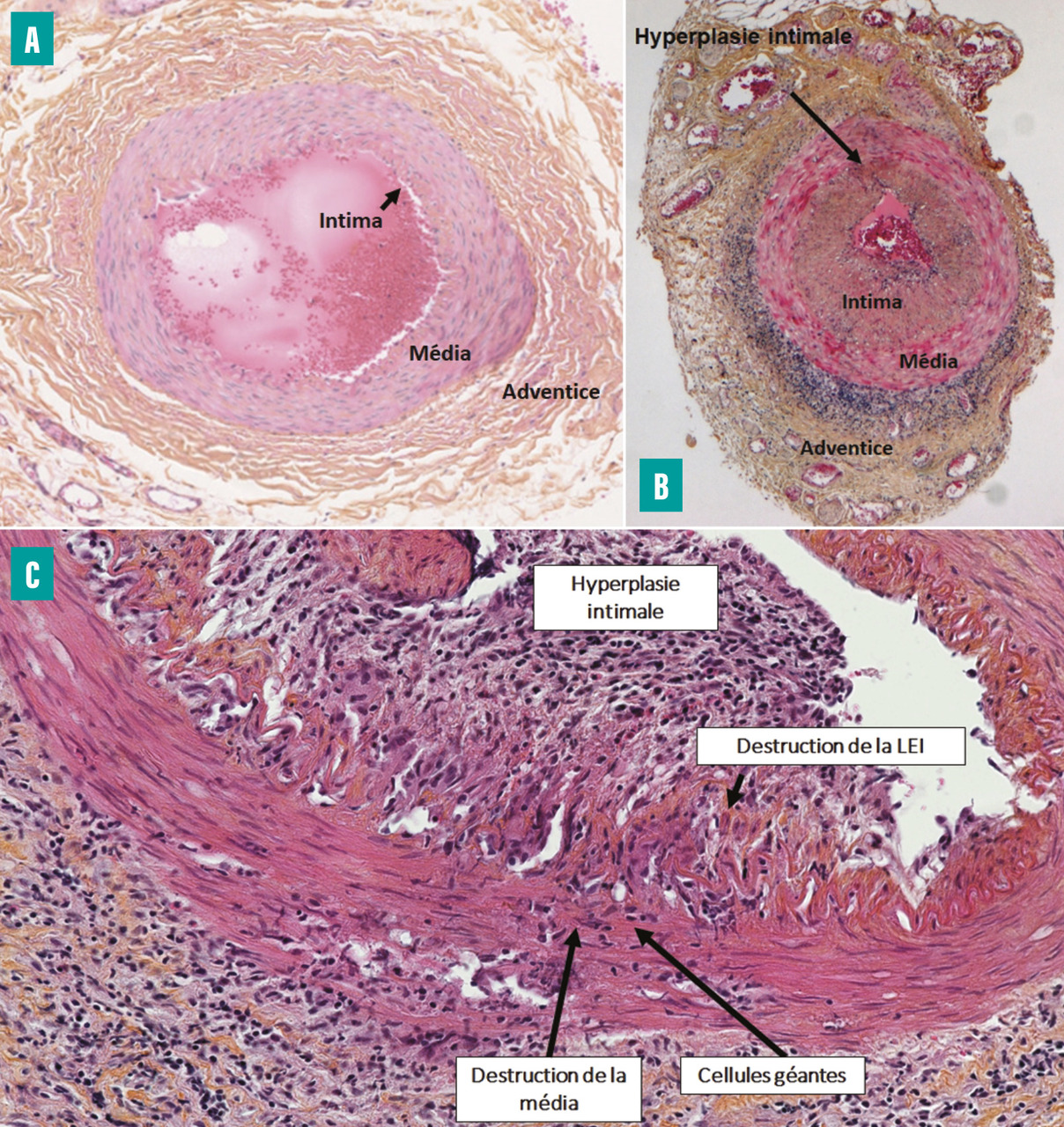
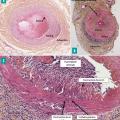
L’analyse histologique révèle une panartérite granulomateuse, non nécrosante, avec un infiltrat cellulaire inflammatoire composé de cellules mononucléées (lymphocytes T et macrophages), parfois de cellules géantes généralement situées à la jonction intima-média, une fragmentation de la limitante élastique interne, une destruction de la média et une hyperplasie de l’intima, qui induit une sténose de la lumière vasculaire (fig. 5 ). Cependant, seules 50 % des biopsies présentent toutes ces caractéristiques. Dans les autres cas, on observe un infiltrat inflammatoire au niveau de la paroi artérielle, composé de cellules mononucléées mais sans cellule géante. L’atteinte isolée de l’adventice est de signification incertaine. C’est l’atteinte de la média qui a une forte valeur pour le diagnostic d’ACG. L’hyperplasie intimale est très fréquente au cours de l’ACG, mais n’est pas spécifique, car elle s’observe aussi au cours du vieillissement vasculaire.4
La sensibilité de la BAT varie de 60 à 80 % ; cela dépend beaucoup du phénotype de la maladie. La BAT est en effet plus fréquemment positive en cas d’ACG céphalique que d’ACG extracéphalique. De plus, les études par TEP-scan des vaisseaux céphaliques ont montré que des patients avec ACG peuvent avoir une atteinte des vaisseaux céphaliques (artères vertébrales, maxillaires) sans atteinte de l’artère temporale.12,15 Ainsi, le diagnostic d’ACG peut être retenu même si la BAT est négative.
Une BAT de bonne qualité doit analyser un fragment artériel d’au moins 0,5 à 1 cm. En deçà, la sensibilité de l’examen diminue. Si possible, la BAT doit être réalisée dans les deux semaines suivant l’initiation du traitement car, au-delà, le pourcentage de positivité diminue. Néanmoins, la BAT est l’examen complémentaire qui peut rester positif le plus longtemps, parfois des mois, voire des années, après l’initiation du traitement. Chez un patient traité depuis plusieurs semaines chez qui on cherche à confirmer un diagnostic d’ACG, la BAT reste donc l’examen de choix.16
Le prélèvement se fait sous anesthésie locale, au bloc opératoire.
L’analyse histologique révèle une panartérite granulomateuse, non nécrosante, avec un infiltrat cellulaire inflammatoire composé de cellules mononucléées (lymphocytes T et macrophages), parfois de cellules géantes généralement situées à la jonction intima-média, une fragmentation de la limitante élastique interne, une destruction de la média et une hyperplasie de l’intima, qui induit une sténose de la lumière vasculaire (
La sensibilité de la BAT varie de 60 à 80 % ; cela dépend beaucoup du phénotype de la maladie. La BAT est en effet plus fréquemment positive en cas d’ACG céphalique que d’ACG extracéphalique. De plus, les études par TEP-scan des vaisseaux céphaliques ont montré que des patients avec ACG peuvent avoir une atteinte des vaisseaux céphaliques (artères vertébrales, maxillaires) sans atteinte de l’artère temporale.12,15 Ainsi, le diagnostic d’ACG peut être retenu même si la BAT est négative.
Une BAT de bonne qualité doit analyser un fragment artériel d’au moins 0,5 à 1 cm. En deçà, la sensibilité de l’examen diminue. Si possible, la BAT doit être réalisée dans les deux semaines suivant l’initiation du traitement car, au-delà, le pourcentage de positivité diminue. Néanmoins, la BAT est l’examen complémentaire qui peut rester positif le plus longtemps, parfois des mois, voire des années, après l’initiation du traitement. Chez un patient traité depuis plusieurs semaines chez qui on cherche à confirmer un diagnostic d’ACG, la BAT reste donc l’examen de choix.16
Échographie-Doppler, en première intention
L’échographie-Doppler couleur des artères temporales et des troncs supra-aortiques est, selon l’European Alliance of Associations for Rheumatology (EULAR), l’examen à réaliser en première intention en cas de suspicion d’ACG, car il est le moins invasif et le moins coûteux, avec un taux plus faible de faux négatifs que la BAT.17 Cependant, le signe du halo, que l’on recherche à l’échographie-Doppler couleur des artères temporales et qui est défini par un épaississement circonférentiel homogène et hypoéchogène de la paroi artérielle temporale, visible à la fois dans le plan longitudinal et dans le plan transversal et non compressible, n’a qu’une sensibilité et une spécificité de 68 % et 81 % respectivement,18 et se négative rapidement (après environ cinq jours de corticothérapie) [fig. 3 G ].16 Les faux positifs peuvent être liés à un épaississement hypoéchogène de la paroi artérielle d’une autre nature, comme c’est le cas au cours des vascularites associées aux anti-corps anticytoplasme des polynucléaires neutrophiles (ANCA) ou au cours de la maladie athéromateuse. Le manque de sensibilité et de spécificité de l’échographie-Doppler des artères temporales est également lié à son caractère opérateur-dépendant.
Un tel épaississement pariétal hypoéchogène circonférentiel doit également être recherché au niveau des artères subclavières, axillaires et mandibulaires. Il est significatif lorsqu’il mesure plus de 1 mm (fig. 3 H, I). De la même manière que l’analyse histologique des artères temporales, l’imagerie de ces dernières est plus rentable en cas de phénotype céphalique.
Ainsi, d’après les recommandations de l’EULAR, l’échographie-Doppler des artères temporales suffit à porter le diagnostic d’ACG en cas de forte probabilité clinique. À l’inverse, cet examen peut être utilisé pour exclure le diagnostic d’ACG quand la probabilité est faible, par exemple en cas de signes cliniques non spécifiques et en l’absence de syndrome inflammatoire.17,19
Cependant, la place de l’échographie-Doppler reste un sujet de débat, comme en témoignent les divergences entre les recommandations françaises, européennes et américaines.16,17,20 Cela est surtout lié au caractère opérateur-dépendant de cet examen, qui en fait varier les performances.
Un tel épaississement pariétal hypoéchogène circonférentiel doit également être recherché au niveau des artères subclavières, axillaires et mandibulaires. Il est significatif lorsqu’il mesure plus de 1 mm (
Ainsi, d’après les recommandations de l’EULAR, l’échographie-Doppler des artères temporales suffit à porter le diagnostic d’ACG en cas de forte probabilité clinique. À l’inverse, cet examen peut être utilisé pour exclure le diagnostic d’ACG quand la probabilité est faible, par exemple en cas de signes cliniques non spécifiques et en l’absence de syndrome inflammatoire.17,19
Cependant, la place de l’échographie-Doppler reste un sujet de débat, comme en témoignent les divergences entre les recommandations françaises, européennes et américaines.16,17,20 Cela est surtout lié au caractère opérateur-dépendant de cet examen, qui en fait varier les performances.
Angioscanner pour détecter les complications vasculaires
L’angioscanner est utilisé pour l’étude de l’aorte, des artères des membres et des troncs supra-aortiques. Il recherche un épaississement circonférentiel et homogène de la paroi artérielle qui est en faveur d’une vascularite. Le seuil pour dire qu’un épaississement est pathologique varie selon les territoires : de 2 à 3 mm pour l’aorte, 1 mm pour les autres artères. L’angioscanner est également l’examen de référence pour détecter les complications vasculaires : dissection, anévrisme ou sténose.16
Angio-IRM peu utilisée en pratique courante
L’angio-IRM peut être utilisée pour l’étude des vaisseaux céphaliques ou de l’aorte et de ses branches.
Concernant les gros vaisseaux (aorte et ses branches), elle recherche un épaississement de la paroi vasculaire et/ou un hypersignal T2, ou une prise de gadolinium de la paroi vasculaire qui évoque une vascularite active. L’angio-IRM est peu utilisée en pratique quotidienne du fait de son accès plus restreint et de la durée de l’examen.
Au niveau céphalique, l’angio-IRM 3 Tesla, parfois couplée à des séquences en « sang noir », permet une étude fine des vaisseaux céphaliques, en particulier l’artère temporale.
Certaines études ont rapporté d’excellentes sensibilité et spécificité de cet examen, mais l’analyse des images n’est pas aisée, l’accès à l’examen est restreint, ce d’autant que les anomalies de l’artère temporale s’estompent après une semaine de traitement par corticoïdes.16
Concernant les gros vaisseaux (aorte et ses branches), elle recherche un épaississement de la paroi vasculaire et/ou un hypersignal T2, ou une prise de gadolinium de la paroi vasculaire qui évoque une vascularite active. L’angio-IRM est peu utilisée en pratique quotidienne du fait de son accès plus restreint et de la durée de l’examen.
Au niveau céphalique, l’angio-IRM 3 Tesla, parfois couplée à des séquences en « sang noir », permet une étude fine des vaisseaux céphaliques, en particulier l’artère temporale.
Certaines études ont rapporté d’excellentes sensibilité et spécificité de cet examen, mais l’analyse des images n’est pas aisée, l’accès à l’examen est restreint, ce d’autant que les anomalies de l’artère temporale s’estompent après une semaine de traitement par corticoïdes.16
Tomographie à émission de positons au 18fluorodéoxyglucose
La tomographie à émission de positons (TEP) au 18fluorodéoxyglucose (18FDG) couplée au scanner est très performante pour détecter une inflammation de la paroi vasculaire et confirmer un diagnostic de vascularite (fig. 4 ).
Jusqu’à présent, le TEP-scan au 18FDG était surtout utilisé pour détecter une atteinte de l’aorte et de ses branches, en montrant un hypermétabolisme de la paroi vasculaire, considéré comme significatif s’il est supérieur ou égal à celui du parenchyme hépatique.
Plus récemment, cet examen a montré de très bonnes performances pour détecter une atteinte inflammatoire au niveau des vaisseaux céphaliques : artères temporales, vertébrales, maxillaires et occipitales. TEP céphalique et extracéphalique peuvent même être couplées pour une recherche encore plus sensible de l’ACG.15
En cas de PPR, le TEP-scan met en évidence un hypermétabolisme périarticulaire au niveau des ceintures scapulaire et/ou pelvienne et parfois un hypermétabolisme interépineux au niveau cervical ou lombaire, ce qui peut aider à porter le diagnostic d’ACG.
Outre son coût élevé (de 700 à 900 €), son inconvénient est que sa sensibilité diminue après l’instauration de la corticothérapie et en cas de diabète mal équilibré. À l’inverse, l’hypermétabolisme vasculaire peut persister même après plusieurs mois de traitement chez des patients asymptomatiques, et la raison de ces hypermétabolismes persistants est actuellement mal comprise.
Jusqu’à présent, le TEP-scan au 18FDG était surtout utilisé pour détecter une atteinte de l’aorte et de ses branches, en montrant un hypermétabolisme de la paroi vasculaire, considéré comme significatif s’il est supérieur ou égal à celui du parenchyme hépatique.
Plus récemment, cet examen a montré de très bonnes performances pour détecter une atteinte inflammatoire au niveau des vaisseaux céphaliques : artères temporales, vertébrales, maxillaires et occipitales. TEP céphalique et extracéphalique peuvent même être couplées pour une recherche encore plus sensible de l’ACG.15
En cas de PPR, le TEP-scan met en évidence un hypermétabolisme périarticulaire au niveau des ceintures scapulaire et/ou pelvienne et parfois un hypermétabolisme interépineux au niveau cervical ou lombaire, ce qui peut aider à porter le diagnostic d’ACG.
Outre son coût élevé (de 700 à 900 €), son inconvénient est que sa sensibilité diminue après l’instauration de la corticothérapie et en cas de diabète mal équilibré. À l’inverse, l’hypermétabolisme vasculaire peut persister même après plusieurs mois de traitement chez des patients asymptomatiques, et la raison de ces hypermétabolismes persistants est actuellement mal comprise.
Diagnostics différentiels : attention aux confusions en cas de vascularite isolée des gros vaisseaux
Dans sa forme céphalique, il y a très peu de diagnostics différentiels de l’ACG. Il s’agit surtout des vascularites associées aux ANCA, qui peuvent parfois atteindre les vasa vasorum des artères temporales et des artérites temporales dues à l’infection par le virus varicelle-zona. De plus, l’artère temporale peut être le siège d’autres vasculopathies non inflammatoires, comme la maladie athéromateuse, l’artériopathie urémique calcifiante ou encore les atteintes post-traumatiques comme les faux anévrismes ou les fistules artérioveineuses.
En cas de vascularite isolée des gros vaisseaux, les diagnostics différentiels sont plus nombreux : infections chroniques (tuberculose, Coxiella burnetii), maladie associée aux IgG4, maladie d’Erdheim-Chester et autres pathologies inflammatoires (maladie de Behçet, polychondrite atrophiante ou VEXAS [vacuoles, E1 enzyme, X-linked, autoinflammatory, somatic syndrome]).
Qu’il s’agisse de l’échographie-Doppler des artères temporales ou de l’imagerie des gros vaisseaux, et cela, quelle que soit la technique d’imagerie utilisée, la principale source d’erreur lors de l’utilisation de l’imagerie vasculaire est liée à l’existence de lésions athéromateuses qui sont très fréquentes à l’âge où se révèle l’ACG. En effet, la maladie athéromateuse entraîne l’apparition de plaques d’athérome plus ou moins calcifiées au niveau de la paroi artérielle, se traduisant en échographie par un épaississement de l’épaisseur intima-média qui peut être confondu avec un authentique signe du halo de l’artère temporale, ou au niveau des gros vaisseaux qui peut être confondu avec un épaississement, un hypersignal ou un hypermétabolisme d’origine inflammatoire. Cependant, l’épaississement vasculaire est généralement non circonférentiel, inhomogène et/ou associé à des calcifications sur l’angio-tomodensitométrie, et l’hypermétabolisme vasculaire au TEP-scan est plus modéré et prédomine dans des territoires vasculaires rarement atteints par l’ACG et plus fréquemment par l’athérome, comme la bifurcation iliaque.
En cas de vascularite isolée des gros vaisseaux, les diagnostics différentiels sont plus nombreux : infections chroniques (tuberculose, Coxiella burnetii), maladie associée aux IgG4, maladie d’Erdheim-Chester et autres pathologies inflammatoires (maladie de Behçet, polychondrite atrophiante ou VEXAS [vacuoles, E1 enzyme, X-linked, autoinflammatory, somatic syndrome]).
Qu’il s’agisse de l’échographie-Doppler des artères temporales ou de l’imagerie des gros vaisseaux, et cela, quelle que soit la technique d’imagerie utilisée, la principale source d’erreur lors de l’utilisation de l’imagerie vasculaire est liée à l’existence de lésions athéromateuses qui sont très fréquentes à l’âge où se révèle l’ACG. En effet, la maladie athéromateuse entraîne l’apparition de plaques d’athérome plus ou moins calcifiées au niveau de la paroi artérielle, se traduisant en échographie par un épaississement de l’épaisseur intima-média qui peut être confondu avec un authentique signe du halo de l’artère temporale, ou au niveau des gros vaisseaux qui peut être confondu avec un épaississement, un hypersignal ou un hypermétabolisme d’origine inflammatoire. Cependant, l’épaississement vasculaire est généralement non circonférentiel, inhomogène et/ou associé à des calcifications sur l’angio-tomodensitométrie, et l’hypermétabolisme vasculaire au TEP-scan est plus modéré et prédomine dans des territoires vasculaires rarement atteints par l’ACG et plus fréquemment par l’athérome, comme la bifurcation iliaque.
Des signes cliniques caractéristiques, confirmés par l’imagerie
Le diagnostic d’ACG est donc suspecté face à l’existence de signes cliniques d’ACG ou de PPR chez un patient de 50 ans ou plus. L’atteinte ophtalmologique, qui peut parfois être isolée ou inaugurale, nécessite une prise en charge en urgence afin d’éviter une perte de vision définitive ; elle est plus fréquente au cours de l’ACG céphalique qu’extracéphalique. Le syndrome inflammatoire est presque toujours constant mais peut parfois manquer ou être peu marqué, en particulier en cas de complication ischémique visuelle ou neurologique. Dans tous les cas, une prise en charge diagnostique et thérapeutique rapide, dans l’idéal par une équipe spécialisée dans une structure de type fast track, est essentielle de manière à confirmer rapidement le diagnostic en mettant en évidence des lésions de vascularite et à initier rapidement un traitement pour éviter les complications ischémiques. Le choix des examens dépend surtout du plateau technique disponible et de l’évolution de la performance de ces examens après que la corticothérapie a été débutée.
Références
1. Hunder GG, Bloch DA, Michel BA, Stevens MB, Arend WP, Calabrese LH, et al. The American College of Rheumatology 1990 criteria for the classification of giant cell arteritis. Arthritis Rheum 1990;33:1122-8.
2. Ponte C, Grayson PC, Robson JC, Suppiah R, Gribbons KB, Judge A, et al. 2022 American College of Rheumatology/EULAR classification criteria for giant cell arteritis. Ann Rheum Dis 2022;81:1647-53.
3. Diamantopoulos AP, Haugeberg G, Lindland A, Myklebust G. The fast-track ultrasound clinic for early diagnosis of giant cell arteritis significantly reduces permanent visual impairment: Towards a more effective strategy to improve clinical outcome in giant cell arteritis? Rheumatology (Oxford) 2016;55:66-70.
4. Salvarani C, Cantini F, Hunder GG. Polymyalgia rheumatica and giant-cell arteritis. Lancet 2008;372:234-45.
5. Liozon E, Ly KH, Robert PY. Ocular complications of giant cell arteritis. Rev Med Interne 2013;34:421-30.
6. Samson M, Jacquin A, Audia S, Daubail B, Devilliers H, Petrella T, et al. Stroke associated with giant cell arteritis: A population-based study. J Neurol Neurosurg Psychiatry 2015;86:216-21.
7. Kermani TA, Warrington KJ, Crowson CS, Ytterberg SR, Hunder GG, Gabriel SE, et al. Large-vessel involvement in giant cell arteritis: A population-based cohort study of the incidence-trends and prognosis. Ann Rheum Dis 2013;72:1989-94.
8. Prieto-Gonzalez S, Depetris M, Garcia-Martinez A, Espigol-Frigole G, Tavera-Bahillo I, Corbera-Bellata M, et al. Positron emission tomography assessment of large vessel inflammation in patients with newly diagnosed, biopsy-proven giant cell arteritis: A prospective, case-control study. Ann Rheum Dis 2014;73:1388-92.
9. De Boysson H, Daumas A, Vautier M, Parienti J-J, Liozon E, Lambert M, et al. Large-vessel involvement and aortic dilation in giant-cell arteritis. A multicenter study of 549 patients. Autoimmun Rev 2018;17:391-8.
10. de Boysson H, Liozon E, Espitia O, Daumas A, Vautier M, Lambert M, et al. Different patterns and specific outcomes of large-vessel involvements in giant cell arteritis. J Autoimmun 2019;103:102283.
11. Moreel L, Betrains A, Molenberghs G, Vanderschueren S, Blockmans D. Epidemiology and predictors of relapse in giant cell arteritis: A systematic review and meta-analysis. Joint Bone Spine 2022;90:105494.
12. Dejaco C, Duftner C, Buttgereit F, Matteson EL, Dasgupta B. The spectrum of giant cell arteritis and polymyalgia rheumatica: Revisiting the concept of the disease. Rheumatology (Oxford) 2017;56:506-15.
13. Gonzalez-Gay MA, Lopez-Diaz MJ, Barros S, Garcia-Porrua C, Sanchez-Andrade A, Paz-Carreira J, et al. Giant cell arteritis: Laboratory tests at the time of diagnosis in a series of 240 patients. Medicine (Baltimore) 2005;84:277-90.
14. Salvarani C, Hunder GG. Giant cell arteritis with low erythrocyte sedimentation rate: Frequency of occurence in a population-based study. Arthritis Rheum 2001;45:140-5.
15. Thibault T, Durand-Bailloud B, Soudry-Faure A, Greigert H, Drouet C, Devilliers H, et al. PET/CT of cranial arteries for a sensitive diagnosis of giant cell arteritis. Rheumatology (Oxford) 2023;62(4):1568-1575.
16. Protocole national de diagnostic et de soins (PNDS). Artérite à cellules géantes (Horton). 2020. https://vu.fr/SOBs
17. Dejaco C, Ramiro S, Duftner C, Besson FL, Bley TA, Blockmans D, et al. EULAR recommendations for the use of imaging in large vessel vasculitis in clinical practice. Ann Rheum Dis 2018;77:636-43.
18. Rinagel M, Chatelus E, Jousse-Joulin S, Sibilia J, Gottenberg JE, Chasset F, et al. Diagnostic performance of temporal artery ultrasound for the diagnosis of giant cell arteritis: A systematic review and meta-analysis of the literature. Autoimmun Rev 2019;18:56-61.
19. Luqmani R. Large vessel vasculitides: Update for the cardiologist. Curr Opin Cardiol 2012;27:578-84.
20. Maz M, Chung SA, Abril A, Langford CA, Gorelik M, Guyatt G, et al. 2021 American College of Rheumatology/Vasculitis Foundation Guideline for the Management of Giant Cell Arteritis and Takayasu Arteritis. Arthritis Rheumatol 2021;73:1349-65.
2. Ponte C, Grayson PC, Robson JC, Suppiah R, Gribbons KB, Judge A, et al. 2022 American College of Rheumatology/EULAR classification criteria for giant cell arteritis. Ann Rheum Dis 2022;81:1647-53.
3. Diamantopoulos AP, Haugeberg G, Lindland A, Myklebust G. The fast-track ultrasound clinic for early diagnosis of giant cell arteritis significantly reduces permanent visual impairment: Towards a more effective strategy to improve clinical outcome in giant cell arteritis? Rheumatology (Oxford) 2016;55:66-70.
4. Salvarani C, Cantini F, Hunder GG. Polymyalgia rheumatica and giant-cell arteritis. Lancet 2008;372:234-45.
5. Liozon E, Ly KH, Robert PY. Ocular complications of giant cell arteritis. Rev Med Interne 2013;34:421-30.
6. Samson M, Jacquin A, Audia S, Daubail B, Devilliers H, Petrella T, et al. Stroke associated with giant cell arteritis: A population-based study. J Neurol Neurosurg Psychiatry 2015;86:216-21.
7. Kermani TA, Warrington KJ, Crowson CS, Ytterberg SR, Hunder GG, Gabriel SE, et al. Large-vessel involvement in giant cell arteritis: A population-based cohort study of the incidence-trends and prognosis. Ann Rheum Dis 2013;72:1989-94.
8. Prieto-Gonzalez S, Depetris M, Garcia-Martinez A, Espigol-Frigole G, Tavera-Bahillo I, Corbera-Bellata M, et al. Positron emission tomography assessment of large vessel inflammation in patients with newly diagnosed, biopsy-proven giant cell arteritis: A prospective, case-control study. Ann Rheum Dis 2014;73:1388-92.
9. De Boysson H, Daumas A, Vautier M, Parienti J-J, Liozon E, Lambert M, et al. Large-vessel involvement and aortic dilation in giant-cell arteritis. A multicenter study of 549 patients. Autoimmun Rev 2018;17:391-8.
10. de Boysson H, Liozon E, Espitia O, Daumas A, Vautier M, Lambert M, et al. Different patterns and specific outcomes of large-vessel involvements in giant cell arteritis. J Autoimmun 2019;103:102283.
11. Moreel L, Betrains A, Molenberghs G, Vanderschueren S, Blockmans D. Epidemiology and predictors of relapse in giant cell arteritis: A systematic review and meta-analysis. Joint Bone Spine 2022;90:105494.
12. Dejaco C, Duftner C, Buttgereit F, Matteson EL, Dasgupta B. The spectrum of giant cell arteritis and polymyalgia rheumatica: Revisiting the concept of the disease. Rheumatology (Oxford) 2017;56:506-15.
13. Gonzalez-Gay MA, Lopez-Diaz MJ, Barros S, Garcia-Porrua C, Sanchez-Andrade A, Paz-Carreira J, et al. Giant cell arteritis: Laboratory tests at the time of diagnosis in a series of 240 patients. Medicine (Baltimore) 2005;84:277-90.
14. Salvarani C, Hunder GG. Giant cell arteritis with low erythrocyte sedimentation rate: Frequency of occurence in a population-based study. Arthritis Rheum 2001;45:140-5.
15. Thibault T, Durand-Bailloud B, Soudry-Faure A, Greigert H, Drouet C, Devilliers H, et al. PET/CT of cranial arteries for a sensitive diagnosis of giant cell arteritis. Rheumatology (Oxford) 2023;62(4):1568-1575.
16. Protocole national de diagnostic et de soins (PNDS). Artérite à cellules géantes (Horton). 2020. https://vu.fr/SOBs
17. Dejaco C, Ramiro S, Duftner C, Besson FL, Bley TA, Blockmans D, et al. EULAR recommendations for the use of imaging in large vessel vasculitis in clinical practice. Ann Rheum Dis 2018;77:636-43.
18. Rinagel M, Chatelus E, Jousse-Joulin S, Sibilia J, Gottenberg JE, Chasset F, et al. Diagnostic performance of temporal artery ultrasound for the diagnosis of giant cell arteritis: A systematic review and meta-analysis of the literature. Autoimmun Rev 2019;18:56-61.
19. Luqmani R. Large vessel vasculitides: Update for the cardiologist. Curr Opin Cardiol 2012;27:578-84.
20. Maz M, Chung SA, Abril A, Langford CA, Gorelik M, Guyatt G, et al. 2021 American College of Rheumatology/Vasculitis Foundation Guideline for the Management of Giant Cell Arteritis and Takayasu Arteritis. Arthritis Rheumatol 2021;73:1349-65.