Les infections cutanées graves sont principalement représentées par les infections nécrosantes des tissus mous ou dermohypodermites bactériennes nécrosantes-fasciites nécrosantes (DHBN-FN). Bien que rares, elles sont associées à une mortalité élevée et à de lourdes séquelles à long terme. La principale difficulté réside dans l’établissement précoce du diagnostic.
La confusion nosologique n’enlève rien à l’urgence de la prise en charge
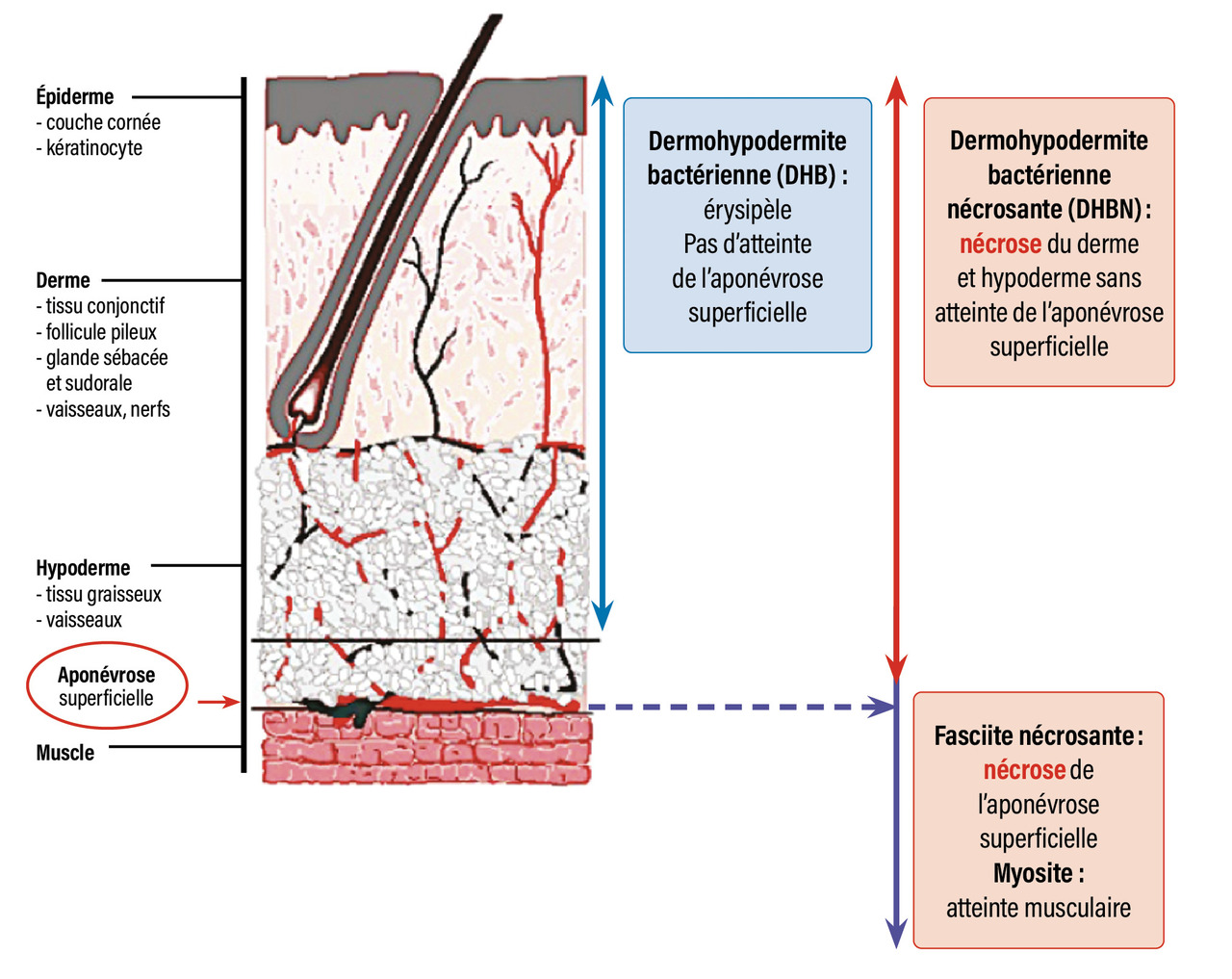
Les DHBN-FN sont des infections bactériennes nécrosantes, rapidement progressives, du derme et de l’hypoderme, pouvant atteindre l’aponévrose et le muscle (fig. 1 ).1
Il existe une certaine confusion nosologique, et de nombreux termes ont été utilisés pour désigner ces infections nécrosantes en fonction de la topographie (par exemple gangrène de Fournier), de la microbiologie (par exemple gangrène synergique, gangrène hémolytique streptococcique, cellulite à Clostridium) et de la profondeur de l’infection (cellulite nécrosante, fasciite nécrosante, myosite nécrosante).2 Au-delà de ces classifications, ces infections cutanées nécrosantes partagent la même prise en charge thérapeutique, qui est une urgence médico-chirurgicale.2
Il existe une certaine confusion nosologique, et de nombreux termes ont été utilisés pour désigner ces infections nécrosantes en fonction de la topographie (par exemple gangrène de Fournier), de la microbiologie (par exemple gangrène synergique, gangrène hémolytique streptococcique, cellulite à Clostridium) et de la profondeur de l’infection (cellulite nécrosante, fasciite nécrosante, myosite nécrosante).2 Au-delà de ces classifications, ces infections cutanées nécrosantes partagent la même prise en charge thérapeutique, qui est une urgence médico-chirurgicale.2
Infections rares dont l’incidence augmente
Ce sont des infections rares, dont l’incidence varie selon les pays entre 0,2 à 6,9 cas pour 100 000 habitants par an ; 2 à 3,4 cas estimés pour 100 000 habitants en France.3 Une augmentation de l’incidence des DHBN-FN a été rapportée ces dix dernières années dans la littérature.4,5 L’incidence des DHBN-FN streptococciques est plus importante dans les pays en développement4 et pendant les saisons où les taux d’infections oropharyngées à streptocoque du groupe A sont les plus élevés (hiver et printemps dans l’hémisphère Nord).5
Une revue de la littérature réalisée entre 1980 et 2008 incluant 67 études avec 3 302 patients estime la mortalité moyenne hospitalière à 23,5 % (intervalle de confiance à 95 % [IC 95 %] : 22,1-24,9). L’amputation est retrouvée dans les suites chez 15 % des patients et une altération fonctionnelle modérée à sévère touche 30 % de ceux atteints de fasciite nécrosante.6
Les infections de la peau et des tissus mous, très fréquentes dans la population générale,7 ne représentent néanmoins que 2 % des infections amenant les patients en réanimation.8 Les deux tiers de ces formes graves sont des infections nécrosantes, imposant une prise en charge chirurgicale urgente ; les autres infections graves – non nécrosantes – le sont soit par l’association à un choc toxinique (infection streptococcique ou plus rarement staphylococcique), soit par leur localisation (notamment cervicofaciale) engageant le pronostic fonctionnel, soit par leur retentissement systémique sur des terrains fragiles.
Une revue de la littérature réalisée entre 1980 et 2008 incluant 67 études avec 3 302 patients estime la mortalité moyenne hospitalière à 23,5 % (intervalle de confiance à 95 % [IC 95 %] : 22,1-24,9). L’amputation est retrouvée dans les suites chez 15 % des patients et une altération fonctionnelle modérée à sévère touche 30 % de ceux atteints de fasciite nécrosante.6
Les infections de la peau et des tissus mous, très fréquentes dans la population générale,7 ne représentent néanmoins que 2 % des infections amenant les patients en réanimation.8 Les deux tiers de ces formes graves sont des infections nécrosantes, imposant une prise en charge chirurgicale urgente ; les autres infections graves – non nécrosantes – le sont soit par l’association à un choc toxinique (infection streptococcique ou plus rarement staphylococcique), soit par leur localisation (notamment cervicofaciale) engageant le pronostic fonctionnel, soit par leur retentissement systémique sur des terrains fragiles.
Circonstances de survenue : identification d’une porte d’entrée
L’origine provient, le plus souvent, d’une effraction du revêtement cutané ou muqueux (de 60 à 80 % des cas), qui peut être évidente ou méconnue du patient. Il peut s’agir d’un traumatisme cutané ouvert ou fermé, de plaies chroniques (ulcère, escarre), de lésions cutanées préexistantes (gale, notamment en zone tropicale, eczéma, varicelle, piqûre de serpent, piqûre d’insectes), d’injections sous-cutanées ou intraveineuses (toxicomanie ou autres),9 de plaies postopératoires.2 Plusieurs études ont démontré qu’un traumatisme fermé minime sans trace visible d’effraction cutanée précédait dans 50 % des cas les DHBN-FN streptococciques (responsable d’une surexpression de la vimentine au niveau musculaire, récepteur du streptocoque A bêtahémolytique) facilitant ainsi l’initiation d’une infection à streptocoque du groupe A dans les tissus profonds à la suite d’une possible bactériémie transitoire de l’oropharynx.10,11 Les plaies postopératoires (24 %), les traumatismes ou morsures animales (22 %) et la varicelle (18 %) sont, chez l’enfant, les trois principales portes d’entrée des DHBN-FN.12
Plusieurs facteurs de risque connus
Les principaux facteurs de risque connus chez l’adulte sont un âge supérieur à 60 ans, le sexe masculin, l’obésité, le diabète, la consommation d’alcool, l’insuffisance rénale, les hépatopathies, l’immunosuppression (dont les néoplasies et la corticothérapie par voie générale) [tableau 1 ].13,14 Une DHBN-FN peut néanmoins survenir même en l’absence de facteur de risque.
Rôle favorisant des AINS dans les DHBN-FN
Plusieurs études ont rapporté une association entre la prise d’anti-inflammatoires non stéroïdiens (AINS) et les DHBN-FN, en particulier streptococciques.15,16 Une étude cas-témoin a identifié une forte association entre l’utilisation d’AINS et les DHBN-FN chez les enfants atteints de varicelle.17 La prise d’AINS par voie générale pourrait masquer les signes de gravité d’une forme nécrosante, retardant ainsi le diagnostic et aggravant alors le pronostic.18
En avril 2019, l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) a publié une mise en garde sur l’utilisation des AINS chez les patients atteints de maladies infectieuses, dont les DHBN-FN19, tout comme au Royaume-Uni, où le National Institute for Health and Care Excellence (NICE) a publié des conseils mettant en garde contre l’utilisation des AINS chez les enfants atteints de varicelle.
En avril 2019, l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) a publié une mise en garde sur l’utilisation des AINS chez les patients atteints de maladies infectieuses, dont les DHBN-FN19, tout comme au Royaume-Uni, où le National Institute for Health and Care Excellence (NICE) a publié des conseils mettant en garde contre l’utilisation des AINS chez les enfants atteints de varicelle.
Une mortalité qui reste élevée
La mortalité des DHBN-FN reste élevée au cours du temps, variant de 25 à 50 % selon les études (inclusion de patients de réanimation).
Une méta-analyse récente a mis en évidence que la mortalité a diminué si l’on compare avant et après l’année 2000 (28,8 % contre 20,6 %), mais qu’elle reste stable au cours des vingt dernières années.20
Plusieurs facteurs de risque de mortalité ont été rapportés, notamment ceux liés à l’hôte (âge avancé, comorbidités, immunosuppression) ou reflétant la présentation clinique et la sévérité de la maladie (DHBN-FN multifocale, choc, nombre de défaillances d’organes), des variables biologiques, la documentation microbiologique (Aeromonas spp, Vibrio spp, Clostridia spp, choc toxique streptococcique) et certaines interventions thérapeutiques (transfert, délai de prise en charge chirurgicale).2,14,21
Le principal facteur pronostique modifiable est la précocité du débridement chirurgical.22
Une méta-analyse récente a mis en évidence que la mortalité a diminué si l’on compare avant et après l’année 2000 (28,8 % contre 20,6 %), mais qu’elle reste stable au cours des vingt dernières années.20
Plusieurs facteurs de risque de mortalité ont été rapportés, notamment ceux liés à l’hôte (âge avancé, comorbidités, immunosuppression) ou reflétant la présentation clinique et la sévérité de la maladie (DHBN-FN multifocale, choc, nombre de défaillances d’organes), des variables biologiques, la documentation microbiologique (Aeromonas spp, Vibrio spp, Clostridia spp, choc toxique streptococcique) et certaines interventions thérapeutiques (transfert, délai de prise en charge chirurgicale).2,14,21
Le principal facteur pronostique modifiable est la précocité du débridement chirurgical.22
Présentations cliniques diverses
Les DHBN-FN intéressent les membres, généralement inférieurs, dans 70 % des cas environ. Des formes variables ont été décrites avec des présentations cliniques très diverses en fonction de la topographie (atteinte des membres, de la région cervico-faciale ou périnéale), de la documentation bactériologique (Vibrio spp, Clostridium spp), du terrain (enfant, patient immunodéprimé, neutropénique…) et du mode d’installation (aigu, subaigu), mais la démarche diagnostique initiale est commune et a pour but de poser ou non une indication chirurgicale en urgence. Les tableaux de « gangrène » (crépitation sous-cutanée et forme fulminante de DHBN-FN) sont volontiers associés à des germes anaérobies du genre Clostridium.
La principale difficulté réside dans le fait d’établir un diagnostic précoce, avec une distinction rapide du caractère nécrosant de la dermohypodermite bactérienne. La précocité du diagnostic et de la prise en charge chirurgicale sont des facteurs pronostiques majeurs.
La principale difficulté réside dans le fait d’établir un diagnostic précoce, avec une distinction rapide du caractère nécrosant de la dermohypodermite bactérienne. La précocité du diagnostic et de la prise en charge chirurgicale sont des facteurs pronostiques majeurs.
Signes locaux de gravité inconstants
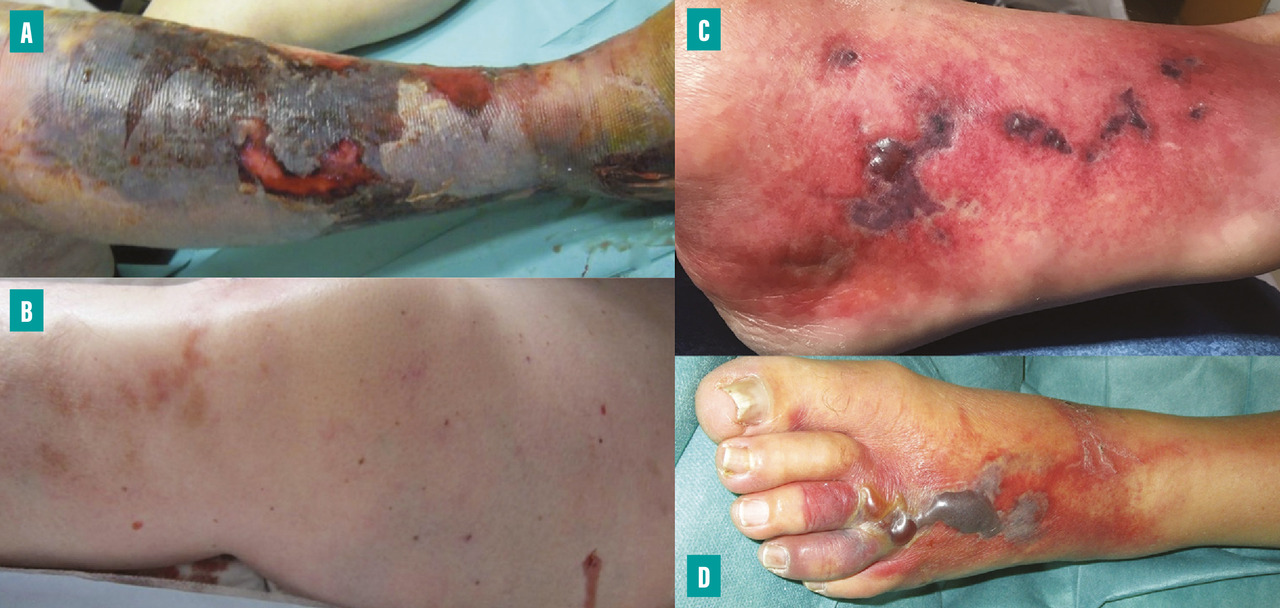
Les signes locaux de gravité évocateurs d’une DHBN-FN sont : une douleur intense disproportionnée par rapport aux signes locaux, un œdème induré diffus et mal limité dépassant les contours de l’érythème, des zones livédoïdes cyaniques mal limitées en carte de géographie, des lésions nécrotiques, des bulles hémorragiques, une hypoesthésie et une crépitation à la palpation (fig. 2 ).
Les signes locaux de gravité tels que les zones cutanées cyaniques ou livédoïdes, voire nécrotiques, les bulles hémorragiques et la crépitation sous-cutanée sont inconstants au stade précoce, comme en témoigne une étude récente où ils n’étaient retrouvés que dans 20 à 25 % des cas à l’admission.24,25 Leur absence ne doit en aucun cas faire écarter le diagnostic.
Les signes locaux de gravité tels que les zones cutanées cyaniques ou livédoïdes, voire nécrotiques, les bulles hémorragiques et la crépitation sous-cutanée sont inconstants au stade précoce, comme en témoigne une étude récente où ils n’étaient retrouvés que dans 20 à 25 % des cas à l’admission.24,25 Leur absence ne doit en aucun cas faire écarter le diagnostic.
Retentissement systémique dans la moitié des cas
La présence de signes de sepsis, comme une hypotension artérielle, une tachycardie, une polypnée, une oligoanurie, une confusion qui attestent d’une défaillance viscérale peuvent s’y associer et constituent des signes de gravité.23 Environ la moitié des patients présentent des signes de retentissement systémique (sepsis ou choc septique) [tableau 2 ].
Lorsque les signes locaux ne sont pas discriminants pour retenir le diagnostic de DHBN-FN, la présence d’un ou plusieurs signes généraux de sepsis constitue un argument majeur pour proposer une exploration chirurgicale. La problématique du clinicien repose sur le fait qu’il est parfois difficile, au stade précoce, de reconnaître une DHBN-FN du fait de l’absence de signes spécifiques.24,25 Les formes aiguës cataclysmiques avec d’emblée des signes de sepsis et des signes locaux de gravité sont de diagnostic facile mais ne concernent qu’un tiers des patients (fig. 2 ).
Il existe des formes subaiguës atypiques avec des signes généraux discrets ou absents et des signes locaux au premier plan peu spécifiques, « grosse jambe rouge aiguë fébrile », qui rendent la distinction entre une DHBN-FN et une dermohypodermite bactérienne non nécrosante (DHBNN) difficile (tableau 2 ).26 Ces formes nécrosantes atypiques, plus fréquentes chez le sujet âgé et diabétique, peuvent être présentes d’emblée ou apparaître au cours de l’évolution d’une DHBNN considérée comme « médicale ».26
Il faut donc insister sur la nécessité d’une surveillance médico-chirurgicale rapprochée de toute DHBNN sous antibiothérapie. Une délimitation au dermomarqueur est indispensable pour évaluer de façon objective la progression de lésions. Leur extension rapide, malgré une antibiothérapie probabiliste adaptée à la topographie, est un critère supplémentaire évocateur de DHBN-FN.
Lorsque les signes locaux ne sont pas discriminants pour retenir le diagnostic de DHBN-FN, la présence d’un ou plusieurs signes généraux de sepsis constitue un argument majeur pour proposer une exploration chirurgicale. La problématique du clinicien repose sur le fait qu’il est parfois difficile, au stade précoce, de reconnaître une DHBN-FN du fait de l’absence de signes spécifiques.24,25 Les formes aiguës cataclysmiques avec d’emblée des signes de sepsis et des signes locaux de gravité sont de diagnostic facile mais ne concernent qu’un tiers des patients (
Il existe des formes subaiguës atypiques avec des signes généraux discrets ou absents et des signes locaux au premier plan peu spécifiques, « grosse jambe rouge aiguë fébrile », qui rendent la distinction entre une DHBN-FN et une dermohypodermite bactérienne non nécrosante (DHBNN) difficile (
Il faut donc insister sur la nécessité d’une surveillance médico-chirurgicale rapprochée de toute DHBNN sous antibiothérapie. Une délimitation au dermomarqueur est indispensable pour évaluer de façon objective la progression de lésions. Leur extension rapide, malgré une antibiothérapie probabiliste adaptée à la topographie, est un critère supplémentaire évocateur de DHBN-FN.
Outils d’aide au diagnostic
Incision chirurgicale limitée au lit du patient
Une incision au bistouri (« bedside incision »), après anesthésie locale, sur une zone suspecte, en cas de doute sur l’indication chirurgicale, peut aider à la décision.23 Elle consiste en une mini-exploration chirurgicale au lit du patient avec une incision de 2 cm jusqu’au fascia pour un examen macroscopique des tissus. La présence de tissus nécrotiques atones, de liquide purulent et d’un décollement aisé des fascias justifie le débridement chirurgical extensif au bloc opératoire.
Peu de place pour l’imagerie…
L’imagerie ne doit pas retarder l’exploration chirurgicale urgente, en particulier pour les patients en état de choc, car elle n’a pas montré une sensibilité satisfaisante pour distinguer les DHBN-FN des dermohypodermites bactériennes non nécrosantes (DHBNN).
L’imagerie par résonance magnétique (IRM) peut être utile pour les DHBN-FN des membres ayant une présentation clinique douteuse et, bien sûr, en l’absence de signes cliniques de gravité généraux (sepsis, choc septique) et/ou locaux (nécrose). Des anomalies de signal ou un épaississement du fascia musculaire en utilisant des séquences en « suppression de graisse », ainsi que l’absence de rehaussement du fascia après injection de produit de contraste semblent suggérer une probabilité élevée de DHBN-FN.27,28
L’imagerie par tomodensitométrie, hormis la mise en évidence de bulles d’air dans 10 % des cas environ, n’a pas sa place dans le diagnostic positif de DHBN-FN des membres. En revanche, elle est indispensable pour rechercher la porte d’entrée d’une DHBN-FN abdominopérinéale (ou gangrène de Fournier) ou rechercher une extension médiastinale antérieure dans une DHBN-FN cervico-faciale.
L’imagerie par résonance magnétique (IRM) peut être utile pour les DHBN-FN des membres ayant une présentation clinique douteuse et, bien sûr, en l’absence de signes cliniques de gravité généraux (sepsis, choc septique) et/ou locaux (nécrose). Des anomalies de signal ou un épaississement du fascia musculaire en utilisant des séquences en « suppression de graisse », ainsi que l’absence de rehaussement du fascia après injection de produit de contraste semblent suggérer une probabilité élevée de DHBN-FN.27,28
L’imagerie par tomodensitométrie, hormis la mise en évidence de bulles d’air dans 10 % des cas environ, n’a pas sa place dans le diagnostic positif de DHBN-FN des membres. En revanche, elle est indispensable pour rechercher la porte d’entrée d’une DHBN-FN abdominopérinéale (ou gangrène de Fournier) ou rechercher une extension médiastinale antérieure dans une DHBN-FN cervico-faciale.
... comme pour les marqueurs biologiques
Il n’existe pas d’examen paraclinique permettant de retenir ou d’éliminer avec certitude le diagnostic de DHBN-FN. Ces examens ne doivent jamais se substituer à l’exploration chirurgicale en cas de forte suspicion clinique.
Un score biologique composite, le LRINEC (laboratory risk indicator for necrotizing fasciitis), fondé sur une étude rétrospective comportant six variables biologiques de routine (protéine C-réactive [CRP], leucocytémie, natrémie, hémoglobine, créatininémie, glycémie), a été proposé comme aide pour distinguer les infections cutanées nécrosantes (DHBN-FN) et non nécrosantes (DHBNN). Néanmoins, la littérature est discordante quant à ses performances diagnostiques, et il semble clair qu’un score bas ne doit certainement pas faire surseoir à une exploration chirurgicale en cas de suspicion clinique élevée de DHBN-FN.29
L’élévation de la créatine kinase et du lactate artériel a été associé au diagnostic de DHBN-FN dans des cohortes à effectif limité.30,31 Cependant, aucun biomarqueur de DHBN-FN n’a de performance diagnostique lui permettant d’être intégré dans un algorithme de prise en charge.
Un score biologique composite, le LRINEC (laboratory risk indicator for necrotizing fasciitis), fondé sur une étude rétrospective comportant six variables biologiques de routine (protéine C-réactive [CRP], leucocytémie, natrémie, hémoglobine, créatininémie, glycémie), a été proposé comme aide pour distinguer les infections cutanées nécrosantes (DHBN-FN) et non nécrosantes (DHBNN). Néanmoins, la littérature est discordante quant à ses performances diagnostiques, et il semble clair qu’un score bas ne doit certainement pas faire surseoir à une exploration chirurgicale en cas de suspicion clinique élevée de DHBN-FN.29
L’élévation de la créatine kinase et du lactate artériel a été associé au diagnostic de DHBN-FN dans des cohortes à effectif limité.30,31 Cependant, aucun biomarqueur de DHBN-FN n’a de performance diagnostique lui permettant d’être intégré dans un algorithme de prise en charge.
Confirmation diagnostique peropératoire
L’exploration chirurgicale du site infecté permet de confirmer le diagnostic, qui repose sur des éléments macroscopiques que sont la présence de tissus atones, voire nécrotiques, une atteinte du fascia qui est d’apparence terne grisâtre au lieu d’être brillant et résistant, une absence de saignement, des thrombus intravasculaires, la présence d’un exsudat caractéristique en « eau de vaisselle », nauséabond, et un « finger test positif » qui consiste en l’absence de résistance à la dissection digitale de tissus adhérents comme la graisse au fasci.2,23
Une gravité qui impose un diagnostic précoce
Le plus souvent liées à une effraction du revêtement cutané ou muqueux, les DHBN-FN sont rares mais responsables d’une mortalité élevée et de lourdes séquelles. Des signes locaux variables et un retentissement général initialement absent dans la moitié des cas rendent leur diagnostic difficile alors que la prise en charge est une urgence.
Références
1. Conférence de consensus. Érysipèle et fasciite nécrosante : prise en charge. Société française de dermatologie et Société française de pathologie infectieuse de langue française. 6 janvier 2000.
2. Hua C, Urbina T, Bosc R, Parks T, Sriskandan S, de Prost N, et al. Necrotising soft-tissue infections. Lancet Infect Dis 2022;S1473-3099(22)00583-7.
3. Audureau E, Hua C, de Prost N, Hemery F, Decousser JW, Bosc R, et al. Mortality of necrotizing fasciitis: Relative influence of individual and hospital-level factors, a nationwide multilevel study, France, 2007-12. Br J Dermatol 2017;177(6):1575‑82.
4. Steer AC, Jenney A, Kado J, Good MF, Batzloff M, Waqatakirewa L, et al. Prospective surveillance of invasive group a streptococcal disease, Fiji, 2005-2007. Emerging Infectious Diseases 2009;15(2):216‑22.
5. Lamagni TL, Darenberg J, Luca-Harari B, Siljander T, Efstratiou A, Henriques-Normark B, et al. Epidemiology of severe Streptococcus pyogenes disease in Europe. J Clin Microbiol [Internet]. juillet 2008 [cité 17 mai 2014];46(7):2359‑67. Disponible sur http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2446932/
6. Pham TN, Moore ML, Costa BA, Cuschieri J, Klein MB. Assessment of functional limitation after necrotizing soft tissue infection. J Burn Care Res 2009;30(2):301‑6.
7. Miller LG, Eisenberg DF, Liu H, Chang CL, Wang Y, Luthra R, et al. Incidence of skin and soft tissue infections in ambulatory and inpatient settings, 2005-2010. BMC Infect Dis 2015;15:362.
8. Cranendonk DR, van Vught LA, Wiewel MA, Cremer OL, Horn J, Bonten MJ, et al. Clinical characteristics and outcomes of patients with cellulitis requiring intensice care. JAMA Dermatol 2017;153(6):578‑82.
9. Grodner C, Bernigaud C, Lapadula S, Beringuer H, Billiet PA, Woerther PL, et al. Health products e-sale should be regulated: A case of necrotizing soft-tissue infection of the abdomen linked to self-injection of slimming products purchased on the internet. Int J Dermatol 2022;61(2):e52‑4.
10. Charpentier C, Kouby F, Hua C, Sbidian E, Darty M, Bosc R, et al. Group B streptococcal necrotizing soft-tissue infection: Role of pharyngeal and perineal carriage. J Eur Acad Dermatol Venereol 2020.
11. Bryant AE, Bayer CR, Huntington JD, Stevens DL. Group A streptococcal myonecrosis: Increased vimentin expression after skeletal-muscle injury mediates the binding of Streptococcus pyogenes. J Infect Dis 2006;193(12):1685‑92.
12. Dauger S, Blondé R, Brissaud O, Marcoux MO, Angoulvant F, Levy M, et al. Necrotizing soft-tissue infections in pediatric intensive care: A prospective multicenter case-series study. Crit Care 2021;25(1):139.
13. Bruun T, Kittang BR, de Hoog BJ, Aardal S, Flaatten HK, Langeland N, et al. Necrotizing soft tissue infections caused by Streptococcus pyogenes and Streptococcus dysgalactiae subsp. equisimilis of groups C and G in western Norway. Clinical Microbiology and Infection [internet] 2013 [cité le 5 juin 2015];19(12):E545‑50. Disponible sur http://www.sciencedirect.com/science/article/pii/S1198743X14630949
14. Madsen MB, Skrede S, Perner A, Arnell P, Nekludov M, Bruun T, et al. Patient’s characteristics and outcomes in necrotising soft-tissue infections: Results from a Scandinavian, multicentre, prospective cohort study. Intensive Care Med 2019;45(9):1241‑51.
15. Nuwayhid ZB, Aronoff DM, Mulla ZD. Blunt trauma as a risk factor for group A streptococcal necrotizing fasciitis. Ann Epidemiol 2007;17(11):878‑81.
16. Hamilton SM, Bayer CR, Stevens DL, Lieber RL, Bryant AE. Muscle injury, vimentin expression, and nonsteroidal anti-inflammatory drugs predispose to cryptic group A streptococcal necrotizing infection. J Infect Dis 2008;198(11):1692‑8.
17. Souyri C, Olivier P, Grolleau S, Lapeyre-Mestre M, French Network of Pharmacovigilance Centres. Severe necrotizing soft-tissue infections and nonsteroidal anti-inflammatory drugs. Clin Exp Dermatol 2008;33(3):249‑55.
18. Weng TC, Chen CC, Toh HS, Tang HJ. Ibuprofen worsens Streptococcus pyogenes soft tissue infections in mice. J Microbiol Immunol Infect 2011;44(6):418‑23.
19. Anti-inflammatoires non stéroïdiens (AINS) et complications infectieuses graves - Point d’Information actualisé le 20/05/2020 - Agence nationale de sécurité du médicament et des produits de santé [internet]. [cité le 27 oct 2020]. Disponible sur https://www.ansm.sante.fr/S-informer/Points-d-information-Points-d-information/Anti-inflammatoires-non-steroidiens-AINS-et-complications-infectieuses-graves-Point-d-Information-actualise-le-20-05-2020
20. Nawijn F, Houwert RM, van Wessem KPJ, Simmermacher RKJ, Govaert GAM, van Dijk MR, et al. A 5-Year evaluation of the implementation of triple diagnostics for early detection of severe necrotizing soft tissue disease: A single-center cohort study. World J Surg. 2019;43(8):1898‑905.
21. Hua C, Sbidian E, Hemery F, Decousser JW, Bosc R, Amathieu R, et al. Prognostic factors in necrotizing soft-tissue infections (NSTI): A cohort study. J Am Acad Dermatol 2015;73(6):1006-12.e8.
22. Nawijn F, Smeeing DPJ, Houwert RM, Leenen LPH, Hietbrink F. Time is of the essence when treating necrotizing soft tissue infections: A systematic review and meta-analysis. World J Emerg Surg 2020;15:4.
23. Stevens DL, Bisno AL, Chambers HF, Everett ED, Dellinger P, Goldstein EJC, et al. Practice guidelines for the diagnosis and management of skin and soft-tissue infections. Clin Infect Dis 2005;41(10):1373‑406.
24. May AK, Stafford RE, Bulger EM, Heffernan D, Guillamondegui O, Bochicchio G, et al. Treatment of complicated skin and soft tissue infections. Surg Infect (Larchmt) 2009;10(5):467‑99.
25. Goh T, Goh LG, Ang CH, Wong CH. Early Diagnosis of necrotizing fasciitis. Br J Surg 2014;101(1):e119-125.
26. Chosidow O. Subacute forms of necrotizing fasciitis and necrotizing cellulitis: Diagnosis criteria and surgical decision-making. Ann Dermatol Venereol 2001;128(3 Pt 2):390‑3.
27. Rahmouni A, Chosidow O, Mathieu D, Gueorguieva E, Jazaerli N, Radier C, et al. MR imaging in acute infectious cellulitis. Radiology 1994;192(2):493‑6.
28. Rahmouni A, Chosidow O. Differentiation of necrotizing infectious fasciitis from nonnecrotizing infectious fasciitis with MR imaging. Radiology 2012;262(2):732‑3; author reply 733.
29. Wong CH, Khin LW, Heng KS, Tan KC, Low CO. The LRINEC (Laboratory Risk Indicator for Necrotizing Fasciitis) score: A tool for distinguishing necrotizing fasciitis from other soft tissue infections. Crit Care Med 2004;32(7):1535‑41.
30. Simonart T, Nakafusa J, Narisawa Y. The importance of serum creatine phosphokinase level in the early diagnosis and microbiological evaluation of necrotizing fasciitis. J Eur Acad Dermatol Venereol 2004;18(6):687‑90.
31. Yaghoubian A, de Virgilio C, Dauphine C, Lewis RJ, Lin M. Use of admission serum lactate and sodium levels to predict mortality in necrotizing soft-tissue infections. Arch Surg. sept 2007;142(9):840‑6; discussion 844-846.
2. Hua C, Urbina T, Bosc R, Parks T, Sriskandan S, de Prost N, et al. Necrotising soft-tissue infections. Lancet Infect Dis 2022;S1473-3099(22)00583-7.
3. Audureau E, Hua C, de Prost N, Hemery F, Decousser JW, Bosc R, et al. Mortality of necrotizing fasciitis: Relative influence of individual and hospital-level factors, a nationwide multilevel study, France, 2007-12. Br J Dermatol 2017;177(6):1575‑82.
4. Steer AC, Jenney A, Kado J, Good MF, Batzloff M, Waqatakirewa L, et al. Prospective surveillance of invasive group a streptococcal disease, Fiji, 2005-2007. Emerging Infectious Diseases 2009;15(2):216‑22.
5. Lamagni TL, Darenberg J, Luca-Harari B, Siljander T, Efstratiou A, Henriques-Normark B, et al. Epidemiology of severe Streptococcus pyogenes disease in Europe. J Clin Microbiol [Internet]. juillet 2008 [cité 17 mai 2014];46(7):2359‑67. Disponible sur http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2446932/
6. Pham TN, Moore ML, Costa BA, Cuschieri J, Klein MB. Assessment of functional limitation after necrotizing soft tissue infection. J Burn Care Res 2009;30(2):301‑6.
7. Miller LG, Eisenberg DF, Liu H, Chang CL, Wang Y, Luthra R, et al. Incidence of skin and soft tissue infections in ambulatory and inpatient settings, 2005-2010. BMC Infect Dis 2015;15:362.
8. Cranendonk DR, van Vught LA, Wiewel MA, Cremer OL, Horn J, Bonten MJ, et al. Clinical characteristics and outcomes of patients with cellulitis requiring intensice care. JAMA Dermatol 2017;153(6):578‑82.
9. Grodner C, Bernigaud C, Lapadula S, Beringuer H, Billiet PA, Woerther PL, et al. Health products e-sale should be regulated: A case of necrotizing soft-tissue infection of the abdomen linked to self-injection of slimming products purchased on the internet. Int J Dermatol 2022;61(2):e52‑4.
10. Charpentier C, Kouby F, Hua C, Sbidian E, Darty M, Bosc R, et al. Group B streptococcal necrotizing soft-tissue infection: Role of pharyngeal and perineal carriage. J Eur Acad Dermatol Venereol 2020.
11. Bryant AE, Bayer CR, Huntington JD, Stevens DL. Group A streptococcal myonecrosis: Increased vimentin expression after skeletal-muscle injury mediates the binding of Streptococcus pyogenes. J Infect Dis 2006;193(12):1685‑92.
12. Dauger S, Blondé R, Brissaud O, Marcoux MO, Angoulvant F, Levy M, et al. Necrotizing soft-tissue infections in pediatric intensive care: A prospective multicenter case-series study. Crit Care 2021;25(1):139.
13. Bruun T, Kittang BR, de Hoog BJ, Aardal S, Flaatten HK, Langeland N, et al. Necrotizing soft tissue infections caused by Streptococcus pyogenes and Streptococcus dysgalactiae subsp. equisimilis of groups C and G in western Norway. Clinical Microbiology and Infection [internet] 2013 [cité le 5 juin 2015];19(12):E545‑50. Disponible sur http://www.sciencedirect.com/science/article/pii/S1198743X14630949
14. Madsen MB, Skrede S, Perner A, Arnell P, Nekludov M, Bruun T, et al. Patient’s characteristics and outcomes in necrotising soft-tissue infections: Results from a Scandinavian, multicentre, prospective cohort study. Intensive Care Med 2019;45(9):1241‑51.
15. Nuwayhid ZB, Aronoff DM, Mulla ZD. Blunt trauma as a risk factor for group A streptococcal necrotizing fasciitis. Ann Epidemiol 2007;17(11):878‑81.
16. Hamilton SM, Bayer CR, Stevens DL, Lieber RL, Bryant AE. Muscle injury, vimentin expression, and nonsteroidal anti-inflammatory drugs predispose to cryptic group A streptococcal necrotizing infection. J Infect Dis 2008;198(11):1692‑8.
17. Souyri C, Olivier P, Grolleau S, Lapeyre-Mestre M, French Network of Pharmacovigilance Centres. Severe necrotizing soft-tissue infections and nonsteroidal anti-inflammatory drugs. Clin Exp Dermatol 2008;33(3):249‑55.
18. Weng TC, Chen CC, Toh HS, Tang HJ. Ibuprofen worsens Streptococcus pyogenes soft tissue infections in mice. J Microbiol Immunol Infect 2011;44(6):418‑23.
19. Anti-inflammatoires non stéroïdiens (AINS) et complications infectieuses graves - Point d’Information actualisé le 20/05/2020 - Agence nationale de sécurité du médicament et des produits de santé [internet]. [cité le 27 oct 2020]. Disponible sur https://www.ansm.sante.fr/S-informer/Points-d-information-Points-d-information/Anti-inflammatoires-non-steroidiens-AINS-et-complications-infectieuses-graves-Point-d-Information-actualise-le-20-05-2020
20. Nawijn F, Houwert RM, van Wessem KPJ, Simmermacher RKJ, Govaert GAM, van Dijk MR, et al. A 5-Year evaluation of the implementation of triple diagnostics for early detection of severe necrotizing soft tissue disease: A single-center cohort study. World J Surg. 2019;43(8):1898‑905.
21. Hua C, Sbidian E, Hemery F, Decousser JW, Bosc R, Amathieu R, et al. Prognostic factors in necrotizing soft-tissue infections (NSTI): A cohort study. J Am Acad Dermatol 2015;73(6):1006-12.e8.
22. Nawijn F, Smeeing DPJ, Houwert RM, Leenen LPH, Hietbrink F. Time is of the essence when treating necrotizing soft tissue infections: A systematic review and meta-analysis. World J Emerg Surg 2020;15:4.
23. Stevens DL, Bisno AL, Chambers HF, Everett ED, Dellinger P, Goldstein EJC, et al. Practice guidelines for the diagnosis and management of skin and soft-tissue infections. Clin Infect Dis 2005;41(10):1373‑406.
24. May AK, Stafford RE, Bulger EM, Heffernan D, Guillamondegui O, Bochicchio G, et al. Treatment of complicated skin and soft tissue infections. Surg Infect (Larchmt) 2009;10(5):467‑99.
25. Goh T, Goh LG, Ang CH, Wong CH. Early Diagnosis of necrotizing fasciitis. Br J Surg 2014;101(1):e119-125.
26. Chosidow O. Subacute forms of necrotizing fasciitis and necrotizing cellulitis: Diagnosis criteria and surgical decision-making. Ann Dermatol Venereol 2001;128(3 Pt 2):390‑3.
27. Rahmouni A, Chosidow O, Mathieu D, Gueorguieva E, Jazaerli N, Radier C, et al. MR imaging in acute infectious cellulitis. Radiology 1994;192(2):493‑6.
28. Rahmouni A, Chosidow O. Differentiation of necrotizing infectious fasciitis from nonnecrotizing infectious fasciitis with MR imaging. Radiology 2012;262(2):732‑3; author reply 733.
29. Wong CH, Khin LW, Heng KS, Tan KC, Low CO. The LRINEC (Laboratory Risk Indicator for Necrotizing Fasciitis) score: A tool for distinguishing necrotizing fasciitis from other soft tissue infections. Crit Care Med 2004;32(7):1535‑41.
30. Simonart T, Nakafusa J, Narisawa Y. The importance of serum creatine phosphokinase level in the early diagnosis and microbiological evaluation of necrotizing fasciitis. J Eur Acad Dermatol Venereol 2004;18(6):687‑90.
31. Yaghoubian A, de Virgilio C, Dauphine C, Lewis RJ, Lin M. Use of admission serum lactate and sodium levels to predict mortality in necrotizing soft-tissue infections. Arch Surg. sept 2007;142(9):840‑6; discussion 844-846.