Les syndromes aortiques aigus comprennent la dissection aortique classique, l’hématome intramural et l’ulcère athéroscléreux pénétrant (
Cette pathologie est la plus fréquente des urgences aortiques, et son incidence, croissante, est actuellement de l’ordre de 2,9 à 3,5 pour 100 000 habitants dans les pays d’Europe de l’Ouest.3 À la phase aiguë, c’est-à-dire au cours des 14 premiers jours, la dissection aortique peut engager le pronostic vital car elle fait courir au patient un risque d’hémorragie par rupture de la paroi aortique fragilisée, ou d’ischémie des artères collatérales de l’aorte, par un syndrome dit de « malperfusion ». Le risque de telles complications à la phase aiguë est de l’ordre de 70 à 80 %, et justifie une prise en charge urgente en milieu cardiovasculaire médico-chirurgical spécialisé.4
Un diagnostic clinique relativement difficile à poser
Cliniquement, la douleur thoracique d’une dissection aortique est brutale, migratrice, irradiant dans le dos et les lombaires. L’hypertension artérielle, terrain favorisant, est présente dans plus de deux tiers des cas. La découverte d’une asymétrie tensionnelle, ou de signes ischémiques, comme un accident vasculaire cérébral ou une ischémie du membre inférieur, sont des éléments très évocateurs de dissection aortique lorsqu’ils sont associés à une douleur thoracique.5 Le terrain typique est plus particulièrement un homme de la soixantaine ayant une hypertension artérielle non contrôlée, voire une dilatation de l’aorte ascendante connue, ou des antécédents familiaux de pathologie aortique. L’hypertension artérielle chronique est largement reconnue comme la cause acquise la plus fréquente de contraintes de cisaillement conduisant à la dissection de l’aorte. Elle est présente chez près de 75 % des patients atteints de dissection aortique.3 Les autres facteurs de risque sont les traumatismes directs, le tabagisme, l’hyperlipidémie, la consommation de cocaïne et la grossesse compliquée d’éclampsie. Certaines études suggèrent même que l’athérosclérose limiterait le risque de dissection.6 Avant 40 ans, les maladies héréditaires du collagène et du tissu élastique, telles que le syndrome de Marfan, le syndrome d’Ehlers-Danlos et le syndrome de Loeys-Dietz, sont les principaux facteurs de risque de dissection aortique aiguë.7
L’angioscanner confirme la suspicion diagnostique
Devant toute suspicion clinique de dissection aortique, le diagnostic doit être confirmé, ou éliminé, par un angioscanner thoraco-abdomino-pelvien. Cet examen est idéalement synchronisé avec l’électrocardiogramme, de façon à limiter les artefacts liés aux battements cardiaques et à obtenir une imagerie nette sur la paroi de l’aorte ascendante à la sortie du cœur.
La phase aiguë d’une dissection aortique correspond aux 14 premiers jours suivant la douleur initiale. Il s’agit d’une période sensible pendant laquelle la dissection peut évoluer, s’étendre et se compliquer de rupture ou de malperfusion d’organes.4 Il est donc primordial que le patient puisse être surveillé de façon étroite dans un centre spécialisé, sur le plan clinique et morphologique, afin d’anticiper d’éventuelles complications et d’y répondre par un traitement chirurgical ou endovasculaire adapté.
Le niveau de l’atteinte conditionne la prise en charge
Le premier élément déterminant de la prise en charge d’une dissection aortique à la phase aiguë est l’atteinte de l’aorte ascendante, que l’on observe dans près de deux tiers des cas.
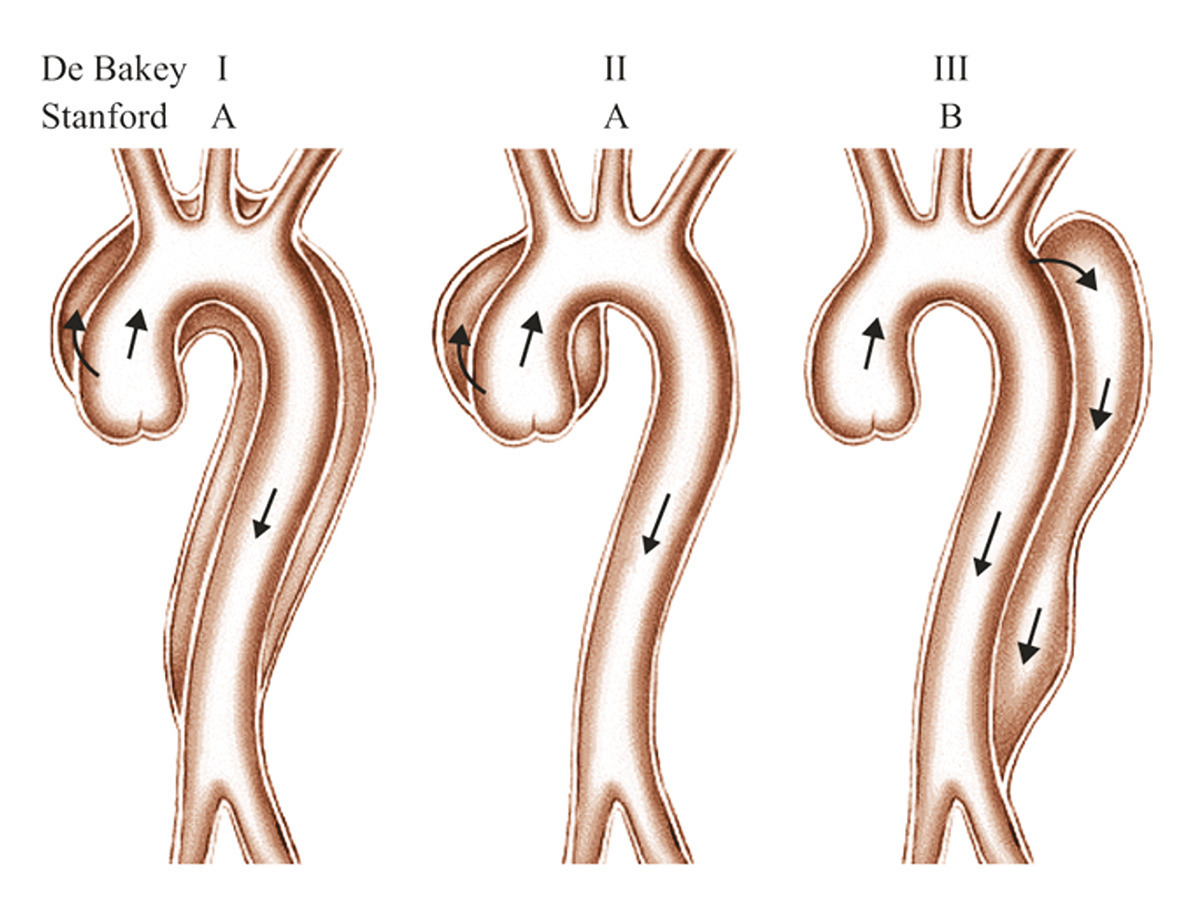
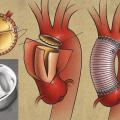
Dissection de type A : risque de tamponnade
La dissection de l’aorte ascendante, autrement appelée dissection de type A selon la classification de Stanford (
Une approche globale de l’atteinte aortique
En l’absence d’atteinte de l’aorte ascendante, on parle de dissection aortique de type B (selon la classification de Stanford). Ce type de dissection ne concerne ainsi que l’aorte thoracique descendante, et peut s’étendre jusqu’aux artères iliaques, voire fémorales. Il faut noter qu’une dissection aortique de type A, après remplacement de l’aorte ascendante, doit être considérée comme une dissection aortique de type B, puisqu’elle expose le patient aux mêmes complications que la dissection résiduelle. Il est donc important de considérer la dissection aortique dans sa globalité, et non comme un problème uniquement lié à l’atteinte de l’aorte ascendante. Le caractère multidisciplinaire de la filière de soins prend ici tout son sens.
D’autres complications à craindre et à rechercher
En dehors de la rupture de l’aorte ascendante, qui doit être prévenue par une intervention immédiate, la survenue, parfois retardée, d’une rupture de l’aorte thoracique descendante, voire de l’aorte abdominale, doit être dépistée par des angioscanners répétés. La présence ou l’apparition d’un hématome périaortique médiastinal ou rétropéritonéal, ou une dilatation anévrismale rapide du faux chenal sont les éléments d’imagerie évocateurs de rupture imminente de l’aorte. Sur le plan clinique, une douleur persistante, malgré des antalgiques adaptés, évoque également une évolution vers la rupture aortique. Lorsqu’elle est suspectée, la rupture aortique impose un traitement en urgence, le plus souvent de l’aorte thoracique descendante par voie endovasculaire.9
Risque de malperfusions d’organes
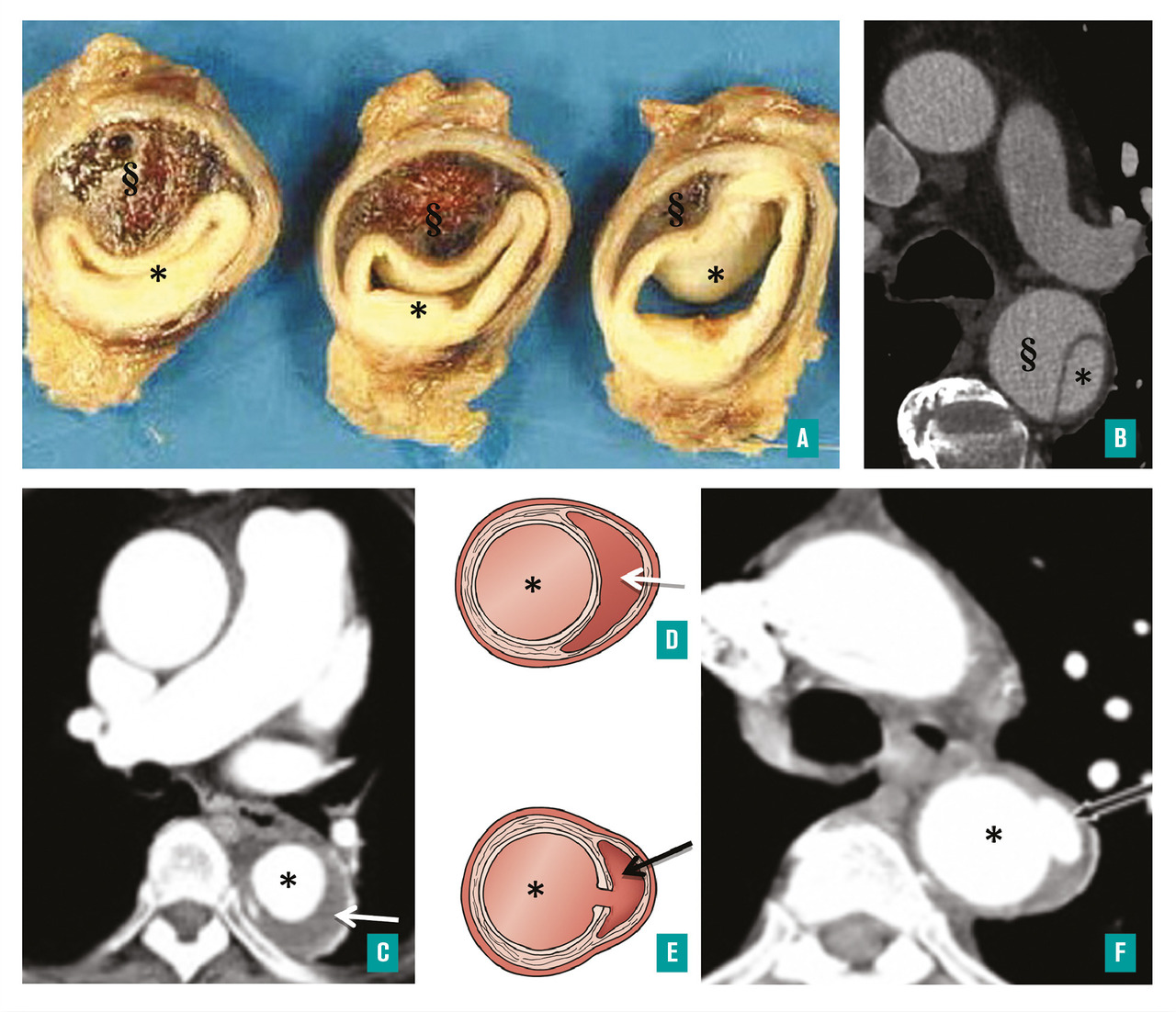
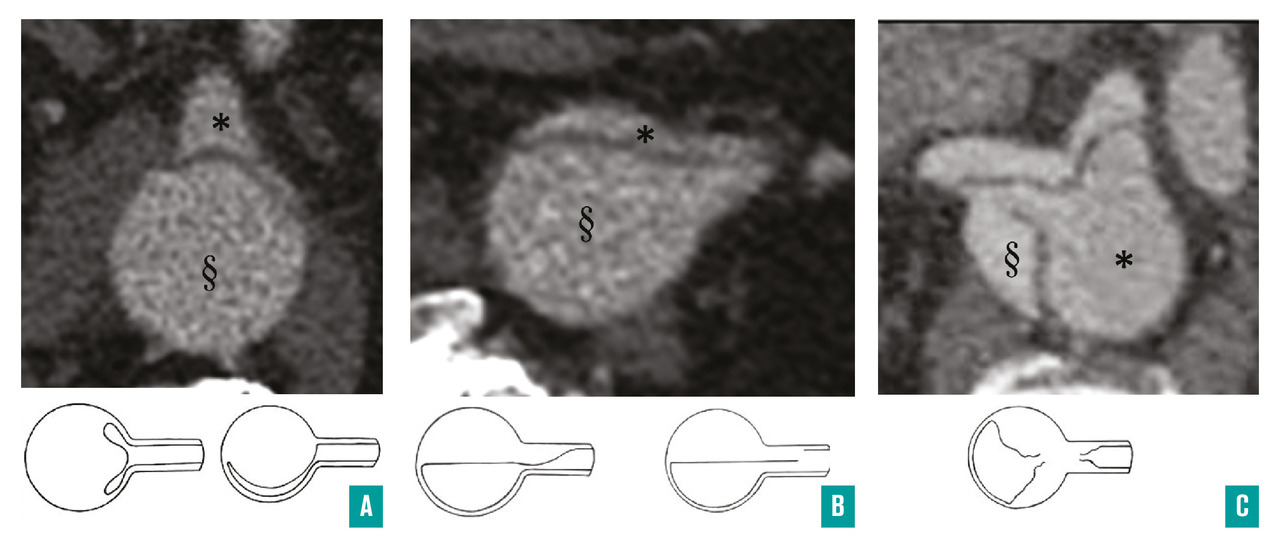
Un autre type de complication doit être attentivement recherché lors de la phase aiguë : il s’agit des malperfusions d’organes. En effet, toutes les artères collatérales de l’aorte peuvent être concernées par une compression ou une déchirure limitant leur perfusion. On parle alors de malperfusions, dont le mécanisme est décrit comme soit dynamique (compression du vrai chenal par le faux chenal), soit statique (déchirure localisée à l’artère collatérale de l’aorte provoquant sa sténose ou sa thrombose) [
Traitement médical ou chirurgie ?
La qualité du contrôle tensionnel et la présence, ou non, de complications sont déterminantes.
Hospitalisation en soins intensifs
Une hospitalisation en soins intensifs est systématiquement recommandée au cours des premiers jours suivant l’épisode de dissection aortique afin d’assurer une surveillance rapprochée, clinique et morphologique, à la recherche d’éléments évocateurs de rupture aortique secondaire ou de malperfusion d’organe. Un repos strict en décubitus avec monitorage continu de la pression artérielle et de la fréquence cardiaque doit permettre d’assurer l’efficacité du traitement médical antihypertenseur par voie intraveineuse, pour des valeurs cibles respectives < 120/80 mmHg et 60 batt/min. Ce traitement médical optimal reposant principalement sur les bêtabloquants et les antagonistes calciques, il s’associe à une titration des antalgiques afin d’assurer le confort du patient. Un angioscanner thoraco-abdomino-pelvien de contrôle à 48-72 heures est recommandé, avant un relais per os du traitement antihypertenseur adapté. Il permet de confirmer l’absence d’évolution rapidement péjorative de la dissection aortique, avant de poursuivre sa surveillance en hospitalisation standard. Un nouveau contrôle par angioscanner doit être réalisé avant la sortie du patient (entre J7 et J10) afin de confirmer l’absence de complication aortique, notamment l’absence d’évolution anévrismale du faux chenal, faisant craindre une rupture secondaire à court ou moyen terme.11
Seuls les patients pour lesquels un contrôle tensionnel et antalgique a pu être obtenu, sans signe scannographique de malperfusion ou d’évolution rapidement anévrismale du faux chenal, peuvent être considérés comme « non compliqués » à l’issue de l’hospitalisation initiale. Ils représentent la moitié des patients pris en charge pour une dissection aortique de type B (ou résiduelle de type A) et seront traités uniquement médicalement (antihypertenseurs), avec surveillance radiologique par scanner au long cours. Les autres patients sont considérés comme « compliqués » et requièrent un traitement chirurgical complémentaire, en général au cours de l’hospitalisation initiale.12
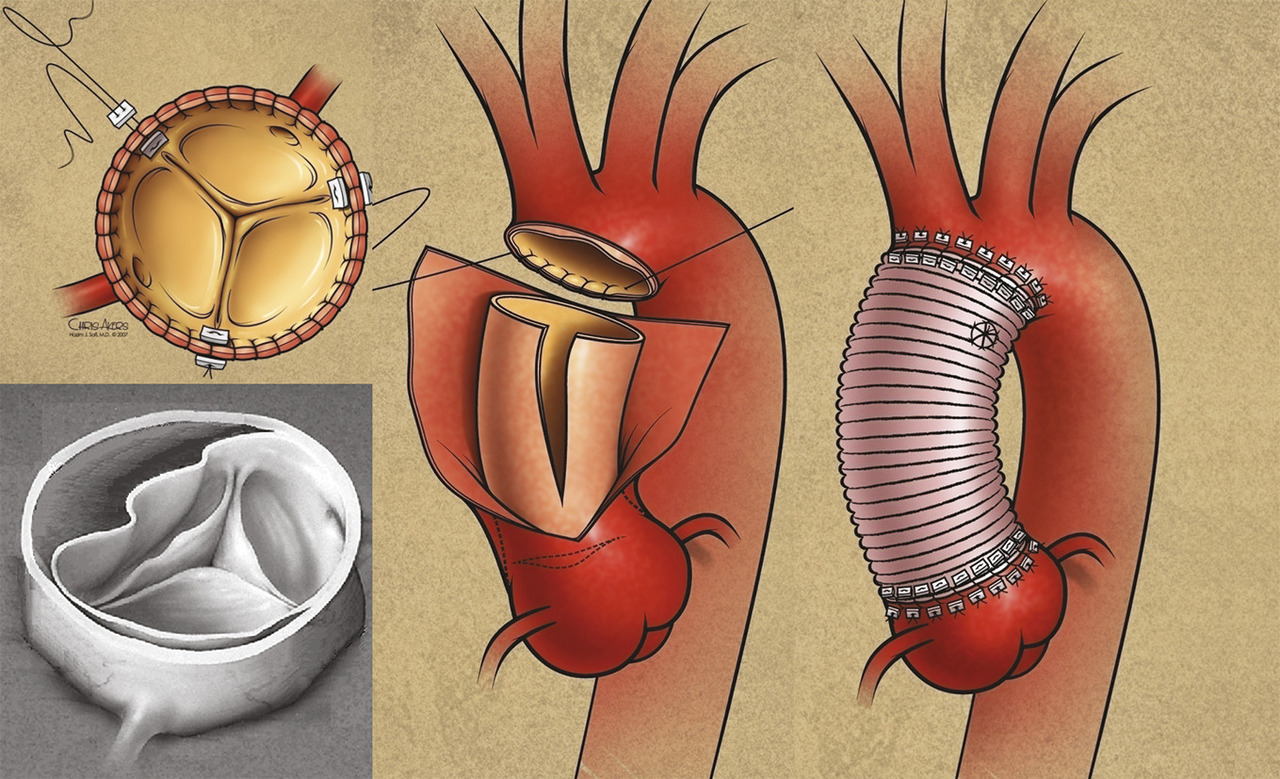
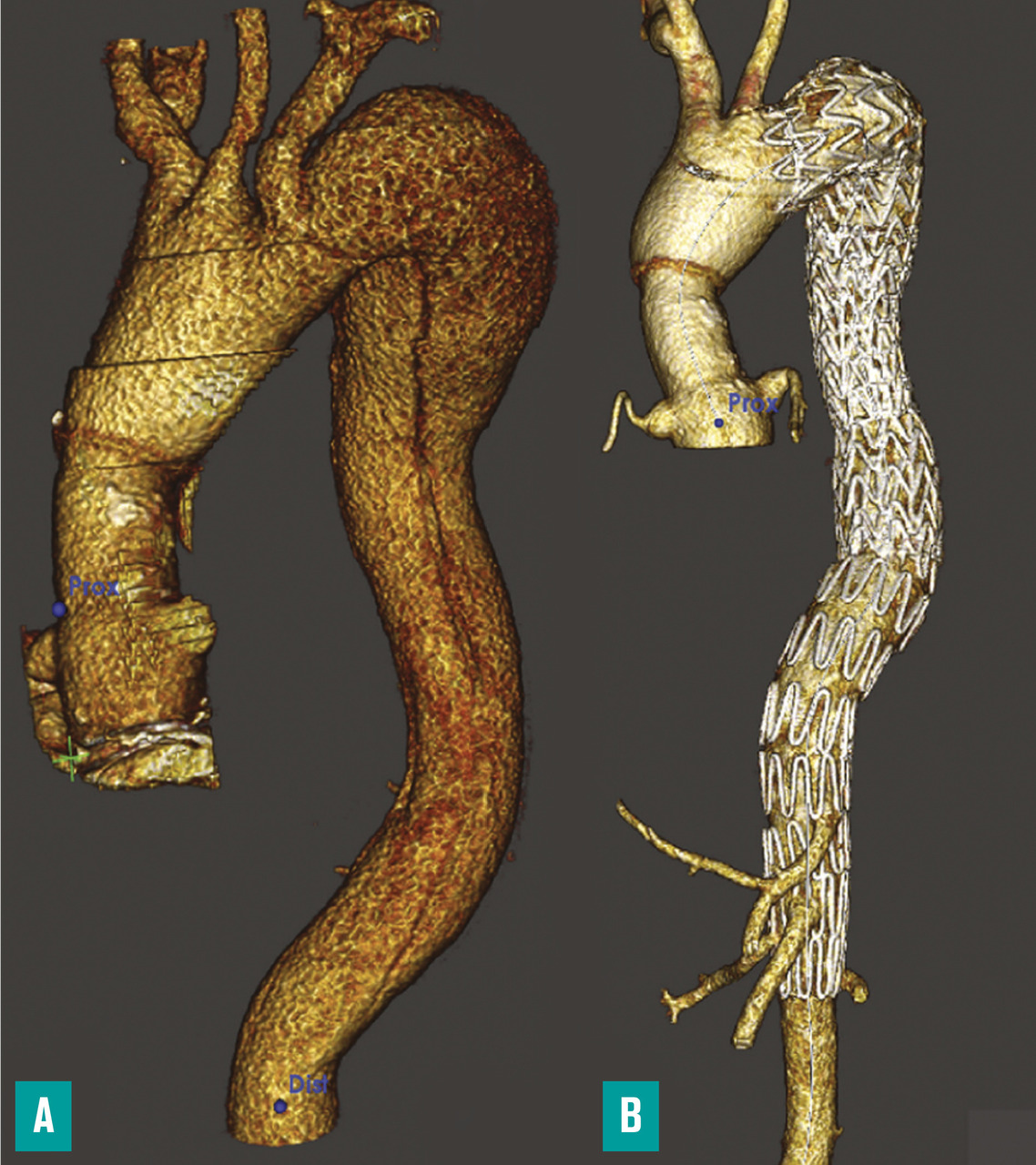
Endoprothèse couverte en cas de complications
La pose d’une endoprothèse aortique couverte est devenue le traitement chirurgical de référence à la phase aiguë des dissections aortiques compliquées. Elle a pour but de fermer la principale porte d’entrée de la dissection (très souvent située juste en aval de l’artère sous-clavière gauche) afin de rediriger le flux sanguin dans le vrai chenal, et de limiter la pression de perfusion du faux chenal. La pression exercée par le faux chenal sur le flap de dissection est ainsi effondrée, levant la compression du vrai chenal et améliorant ainsi la perfusion des artères collatérales qui en naissent. En cas de malperfusion sévère, et afin d’améliorer les pressions de perfusion des artères viscérales, plusieurs études recommandent l’ajout d’un stent aortique non couvert, à larges mailles auto-expansibles (composées de nitinol) en aval de l’endoprothèse couverte thoracique (
Des moyens de prévention existent
Les principaux éléments de prévention de la dissection aortique résident dans le dépistage et le traitement de l’hypertension artérielle. La recherche d’une dilatation de l’aorte ascendante par échographie cardiaque est également un élément primordial de la prévention, surtout si elle s’accompagne d’éléments en faveur d’un syndrome dysmorphique de type maladie de Marfan, syndrome d’Ehlers-Danlos vasculaire, syndrome de Loeys-Dietz, bicuspidie aortique, ou syndrome de Turner. Compte tenu du contexte familial notable des pathologies aortiques, une enquête familiale s’impose auprès de l’entourage d’un patient ayant subi une dissection aortique. Une échographie aortique de dépistage est recommandée au sein de la fratrie et des enfants. Un contexte de maladie génétique ou d’antécédents familiaux et la présence d’une dilatation de l’aorte ascendante sont des facteurs favorisants reconnus de dissection aortique. Cependant, ils ne sont présents que dans un tiers des cas, rendant la prévention primaire de cette maladie encore difficile et peu efficace.14
1. Coady MA, Rizzo JA, Elefteriades JA. Pathologic variants of thoracic aortic dissections. Penetrating atherosclerotic ulcers and intramural hematomas. Cardiol Clin 1999;17(4):637-57.
2. Nienaber CA. Pathophysiology of acute aortic syndromes. In : Baliga RR, Nienaber CA, Isselbacher EM, Eagle KA. (éds) Aortic Dissection and Related Syndromes. New York : Springer, 2007, p. 17-43.
3. Mészáros I, Mórocz J, Szlávi J, Schmidt J, Tornóci L, Nagy L, et al. Epidemiology and clinicopathology of aortic dissection. Chest 2000;117(5):1271-8.
4. Booher AM, Isselbacher EM, Nienaber CA, Trimarchi S, Evangelista A, Montgomery DG, et al. The IRAD classification system for characterizing survival after aortic dissection. Am J Med 2013;126(8):730.e19-24.
5. Nienaber CA, Eagle KA. Aortic dissection: new frontiers in diagnosis and management: Part II: therapeutic management and follow-up. Circulation 2003;108(6):772-8.
6. Roberts WC. Aortic dissection: anatomy, consequences and causes. Am Heart J 1981;101(2):195-214.
7. Januzzi JL, Isselbacher EM, Fattori R, Cooper JV, Smith DE, Fang J, et al. Characterizing the young patient with aortic dissection: results from the International Registry of Aortic Dissection (IRAD). J Am Coll Cardiol 2004;43(4):665-9.
8. Daily PO, Trueblood HW, Stinson EB, Wuerflein RD, Shumway NE. Management of acute aortic dissections. Ann Thorac Surg 1970;10(3):237-47.
9. Faure EM, Canaud L, Marty-Ané C, Becquemin JP, Alric P. Endovascular management of rupture in acute type B aortic dissections. Eur J Vasc Endovasc Surg 2015;49(6):655-60.
10. Chung JW, Elkins C, Sakai T, Kato N, Vestring T, Semba CP, et al. True-lumen collapse in aortic dissection: part II. Evaluation of treatment methods in phantoms with pulsatile flow. Radiology 2000;214(1):99-106.
11. Hiratzka LF, Bakris GL, Beckman JA, Bersin RM, Carr VF, Casey DE, et al. 2010 ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/SIR/STS/SVM guidelines for the diagnosis and management of patients with thoracic aortic disease. J Am Coll Cardiol 2010;55(14):e27-e129.
12. Erbel R, Aboyans V, Boileau C, Bossone E, Bartolomeo RD, Eggebrecht H, et al. 2014 ESC guidelines on the diagnosis and treatment of aortic diseases: Document covering acute and chronic aortic diseases of the thoracic and abdominal aorta of the adult. The Task Force for the Diagnosis and Treatment of Aortic Diseases of the European Society of Cardiology (ESC). Eur Heart J 2014;35(41):2873-926.
13. Alsac JM, Girault A, El Batti S, Abou Rjeili M, Alomran F, Achouh P, et al. Experience of the Zenith Dissection Endovascular System in the emergency setting of malperfusion in acute type B dissections. J Vasc Surg 2014;59(3):645-50.
14. Hagan PG, Nienaber CA, Isselbacher EM, Bruckman D, Karavite DJ, Russman PL, et al. The International Registry of Acute Aortic Dissection (IRAD): new insights into an old disease. JAMA 2000;283(7):897-903.