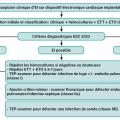
Les présentations cliniques d’endocardite infectieuse (EI) sont très hétérogènes, ce qui participe à la difficulté diagnostique.1,2 La présentation peut être aiguë, de progression très rapide, mais le plus souvent le tableau clinique est subaigu.
Selon le registre EURO-ENDO, les présentations cliniques les plus fréquentes sont une fièvre (77,7 %), un souffle cardiaque (64,5 %) et une insuffisance cardiaque (27,2 %).3 Dans 25 % des cas, une complication embolique est détectée, comme un accident vasculaire cérébral ischémique ; des anomalies de conduction sont mises en évidence chez 11 % des patients. L’EI peut aussi se manifester sous la forme d’une complication mimant une autre pathologie rhumatologique, neurologique ou auto-immune, ou un cancer. Une présentation atypique est fréquente chez les patients âgés ou immunodéprimés. De ce fait, une forte suspicion diagnostique est le plus souvent évoquée devant une fièvre avec des hémocultures positives chez un patient ayant des facteurs de risque d’EI.
Devant tout soupçon, un examen général est réalisé, à la recherche de signes cardiaques ou extracardiaques et de signes cutanés spécifiques ou non (faux panaris d’Osler, placard érythémateux de Janeway, purpura pétéchial). L’identification d’une porte d’entrée infectieuse peut aussi être le facteur déclenchant : lésion cutanée (Staphylococcus aureus), foyer infectieux dentaire (streptocoques), etc. Un syndrome inflammatoire non spécifique et/ou une hyperleucocytose inexpliquée ou une sérologie rhumatoïde positive peuvent être les éléments révélateurs de l’endocardite.
Différents spécialistes sont donc amenés à évoquer le diagnostic d’EI et à diriger rapidement le patient vers un centre spécialisé.
Selon le registre EURO-ENDO, les présentations cliniques les plus fréquentes sont une fièvre (77,7 %), un souffle cardiaque (64,5 %) et une insuffisance cardiaque (27,2 %).3 Dans 25 % des cas, une complication embolique est détectée, comme un accident vasculaire cérébral ischémique ; des anomalies de conduction sont mises en évidence chez 11 % des patients. L’EI peut aussi se manifester sous la forme d’une complication mimant une autre pathologie rhumatologique, neurologique ou auto-immune, ou un cancer. Une présentation atypique est fréquente chez les patients âgés ou immunodéprimés. De ce fait, une forte suspicion diagnostique est le plus souvent évoquée devant une fièvre avec des hémocultures positives chez un patient ayant des facteurs de risque d’EI.
Devant tout soupçon, un examen général est réalisé, à la recherche de signes cardiaques ou extracardiaques et de signes cutanés spécifiques ou non (faux panaris d’Osler, placard érythémateux de Janeway, purpura pétéchial). L’identification d’une porte d’entrée infectieuse peut aussi être le facteur déclenchant : lésion cutanée (Staphylococcus aureus), foyer infectieux dentaire (streptocoques), etc. Un syndrome inflammatoire non spécifique et/ou une hyperleucocytose inexpliquée ou une sérologie rhumatoïde positive peuvent être les éléments révélateurs de l’endocardite.
Différents spécialistes sont donc amenés à évoquer le diagnostic d’EI et à diriger rapidement le patient vers un centre spécialisé.
Rechercher les facteurs de risque
La recherche de facteurs de risque cardiaques ou non cardiaques doit être systématique devant toute suspicion d’EI : antécédent, valvulopathie, prothèse valvulaire cardiaque, cathéter veineux central ou artériel, dispositif électronique cardiaque implantable, cardiopathie congénitale, injection de drogues, immunosuppression, procédures dentaires ou chirurgicales récentes, hospitalisation récente ou hémodialyse.4 Enfin, il faut savoir rechercher une EI chez les patients atteints d’une infection chronique mal contrôlée, comme une infection dentaire, cutanée, articulaire ou digestive…
Microbiologie et imagerie pour confirmer le diagnostic
Le diagnostic d’EI est souvent difficile du fait des présentations variées mais aussi parce qu’il se fait sur la combinaison de critères diagnostiques qui ne sont pas spécifiques isolément. L’approche doit donc être méthodique. Les deux piliers du diagnostic sont la microbiologie, pour confirmer l’infection, et l’imagerie cardiaque, pour la mise en évidence des lésions de l’endocarde.
Diagnostic microbiologique sur trois séries d’hémocultures
Les causes de l’EI ont évolué ces dernières dizaines d’années, avec une augmentation de la prévalence chez les patients porteurs de matériel intracardiaque. L’évolution de la bactériologie de la maladie, avec une prédominance de Staphylococcus aureus, est associée aux procédures invasives et aux hospitalisations répétées.5 Par ordre de fréquence, on observe ensuite les streptocoques oraux puis les staphylocoques à coagulase négative.3 Chez les sujets âgés, les infections à Enterococcus faecalis sont plus fréquentes et semblent en augmentation, ce qui explique leur intégration dans les germes typiques d’EI dans les recommandations 2023 de l’ESC (tableau ).
Afin de confirmer l’infection, il est recommandé de prélever, avant toute antibiothérapie, sur une veine périphérique, trois séries d’hémocultures (culture aéro- et anaérobie) à trente minutes d’intervalle sur vingt-quatre heures, en veillant à bien remplir les flacons (10 mL). Il n’est pas nécessaire de prélever spécifiquement pendant les pics fébriles, car la bactériémie est constante dans l’EI.
La recherche d’EI doit être spécifiée au laboratoire de bactériologie qui peut mettre en culture pour des temps de croissance longue (groupe HACEK : Haemophilus spp, Aggregatibacter actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens, Kingella kingae). Si les hémocultures sont négatives à vingt-quatre heures, de nouveaux prélèvements doivent être effectués.
L’EI à hémocultures négatives peut représenter jusqu’à 10 % des cas ; elle se définit par l’absence de mise en évidence de micro-organisme par les cultures sanguines usuelles. Une antibiothérapie préalable en est la cause la plus fréquente. Il peut s’agir aussi d’endocardites à germes intracellulaires ou plus rarement fongiques, nécessitant des techniques microbiologiques spécifiques. Des tests sérologiques systématiques doivent être réalisés dans ce cas pour Coxiella burnetii, et Bartonella spp. (et à discuter pour Aspergillus spp., Mycoplasma pneumoniae, Brucella spp. et Legionella pneumophila). Des techniques de polymerase chain reaction (PCR) sur sang complet sont effectuées pour Tropheryma whipplei, Bartonella spp. La PCR et le séquençage du gène ARN 16S sur tissus ou sur du matériel embolique peuvent permettre d’identifier le germe et sont donc maintenant intégrés comme critère diagnostique microbiologique. En cas de chirurgie, la mise en culture des prélèvements valvulaires doit être systématique et peut permettre d’identifier le micro-organisme a posteriori.
L’anatomopathologie constitue le gold standard pour le diagnostic d’EI. En cas d’hémocultures restant négatives, l’hypothèse d’une endocardite non infectieuse doit être envisagée, avec la recherche d’anticorps antinucléaires et d’anticorps antiphospholipides ; une réaction allergique à la bioprothèse (anticorps anti-porc) est également possible.
Afin de confirmer l’infection, il est recommandé de prélever, avant toute antibiothérapie, sur une veine périphérique, trois séries d’hémocultures (culture aéro- et anaérobie) à trente minutes d’intervalle sur vingt-quatre heures, en veillant à bien remplir les flacons (10 mL). Il n’est pas nécessaire de prélever spécifiquement pendant les pics fébriles, car la bactériémie est constante dans l’EI.
La recherche d’EI doit être spécifiée au laboratoire de bactériologie qui peut mettre en culture pour des temps de croissance longue (groupe HACEK : Haemophilus spp, Aggregatibacter actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens, Kingella kingae). Si les hémocultures sont négatives à vingt-quatre heures, de nouveaux prélèvements doivent être effectués.
L’EI à hémocultures négatives peut représenter jusqu’à 10 % des cas ; elle se définit par l’absence de mise en évidence de micro-organisme par les cultures sanguines usuelles. Une antibiothérapie préalable en est la cause la plus fréquente. Il peut s’agir aussi d’endocardites à germes intracellulaires ou plus rarement fongiques, nécessitant des techniques microbiologiques spécifiques. Des tests sérologiques systématiques doivent être réalisés dans ce cas pour Coxiella burnetii, et Bartonella spp. (et à discuter pour Aspergillus spp., Mycoplasma pneumoniae, Brucella spp. et Legionella pneumophila). Des techniques de polymerase chain reaction (PCR) sur sang complet sont effectuées pour Tropheryma whipplei, Bartonella spp. La PCR et le séquençage du gène ARN 16S sur tissus ou sur du matériel embolique peuvent permettre d’identifier le germe et sont donc maintenant intégrés comme critère diagnostique microbiologique. En cas de chirurgie, la mise en culture des prélèvements valvulaires doit être systématique et peut permettre d’identifier le micro-organisme a posteriori.
L’anatomopathologie constitue le gold standard pour le diagnostic d’EI. En cas d’hémocultures restant négatives, l’hypothèse d’une endocardite non infectieuse doit être envisagée, avec la recherche d’anticorps antinucléaires et d’anticorps antiphospholipides ; une réaction allergique à la bioprothèse (anticorps anti-porc) est également possible.
Apports de l’imagerie cardiaque pour la mise en évidence des lésions de l’endocarde
Le deuxième pilier du diagnostic, l’imagerie cardiaque, permet de mettre en évidence les lésions structurelles et fonctionnelles de l’endocarde. Une approche d’imagerie multimodale peut être essentielle pour confirmer le diagnostic. L’équipe multidisciplinaire (endocarditis team) joue un rôle clé dans la stratégie diagnostique. L’examen de première ligne pour le diagnostic de l’EI reste l’échocardiographie.
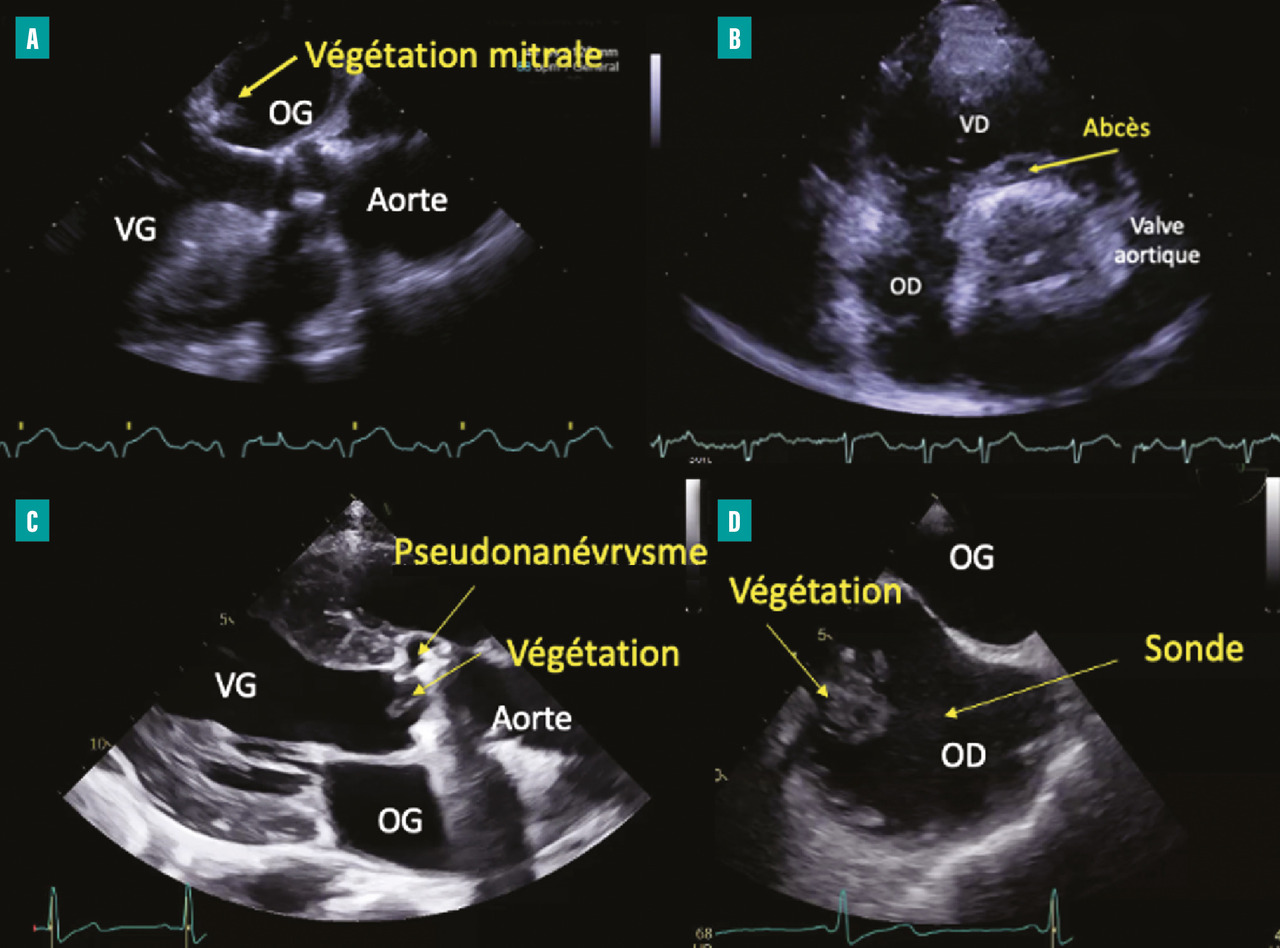
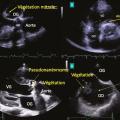
– la végétation (lésion valvulaire la plus fréquente, image vibratile insérée sur une valve ou sur toute structure endocardique ou du matériel intracardiaque correspondant à une masse septique) ;
– les lésions périvalvulaires :
• abcès (épaississement périvalvulaire hyperéchogène, puis néocavité vide d’écho),
• pseudoanévrysme avec déhiscence d’une prothèse (espace anéchogène périvalvulaire pulsatile communiquant avec les cavités d’amont et d’aval et responsable d’une fuite périprothétique),
• communication de type fistule entre deux cavités adjacentes et perforation valvulaire (fig. 1 ).
La taille d’une végétation (longueur maximale de la végétation) est une mesure essentielle guidant la prise en charge chirurgicale.
En deuxième intention, une échocardiographie transœsophagienne (ETO) est réalisée si :
– l’ETT est non concluante alors que la suspicion clinique est forte ;
– le diagnostic est confirmé en ETT ; l’ETO permet alors de détecter les complications locales ;
– le patient est porteur d’une prothèse ou d’un dispositif intracardiaque quel que soit le résultat de l’ETT.
La sensibilité de l’ETO est supérieure à celle de l’ETT pour détecter une végétation, tout particulièrement sur les prothèses (96 % versus 70 % pour les valves natives ; 92 % versus 50 % pour les prothèses valvulaires), d’où la nécessité de réaliser une ETO chez les patients porteurs de matériel intracardiaque.
La spécificité de chacune des deux techniques est d’environ 90 %.6
Si les examens échocardiographiques initiaux sont négatifs mais qu’une suspicion clinique forte persiste, il est recommandé de renouveler l’ETT +/- l’ETO après cinq à sept jours.
L’ETT réalisée initialement permet aussi une évaluation globale du cœur : quantification d’une régurgitation d’apparition récente et évaluation de son retentissement, fonctionnement d’une prothèse valvulaire, des cavités cardiaques, de la fonction ventriculaire gauche et droite et des pressions pulmonaires.
Une surveillance échocardiographique régulière est préconisée sous traitement pour détecter de nouvelles complications silencieuses et la taille des végétations.En cas de bactériémie à Staphylococcus aureus, Enterococcus faecalis ou Streptococcus spp. et de présence de facteurs de risque associés, la réalisation d’une ETT peut se discuter, même en l’absence de point d’appel clinique du fait de la fréquence d’EI dans ce contexte.7 L’association de paramètres microbiologiques (nombre de flacons positifs) et de facteurs de risque cardiaques peut aider à identifier les patients pour lesquels l’ETT est nécessaire.
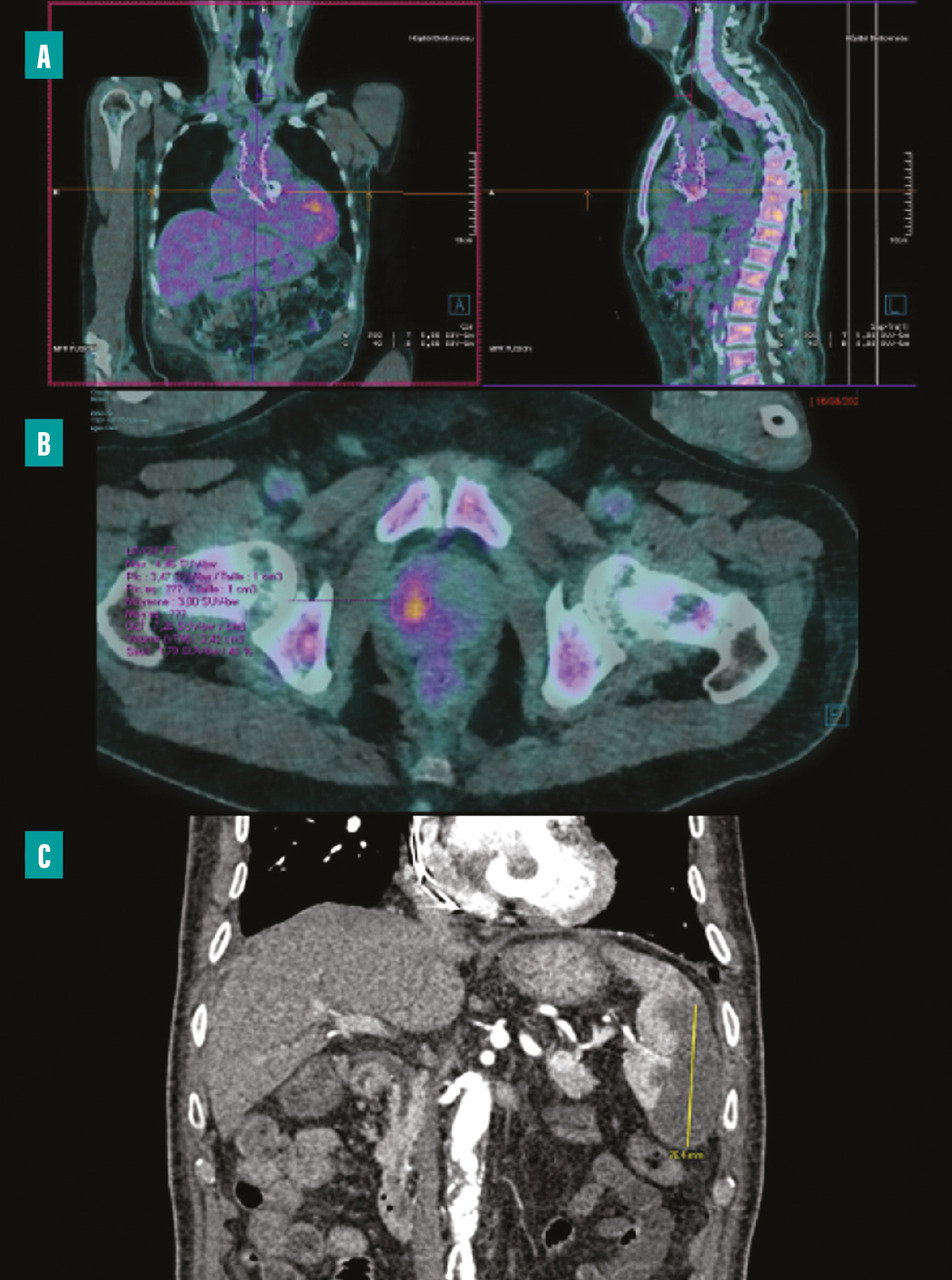
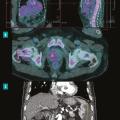
La tomographie par émission de positons (TEP-scanner au 18F-FDG) et la scintigraphie aux leucocytes marqués (moins sensible que la TEP) permettent, en cas de fixation anormale sur du matériel ou l’endocarde adjacent, d’avoir un critère diagnostique majeur.4,9 Elle permet aussi de détecter des lésions emboliques périphériques ou des lésions secondaires infectieuses (fig. 2 ).
La sensibilité de ces examens est bonne pour le diagnostic d’EI sur matériel mais assez faible sur valve native et ne permet donc pas d’éliminer le diagnostic en cas de négativité. Dans les trois premiers mois postopératoires d’une chirurgie de remplacement valvulaire, une fixation focale intense ou hétérogène est associée à un diagnostic d’infection, alors que les changements liés à une inflammation postopératoire peuvent être différenciés et observés au-delà des trois premiers mois. L’examen peut donc être réalisé quel que soit le délai de la suspicion par rapport à la chirurgie.
L’imagerie par résonance magnétique (IRM) cérébrale dispose d’une meilleure sensibilité que le scanner cérébral pour détecter les lésions et les caractérise mieux. Elle est indiquée en cas de signe neurologique clinique, de nécessité d’anticoagulation curative ou d’indication chirurgicale de l’endocardite. Si l’IRM est non accessible ou le patient en état critique, un scanner cérébral avec injection peut être réalisé. Chez le patient sans symptôme neurologique et dont le diagnostic d’EI n’est pas confirmé, une lésion cérébrale détectée à l’IRM peut aussi aider au diagnostic en ajoutant un critère mineur à la classification diagnostique. L’IRM est la technique d’imagerie de référence pour le diagnostic des lésions spinales, spondylodiscite et ostéomyélite.
Un scanner corps entier avec injection permet de rechercher un abcès splénique ou autre (fig. 2 ) et d’analyser les vaisseaux périphériques afin de dépister une complication vasculaire à type d’embole, d’anévrysme mycotique. Il n’est pas recommandé à titre systématique, mais la détection de lésions distales ajoute un critère mineur et peut permettre de rendre le diagnostic certain. Il peut aussi aider à la recherche d’autres foyers infectieux et ainsi identifier un diagnostic alternatif, le TEP-scanner étant, dans ce cas, supérieur.
Échocardiographie transthoracique en première intention
Dès la suspicion clinique d’EI, une échocardiographie transthoracique (ETT) doit être systématiquement réalisée. Les anomalies échocardiographiques principales amenant au diagnostic sont :– la végétation (lésion valvulaire la plus fréquente, image vibratile insérée sur une valve ou sur toute structure endocardique ou du matériel intracardiaque correspondant à une masse septique) ;
– les lésions périvalvulaires :
• abcès (épaississement périvalvulaire hyperéchogène, puis néocavité vide d’écho),
• pseudoanévrysme avec déhiscence d’une prothèse (espace anéchogène périvalvulaire pulsatile communiquant avec les cavités d’amont et d’aval et responsable d’une fuite périprothétique),
• communication de type fistule entre deux cavités adjacentes et perforation valvulaire (
La taille d’une végétation (longueur maximale de la végétation) est une mesure essentielle guidant la prise en charge chirurgicale.
En deuxième intention, une échocardiographie transœsophagienne (ETO) est réalisée si :
– l’ETT est non concluante alors que la suspicion clinique est forte ;
– le diagnostic est confirmé en ETT ; l’ETO permet alors de détecter les complications locales ;
– le patient est porteur d’une prothèse ou d’un dispositif intracardiaque quel que soit le résultat de l’ETT.
La sensibilité de l’ETO est supérieure à celle de l’ETT pour détecter une végétation, tout particulièrement sur les prothèses (96 % versus 70 % pour les valves natives ; 92 % versus 50 % pour les prothèses valvulaires), d’où la nécessité de réaliser une ETO chez les patients porteurs de matériel intracardiaque.
La spécificité de chacune des deux techniques est d’environ 90 %.6
Si les examens échocardiographiques initiaux sont négatifs mais qu’une suspicion clinique forte persiste, il est recommandé de renouveler l’ETT +/- l’ETO après cinq à sept jours.
L’ETT réalisée initialement permet aussi une évaluation globale du cœur : quantification d’une régurgitation d’apparition récente et évaluation de son retentissement, fonctionnement d’une prothèse valvulaire, des cavités cardiaques, de la fonction ventriculaire gauche et droite et des pressions pulmonaires.
Une surveillance échocardiographique régulière est préconisée sous traitement pour détecter de nouvelles complications silencieuses et la taille des végétations.En cas de bactériémie à Staphylococcus aureus, Enterococcus faecalis ou Streptococcus spp. et de présence de facteurs de risque associés, la réalisation d’une ETT peut se discuter, même en l’absence de point d’appel clinique du fait de la fréquence d’EI dans ce contexte.7 L’association de paramètres microbiologiques (nombre de flacons positifs) et de facteurs de risque cardiaques peut aider à identifier les patients pour lesquels l’ETT est nécessaire.
Scanner cardiaque, équivalent à l’ETO
Le scanner cardiaque, avec acquisition synchronisée sur l’électrocardiogramme, est un outil diagnostique équivalent à l’ETO pour les lésions périvalvulaires ou périprothétiques. Il peut donc être utilisé en complément8 ou en remplacement de l’ETO lorsque celle-ci n’est pas possible ou contre-indiquée. En préopératoire, il permet l’analyse du réseau coronarien de façon non invasive.Imagerie de médecine nucléaire pour les situations diagnostiques difficiles
Le développement des techniques hybrides associant médecine nucléaire et scanner apporte de nouveaux outils d’imagerie pour les situations diagnostiques difficiles d’EI, particulièrement sur matériel.La tomographie par émission de positons (TEP-scanner au 18F-FDG) et la scintigraphie aux leucocytes marqués (moins sensible que la TEP) permettent, en cas de fixation anormale sur du matériel ou l’endocarde adjacent, d’avoir un critère diagnostique majeur.4,9 Elle permet aussi de détecter des lésions emboliques périphériques ou des lésions secondaires infectieuses (
La sensibilité de ces examens est bonne pour le diagnostic d’EI sur matériel mais assez faible sur valve native et ne permet donc pas d’éliminer le diagnostic en cas de négativité. Dans les trois premiers mois postopératoires d’une chirurgie de remplacement valvulaire, une fixation focale intense ou hétérogène est associée à un diagnostic d’infection, alors que les changements liés à une inflammation postopératoire peuvent être différenciés et observés au-delà des trois premiers mois. L’examen peut donc être réalisé quel que soit le délai de la suspicion par rapport à la chirurgie.
Imagerie extracardiaque pour la recherche de complications emboliques
Les complications cérébrales sont fréquentes, chez 60 à 80 % des patients,10 et peuvent être principalement ischémiques (50 à 80 %) mais aussi hémorragiques ou à type d’abcès ou anévrysme mycotique.L’imagerie par résonance magnétique (IRM) cérébrale dispose d’une meilleure sensibilité que le scanner cérébral pour détecter les lésions et les caractérise mieux. Elle est indiquée en cas de signe neurologique clinique, de nécessité d’anticoagulation curative ou d’indication chirurgicale de l’endocardite. Si l’IRM est non accessible ou le patient en état critique, un scanner cérébral avec injection peut être réalisé. Chez le patient sans symptôme neurologique et dont le diagnostic d’EI n’est pas confirmé, une lésion cérébrale détectée à l’IRM peut aussi aider au diagnostic en ajoutant un critère mineur à la classification diagnostique. L’IRM est la technique d’imagerie de référence pour le diagnostic des lésions spinales, spondylodiscite et ostéomyélite.
Un scanner corps entier avec injection permet de rechercher un abcès splénique ou autre (
Critères diagnostiques des recommandations 2023
La classification diagnostique repose sur l’association de critères cliniques, biologiques et d’imagerie, majeurs et mineurs, regroupés dans la classification modifiée des recommandations 2023 (tableau ).
L’identification du micro-organisme et la mise en évidence de lésions de l’endocarde sont deux critères majeurs de cette classification, permettant, en cas d’association, d’affirmer le diagnostic d’EI comme certain. Les recommandations 2015 avaient introduit la notion d’une approche d’imagerie multimodale pour affiner le diagnostic des lésions de l’endocarde. Les recommandations 2023 ont confirmé cette approche. Toute lésion de l’endocarde diagnostiquée, quelle que soit la technique d’imagerie, ajoute un critère diagnostique majeur. Parmi les critères mineurs, la présence d’une spondylodiscite est maintenant reconnue comme un critère mineur diagnostique parmi les lésions distales liées à l’EI (tableau ).
Les cas de possible EI reposent sur l’association d’un critère majeur et d’un ou deux critères mineurs.
La classification diagnostique doit être appliquée par l’équipe multidisciplinaire à l’admission mais aussi tout au long du suivi afin d’établir le diagnostic final d’endocardite.
L’identification du micro-organisme et la mise en évidence de lésions de l’endocarde sont deux critères majeurs de cette classification, permettant, en cas d’association, d’affirmer le diagnostic d’EI comme certain. Les recommandations 2015 avaient introduit la notion d’une approche d’imagerie multimodale pour affiner le diagnostic des lésions de l’endocarde. Les recommandations 2023 ont confirmé cette approche. Toute lésion de l’endocarde diagnostiquée, quelle que soit la technique d’imagerie, ajoute un critère diagnostique majeur. Parmi les critères mineurs, la présence d’une spondylodiscite est maintenant reconnue comme un critère mineur diagnostique parmi les lésions distales liées à l’EI (
Les cas de possible EI reposent sur l’association d’un critère majeur et d’un ou deux critères mineurs.
La classification diagnostique doit être appliquée par l’équipe multidisciplinaire à l’admission mais aussi tout au long du suivi afin d’établir le diagnostic final d’endocardite.
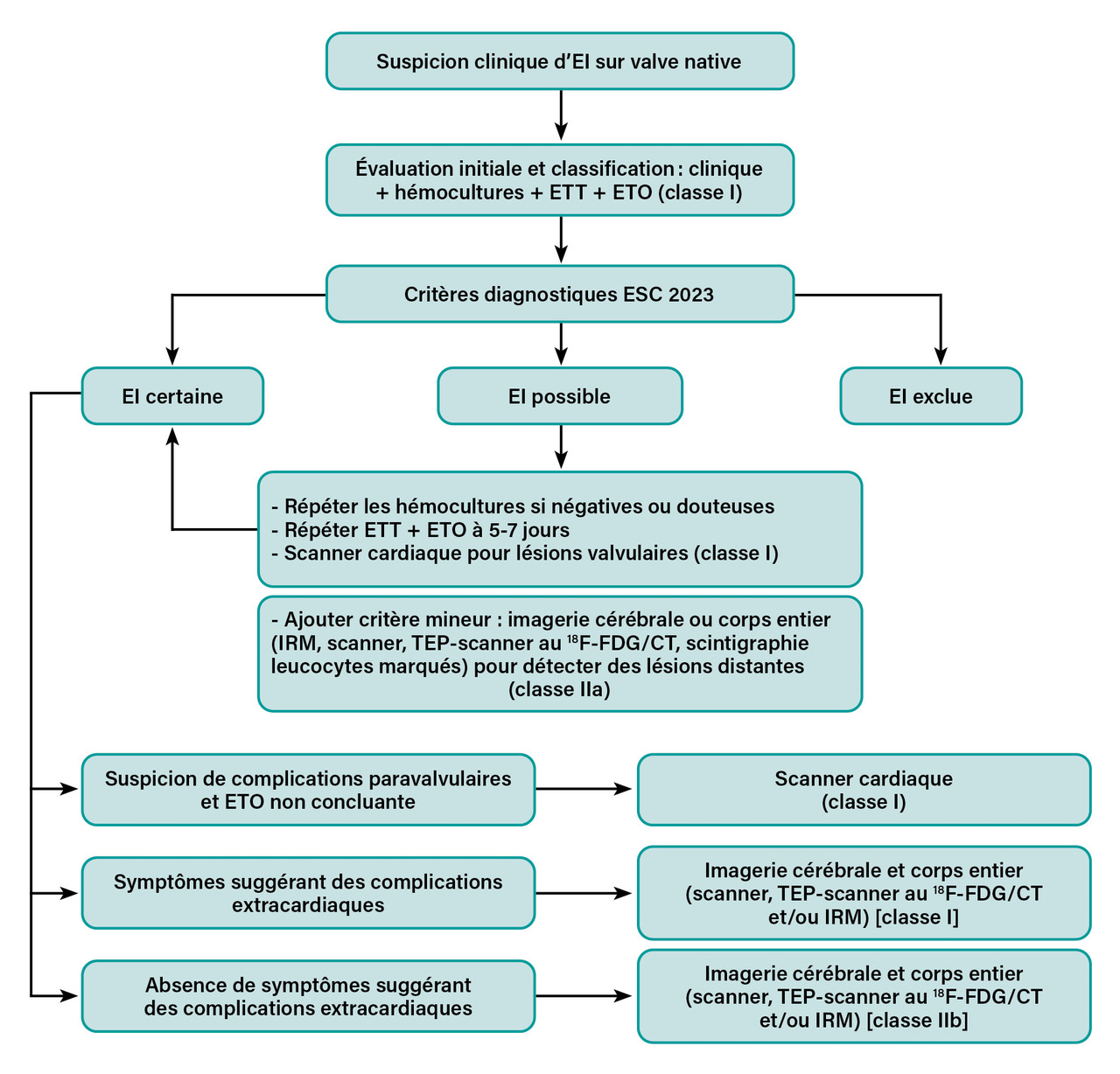
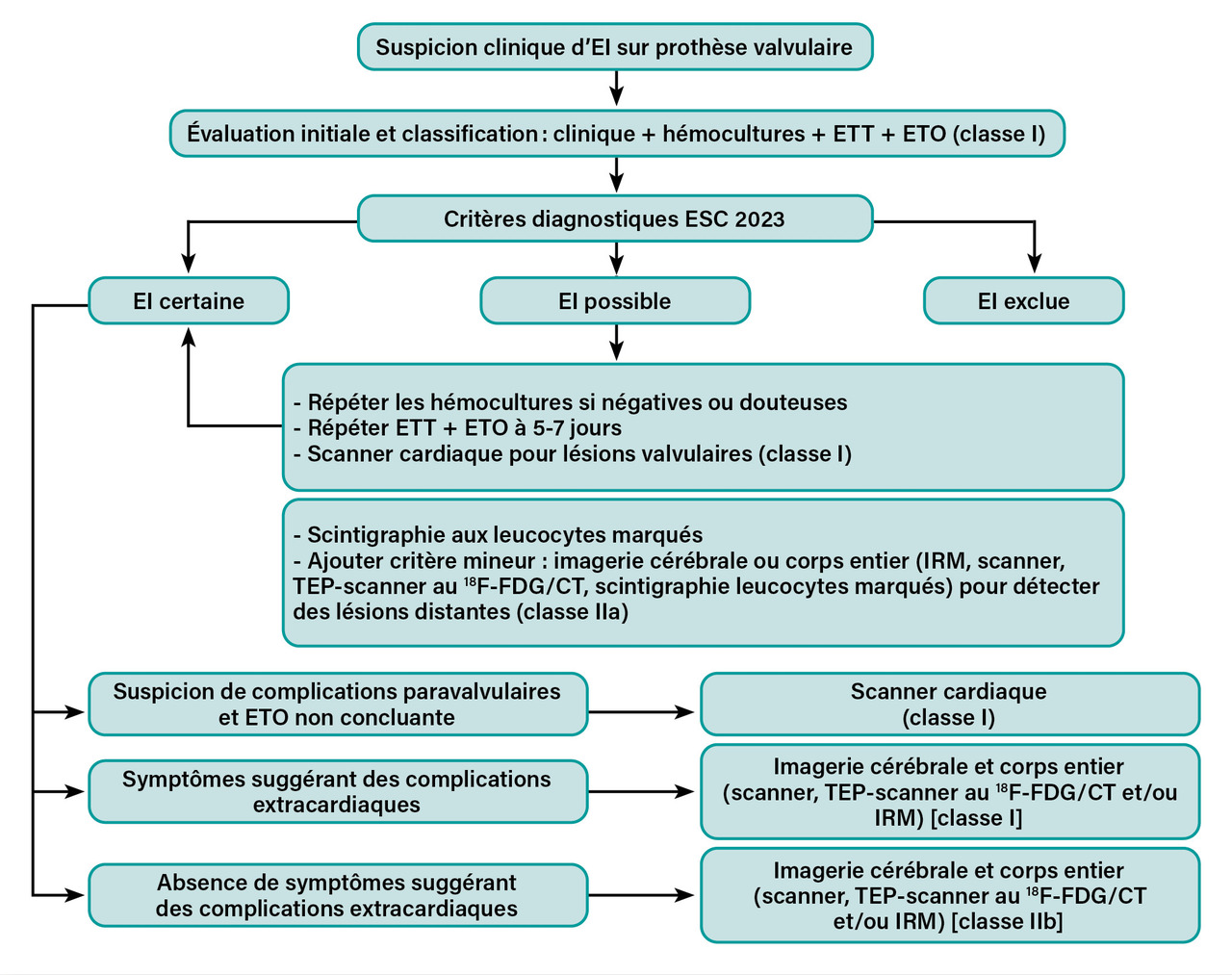
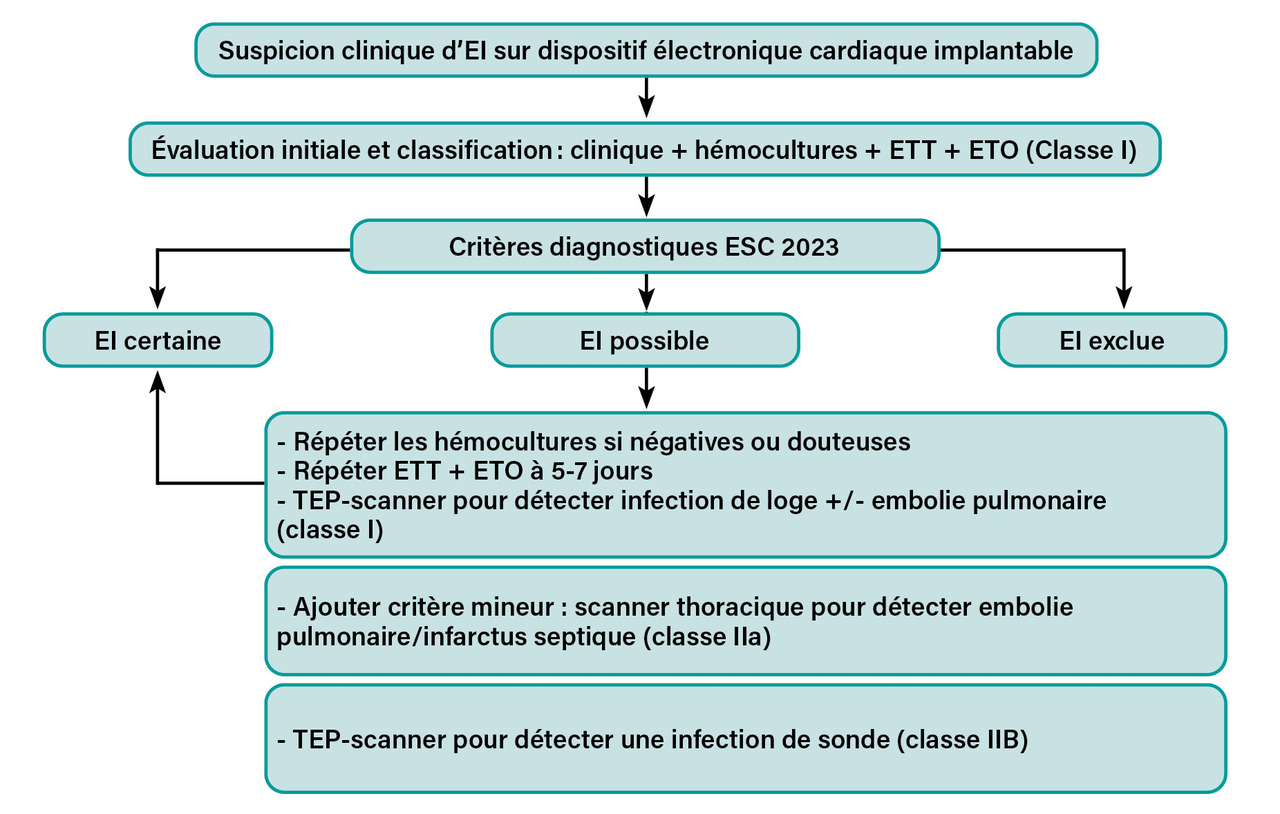
Stratégie diagnostique adaptée au type de dispositif implanté
Des algorithmes spécifiques sont proposés s’il s’agit d’une valve native ou d’une valve prothétique (fig. 3, 4 et 5 ). En effet, en présence d’une prothèse valvulaire ou d’un dispositif électronique cardiaque implantable, l’échocardiographie présente des limites, et le recours aux techniques d’imagerie sus-citées est fortement recommandé.
L’EI sur dispositif électronique cardiaque implantable est considérée comme une EI du cœur droit et est incluse dans les algorithmes.12
L’EI sur dispositif électronique cardiaque implantable est considérée comme une EI du cœur droit et est incluse dans les algorithmes.12
Diagnostic délicat reposant sur des critères précis
Le diagnostic d’endocardite infectieuse est difficile, et une approche méthodique est nécessaire. Les recommandations de l’ESC 2023 ont précisé certains points en lien avec l’évolution des données microbiologiques et d’imagerie. Les critères diagnostiques ont ainsi été modifiés et des algorithmes spécifiques proposés.
Références
1. Murdoch DR, Corey GR, Hoen B, Miro JM, Fowler Jr VG, Bayer AS, et al. Clinical presentation, etiology, and outcome of infective endocarditis in the 21st century: The International Collaboration on Endocarditis-Prospective Cohort Study. Arch Intern Med 2009;169(5):463-73.
2. Habib G, Lancellotti P, Antunes MJ, Bongiorni MG, Casalta JP, Del Zotti F, et al. 2015 ESC Guidelines for the management of infective endocarditis: The task force for the management ofinfective endocarditis of the European Society of Cardiology (ESC). Endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur Heart J 2015;36(44):3075-128.
3. Habib G, Erba PA, Iung B, Donal E, Cosyns B, Lariche C, et al. Clinical presentation, aetiology and outcome of infective endocarditis. Results of the ESC-EORP EURO-ENDO (European infective endocarditis) registry: A prospective cohort study. Eur Heart J 2019;40(39):3222-32.
4. Delgado V, Ajmone Marsan N, De Waha S, Bonaros N, Brida M, Burri H, et al. 2023 ESC Guidelines for the management of endocarditis. Eur Heart J 2023:44(39):3498-4042.
5. Cahill TJ, Prendergast BD. Infective endocarditis. Lancet 2016;387(10021):882-93.
6. Habib G, Badano L, Tribouilloy C, Vilacosta I, Zamorano JL, Galderisi M, et al. Recommendations for the practice of echocardiography in infective endocarditis. Eur J Echocardiogr 2010;11(2):202-19.
7. Rasmussen RV, Host U, Arpi M, Hassager C, Johansen HK, Korup E, et al. Prevalence of infective endocarditis in patients with Staphylococcus aureus bacteraemia: The value of screening with echocardiography. Eur J Echocardiogr 2011;12(6):414-20.
8. Feuchtner GM, Stolzmann P, Dichtl W, Schertler T, Bonatti J, Scheffe H, et al. Multislice computed tomography in infective endocarditis: Comparison with transesophageal echocardiography and intraoperative findings. J Am Coll Cardiol 2009;53(5):436-44.
9. Saby L, Laas O, Habib G, Cammilleri S, Mancini J, Tessonnier L, et al. Positron emission tomography/computed tomography for diagnosis of prosthetic valve endocarditis: Increased valvular 18F-fluorodeoxyglucose uptake as a novel major criterion. J Am Coll Cardiol 2013;61(23):2374-82.
10. Iung B, Tubiana S, Klein I, Messika-Zeitoun D, Brochet E, Lepage L, et al. Determinants of cerebral lesions in endocarditis on systematic cerebral magnetic resonance imaging: A prospective study. Stroke 2013;44(11):3056-62.
11. Iung B, Duval X. Infective endocarditis: Innovations in the management of an old disease. Nat Rev Cardiol 2019;16(10):623-35.
12. Blomström-Lundqvist C, Traykov V, Erba PA, Burri H, Nielsen JC, Bongiorni MG, et al. European Heart Rhythm Association (EHRA) international consensus document on how to prevent, diagnose, and treat cardiac implantable electronic device infections-endorsed by the Heart Rhythm Society (HRS), the Asia Pacific Heart Rhythm Society (APHRS), the Latin American Heart Rhythm Society (LAHRS), International Society for Cardiovascular Infectious Diseases (ISCVID), and the European Society of Clinical Microbiology and Infectious Diseases (ESCMID) in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2020;41(21):2012-32.
2. Habib G, Lancellotti P, Antunes MJ, Bongiorni MG, Casalta JP, Del Zotti F, et al. 2015 ESC Guidelines for the management of infective endocarditis: The task force for the management ofinfective endocarditis of the European Society of Cardiology (ESC). Endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur Heart J 2015;36(44):3075-128.
3. Habib G, Erba PA, Iung B, Donal E, Cosyns B, Lariche C, et al. Clinical presentation, aetiology and outcome of infective endocarditis. Results of the ESC-EORP EURO-ENDO (European infective endocarditis) registry: A prospective cohort study. Eur Heart J 2019;40(39):3222-32.
4. Delgado V, Ajmone Marsan N, De Waha S, Bonaros N, Brida M, Burri H, et al. 2023 ESC Guidelines for the management of endocarditis. Eur Heart J 2023:44(39):3498-4042.
5. Cahill TJ, Prendergast BD. Infective endocarditis. Lancet 2016;387(10021):882-93.
6. Habib G, Badano L, Tribouilloy C, Vilacosta I, Zamorano JL, Galderisi M, et al. Recommendations for the practice of echocardiography in infective endocarditis. Eur J Echocardiogr 2010;11(2):202-19.
7. Rasmussen RV, Host U, Arpi M, Hassager C, Johansen HK, Korup E, et al. Prevalence of infective endocarditis in patients with Staphylococcus aureus bacteraemia: The value of screening with echocardiography. Eur J Echocardiogr 2011;12(6):414-20.
8. Feuchtner GM, Stolzmann P, Dichtl W, Schertler T, Bonatti J, Scheffe H, et al. Multislice computed tomography in infective endocarditis: Comparison with transesophageal echocardiography and intraoperative findings. J Am Coll Cardiol 2009;53(5):436-44.
9. Saby L, Laas O, Habib G, Cammilleri S, Mancini J, Tessonnier L, et al. Positron emission tomography/computed tomography for diagnosis of prosthetic valve endocarditis: Increased valvular 18F-fluorodeoxyglucose uptake as a novel major criterion. J Am Coll Cardiol 2013;61(23):2374-82.
10. Iung B, Tubiana S, Klein I, Messika-Zeitoun D, Brochet E, Lepage L, et al. Determinants of cerebral lesions in endocarditis on systematic cerebral magnetic resonance imaging: A prospective study. Stroke 2013;44(11):3056-62.
11. Iung B, Duval X. Infective endocarditis: Innovations in the management of an old disease. Nat Rev Cardiol 2019;16(10):623-35.
12. Blomström-Lundqvist C, Traykov V, Erba PA, Burri H, Nielsen JC, Bongiorni MG, et al. European Heart Rhythm Association (EHRA) international consensus document on how to prevent, diagnose, and treat cardiac implantable electronic device infections-endorsed by the Heart Rhythm Society (HRS), the Asia Pacific Heart Rhythm Society (APHRS), the Latin American Heart Rhythm Society (LAHRS), International Society for Cardiovascular Infectious Diseases (ISCVID), and the European Society of Clinical Microbiology and Infectious Diseases (ESCMID) in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2020;41(21):2012-32.