Le cancer de l’endomètre est le 6e cancer le plus fréquent chez la femme dans le monde, avec 417 000 nouveaux cas rapportés en 2020. En 2018, sur les 382 069 cas de cancers de l’endomètre, le nombre de décès spécifiques a été évalué à 89 929. L’incidence la plus élevée est actuellement observée en Amérique du Nord, suivie de l’Europe de l’Est et de l’Europe centrale.1 Au niveau mondial, le risque de cancer de l’endomètre chez une femme au cours de sa vie est d’environ 3 %, avec un âge médian au diagnostic de 63 ans. Plus de 90 % des cancers de l’endomètre surviennent après 50 ans ; c’est donc pour l’essentiel un cancer de la femme ménopausée. Le pronostic est bon, avec un taux de survie à cinq ans tous stades confondus de 84,5 %.
Incidence stable en France, en hausse aux États-Unis
En France en 2018,2 le cancer du corps de l’utérus est placé au 4e rang des cancers les plus fréquents chez la femme (8 224 cas), après le cancer du sein (58 459 cas), le cancer colorectal (20 120 cas), le cancer du poumon (15 132 cas).
Il se situe au 6e rang des décès par cancer chez la femme, avec 2 415 décès observés en 2018, largement derrière le cancer du sein (12 146 décès), le cancer du poumon (10 356 décès), le cancer colorectal (7 908 décès), le cancer du pancréas (5 666 décès) et le cancer de l’ovaire (3 479 décès).
L’incidence en France est restée quasiment stable au cours des trente dernières années (variation annuelle moyenne +0,1 %, intervalle de confiance à 95 % [IC95] : -0,1-0,3). En revanche, au niveau mondial, l’incidence a augmenté de 132 % au cours des trente dernières années. Aux États-Unis, bien que les diagnostics soient plus nombreux dans toutes les tranches d’âge, on constate surtout un doublement des cas chez les femmes de moins de 40 ans qui représentent 4 % des patientes atteintes de tous les cancers de bas grade de l’endomètre diagnostiqués. Cette évolution de l’incidence est liée à un accroissement de la prévalence des facteurs de risque, en particulier l’obésité et le vieillissement de la population.
Classification histopathologique : l’historique
La distinction entre les deux grands types histologiques a été décrite pour la première fois en 1983 :3 les adénocarcinomes endométrioïdes et les adénocarcinomes non endométrioïdes.
Adénocarcinomes endométrioïdes : en général de bon pronostic
Les adénocarcinomes endométrioïdes concernent 80 % des patientes, et sont associés à un terrain d’hyperœstrogénie relative, généralement de bon pronostic. Ils sont classés en fonction de leur complexité architecturale en tumeurs de bas grade (grades 1 et 2) et tumeurs de haut grade (grade 3). Ils se développent sur un fond d’hyperplasie. La prolifération diffuse de la composante glandulaire sous l’effet des œstrogènes est appelée hyperplasie endométriale sans atypie, et comporte un faible risque (de 1 à 3 %) de cancer. L’hyperplasie endométriale atypique est une expansion glandulaire clonale qui induit un risque de cancer 45 fois plus élevé.
Un certain nombre d’anomalies moléculaires ont été décrites : perte de PTEN (phosphatase and tensin homolog, gène suppresseur de tumeur), mutation du gène de la ß-caténine et instabilité microsatellitaire (syndrome de Lynch ou formes sporadiques dans 30 % des cas).
Adénocarcinomes non endométrioïdes : un risque métastatique élevé
Les adénocarcinomes non endométrioïdes sont non hormonodépendants, et comprennent les adénocarcinomes séreux, ceux à cellules claires, les carcinosarcomes (tumeurs mixtes à double composante épithéliale et mésenchymateuse) et les carcinomes indifférenciés. Ils concernent des patientes en moyenne plus âgées (plus de 65 ans), et sont de plus mauvais pronostic. À l’inverse des carcinomes endométrioïdes, ils dérivent d’une transformation maligne de l’épithélium de surface et se développent sur un fond d’atrophie endométriale. Ils présentent un risque métastatique plus élevé avec une propagation extra-utérine au moment du diagnostic initial dans 40 à 50 % des cas. Ces tumeurs présentent des atypies nucléaires sévères et une mutation p53.
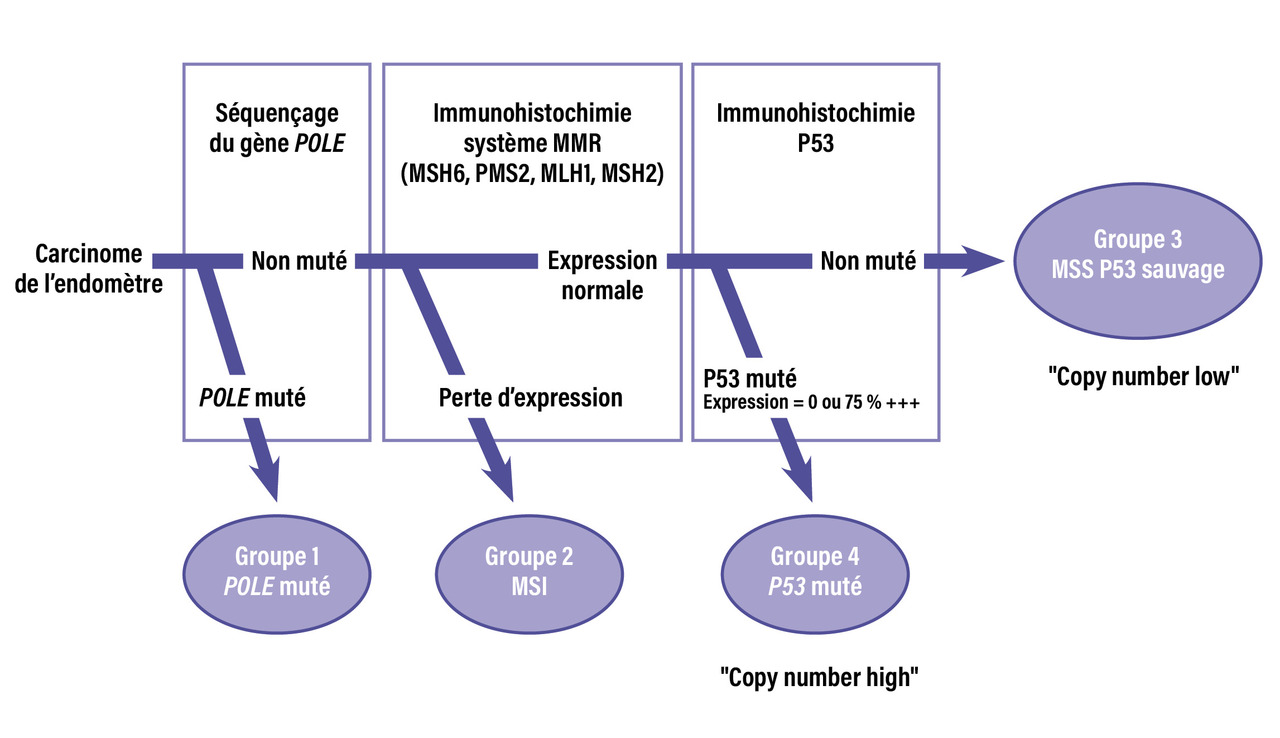
Nouvelle classification : quatre profils moléculaires
Les analyses du TCGA (The Cancer Genome Atlas) ont permis d’établir une nouvelle classification en quatre profils moléculaires, du meilleur au moins bon pronostic (
Les profils ultramutés « POLE » (12,4 %) sont de haut grade avec mutation de la polymérase ℇ impliquée dans la réparation de l’ADN ; de très bon pronostic, ils concernent des patientes assez jeunes (survie globale à cinq ans de 98 %).
Les profils hypermutés avec instabilité microsatellitaire (MSI ou MMRd [mismatch repair deficiency]) [33,4 %] correspondent à la perte de protéines de la voie de réparation MMR qui entraîne des mutations dans de courtes séquences répétées de l’ADN (instabilité des microsatellites). Cette perte peut être due soit à une hyperméthylation du promoteur de MLH1 (15 à 20 %, sporadique), soit à la mutation d’un des gènes MMR (sporadique [7 %] ou dans le cadre d'un syndrome de Lynch [3 %]). Le pronostic est intermédiaire, avec une survie globale à cinq ans de 71,7 %.
Les cancers de l’endomètre à faible nombre de copies NSMP (no specific molecular profile) [31,5 %] ont un taux de mutations faible, sont généralement de bas grade et de pronostic intermédiaire (taux de survie globale à cinq ans de 74,4 %).
Les profils p53-mutés (22,7 %) sont des tumeurs séreuses et correspondent à 25 % des endométrioïdes de haut grade, de mauvais pronostic (taux de survie globale à cinq ans de 48 %).
Des facteurs de risque bien identifiés
Outre l’obésité,5 des prédispositions génétiques sont aujourd’hui bien connues.
Obésité, facteurs reproductifs et métaboliques
Le risque de cancer de l’endomètre augmente avec l’âge et l’indice de masse corporelle (IMC). Parmi les vingt types de tumeurs les plus fréquents, le cancer de l’endomètre a le lien le plus fort avec l’obésité, chaque augmentation de 5 kg/m2 de l’IMC étant associée à un accroissement de 54 % du risque de cancer. Le risque à vie de cancer de l’endomètre chez les femmes dont l’IMC est supérieur à 40 kg/m2 est de 10 à 15 %, ce qui équivaut au risque à vie de cancer du poumon chez les fumeurs. L’obésité crée un milieu pro-inflammatoire dominé par des taux circulants élevés de protéine C-réactive, d’interleukine-6 et de facteur de nécrose tumorale-α, ainsi qu’une déficience relative des types de cellules immunitaires protectrices de l’endomètre.
L’obésité entraîne par ailleurs une hyperœstrogénie due à l’aromatisation périphérique des androgènes surrénaliens en œstrogènes par le tissu adipeux. En période d’activité génitale, les œstrogènes stimulent la prolifération de l’endomètre, tandis que la progestérone la régule. Chez les femmes ménopausées, du fait de la carence en progestérone, l’hyperœstrogénie liée à l’obésité n’est pas compensée. Les facteurs de risque reproductifs qui augmentent l’exposition à vie aux œstrogènes non opposés*, notamment les règles précoces (avant 12 ans), la ménopause tardive (à 55 ans ou plus), l’anovulation (syndrome des ovaires polykystiques [SOPK]) et la nulliparité, majorent également le risque de cancer de l’endomètre. Le tamoxifène est un modulateur sélectif des récepteurs des œstrogènes qui inhibe la prolifération mammaire mais stimule celle de l’endomètre ; sa prescription à long terme pour la prévention ou le traitement du cancer du sein hormonosensible multiplie par 4 le risque de cancer de l’endomètre.
De même, un traitement hormonal de la ménopause mal équilibré, c’est-à-dire sous-dosé en progestérone (ou même par prise exclusive d’œstrogènes non compensée), constitue un facteur de risque de cancer de l’endomètre du fait de l’hyperoestrogénie relative qui en résulte.
L’insulinorésistance, caractéristique de l’obésité, du diabète de type 2 et du SOPK, favorise la stimulation de l’endomètre en augmentant la biodisponibilité des œstrogènes et de l’IGF-1 (insulin-like growth factor one ou somatomédine C). L’activation de la voie de signalisation pro-oncogène PI3K-AKT-mTOR explique une incidence plus élevée de la maladie dans le diabète de type 2 et le SOPK, indépendamment de l’IMC.
Facteurs génétiques
Le syndrome de Lynch constitue la principale prédisposition génétique au cancer de l’endomètre.6 Il se caractérise par une mutation de l’un des quatre gènes de réparation des mésappariements MMR (MLH1, MSH2, MSH6, PMS2), entraînant un risque à vie de 13 à 49 % de cancer de l’endomètre.
Le syndrome de Cowden, dû à une mutation du gène suppresseur de tumeur PTEN, confère un risque de cancer de l’endomètre de 20 à 30 % au cours de la vie.
Enfin, un antécédent familial de cancer de l’endomètre au premier degré double le risque de maladie, même en l’absence de mutation génétique connue retrouvée.
Des pistes indéniables pour le dépistage et la prévention
Il n’existe pas de programme établi de dépistage du cancer de l’endomètre ; son objectif serait d’identifier l’hyperplasie atypique ou le cancer de l’endomètre au stade précoce.
On recommande cependant aux patientes avec un syndrome de Lynch ou de Cowden un suivi régulier, avec échographie pelvienne et biopsie de l’endomètre annuelles.
L’information des femmes sur les symptômes d’alerte du cancer de l’endomètre et sur l’importance de consulter rapidement en cas de saignement vaginal anormal peut être la stratégie la plus importante pour une détection précoce.
En matière de prévention, le maintien d’un IMC normal constitue le critère majeur. Le traitement de l’obésité par une intervention chirurgicale, pharmacologique ou diététique, associé à des niveaux élevés d’activité physique, réduit de manière significative le risque de cancer de l’endomètre.
Il a été démontré qu’une exposition élevée à la progestérone endogène au cours de la vie, par le biais de cycles menstruels réguliers, de la grossesse et de l’allaitement, et à la progestérone exogène, par le biais d’une exposition prolongée (plus de cinq ans) aux contraceptifs, réduirait le risque de cancer de l’endomètre.
Le traitement de l’insulinorésistance par la metformine a une valeur théorique pour la prévention du cancer de l’endomètre mais qui n'a pas encore été démontré.
Dans le cas du syndrome de Lynch, le risque de cancer augmente fortement à partir de 35-40 ans, et une hystérectomie prophylactique peut être proposée une fois le projet de grossesse accompli.
* NDLR : œstrogènes non opposés : œstrogènes sans progestérone associée (déséquilibre hormonal).
1. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2018;68(6):394-424.
2. Defossez G, Le Guyader‑Peyrou S, Uhry Z, Grosclaude P, Colonna M, Dantony E, et al. Estimations nationales de l'incidence et de la mortalité par cancer en France métropolitaine entre 1990 et 2018. Synthèse. Saint‑Maurice : Santé publique France, 2019. 20 p.
3. Bokhman JV. Two pathogenetic types of endometrial carcinoma. Gynecol Oncol 1983;15(1):10-7.
4. Cancer Genome Atlas Research Network; Kandoth C, Schultz N, Cherniack AD, Akbani R, Liu Y et al. Integrated genomic characterization of endometrial carcinoma. Nature 2013;497(7447):67-73.
5. Crosbie EJ, Zwahlen M, Kitchener HC, Egger M, Renehan AG. Body mass index, hormone replacement therapy, and endometrial cancer risk: A meta-analysis. Cancer Epidemiol Biomarkers Prev. 2010;19(12):3119-30.
6. Dominguez-Valentin M, Sampson JR, Seppälä TT, Ten Broeke SW, Plazzer JP, Nakken S, et al. Cancer risks by gene, age, and gender in 6350 carriers of pathogenic mismatch repair variants: findings from the Prospective Lynch Syndrome Database. Genet Med. 2020;22(1):15-25.
7. Ngo C, Genestie C. Classification des carcinomes de l’endomètre. Correspondances en Onco-Théranostic 2018;VII(4):134-7.