La drépanocytose est la maladie génétique grave la plus fréquente en France et dans le monde. Une mutation unique sur le chromosome 11, changement d’un acide glutamique par la valine, entraîne le remplacement des chaînes bêta de globine (aussi appelées A) par des chaînes S ayant des capacités de polymérisation. Dans diverses situations comme l’hypoxie, l’acidose, la déshydratation, l’inflammation, etc., cette polymérisation entraîne la déformation des globules rouges (falciformation), provoquant vaso-occlusion veinulaire et anémie hémolytique. C’est une maladie autosomique récessive. Ainsi, les patients homozygotes S/S (environ 70 % des patients en France)1,2 développent la forme la plus grave de la maladie. Les premières crises osseuses surviennent chez eux dès l’âge de 6 à 9 mois. D’autres mutations, transformant la deuxième chaîne bêta de globine, sont aussi responsables de syndromes drépanocytaires majeurs (SDM). On parle alors de doubles hétérozygotes : essentiellement les formes S/C (environ 20 % en France) et S/bêtathalassémie (environ 10 %) [l’anomalie est ici quantitative par défaut de production de l’autre chaîne bêta]. Ces différentes formes n’ont pas la même gravité clinique, ni la même concentration basale d’hémoglobine (Hb), ni la même espérance de vie (tableau ).
Ces différents génotypes sont répartis très diversement autour du globe. Par exemple, près de 50 % des patients avec SDM sont de génotype SC dans certains pays d’Afrique de l’Ouest comme le Burkina Faso, le Ghana ou le Togo.3 Il existe aussi une sur-représentation des génotypes SC aux Antilles (37 % des nouveau-nés avec SDM en Guyane, par exemple).2
Ces différents génotypes sont répartis très diversement autour du globe. Par exemple, près de 50 % des patients avec SDM sont de génotype SC dans certains pays d’Afrique de l’Ouest comme le Burkina Faso, le Ghana ou le Togo.3 Il existe aussi une sur-représentation des génotypes SC aux Antilles (37 % des nouveau-nés avec SDM en Guyane, par exemple).2
Une épidémiologie liée aux mouvements migratoires mondiaux à travers les siècles
Si la maladie a été décrite pour la première fois en 1910 par l’Américain James Herrick, la mutation génétique remonte à plus de 7 200 ans. La pression de sélection a, dans ces temps anciens, fait émerger le trait drépanocytaire S (un seul des deux allèles des chaînes bêta de globine muté) comme facteur protecteur de formes graves de paludisme dans les pays à forte endémicité du parasite.4 Parmi les nombreuses mutations conférant une protection relative contre le paludisme (déficit en G6PD, thalassémie, trait AC…), le trait AS est le plus fortement associé à une baisse de la mortalité comparée à celle des sujets avec hémoglobine normale (AA). Les patients avec SDM, infectés par le Plasmodium, ont en revanche une mortalité accrue par rapport à des sujets sains, du fait notamment de l’aggravation de l’anémie et du déclenchement de crises graves secondaires à l’infection palustre.5 Une crise de paludisme est donc une situation très dangereuse chez les patients avec SDM.
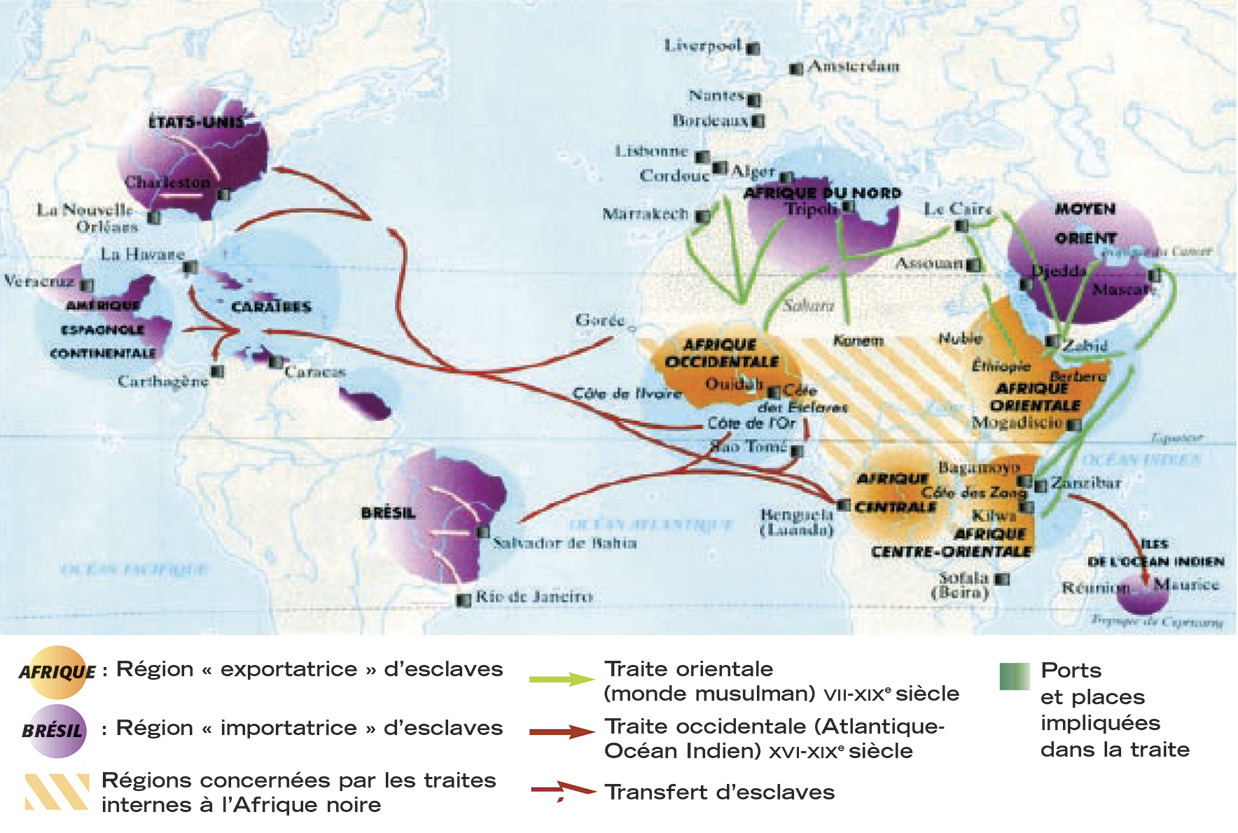
La recrudescence de cette maladie en France depuis une vingtaine d’années ne peut se comprendre que par les mouvements migratoires mondiaux à travers les siècles. La traite des esclaves entre l’Afrique et le Nouveau Monde du XVe au XVIIIe siècle a disséminé le trait AS en Amérique du Nord, au Brésil et aux Antilles (fig. 1 ). Cela explique que les sujets originaires des Antilles sont touchés par la maladie depuis plusieurs siècles.
L’augmentation du nombre de malades en France métropolitaine est plus récente. Elle est la conjonction d’une migration intranationale et de population en provenance d’Afrique subsaharienne. Entre 1963 et 1982, le Bureau pour le développement des migrations dans les départements d’outre-mer (Bumidom) a organisé, à la demande du général de Gaulle, du fait d’un taux de chômage important dans ces territoires ultramarins, le transfert de jeunes actifs de ces territoires vers l’Hexagone, essentiellement en région parisienne.
Depuis les années 1960, avec une accélération en 1990, l’immigration nouvelle de populations en provenance d’Afrique subsaharienne en Europe s’est concentrée autour des grandes capitales ayant d’anciennes colonies, particulièrement Paris, Londres et Bruxelles.6 Parmi ces populations, des sujets porteurs du trait drépanocytaire (entre 10 et 25 % selon les pays d’origine, le plus souvent sans le savoir) ont ensuite donné naissance à des enfants drépanocytaires, dès les années 1970-1980, et avec une accélération dans les années 1990.
La recrudescence de cette maladie en France depuis une vingtaine d’années ne peut se comprendre que par les mouvements migratoires mondiaux à travers les siècles. La traite des esclaves entre l’Afrique et le Nouveau Monde du XVe au XVIIIe siècle a disséminé le trait AS en Amérique du Nord, au Brésil et aux Antilles (
L’augmentation du nombre de malades en France métropolitaine est plus récente. Elle est la conjonction d’une migration intranationale et de population en provenance d’Afrique subsaharienne. Entre 1963 et 1982, le Bureau pour le développement des migrations dans les départements d’outre-mer (Bumidom) a organisé, à la demande du général de Gaulle, du fait d’un taux de chômage important dans ces territoires ultramarins, le transfert de jeunes actifs de ces territoires vers l’Hexagone, essentiellement en région parisienne.
Depuis les années 1960, avec une accélération en 1990, l’immigration nouvelle de populations en provenance d’Afrique subsaharienne en Europe s’est concentrée autour des grandes capitales ayant d’anciennes colonies, particulièrement Paris, Londres et Bruxelles.6 Parmi ces populations, des sujets porteurs du trait drépanocytaire (entre 10 et 25 % selon les pays d’origine, le plus souvent sans le savoir) ont ensuite donné naissance à des enfants drépanocytaires, dès les années 1970-1980, et avec une accélération dans les années 1990.
Augmentation du nombre de patients atteints de drépanocytose en France
Dépistage néonatal universel depuis janvier 2023
En France, le dépistage néonatal sur test buvard existe depuis 1984 dans les départements d’outre-mer. Depuis 1995, s’y ajoutait un ciblage des populations antillaises, africaines et méditerranéennes, dans les maternités métropolitaines. En 2023, la drépanocytose a enfin intégré le dépistage universel, ajoutée aux cinq maladies génétiques antérieurement dépistées systématiquement à la naissance (au total, 13 maladies sont dépistées depuis janvier 2023).
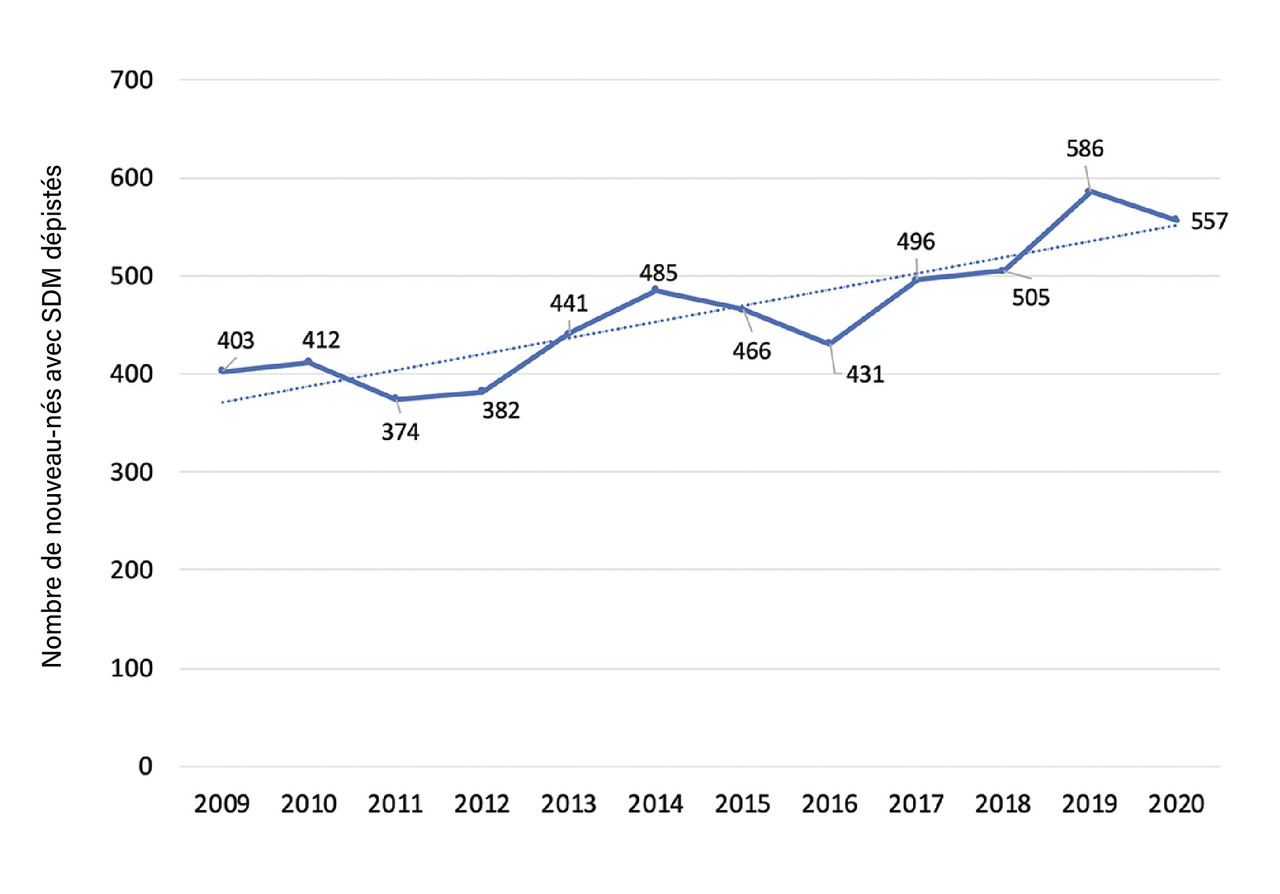
En 2020, 557 nouveau-nés avec SDM ont été dépistés, soit une incidence de 1/1 323 naissances (1/610 sur la population dépistée). Ce chiffre est passé d’une moyenne de 393 naissances par an (période 2009-2012) à 538 (période 2017-2020), soit une hausse de 44 % (fig. 2 ).2 C’est la seule maladie dépistée à la naissance dont l’incidence augmente constamment. La drépanocytose est également, et de loin, la maladie génétique la plus fréquente dépistée si on la compare, en 2020, aux 122 nouveau-nés atteints de mucoviscidose (soit plus de quatre fois moins) ou aux 292 nouveau-nés ayant une hypothyroïdie congénitale.2
À ces nouveau-nés drépanocytaires, il faut ajouter chaque année les nouveaux patients migrants ; leur nombre annuel est à peu près le même que celui des naissances, mais les données sont peu précises. En effet, 45 % des adultes drépanocytaires suivis dans le Centre national de référence de l’Hôpital européen Georges-Pompidou sont nés en Afrique (majoritairement subsaharienne), avec un âge médian d’arrivée en France de 18 ans (écart interquartile [IQR] = 13-23).1
En 2020, 557 nouveau-nés avec SDM ont été dépistés, soit une incidence de 1/1 323 naissances (1/610 sur la population dépistée). Ce chiffre est passé d’une moyenne de 393 naissances par an (période 2009-2012) à 538 (période 2017-2020), soit une hausse de 44 % (
À ces nouveau-nés drépanocytaires, il faut ajouter chaque année les nouveaux patients migrants ; leur nombre annuel est à peu près le même que celui des naissances, mais les données sont peu précises. En effet, 45 % des adultes drépanocytaires suivis dans le Centre national de référence de l’Hôpital européen Georges-Pompidou sont nés en Afrique (majoritairement subsaharienne), avec un âge médian d’arrivée en France de 18 ans (écart interquartile [IQR] = 13-23).1
Plus de la moitié des patients vivent en Île-de-France
Du fait des mouvements migratoires détaillés en introduction, en France, plus de la moitié des patients vivent en Île-de-France (51 % des naissances avec SDM en 2019).2
L’autre important lieu de vie des patients se situe aux Antilles (13 % des naissances en 2019) et dans les autres grandes métropoles françaises. C’est un exemple unique en France de maladie aussi concentrée sur un territoire.
L’autre important lieu de vie des patients se situe aux Antilles (13 % des naissances en 2019) et dans les autres grandes métropoles françaises. C’est un exemple unique en France de maladie aussi concentrée sur un territoire.
Maladie rare la plus fréquente en France
Dans une étude récente réalisée à partir de bases de données de l’Assurance maladie sur la période 2011-2016,7 on estimait, en 2016, le nombre de patients drépanocytaires entre 19 800 et 32 400. Depuis, et jusqu’au début de l’année 2023, environ 3 300 naissances supplémentaires avec SDM ont été enregistrées, mais aucune donnée ne précise le nombre de nouveaux migrants drépanocytaires arrivés durant cette période, ni le nombre de décès. On estime toutefois à environ 25 000 à 30 000 le nombre de ces patients en France en 2023. La Banque nationale de données maladies rares (BNDMR) apporte un élément supplémentaire, faisant de la drépanocytose, dans son rapport de novembre 2022 (www.bndmr.fr), la première maladie rare en France parmi plus de 4 600 maladies rares (9 828 patients avec SDM [75 % de SS] renseignés dans la base qui est non exhaustive car essentiellement implémentée par les centres de référence).
Par ailleurs, le dépistage néonatal permet de dépister chaque année un nombre très important de nouveau-nés AS (11 600 en 2019), soit une incidence de 1/30 naissances en population ciblée.2 Cela permet, en considérant qu’au minimum un des parents est porteur et vit sur le territoire français, d’estimer le nombre de porteurs du gène à plus de 400 000 sujets en France (données personnelles), sans compter les sujets avec traits AC ou bêtathalassémiques.
Par ailleurs, le dépistage néonatal permet de dépister chaque année un nombre très important de nouveau-nés AS (11 600 en 2019), soit une incidence de 1/30 naissances en population ciblée.2 Cela permet, en considérant qu’au minimum un des parents est porteur et vit sur le territoire français, d’estimer le nombre de porteurs du gène à plus de 400 000 sujets en France (données personnelles), sans compter les sujets avec traits AC ou bêtathalassémiques.
Un besoin croissant d’hospitalisations
Dans un rapport de 2011 de la Direction de la recherche, des études, de l’évaluation et des statistiques (DREES) sur l’état de santé de la population en France (p. 316), les auteurs notaient que le nombre de patients drépanocytaires hospitalisés au moins une fois dans l’année augmentait annuellement de 7,2 % entre 2004 et 2009.8 Depuis cette époque, les chiffres du Programme de médicalisation des systèmes d’information (PMSI) dont nous disposons (non publiés) sont éloquents : le nombre de séjours de patients hospitalisés avec code « drépanocytose » en diagnostic principal ou relié (DP ou DR) a plus que doublé, passant de 9 200 en 2010 à 21 600 en 2017, avec une augmentation presque linéaire. Cette évolution des hospitalisations est un reflet de l’augmentation du nombre de patients, à la fois due à une augmentation du nombre de naissances et à l’arrivée de nouveaux patients en France, et d’une meilleure prise en charge de la maladie, avec recul de l’âge au décès. Cela a une répercussion sur le parcours de soins des patients car un grand nombre de ces hospitalisations se font via un passage aux urgences pour gérer la crise douloureuse, avec la nécessité de trouver des lits d’aval de pédiatrie ou de médecine adulte. De plus, ces hospitalisations sont réalisées massivement en Île-de-France ou aux Antilles, ce qui n’est pas sans poser des problèmes de prise en charge dans ces territoires mal préparés à ces changements démographiques brutaux et ayant des hôpitaux en forte tension de lits et de personnels soignants. En outre, la drépanocytose n’est toujours pas au programme de l’examen classant national. Ainsi, les personnels médicaux et paramédicaux formés manquent. Un grand plan, au minimum régional mais au mieux national, semble nécessaire pour faire face à l’afflux de malades, qui ne va cesser de croître.
L’âge médian au décès augmente
L’espérance de vie en France de ces patients est très difficile à évaluer aujourd’hui ; il n’existe pas d’étude spécifique sur ce sujet. De plus, un grand nombre de progrès thérapeutiques arrivent et pourront changer les données (voir « Perspectives thérapeutiques dans la drépanocytose » p. 535 ).
Comme dans la plupart des pays développés, la prise en charge précoce et standardisée qui suit le dépistage néonatal a permis de réduire la mortalité dans la période infantile (inférieure à 5 % pour les moins de 18 ans). Cela s’accompagne, avec l’âge, d’un accroissement des lésions chroniques d’organes grevant, pour de nombreux malades, la qualité et l’espérance de vie. Une analyse de cohortes adultes de plusieurs centaines de patients suivis en centres experts, d’âge médian autour de 30 ans, en Amérique et en Europe, retrouve une mortalité chez les patients homozygotes de 8 à 15 % à 5 ans, ce qui est proche de celle d’un lymphome hodgkinien découvert au même âge (données personnelles, communication orale). La maladie reste donc grave chez l’adulte en 2023. L’âge médian au décès a cependant nettement augmenté sur deux périodes, passant de 18 ans en 1981-1985 à 35 ans (IQR = 22-52) en 2001-2005 en France métropolitaine.9
Aux États-Unis, on observe les mêmes évolutions, avec un âge médian au décès passé de 28 ans en 1979 à 43 ans en 2017,10 rendant compte de la baisse importante de la mortalité infantile.
Dans une étude plus récente, la mortalité annuelle des patients drépanocytaires de plus de 16 ans en France était de 1 % par an.11 Un des facteurs bien identifiés d’augmentation de risque de décès à un âge jeune est le nombre annuel d’hospitalisations pour crises. Cela doit inciter à intensifier les traitements chez ces patients régulièrement hospitalisés, et à ne pas banaliser ces hospitalisations.
Les causes principales de mort chez l’adulte drépanocytaire sont le syndrome thoracique aigu, les infections et l’évolution de lésions chroniques (rein et cœur notamment). Chez l’enfant, le risque essentiel pour les sujets homozygotes en France est l’accident vasculaire cérébral, source de morbidité importante. La drépanocytose est, en 2023, la première cause d’accident vasculaire cérébral de l’enfant et de l’adulte jeune en France.
Comme dans la plupart des pays développés, la prise en charge précoce et standardisée qui suit le dépistage néonatal a permis de réduire la mortalité dans la période infantile (inférieure à 5 % pour les moins de 18 ans). Cela s’accompagne, avec l’âge, d’un accroissement des lésions chroniques d’organes grevant, pour de nombreux malades, la qualité et l’espérance de vie. Une analyse de cohortes adultes de plusieurs centaines de patients suivis en centres experts, d’âge médian autour de 30 ans, en Amérique et en Europe, retrouve une mortalité chez les patients homozygotes de 8 à 15 % à 5 ans, ce qui est proche de celle d’un lymphome hodgkinien découvert au même âge (données personnelles, communication orale). La maladie reste donc grave chez l’adulte en 2023. L’âge médian au décès a cependant nettement augmenté sur deux périodes, passant de 18 ans en 1981-1985 à 35 ans (IQR = 22-52) en 2001-2005 en France métropolitaine.9
Aux États-Unis, on observe les mêmes évolutions, avec un âge médian au décès passé de 28 ans en 1979 à 43 ans en 2017,10 rendant compte de la baisse importante de la mortalité infantile.
Dans une étude plus récente, la mortalité annuelle des patients drépanocytaires de plus de 16 ans en France était de 1 % par an.11 Un des facteurs bien identifiés d’augmentation de risque de décès à un âge jeune est le nombre annuel d’hospitalisations pour crises. Cela doit inciter à intensifier les traitements chez ces patients régulièrement hospitalisés, et à ne pas banaliser ces hospitalisations.
Les causes principales de mort chez l’adulte drépanocytaire sont le syndrome thoracique aigu, les infections et l’évolution de lésions chroniques (rein et cœur notamment). Chez l’enfant, le risque essentiel pour les sujets homozygotes en France est l’accident vasculaire cérébral, source de morbidité importante. La drépanocytose est, en 2023, la première cause d’accident vasculaire cérébral de l’enfant et de l’adulte jeune en France.
Moins de cas dans les autres pays à revenus élevés
Les États-Unis comptent environ 100 000 patients drépanocytaires, avec près de 2 000 naissances par an. L’espérance de vie à la naissance y a été estimée récemment à 54 ans pour des enfants nés en 2015, quel que soit le sexe, soit 22 ans de moins qu’une population contrôle.12
L’Europe compte entre 55 000 et 65 000 patients. La France regroupe environ la moitié des patients européens, suivie par le Royaume-Uni (lieu de vie prédominant dans la région londonienne) avec environ 14 000 patients13 et 1 naissance sur 2 742, soit 262 naissances annuelles en 2019-2020 avec, contrairement à la France, une très grande stabilité des naissances.14 La Grèce, l’Italie, l’Allemagne et la Belgique se situent loin derrière (moins de 5 000 patients pour chaque pays). Les prises en charge sont assez proches dans tous ces pays.
L’autre pays de niveau intermédiaire de revenus touché de façon importante par la maladie est le Brésil, qui compterait plus de 100 000 patients et 3 500 naissances annuelles.
L’Europe compte entre 55 000 et 65 000 patients. La France regroupe environ la moitié des patients européens, suivie par le Royaume-Uni (lieu de vie prédominant dans la région londonienne) avec environ 14 000 patients13 et 1 naissance sur 2 742, soit 262 naissances annuelles en 2019-2020 avec, contrairement à la France, une très grande stabilité des naissances.14 La Grèce, l’Italie, l’Allemagne et la Belgique se situent loin derrière (moins de 5 000 patients pour chaque pays). Les prises en charge sont assez proches dans tous ces pays.
L’autre pays de niveau intermédiaire de revenus touché de façon importante par la maladie est le Brésil, qui compterait plus de 100 000 patients et 3 500 naissances annuelles.
Inde et Afrique, épicentres de la maladie
Les travaux du chercheur géographe anglais Frédéric Piel ont apporté au cours des vingt dernières années des données épidémiologiques importantes sur l’estimation des naissances dans les pays à faibles revenus et leur évolution prévisible pour les trente prochaines années. Il a ainsi estimé que le nombre de naissances dans le monde pourrait augmenter de plus de 300 000 naissances homozygotes par an en 2013 (5,5 millions de AS) et à 400 000 par an en 2050. Les deux tiers de ces naissances surviennent en Afrique subsaharienne, dont la moitié est francophone.15 Deux pays d’Afrique centrale, le Nigeria et la République démocratique du Congo, ont la plus forte prévalence du fait de leur importante population. Environ 1 % des naissances de ces deux pays concernent des patients avec SDM. L’Inde est l’autre pays avec le plus grand nombre de naissances de patients drépanocytaires.15
Le nombre actuel de malades vivant avec un SDM en Afrique est beaucoup plus complexe à établir tant la mortalité est très variable suivant les régions ; il n’existe aucun registre ni dépistage systématique, et un grand nombre de patients non diagnostiqués meurent de paludisme à un âge jeune. On peut cependant estimer avec prudence le nombre de patients vivant avec un SDM en Afrique entre 5 et 15 millions en 2023. Les porteurs sains A/S se comptent, eux, en centaines de millions.
L’accès aux soins de ces patients est payant dans les pays d’Afrique subsaharienne ; l’hydroxyurée est ainsi très peu prescrite car non remboursée et peu disponible dans les pharmacies. Tout cela concourt à une mortalité très élevée. Dans une étude prospective kényane, des chercheurs ont dépisté systématiquement les nouveau-nés pour cette maladie et ont comparé la mortalité de ceux qui avaient la drépanocytose (n = 128) à ceux sans cette maladie et nés dans la même région. La drépanocytose touchait 0,8 % des naissances. Après cinq ans de suivi, alors même que ces patients étaient privilégiés par un dépistage néonatal et un accès précoce aux vaccinations et à l’antibiothérapie préventive (mais pas à l’hydroxyurée), 29 % des enfants drépanocytaires étaient morts, soit plus de vingt fois plus que dans la population contrôle.16 Une étude récente réalisée dans cinq pays d’Afrique francophone met en évidence une mortalité des patients drépanocytaires moins élevée que celle issue d’estimations antérieures. Cependant, la mortalité reste très importante, surtout si on considère que l’étude a été réalisée à partir de centres universitaires de référence optimisant la prise en charge : mortalité des enfants drépanocytaires de 36,4 % à 5 ans et de 43,3 % à 10 ans (risque relatif de 6 par rapport aux contrôles).17
Le nombre actuel de malades vivant avec un SDM en Afrique est beaucoup plus complexe à établir tant la mortalité est très variable suivant les régions ; il n’existe aucun registre ni dépistage systématique, et un grand nombre de patients non diagnostiqués meurent de paludisme à un âge jeune. On peut cependant estimer avec prudence le nombre de patients vivant avec un SDM en Afrique entre 5 et 15 millions en 2023. Les porteurs sains A/S se comptent, eux, en centaines de millions.
L’accès aux soins de ces patients est payant dans les pays d’Afrique subsaharienne ; l’hydroxyurée est ainsi très peu prescrite car non remboursée et peu disponible dans les pharmacies. Tout cela concourt à une mortalité très élevée. Dans une étude prospective kényane, des chercheurs ont dépisté systématiquement les nouveau-nés pour cette maladie et ont comparé la mortalité de ceux qui avaient la drépanocytose (n = 128) à ceux sans cette maladie et nés dans la même région. La drépanocytose touchait 0,8 % des naissances. Après cinq ans de suivi, alors même que ces patients étaient privilégiés par un dépistage néonatal et un accès précoce aux vaccinations et à l’antibiothérapie préventive (mais pas à l’hydroxyurée), 29 % des enfants drépanocytaires étaient morts, soit plus de vingt fois plus que dans la population contrôle.16 Une étude récente réalisée dans cinq pays d’Afrique francophone met en évidence une mortalité des patients drépanocytaires moins élevée que celle issue d’estimations antérieures. Cependant, la mortalité reste très importante, surtout si on considère que l’étude a été réalisée à partir de centres universitaires de référence optimisant la prise en charge : mortalité des enfants drépanocytaires de 36,4 % à 5 ans et de 43,3 % à 10 ans (risque relatif de 6 par rapport aux contrôles).17
L’expansion de la drépanocytose nécessite des ressources médicales
La drépanocytose est une maladie en forte expansion démographique en France et dans le monde. On ne devrait plus la considérer comme rare en France. Le recours hospitalier pour la gestion des crises ne cesse de croître et pose des problèmes dans un système hospitalier mal préparé à accueillir ces patients, notamment par manque de formation. En parallèle, l’Afrique manque cruellement de ressources pour offrir aux patients les soins minimaux qu’ils méritent et l’accès au traitement de base de la maladie, l’hydroxyurée, pourtant peu onéreux et bénéficiant d’un excellent profil de tolérance.
Références
1. Honsel V, Khimoud D, Ranque B, Offredo L, Joseph L, Pouchot J, et al. Comparison between adult patients with sickle cell disease of sub-saharan african origin born in metropolitan France and in sub-saharan Africa. J Clin Med 2019;8:2173.
2. Programme national du dépistage néonatal. Rapport d’activité 2020. https://vu.fr/esVO
3. Devoucoux R, Hurpin C, Baudon D, Molez JF, Roux JF, Guilloud-Bataille M, et al. Population genetics of abnormal haemoglobins in Burkina Faso, west Africa. Ann Hum Biol 1991;18:295-302.
4. Shriner D, Rotimi CN. Whole-genome-sequence-based haplotypes reveal single origin of the sickle allele during the holocene wet phase. Am J Hum Genet 2018;102:547-56.
5. Allison AC. Genetic control of resistance to human malaria. Curr Opin Immunol 2009;21:499-505.
6. Piel FB, Tatem AJ, Huang Z, Gupta S, Williams TN, Weatherall DJ, et al. Global migration and the changing distribution of sickle haemoglobin: A quantitative study of temporal trends between 1960 and 2000. Lancet Glob Health 2014;2:e80-9.
7. Leleu H, Arlet JB, Habibi A, Etienne-Julan M, Khellaf M, Adjibi Y, et al. Epidemiology and disease burden of sickle cell disease in France: A descriptive study based on a French nationwide claim database. PLoS One 2021;16:e0253986.
8. L’état de santé de la population en France. Rapport 2011. Direction de la recherche, des études, de l’évaluation et des statistiques. https://vu.fr/UDvP
9. Suzan F, Paty AC. Études descriptives de la mortalité et des hospitalisations liées à la drépanocytose en France. Bull Epidémiol Hebd 2012;(27-28):317-20.
10. Payne AB, Mehal JM, Chapman C, Haberling DL, Richardson LC, Bean CJ, et al. Trends in sickle cell disease-related mortality in the United States, 1979 to 2017. Ann Emerg Med 2020;76:S28-S36.
11. Arlet JB, Lennon H, Bailey M, Herquelot E, Lamarsalle L, Raguideau F, et al. Association between hospitalised vaso-occlusive crises and acute/chronic complications in sickle cell disease patients aged 16 years and older using the French National Health Insurance Database (SNDS). Blood 2021;138:3107.
12. Lubeck D, Agodoa I, Bhakta N, Danese M, Pappu K, Howard R, et al. Estimated life expectancy and income of patients with sickle cell disease compared with those without sickle cell disease. JAMA Netw Open 2019;2:e1915374.
13. Dormandy E, James J, Inusa B, Rees D. How many people have sickle cell disease in the UK? J Public Health (Oxf) 2018;4:e291-e295.
14. Sickle cell and thalassaemia screening: Data report 2019 to 2020. Published 13 April 2022. www.gov.uk. https://vu.fr/LTrS
15. Piel FB, Patil AP, Howes RE, Nyangiri OA, Gething PW, Dewi M, et al. Global epidemiology of sickle haemoglobin in neonates: A contemporary geostatistical model-based map and population estimates. Lancet 2013;381:142-51.
16. Uyoga S, Macharia AW, Mochamah G, Ndila CM, Nyutu G, Makale J, et al. The epidemiology of sickle cell disease in children recruited in infancy in Kilifi, Kenya: A prospective cohort study. Lancet Glob Health 2019;7(10):e1458-e1466.
17. Ranque B, Kitenge R, Ndiaye DD, BA MD, Adjoumani L, Traore H, et al. Estimating the risk of child mortality attributable to sickle cell anaemia in sub-Saharan Africa: A retrospective, multicentre, case-control study. Lancet Haematol 2022;9(3):e208-e216.
2. Programme national du dépistage néonatal. Rapport d’activité 2020. https://vu.fr/esVO
3. Devoucoux R, Hurpin C, Baudon D, Molez JF, Roux JF, Guilloud-Bataille M, et al. Population genetics of abnormal haemoglobins in Burkina Faso, west Africa. Ann Hum Biol 1991;18:295-302.
4. Shriner D, Rotimi CN. Whole-genome-sequence-based haplotypes reveal single origin of the sickle allele during the holocene wet phase. Am J Hum Genet 2018;102:547-56.
5. Allison AC. Genetic control of resistance to human malaria. Curr Opin Immunol 2009;21:499-505.
6. Piel FB, Tatem AJ, Huang Z, Gupta S, Williams TN, Weatherall DJ, et al. Global migration and the changing distribution of sickle haemoglobin: A quantitative study of temporal trends between 1960 and 2000. Lancet Glob Health 2014;2:e80-9.
7. Leleu H, Arlet JB, Habibi A, Etienne-Julan M, Khellaf M, Adjibi Y, et al. Epidemiology and disease burden of sickle cell disease in France: A descriptive study based on a French nationwide claim database. PLoS One 2021;16:e0253986.
8. L’état de santé de la population en France. Rapport 2011. Direction de la recherche, des études, de l’évaluation et des statistiques. https://vu.fr/UDvP
9. Suzan F, Paty AC. Études descriptives de la mortalité et des hospitalisations liées à la drépanocytose en France. Bull Epidémiol Hebd 2012;(27-28):317-20.
10. Payne AB, Mehal JM, Chapman C, Haberling DL, Richardson LC, Bean CJ, et al. Trends in sickle cell disease-related mortality in the United States, 1979 to 2017. Ann Emerg Med 2020;76:S28-S36.
11. Arlet JB, Lennon H, Bailey M, Herquelot E, Lamarsalle L, Raguideau F, et al. Association between hospitalised vaso-occlusive crises and acute/chronic complications in sickle cell disease patients aged 16 years and older using the French National Health Insurance Database (SNDS). Blood 2021;138:3107.
12. Lubeck D, Agodoa I, Bhakta N, Danese M, Pappu K, Howard R, et al. Estimated life expectancy and income of patients with sickle cell disease compared with those without sickle cell disease. JAMA Netw Open 2019;2:e1915374.
13. Dormandy E, James J, Inusa B, Rees D. How many people have sickle cell disease in the UK? J Public Health (Oxf) 2018;4:e291-e295.
14. Sickle cell and thalassaemia screening: Data report 2019 to 2020. Published 13 April 2022. www.gov.uk. https://vu.fr/LTrS
15. Piel FB, Patil AP, Howes RE, Nyangiri OA, Gething PW, Dewi M, et al. Global epidemiology of sickle haemoglobin in neonates: A contemporary geostatistical model-based map and population estimates. Lancet 2013;381:142-51.
16. Uyoga S, Macharia AW, Mochamah G, Ndila CM, Nyutu G, Makale J, et al. The epidemiology of sickle cell disease in children recruited in infancy in Kilifi, Kenya: A prospective cohort study. Lancet Glob Health 2019;7(10):e1458-e1466.
17. Ranque B, Kitenge R, Ndiaye DD, BA MD, Adjoumani L, Traore H, et al. Estimating the risk of child mortality attributable to sickle cell anaemia in sub-Saharan Africa: A retrospective, multicentre, case-control study. Lancet Haematol 2022;9(3):e208-e216.
Dans cet article
- Une épidémiologie liée aux mouvements migratoires mondiaux à travers les siècles
- Augmentation du nombre de patients atteints de drépanocytose en France
- Moins de cas dans les autres pays à revenus élevés
- Inde et Afrique, épicentres de la maladie
- L’expansion de la drépanocytose nécessite des ressources médicales