Dans cet article, nous développerons l’épidémiologie du diabète de type 1 et de ses compli- cations, en se focalisant en particulier sur les sujets jeunes.
Épidémiologie du diabète de type 1
L’épidémiologie du diabète de type 1 est surtout décrite chez les sujets jeunes, essentiellement parce qu’un sujet de moins de 20 ans qui a un diabète nécessitant de l’insuline a obligatoirement un type 1, très majoritairement auto-immun, les autres types de diabète étant très rares chez le sujet jeune. Chez l’adulte, le fait d’avoir un diabète traité par insuline ne signifie pas « type 1 », puisque dans les bases de données il est en général très difficile de distinguer le vrai « type 1 » du « type 2 » devenu insulinorequérant. Les données statistiques couvrent donc aussi bien le diabète de type 1 que de type 2. On estime chez l’adulte que le diabète de type 1 représente 10 % de l’ensemble des diabètes, soit 0,3 à 0,5 % de la population adulte.
Dans le monde, chez l’enfant
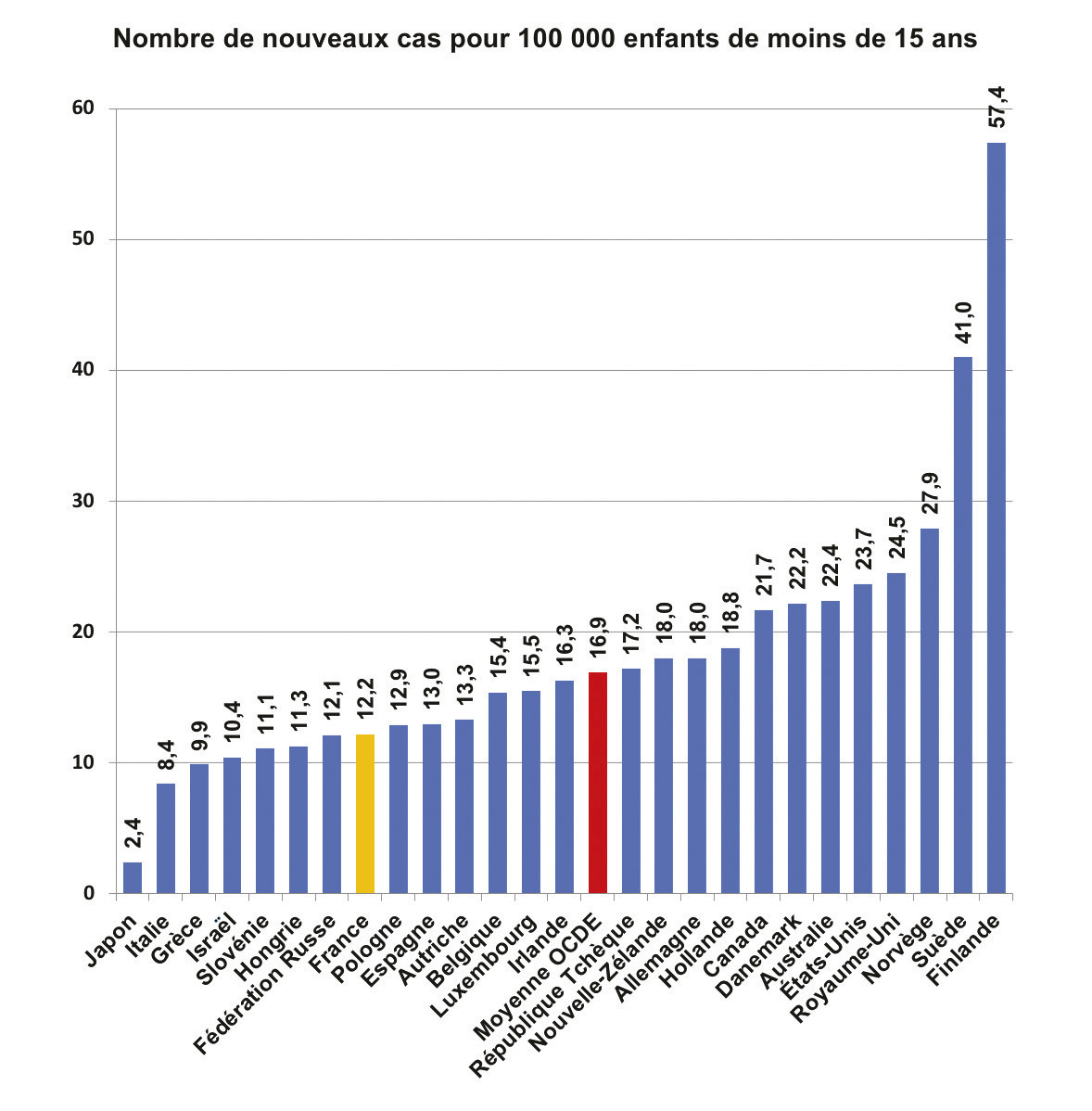
Il existe d’importantes variations géographiques concernant les taux d’incidence du diabète de type 1 chez l’enfant (fig. 1).1, 2 Les pays européens obéissent globalement à un gradient nord-sud et ouest-est : les taux d’incidence du diabète de type 1 sont élevés dans le nord et le nord-ouest de l’Europe et bas en Europe centrale, de l’Est et du Sud. Selon les résultats de l’étude Eurodiab, l’incidence annuelle du diabète de type 1 était maximale en Finlande, et une des plus faibles en Italie.3 Certains pays ne s’inscrivaient cependant pas dans ce gradient : le taux d’incidence de la Sardaigne (37,8 pour 100 000) était bien plus élevé que celui de l’Italie, possiblement en raison d’un isolat de population ayant une prédisposition génétique accrue.3 Enfin, la variation d’incidence annuelle a montré que dans certains pays (dont la France), on observait une augmentation d’incidence assez forte chaque année (> 2 %), alors que dans d’autres pays (comme l’Espagne ou la Norvège), cette incidence était stabilisée.3
En France, chez l’enfant
En France, des données d’incidence ont pu être estimées à partir de 1988.3, 4 Un registre fondé sur quatre régions (Aquitaine, Lorraine, Haute et Basse-Normandie) a permis l’estimation du taux d’incidence nationale du diabète de type 1 jusqu’en 1997.4 Chez les jeunes de moins de 20 ans, une augmentation d’incidence de 7,4 à 9,6 pour 100 000 jeunes par an a été mesurée entre 1988 et 1997, ce qui correspondait à une augmentation de 4,2 % par an pour le sous-groupe âgé de moins de 15 ans. La plus forte augmentation de l’incidence était observée chez les enfants de moins de 5 ans, avec des taux augmentant de 4,2 à 7,5 pour 100 000 par an entre 1988 et 1997, alors que l’incidence était restée stable chez les jeunes de 15 à 19 ans.4 Puis une seule de ces régions, l’Aquitaine, a maintenu un registre entre 1998 et 2004.5 L’incidence chez les jeunes de moins de 15 ans augmentait régulièrement, pour atteindre 13,5 pour 100 000 en 2004,5 correspondant à une augmentation annuelle de 3,3 %. Entre 1987 et 2004, ces sources étaient les seules à permettre une estimation de l’incidence cumulée du diabète de type 1 chez l’enfant en France : on estimait ainsi qu’il touchait environ 1 jeune de moins de 15 ans sur 1 000 dans les années 2000.
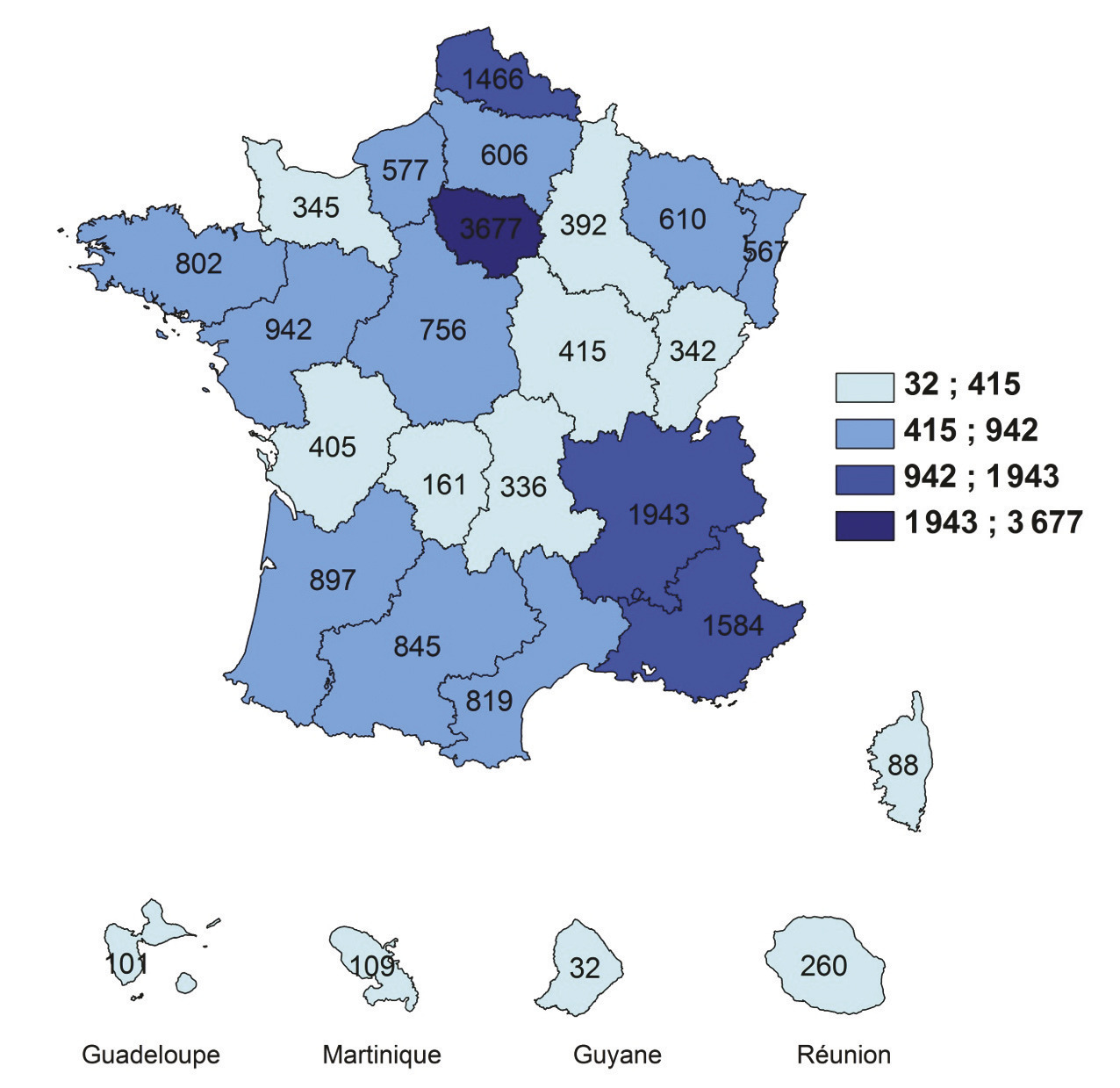
L’accès récent aux bases de données médico-administratives permet maintenant une « photographie » de la prévalence et de l’incidence du diabète sur le territoire national. Ces données ont permis d’estimer que la prévalence du diabète était de l’ordre de 1,3 pour 1 000 jeunes de moins de 20 ans en 2013.6 Les effectifs régionaux sont indiqués dans la figure 2, le total étant de 19 127 (France entière, régime général). En ce qui concerne l’incidence annuelle,7 elle était de 18 pour 100 000 jeunes de moins de 15 ans (entre 2013 et 2015, France entière, tous régimes), avec un ratio garçon/fille de 1,13. Les enfants de moins de 5 ans, de 5 à 9 ans, et de 10 à 14 ans représentaient respectivement 22 %, 36 %, et 42 % des nouveaux cas de diabète avant 15 ans.
L’accès récent aux bases de données médico-administratives permet maintenant une « photographie » de la prévalence et de l’incidence du diabète sur le territoire national. Ces données ont permis d’estimer que la prévalence du diabète était de l’ordre de 1,3 pour 1 000 jeunes de moins de 20 ans en 2013.6 Les effectifs régionaux sont indiqués dans la figure 2, le total étant de 19 127 (France entière, régime général). En ce qui concerne l’incidence annuelle,7 elle était de 18 pour 100 000 jeunes de moins de 15 ans (entre 2013 et 2015, France entière, tous régimes), avec un ratio garçon/fille de 1,13. Les enfants de moins de 5 ans, de 5 à 9 ans, et de 10 à 14 ans représentaient respectivement 22 %, 36 %, et 42 % des nouveaux cas de diabète avant 15 ans.
Épidémiologie des complications du diabète de type 1
Réduction des risques associée à l’intensification du traitement
Les complications microangiopathiques sont les plus fréquentes et les plus précoces (rétinopathie, neuropathie, néphropathie diabétiques). Les complications macroangiopathiques sont plus rares. Les grandes études épidémiologiques telles que le Diabetes Control and Complications Trial (DCCT) et l’Epidemiology of Diabetes Interventions and Complications (EDIC) ont démontré le rôle de l’hyperglycémie chronique sur le développement de ces complications et l’effet positif d’un bon équilibre glycémique à long terme.8-11
Dans ces études, le risque de développer une néphropathie diabétique diminue de 34-39 %, une neuropathie de 60 %, une rétinopathie de près de 50-76 % à 7,5 ans lorsque le traitement est intensifié (et que l’hémoglobine glyquée [HbA1c] est autour de 7,2 %), par comparaison à un traitement non intensifié associé à une HbA1c moyenne de 9,1 %.8-11 Pour la macroangiopathie, un traitement intensif, aboutissant à une HbA1c moyenne proche de 7,2 % pendant 6,5 années (et autour de 8 % les années suivantes) diminuait la fréquence des compli- cations cardiovasculaires à 17 ans de 42 %, et à 30 ans de 30 %.11, 12 La réduction du risque avec la réduction de l’HbA1c a été parfaitement démontrée.
Dans ces études, le risque de développer une néphropathie diabétique diminue de 34-39 %, une neuropathie de 60 %, une rétinopathie de près de 50-76 % à 7,5 ans lorsque le traitement est intensifié (et que l’hémoglobine glyquée [HbA1c] est autour de 7,2 %), par comparaison à un traitement non intensifié associé à une HbA1c moyenne de 9,1 %.8-11 Pour la macroangiopathie, un traitement intensif, aboutissant à une HbA1c moyenne proche de 7,2 % pendant 6,5 années (et autour de 8 % les années suivantes) diminuait la fréquence des compli- cations cardiovasculaires à 17 ans de 42 %, et à 30 ans de 30 %.11, 12 La réduction du risque avec la réduction de l’HbA1c a été parfaitement démontrée.
Rétinopathie : risque absolu, risque relatif
Dans l’étude DCCT, le risque de développer une rétinopathie après 14 ans de diabète était de 12 % dans le groupe traité intensivement (HbA1c moyenne proche de 7 %), et de 54 % dans le groupe traité conventionnellement (HbA1c moyenne proche de 9 %),12 et le risque de progression augmentait de 1 % par an pour une HbA1c, de 5,5 % à 10 % par an pour une HbA1c de 10,5 %.8 Dans l’étude DCCT-EDIC, après 30 ans d’évolution du diabète (chez des sujets âgés de 50 ans en moyenne), avec l’intensifi- cation du traitement (aboutissant à une HbA1c autour de 8 % en moyenne sur l’ensemble du suivi), la fréquence de la rétinopathie sévère (nécessitant un traitement par laser) était de près de 15 %, et la présence de micro- anévrismes uniquement de 37 %.12 La prévalence de la rétinopathie (sévère et non sévère) est estimée entre 50 et 70 % chez les diabétiques de type 1 tout-venant (soit après 20 à 30 ans d’évolution moyenne du diabète).13-15
Dans la littérature scientifique, la description d’une rétinopathie diabétique la plus précoce a été faite chez un patient de 5 ans et demi, et la durée la plus courte d’évolution du diabète de type 1 avant une rétinopathie était de 5 ans, mais cela correspond à des cas isolés. La majorité des rétinopathies diabétiques diagnostiquées avant 18 ans sont des rétinopathies non proliférantes minimes avec un microanévrisme ou une hémorragie rétinienne unilatérale. Seuls quelques cas de rétinopathie sévère sont trouvés dans la littérature avant 18 ans.
Chez l’adulte, un risque de 5 % de développer une rétinopathie diabétique proliférante ou un œdème maculaire cliniquement significatif est observé après 4 ans en l’absence de rétinopathie initiale, après 3 ans en cas de rétinopathie diabétique minime initiale, après 6 mois en cas de rétinopathie modérée et après 3 mois en cas de rétinopathie non proliférante sévère. Pour une HbA1c de 6 %, le risque de passer de l’absence de rétinopathie à une rétinopathie diabétique proliférante ou à un œdème maculaire cliniquement significatif était de 5 % à 15 ans et de 10 % à 30 ans (augmentation linéaire avec le temps), de 10 % et 20 % respectivement si l’HbA1c était de 7 %, de 15 % et 30 % si l’HbA1c était de 8 %, et de 30 % et 60 % si l’HbA1c était de 9 %.12 Dans tous les cas, le traitement approprié de la rétinopathie a permis une qualité de vie sur le plan visuel satisfaisante.
Dans la littérature scientifique, la description d’une rétinopathie diabétique la plus précoce a été faite chez un patient de 5 ans et demi, et la durée la plus courte d’évolution du diabète de type 1 avant une rétinopathie était de 5 ans, mais cela correspond à des cas isolés. La majorité des rétinopathies diabétiques diagnostiquées avant 18 ans sont des rétinopathies non proliférantes minimes avec un microanévrisme ou une hémorragie rétinienne unilatérale. Seuls quelques cas de rétinopathie sévère sont trouvés dans la littérature avant 18 ans.
Chez l’adulte, un risque de 5 % de développer une rétinopathie diabétique proliférante ou un œdème maculaire cliniquement significatif est observé après 4 ans en l’absence de rétinopathie initiale, après 3 ans en cas de rétinopathie diabétique minime initiale, après 6 mois en cas de rétinopathie modérée et après 3 mois en cas de rétinopathie non proliférante sévère. Pour une HbA1c de 6 %, le risque de passer de l’absence de rétinopathie à une rétinopathie diabétique proliférante ou à un œdème maculaire cliniquement significatif était de 5 % à 15 ans et de 10 % à 30 ans (augmentation linéaire avec le temps), de 10 % et 20 % respectivement si l’HbA1c était de 7 %, de 15 % et 30 % si l’HbA1c était de 8 %, et de 30 % et 60 % si l’HbA1c était de 9 %.12 Dans tous les cas, le traitement approprié de la rétinopathie a permis une qualité de vie sur le plan visuel satisfaisante.
Néphropathie : risque absolu, risque relatif
Avant l’ère du traitement intensif, la prévalence de la microalbuminurie était de 20 à 30 % après 15 ans d’évolution du diabète, et la prévalence de la macroal- buminurie et de l’insuffisance rénale était de 30 % et 15 %, respectivement, après 30 ans d’évolution. Dans l’étude DCCT-EDIC, après 30 ans d’évolution du diabète (chez des sujets âgés de 50 ans en moyenne), avec l’intensifi- cation du traitement (aboutissant à une HbA1c autour de 8 % en moyenne sur l’ensemble du suivi), l’absence de néphropathie était observée chez près de 80 % des sujets, la microalbuminurie chez près de 15 %, la macroprotéinurie chez 4 %, et l’insuffisance rénale avancée chez moins de 2 %.12
Peu d’études épidémiologiques sur la prévalence de la néphropathie concernent la population pédiatrique. Dans une étude française multicentrique réalisée au- près de 702 jeunes, âgés de 18 à 21 ans, la fréquence de la microalbuminurie était de 5,1 ± 1,6 % pour une durée d’évolution du diabète de type 1 supérieure à 3 ans.16 La constatation d’une microalbuminurie chez un adolescent diabétique ne signifie pas obligatoirement une progression inexorable de la néphropathie. En effet, la micro- albuminurie peut régresser dans 30 à 60 % des cas.17, 18
Peu d’études épidémiologiques sur la prévalence de la néphropathie concernent la population pédiatrique. Dans une étude française multicentrique réalisée au- près de 702 jeunes, âgés de 18 à 21 ans, la fréquence de la microalbuminurie était de 5,1 ± 1,6 % pour une durée d’évolution du diabète de type 1 supérieure à 3 ans.16 La constatation d’une microalbuminurie chez un adolescent diabétique ne signifie pas obligatoirement une progression inexorable de la néphropathie. En effet, la micro- albuminurie peut régresser dans 30 à 60 % des cas.17, 18
Neuropathie : risque absolu, risque relatif
Dans l’étude DCCT, le risque de neuropathie clinique était réduit de 60 % avec le traitement intensif : il était de 6 % à l’entrée dans l’étude (soit après 5 ans d’évolution moyenne du diabète), de 9 % après 7 ans de traitement intensif contre 18 % après de 7 ans de traitement conventionnel. Enfin, dans l’étude DCCT-EDIC, après 30 ans d’évolution du diabète (chez des sujets âgés de 50 ans en moyenne), avec l’intensification du traitement (aboutissant à une HbA1c autour de 8 % en moyenne sur l’ensemble du suivi), la prévalence de la neuropathie clinique était de 24 %.12
L’incidence de la neuropathie symptomatique chez l’enfant est très rare avant la puberté ou après 1 à 2 ans d’évolution de diabète.19 Lorsqu’elle est dépistée de manière systématique (sensibilité vibratoire et mono- filament), sa prévalence est de l’ordre de 8 à 20 % chez l’enfant.20
L’incidence de la neuropathie symptomatique chez l’enfant est très rare avant la puberté ou après 1 à 2 ans d’évolution de diabète.19 Lorsqu’elle est dépistée de manière systématique (sensibilité vibratoire et mono- filament), sa prévalence est de l’ordre de 8 à 20 % chez l’enfant.20
Complications macrovasculaires : risque absolu, risque relatif
Les études DCCT et EDIC ont également prouvé qu’un traitement intensif pendant 6 ans et demi réduisait le risque de faire un événement cardiovasculaire de 30 % avec un effet qui reste bénéfique 20 ans après. À la fin de l’étude DCCT-EDIC, après 30 ans d’évolution du diabète (chez des sujets âgés de 50 ans en moyenne), avec l’intensification du traitement (aboutissant à une HbA1c autour de 8 % en moyenne sur l’ensemble du suivi), l’incidence d’événements cardiovasculaires était de 0,38 % patient- année : 46 événements chez 31 patients d’une cohorte de 620 sujets, contre 98 événements chez 51 patients d’une cohorte de 597 sujets.21
Si les événements cardiovasculaires ne se produisent jamais chez l’enfant, les risques cardiovasculaires sont déjà présents et doivent donc être dépistés et pris en charge : 86 % des enfants ont au moins un facteur de risque cardiovasculaire, 21 à 45 % au moins 2, 15 % au moins 3.22
Si les événements cardiovasculaires ne se produisent jamais chez l’enfant, les risques cardiovasculaires sont déjà présents et doivent donc être dépistés et pris en charge : 86 % des enfants ont au moins un facteur de risque cardiovasculaire, 21 à 45 % au moins 2, 15 % au moins 3.22
Références
1. Craig ME, Jefferies C, Dabelea D, Balde N, Seth A, Donaghue KC; International Society for Pediatric and Adoles- cent Diabetes. ISPAD clinical practice consensus guidelines 2014. Definition, epidemiology, and classification of diabetes in children and adolescents. Pediatr Diabetes 2014;15(Suppl 20):4-17.
2. http://dx.doi.org/10.1787/health_glance-2013-graph21-en
3. Green A, Patterson CC; EURODIAB TIGER study group. Europe and Diabetes. Trends in the incidence of childhood-onset diabetes in Europe 1989-1998. Diabetologia 2001;44-Suppl 3:B3-8.
4. Charkaluk ML, Czernichow P, Levy-Marchal C. Incidence data of childhood-onset type I diabetes in France during 1988- 1997: The case for a shift toward younger age at onset. Pediatr Res 2002;52:859-62.
5. Barat P, Valade A, Brosselin P, Alberti C, Maurice-Tison S, Lévy-Marchal C. The growing incidence of type 1 diabetes in children: The 17-year French experience in Aquitaine. Diabetes Metab 2008;34(6 PT 1):601-5.
6. Fagot-Campagna A, Denis P, Rivière S. Données épidémiologiques du DT1 chez le jeune à partir du registre de la CNAMTS. Présentation orale. Journée scientifique de l’AJD. Congrès de la Société francophone du diabète 2015.
7. Piffaretti C, Mandereau-Bruno L, Guilmin-Crepon S, Choleau C, Coutant R, Fosse-Edorh S. Incidence du diabète de type 1 chez l’enfant en France en 2013-2015, à partir du système national des données de santé (SNDS). Variations régionales. Bull Epidemiol Hebd 2017;27-28:571-8. http://invs.santepubliquefrance.fr ou https://bit.ly/2KG1kni
8. Nathan DM, Genuth S, Lachin J, et al. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. New Engl J Med 1993;329:977-86.
9. Diabetes Control and Complications Trial Research Group. Effect of intensive diabetes treatment on the development and progression of long-term complications in adolescents with insulin-dependent diabetes mellitus: Diabetes Control and Complications Trial. J Pediatr 1994;125:177-88.
10. Writing team for the Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications research group. Sustained effect of intensive treatment of type 1 diabetes mellitus on development and progression of diabetic nephropathy: the Epidemiology of Diabetes Interventions and Complications (EDIC) study. JAMA 2003;290:2159-67.
11. Nathan DM, Cleary PA, Backlund JY, et al. Intensive diabetes treatment and cardiovascular disease in patients with type 1 diabetes. New Engl J Med 2005;353:2643-53.
12. Nathan DM, DCCT/EDIC research group. The diabetes control and complications trial/epidemiology of diabetes interventions and complications study at 30 years: overview. Diabetes Care 2014;37:9-16.
13. Thomas RL, Dunstan FD, Luzio SD, et al. Prevalence of diabetic retinopathy within a national diabetic retinopathy screening service. Br J Ophthalmol 2015;99:64-8.
14. Mathur R, Bhaskaran K, Edwards E, et al. Population trends in the 10-year incidence and prevalence of diabetic retinopathy in the UK: a cohort study in the Clinical Practice Research Datalink 2004-2014. BMJ Open 2017;7:e014444.
15. Nathan DM, Bebu I, Hainsworth D, et al. Frequency of evidence-based screening for retinopathy in type 1 diabetes. New Engl J Med 2017;376:1507-16.
16. Levy-Marchal C, Sahler C, Cahane M, Czernichow P; GECER study group. Risk factors for microalbuminuria in children and adolescents with type 1 diabetes. J Pediatr Endocrinol Metab 2000;13:613-20.
17. Perkins BA, Ficociello LH, Silva KH, Finkelstein DM, Warram JH, Krolewski AS. Regression of microalbuminuria in type 1 diabetes. New Engl J Med 2003;348:2285-93.
18. Gorman D, Sochett E, Daneman D. The natural history of microalbuminuria in adolescents with type 1 diabetes. J Pediatr 1999;134:333-7.
19. Louraki M, Katsalouli M, Kanaka-Gantenbein C, et al. The prevalence of early subclinical somatic neuropathy in children and adolescents with Type 1 diabetes mellitus and its association with the persistence of autoantibodies to glutamic acid decarboxylase (GAD) and islet antigen-2 (IA-2). Diabetes Res Clin Pract 2016;117:82-90.
20. Dabelea D, Stafford JM, Mayer-Davis EJ, et al and S. f. D. i. Y. R. Group. Association of type 1 diabetes vs type 2 diabetes diagnosed during childhood and adolescence with complications during teenage years and young adulthood. JAMA 2017;317:825-35.
21. Nathan DM, Bayless M, Cleary P, et al, DCCT/EDIC research group. Diabetes control and complications trial/epidemiology of diabetes interventions and complications study at 30 years: advances and contributions. Diabetes 2013;62:3976-86.
22. Margeirsdottir HD, Larsen JR, Brunborg C, Overby NC, Dahl-Jorgensen K, Norwegian study group for childhood. High prevalence of cardiovascular risk factors in children and adolescents with type 1 diabetes: a population-based study. Diabetologia 2008;51:554-61.
2. http://dx.doi.org/10.1787/health_glance-2013-graph21-en
3. Green A, Patterson CC; EURODIAB TIGER study group. Europe and Diabetes. Trends in the incidence of childhood-onset diabetes in Europe 1989-1998. Diabetologia 2001;44-Suppl 3:B3-8.
4. Charkaluk ML, Czernichow P, Levy-Marchal C. Incidence data of childhood-onset type I diabetes in France during 1988- 1997: The case for a shift toward younger age at onset. Pediatr Res 2002;52:859-62.
5. Barat P, Valade A, Brosselin P, Alberti C, Maurice-Tison S, Lévy-Marchal C. The growing incidence of type 1 diabetes in children: The 17-year French experience in Aquitaine. Diabetes Metab 2008;34(6 PT 1):601-5.
6. Fagot-Campagna A, Denis P, Rivière S. Données épidémiologiques du DT1 chez le jeune à partir du registre de la CNAMTS. Présentation orale. Journée scientifique de l’AJD. Congrès de la Société francophone du diabète 2015.
7. Piffaretti C, Mandereau-Bruno L, Guilmin-Crepon S, Choleau C, Coutant R, Fosse-Edorh S. Incidence du diabète de type 1 chez l’enfant en France en 2013-2015, à partir du système national des données de santé (SNDS). Variations régionales. Bull Epidemiol Hebd 2017;27-28:571-8. http://invs.santepubliquefrance.fr ou https://bit.ly/2KG1kni
8. Nathan DM, Genuth S, Lachin J, et al. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. New Engl J Med 1993;329:977-86.
9. Diabetes Control and Complications Trial Research Group. Effect of intensive diabetes treatment on the development and progression of long-term complications in adolescents with insulin-dependent diabetes mellitus: Diabetes Control and Complications Trial. J Pediatr 1994;125:177-88.
10. Writing team for the Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications research group. Sustained effect of intensive treatment of type 1 diabetes mellitus on development and progression of diabetic nephropathy: the Epidemiology of Diabetes Interventions and Complications (EDIC) study. JAMA 2003;290:2159-67.
11. Nathan DM, Cleary PA, Backlund JY, et al. Intensive diabetes treatment and cardiovascular disease in patients with type 1 diabetes. New Engl J Med 2005;353:2643-53.
12. Nathan DM, DCCT/EDIC research group. The diabetes control and complications trial/epidemiology of diabetes interventions and complications study at 30 years: overview. Diabetes Care 2014;37:9-16.
13. Thomas RL, Dunstan FD, Luzio SD, et al. Prevalence of diabetic retinopathy within a national diabetic retinopathy screening service. Br J Ophthalmol 2015;99:64-8.
14. Mathur R, Bhaskaran K, Edwards E, et al. Population trends in the 10-year incidence and prevalence of diabetic retinopathy in the UK: a cohort study in the Clinical Practice Research Datalink 2004-2014. BMJ Open 2017;7:e014444.
15. Nathan DM, Bebu I, Hainsworth D, et al. Frequency of evidence-based screening for retinopathy in type 1 diabetes. New Engl J Med 2017;376:1507-16.
16. Levy-Marchal C, Sahler C, Cahane M, Czernichow P; GECER study group. Risk factors for microalbuminuria in children and adolescents with type 1 diabetes. J Pediatr Endocrinol Metab 2000;13:613-20.
17. Perkins BA, Ficociello LH, Silva KH, Finkelstein DM, Warram JH, Krolewski AS. Regression of microalbuminuria in type 1 diabetes. New Engl J Med 2003;348:2285-93.
18. Gorman D, Sochett E, Daneman D. The natural history of microalbuminuria in adolescents with type 1 diabetes. J Pediatr 1999;134:333-7.
19. Louraki M, Katsalouli M, Kanaka-Gantenbein C, et al. The prevalence of early subclinical somatic neuropathy in children and adolescents with Type 1 diabetes mellitus and its association with the persistence of autoantibodies to glutamic acid decarboxylase (GAD) and islet antigen-2 (IA-2). Diabetes Res Clin Pract 2016;117:82-90.
20. Dabelea D, Stafford JM, Mayer-Davis EJ, et al and S. f. D. i. Y. R. Group. Association of type 1 diabetes vs type 2 diabetes diagnosed during childhood and adolescence with complications during teenage years and young adulthood. JAMA 2017;317:825-35.
21. Nathan DM, Bayless M, Cleary P, et al, DCCT/EDIC research group. Diabetes control and complications trial/epidemiology of diabetes interventions and complications study at 30 years: advances and contributions. Diabetes 2013;62:3976-86.
22. Margeirsdottir HD, Larsen JR, Brunborg C, Overby NC, Dahl-Jorgensen K, Norwegian study group for childhood. High prevalence of cardiovascular risk factors in children and adolescents with type 1 diabetes: a population-based study. Diabetologia 2008;51:554-61.