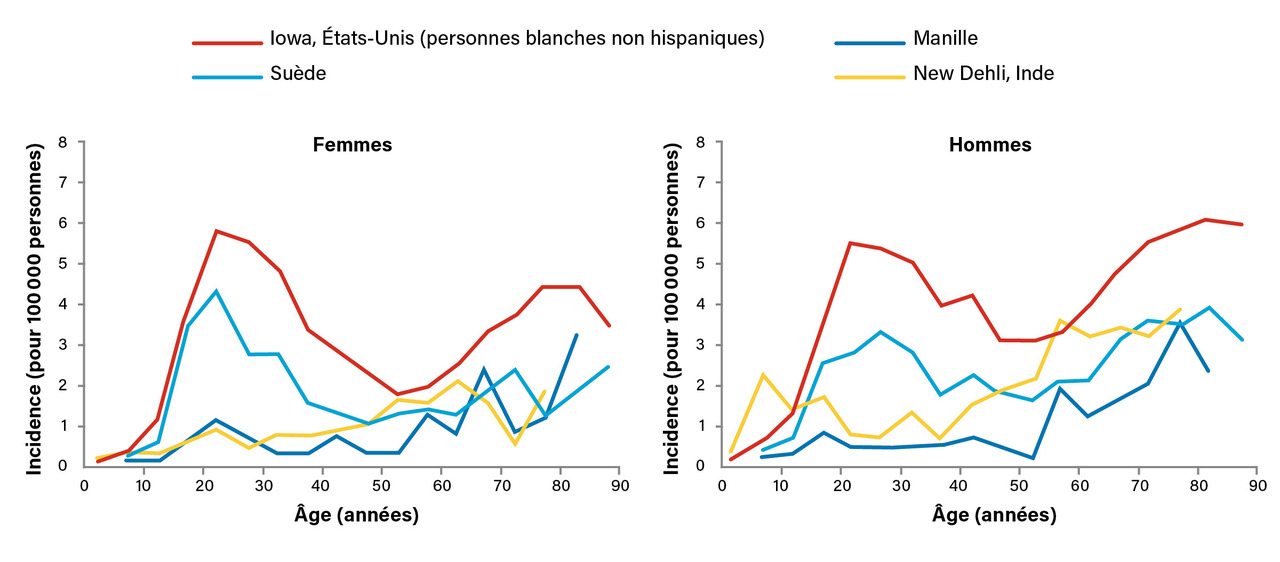
L’épidémiologie du lymphome de Hodgkin (LH) est très singulière. Il existe une incidence très variable en fonction des zones géographiques étudiées, ce qui sous-entend une influence des modes de vie et du développement socioéconomique. En France, l’incidence est de 3,2 pour 100 000 habitants, selon les données de 2018 du registre des cancers FRANCIM (FRANce Cancer Incidence et Mortalité) ; cela correspond à environ 2 200 nouveaux patients par an.
Une incidence variable en fonction de l’environnement socio-économique
Une analyse de l’incidence du LH sur le pourtour méditerranéen montre des variations importantes parmi les pays étudiés dont les statuts socioéconomiques sont différents.1 L’incidence est décrite comme « bimodale », avec un pic chez l’adulte jeune – proche de 30 ans –, puis un second pic chez les individus plus âgés – proche de 70 ans. En analysant l’incidence des LH à Singapour sur deux périodes différentes, de 1968 à 1977 et de 1996 à 2004, Hjalgrim et al. ont montré que l’incidence du LH s’est grandement modifiée avec l’apparition du fameux pic d’incidence chez l’adulte jeune alors qu’il n’était pas présent sur la première période.2 Cette observation est à mettre en parallèle avec des modifications du mode de vie de type occidental à Singapour. Ces données décrites également pour d’autres pays par le Centre international de recherche sur le cancer (CIRC) confortent l’influence de facteurs environnementaux (fig. 1 ).3 Toutefois, ces distributions épidémiologiques demandent à être mieux comprises pour identifier les agents étiologiques qui sous-tendent ces différences.
L’hypothèse la plus communément développée correspond à une réduction de l’exposition microbienne dans l’enfance dans les pays industrialisés, qui favoriserait une immaturité du système immunitaire favorable à l’émergence du LH chez l’adulte jeune. Ce sont surtout des données épidémiologiques indirectes qui sous-tendent cette hypothèse « hygiéniste ». Un nombre élevé d’enfants dans une fratrie, l’ordre croissant de naissance, la fréquence augmentée d’infections chez l’enfant et, par exemple, le fait d’avoir été gardé en crèche dans la petite enfance sont des facteurs protecteurs de LH. Les antécédents d’asthme et d’eczéma sont considérés comme des facteurs de risque de LH. L’hypothèse « hygiéniste » est également évoquée pour ces pathologies immunologiques avec une diminution de l’exposition aux pathogènes dans l’enfance. Une étude épidémiologique de registre a comparé, avec des questionnaires très détaillés, les habitudes de vie (mettre les objets à la bouche, sucer son pouce, ronger ses ongles, événements infectieux, présence d’animaux…) dans l’enfance chez des jumeaux, ce qui permet de contrôler la susceptibilité génétique au LH des individus. Cette étude confirme des différences d’exposition aux agents infectieux entre patient atteint d’un LH et jumeau indemne de pathologie.4 Aucun agent infectieux n’a cependant été identifié à ce jour comme agent étiologique du LH.
L’hypothèse la plus communément développée correspond à une réduction de l’exposition microbienne dans l’enfance dans les pays industrialisés, qui favoriserait une immaturité du système immunitaire favorable à l’émergence du LH chez l’adulte jeune. Ce sont surtout des données épidémiologiques indirectes qui sous-tendent cette hypothèse « hygiéniste ». Un nombre élevé d’enfants dans une fratrie, l’ordre croissant de naissance, la fréquence augmentée d’infections chez l’enfant et, par exemple, le fait d’avoir été gardé en crèche dans la petite enfance sont des facteurs protecteurs de LH. Les antécédents d’asthme et d’eczéma sont considérés comme des facteurs de risque de LH. L’hypothèse « hygiéniste » est également évoquée pour ces pathologies immunologiques avec une diminution de l’exposition aux pathogènes dans l’enfance. Une étude épidémiologique de registre a comparé, avec des questionnaires très détaillés, les habitudes de vie (mettre les objets à la bouche, sucer son pouce, ronger ses ongles, événements infectieux, présence d’animaux…) dans l’enfance chez des jumeaux, ce qui permet de contrôler la susceptibilité génétique au LH des individus. Cette étude confirme des différences d’exposition aux agents infectieux entre patient atteint d’un LH et jumeau indemne de pathologie.4 Aucun agent infectieux n’a cependant été identifié à ce jour comme agent étiologique du LH.
Association avec le virus d’Epstein-Barr (EBV)
Dans environ 20 % des cas, une association avec le virus d’Epstein-Barr (EBV) est retrouvée dans le LH, avec une intégration du génome viral dans les cellules tumorales. Des variations importantes de l’association entre EBV et le LH existent en fonction de la zone géographique, avec des liens très fréquents en Amérique du Sud, en Afrique et en Asie.
Les études épidémiologiques montrent que la mononucléose infectieuse (MNI) est un facteur de risque de survenue dans les cinq années qui suivent l’infection.
L’association avec l’EBV varie en fonction de l’âge : fréquence accrue dans les formes pédiatriques avant 10 ans et chez les patients les plus âgés.
Sur le plan anatomopathologique, la présence d’EBV est plus fréquente dans les sous-types de LH à cellularité mixte que dans les formes scléronodulaires.
Les études épidémiologiques montrent que la mononucléose infectieuse (MNI) est un facteur de risque de survenue dans les cinq années qui suivent l’infection.
L’association avec l’EBV varie en fonction de l’âge : fréquence accrue dans les formes pédiatriques avant 10 ans et chez les patients les plus âgés.
Sur le plan anatomopathologique, la présence d’EBV est plus fréquente dans les sous-types de LH à cellularité mixte que dans les formes scléronodulaires.
Différentes formes de LH
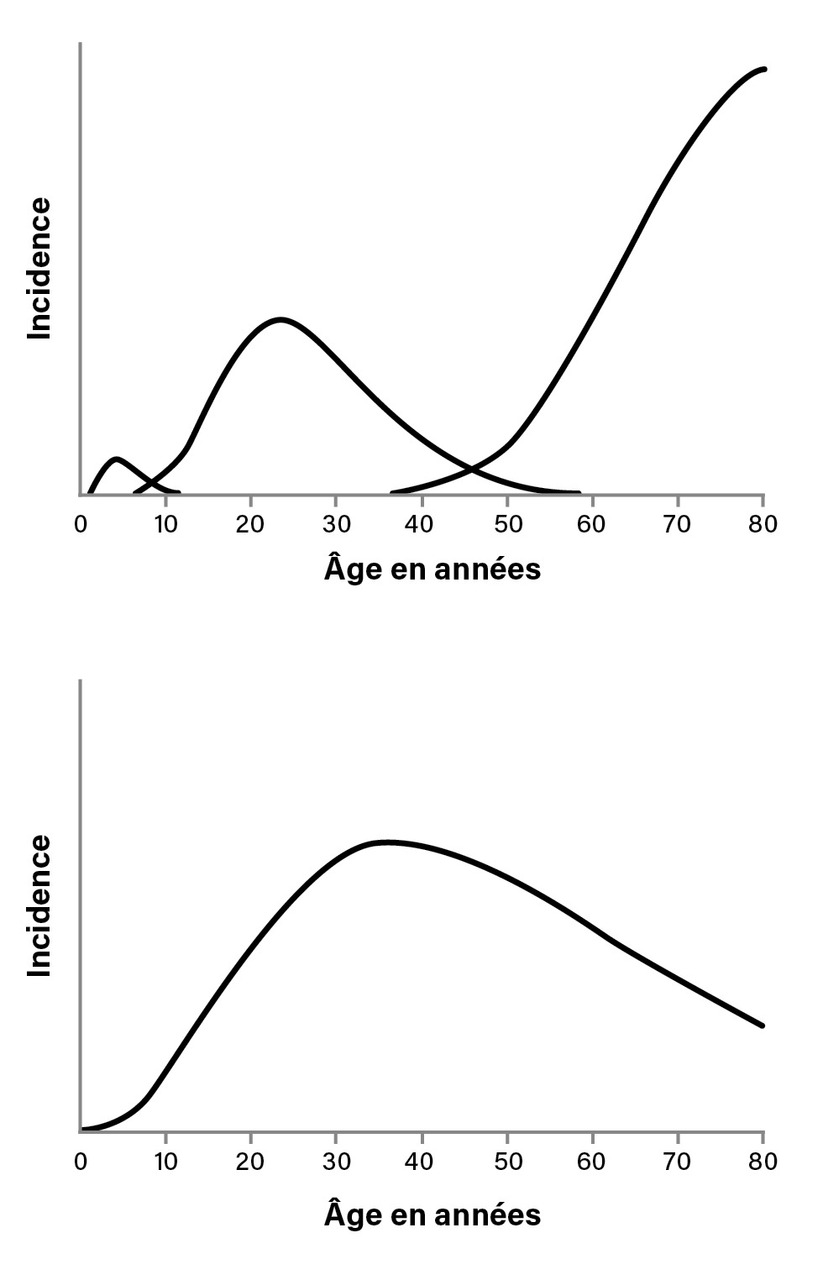
L’intégration des données précédemment exposées permet de proposer un modèle à quatre entités selon Hjalgrim :5 les formes pédiatriques (avant 10 ans) de LH associées à l’EBV ; les formes du sujet âgé associées à l’EBV ; les formes du jeune adulte pouvant être associées à un antécédent de MNI avec une courbe d’incidence en fonction de l’âge à « trois bosses » (fig. 2 ) ; le LH non associé à l’EBV avec un pic d’incidence chez l’adulte jeune qui a finalement une courbe d’incidence unimodale. C’est pour cette dernière forme que pourrait être appliquée l’hypothèse « hygiéniste » avec une exposition retardée aux agents pathogènes. Cette proposition de modèle imposerait, dans les études biologiques sur le LH, d’analyser dans un premier temps l’association à l’EBV. En effet, les études biologiques récentes montrent un profil immunologique des cellules du micro-environnement tumoral très différent entre les formes de LH associées ou non à l’EBV. Les LH EBV+ sont ainsi associés à une réponse immunologique de type Th1 avec la présence de lymphocytes CD8+ ; les LH EBV- ont, en revanche, une réponse de type Th17 impliquant les interleukines IL-17 et IL-23. De futures études biologiques restent à effectuer pour mieux faire le lien entre les données épidémiologiques et la physiopathologie du LH.
Pour le LH non associé à l’EBV, il reste à déterminer s’il existe un agent causal infectieux ou si le LH se développe à partir d’anomalies successives d’un lymphocyte B mais avec une physiopathologie, une présentation clinique et un pronostic très différents de ceux du lymphome non hodgkinien.
Pour le LH non associé à l’EBV, il reste à déterminer s’il existe un agent causal infectieux ou si le LH se développe à partir d’anomalies successives d’un lymphocyte B mais avec une physiopathologie, une présentation clinique et un pronostic très différents de ceux du lymphome non hodgkinien.
Absence de gène de susceptibilité identifié
Il y a, dans la susceptibilité au LH, un caractère génétique. En cas d’antécédent familial, il existe en effet un risque accru de survenue d’un LH (odds ratio proche de 3).6 Le risque est encore plus grand pour de vrais jumeaux (odds ratio proche de 100). À ce jour, il n’a pas été mis en évidence de gènes de susceptibilité précis dans le LH, comme cela peut être le cas dans certains cancers gynécologiques (par exemple BRCA1/2) ou digestifs (par exemple MLH1/2). Néanmoins, les analyses génétiques comparant des patients et des contrôles montrent l’implication de polymorphismes génétiques, notamment au niveau du système HLA.6 Le LH étant un cancer rare, il n’y a pas actuellement d’examens ni de suivi spécifique nécessaire en cas d’antécédent familial.
Association au VIH
Le virus de l’immunodéficience humaine (VIH) constitue un facteur de risque de LH, avec une incidence multipliée par 10. Dans ces formes, on retrouve systématiquement une association à l’EBV. L’état d’immunosuppression des patients influence le risque de survenue de LH. Alors que des lymphomes non hodgkiniens, souvent de forme agressive (lymphome diffus à grandes cellules B, lymphome plasmoblastique, lymphome des séreuses), surviennent sur des niveaux importants d’immunosuppression (lymphocytes T CD4 souvent inférieurs à 100/mm3), le LH se déclare sur des terrains d’immunosuppression modérés.
Des études épidémiologiques montrent même une augmentation de l’incidence du LH chez les patients avec une séropositivité au VIH à l’ère des trithérapies antivirales ou en cas de reconstitution immunologique après le début des antiviraux. L’hypothèse, probablement simpliste, serait que le développement du LH nécessite des effecteurs immunologiques pour constituer le micro-environnement tumoral, d’où une survenue de LH chez les patients séropositifs au VIH avec un terrain d’immunosuppression modéré. La présentation clinique dans cette situation est en général beaucoup plus sévère que celle des patients séronégatifs au VIH avec des stades cliniques plus avancés (stade IV de la classification d’Ann Arbor) et davantage de signes généraux (fièvre, sueurs nocturnes, amaigrissement).
Des études épidémiologiques montrent même une augmentation de l’incidence du LH chez les patients avec une séropositivité au VIH à l’ère des trithérapies antivirales ou en cas de reconstitution immunologique après le début des antiviraux. L’hypothèse, probablement simpliste, serait que le développement du LH nécessite des effecteurs immunologiques pour constituer le micro-environnement tumoral, d’où une survenue de LH chez les patients séropositifs au VIH avec un terrain d’immunosuppression modéré. La présentation clinique dans cette situation est en général beaucoup plus sévère que celle des patients séronégatifs au VIH avec des stades cliniques plus avancés (stade IV de la classification d’Ann Arbor) et davantage de signes généraux (fièvre, sueurs nocturnes, amaigrissement).
Chez les patients les plus âgés
Le LH correspond probablement à des spectres de pathologies différents, notamment en fonction de l’âge des patients. Sur le plan du pronostic, il existe des modifications notables de la survie en fonction de la tranche d’âge des patients avec, dans les études épidémiologiques, un excès de mortalité de respectivement 2,9 pour la tranche d’âge 45-59 ans, 5,75 pour les 60-69 ans, 9,7 pour les 70-80 ans et 18,6 pour les plus de 80 ans par rapport à la tranche d’âge de référence de 18-44 ans.7 De façon relativement arbitraire, les patients « âgés » sont définis comme les patients de 60 ans et plus, notamment sous l’angle de la tolérance des traitements de chimiothérapie. Ces patients ont une présentation clinique très différente des patients plus jeunes, avec davantage de symptômes en lien avec le LH (fièvre, amaigrissement, sueurs nocturnes), une altération de l’état général plus prononcée et un stade de la maladie plus avancé (stades III et IV de la classification d’Ann Arbor). La maladie se présente davantage sous la forme de multiples adénopathies disséminées de taille modeste et d’atteintes extra-ganglionnaires, alors que la présentation clinique de l’adulte jeune correspond le plus souvent à une atteinte supradiaphragmatique avec des masses ganglionnaires importantes, notamment au niveau médiastinal.
Les examens anatomopathologiques montrent une fréquence accrue de LH de sous-type cellularité mixte et d’association à l’EBV avec probablement une physiopathologie différente du LH pour cette tranche d’âge. Le pronostic des patients âgés est nettement moins bon avec une survie sans progression de 60 % à cinq ans alors qu’elle est supérieure à 80 % pour des patients plus jeunes.8
S’ajoutent des problématiques de toxicités aiguës et tardives des traitements. Il s’agit, compte tenu du terrain d’immunosuppression, de problèmes infectieux, de toxicité cardiaque liée au traitement de chimiothérapie (notamment en lien avec l’utilisation des anthracyclines) et d’un risque accru de cancer secondaire d’environ 10 %, avec des implications sur la surveillance de ces patients.
Les examens anatomopathologiques montrent une fréquence accrue de LH de sous-type cellularité mixte et d’association à l’EBV avec probablement une physiopathologie différente du LH pour cette tranche d’âge. Le pronostic des patients âgés est nettement moins bon avec une survie sans progression de 60 % à cinq ans alors qu’elle est supérieure à 80 % pour des patients plus jeunes.8
S’ajoutent des problématiques de toxicités aiguës et tardives des traitements. Il s’agit, compte tenu du terrain d’immunosuppression, de problèmes infectieux, de toxicité cardiaque liée au traitement de chimiothérapie (notamment en lien avec l’utilisation des anthracyclines) et d’un risque accru de cancer secondaire d’environ 10 %, avec des implications sur la surveillance de ces patients.
Mieux comprendre les données épidémiologiques pour identifier des facteurs causaux
Comme bien souvent dans les pathologies tumorales, une entité nosologique sous-tend plusieurs pathologies avec des éléments physiopathologiques très différents. C’est le cas pour le LH, notamment en fonction de l’âge et de l’association à l’EBV. La mise en évidence d’entités cliniques et biologiques spécifiques permettra le développement de stratégies thérapeutiques différentes avec le besoin urgent de nouveaux traitements pour les formes de mauvais pronostic, notamment celles des patients les plus âgés. Les données épidémiologiques, en particulier le lien entre les facteurs socio-économiques, environnementaux et la physiopathologie du LH, demandent à être mieux comprises pour identifier des facteurs causaux.
Références
1. Salati M, Cesaretti M, Macchia M, Mistiri ME, Federico M. Epidemiological overview of Hodgkin lymphoma across the mediterranean basin. Mediterr J Hematol Infect Dis 2014;6(1):e2014048.
2. Hjalgrim H, Seow A, Rostgaard K, Friborg J. Changing patterns of Hodgkin lymphoma incidence in Singapore. Int J Cancer 2008;123(3):716-9.
3. Connors JM, Cozen W, Steidl C, Carbone A, Hoppe RT, Flechtner HH, et al. Hodgkin lymphoma. Nat Rev Dis Primers 2020;6(1):61.
4. Cozen W, Hamilton AS, Zhao P, Salam MT, Deapen DM, Nathwani BN, et al. A protective role for early oral exposures in the etiology of young adult Hodgkin lymphoma. Blood 2009;114(19):4014-20.
5. Hjalgrim H. On the aetiology of Hodgkin lymphoma. Dan Med J 2012;59(7):B4485.
6. Cerhan JR, Slager SL. Familial predisposition and genetic risk factors for lymphoma. Blood 2015;126(20):2265-73.
7. Björkholm M, Weibull CE, Eloranta S, Smedby KE, Glimelius I, Dickman PW. Greater attention should be paid to developing therapies for elderly patients with Hodgkin lymphoma. A population-based study from Sweden. Eur J Haematol 2018;101(1):106-14.
8. Böll B, Görgen H. The treatment of older Hodgkin lymphoma patients. Br J Haematol 2019;184(1): 82-92.
2. Hjalgrim H, Seow A, Rostgaard K, Friborg J. Changing patterns of Hodgkin lymphoma incidence in Singapore. Int J Cancer 2008;123(3):716-9.
3. Connors JM, Cozen W, Steidl C, Carbone A, Hoppe RT, Flechtner HH, et al. Hodgkin lymphoma. Nat Rev Dis Primers 2020;6(1):61.
4. Cozen W, Hamilton AS, Zhao P, Salam MT, Deapen DM, Nathwani BN, et al. A protective role for early oral exposures in the etiology of young adult Hodgkin lymphoma. Blood 2009;114(19):4014-20.
5. Hjalgrim H. On the aetiology of Hodgkin lymphoma. Dan Med J 2012;59(7):B4485.
6. Cerhan JR, Slager SL. Familial predisposition and genetic risk factors for lymphoma. Blood 2015;126(20):2265-73.
7. Björkholm M, Weibull CE, Eloranta S, Smedby KE, Glimelius I, Dickman PW. Greater attention should be paid to developing therapies for elderly patients with Hodgkin lymphoma. A population-based study from Sweden. Eur J Haematol 2018;101(1):106-14.
8. Böll B, Görgen H. The treatment of older Hodgkin lymphoma patients. Br J Haematol 2019;184(1): 82-92.
Dans cet article
- Une incidence variable en fonction de l’environnement socio-économique
- Association avec le virus d’Epstein-Barr (EBV)
- Différentes formes de LH
- Absence de gène de susceptibilité identifié
- Association au VIH
- Chez les patients les plus âgés
- Mieux comprendre les données épidémiologiques pour identifier des facteurs causaux