Le cancer de l’ovaire concerne plus de 5 000 femmes en France chaque année, avec une incidence en légère baisse depuis une trentaine d’années. Survenant le plus souvent chez la femme ménopausée, ses facteurs de risque sont multiples mais à faible impact en dehors des facteurs génétiques.
Au 8e rang des cancers chez les Françaises
Avec 5 193 nouveaux cas en France en 2018, le cancer de l’ovaire se situe au 8e rang des cancers chez la femme (après les cancers du sein, colorectal, du poumon, du corps de l’utérus, de la thyroïde, le mélanome et le cancer du pancréas). Avec un taux standardisé (monde) annuel de 7,5/100 000, sa fréquence est légèrement supérieure à celle du cancer du col de l’utérus (6,1/100 000), et inférieure à celle du cancer du corps de l’utérus (11/100 000). Elle est bien inférieure à celle du cancer du sein, qui reste à la première place des cancers féminins, avec un taux annuel de 99,9/100 000 (58 459 nouveaux cas par an en France).1
Le cancer de l’ovaire se situe au 5e rang des décès par cancer chez la femme, avec 3 479 décès observés en 2018, bien après le cancer du sein (12 146 décès), le cancer du poumon (10 356 décès) et le cancer colorectal (7 908 décès). Le taux standardisé (monde) était de 3,9/100 000 pour l’année 2018.
L’incidence de ce cancer connaît une légère diminution : le taux d’incidence standardisé monde a baissé en moyenne de 1 % par an depuis 1990, et de 1,1 % par an depuis 2010. Cette évolution du risque pourrait s’expliquer par l’utilisation accrue, plus précoce et prolongée de contraceptifs oraux œstroprogestatifs. Cette tendance à la baisse devrait donc se poursuivre dans les années à venir.
Concernant les différences ethniques, on observe la plus grande prévalence chez les femmes caucasiennes, avec 11,3 cas/100 000, suivies des Hispaniques, Asiatiques et Africaines.
Le pronostic est directement lié au stade de la maladie au moment du diagnostic. Or, du fait du caractère très peu symptomatique du cancer de l’ovaire, la grande majorité (plus de 70 %) est découverte à un stade localement avancé (FIGO stades III et IV [
Des structures histologiques plus ou moins fréquentes
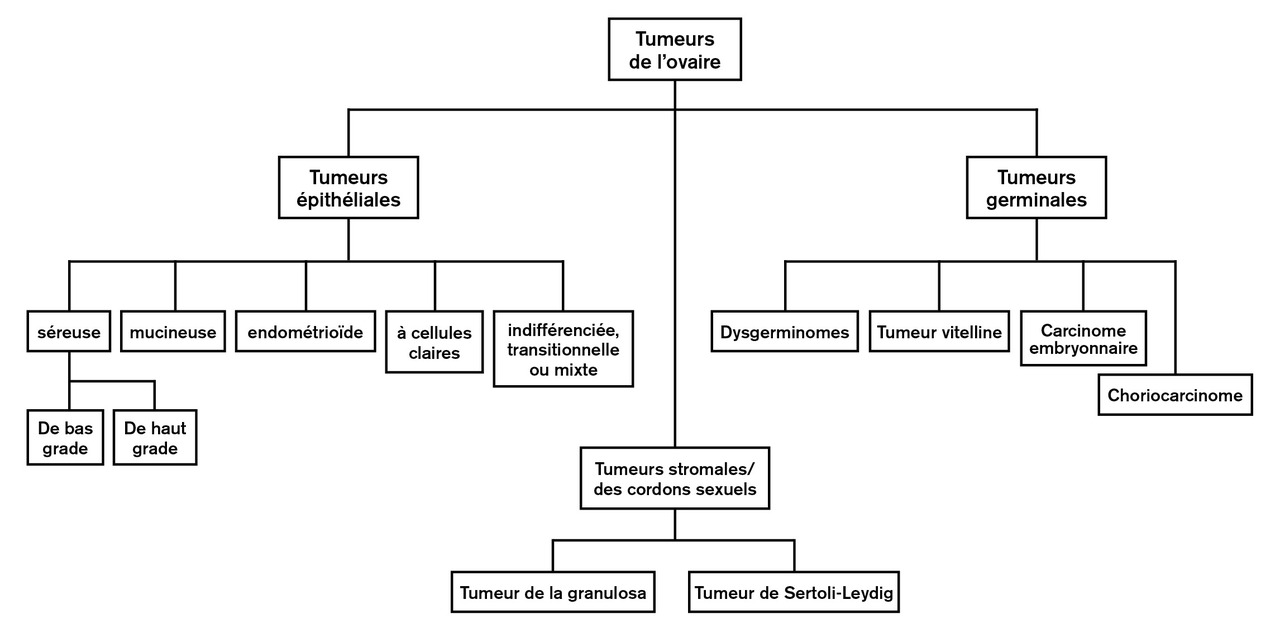
Les tumeurs de l’ovaire peuvent être classées en fonction de la structure normale qu’elles reproduisent : épithélium de surface (tumeurs épithéliales), cordons sexuels/stroma, ou cellules germinales (
Les cancers épithéliaux, de loin les plus fréquents, se différencient eux-mêmes en plusieurs sous-types histologiques : séreux (le plus souvent), mucineux, endométrioïdes, à cellules claires, et à cellules transitionnelles, indifférenciées ou mixtes (ces trois derniers sous-types étant beaucoup plus rares).
De multiples théories de carcinogenèse ont été émises pour expliquer l’épidémiologie des cancers de l’ovaire : dommages répétés sur l’épithélium ovarien à chaque cycle ovulatoire, rôles des gonadotrophines hypophysaires stimulant les estrogènes, rôle favorisant des androgènes et protecteur de la progestérone, défaut d’apoptose des cellules thécales et de la granulosa, rôle de l’inflammation chronique (maladies inflammatoires pelviennes, endométriose).
Cette multiplicité d’hypothèses est en grande partie liée à la nature hétérogène des différents types histologiques. En effet, certains sous-types ont des précurseurs bien identifiés (mucineux, séreux de bas grade, ou endométrioïdes) et sont associés aux mutations des gènes BRAF et KRAS. Les carcinomes séreux de haut grade ont une physiopathologie très différente : ils dériveraient de novo, sans passage par la tumeur borderline, et se caractérisent par une mutation du gène p53.
De multiples facteurs de risque identifiés
Le cancer de l’ovaire est rare chez la femme jeune, particulièrement avant 30 ans ; le risque augmente avec l’âge, plus nettement après 50 ans. Le cancer de l’ovaire est donc pour l’essentiel un cancer de la femme ménopausée.
Si l’âge est un facteur de risque essentiel non modifiable, d’autres s’y ajoutent.
Trois fois plus de risque en cas d’antécédent au premier degré
Les antécédents familiaux constituent le principal facteur de risque de cancer de l’ovaire. Une femme avec un antécédent familial au premier degré a 3 fois plus de risque de développer un cancer de l’ovaire.
Les principaux gènes identifiés sont les gènes BRCA1 et BRCA2 dont la mutation germinale confère une prédisposition aux cancers du sein et de l’ovaire ; le risque cumulé à 80 ans de développer un cancer de l’ovaire est de 44 % en cas de mutation de BRCA1, et de 17 % en cas de mutation de BRCA2.2 Les cancers développés sont alors des cancers épithéliaux non mucineux, principalement séreux de haut grade (parmi les patientes présentant un cancer séreux de haut grade, une mutation germinale BRCA est retrouvée dans 15 % des cas).
D’autres gènes impliqués également dans la réparation de l’ADN ont été identifiés : RAD51C, RAD51D, BRIP1, FANCM, PALB2 ainsi que de nombreux autres dont la prédisposition associée est à plus faible risque (CHEK2, WNT4, TERT, ABO…).
Enfin, une autre classe de gènes est également associée au cancer de l’ovaire : ceux du système MMR (mismatch repair, réparation de mésappariement de bases). Leur mutation conduit au syndrome de Lynch, autosomique dominant, qui confère entre autres une prédisposition à certains types de cancers gynécologiques : cancer endométrial et certains sous-types de cancers de l’ovaire comme les endométrioïdes et ceux à cellules claires. Les mutations les plus fréquemment retrouvées concernent MSH2 et MSH6.3
Facteurs hormonaux : une influence démontrée
La parité est associée à un risque diminué de cancer de l’ovaire épithélial quel que soit le type histologique, avec cependant une hétérogénéité entre les sous-types : la réduction de risque la plus importante est observée pour les carcinomes à cellules claires ; la plus faible concerne les cancers séreux de haut grade. Ce même phénomène est observé pour le nombre d’enfants.4
En revanche, la parité ne semble pas avoir d’impact sur le risque de tumeur de la granulosa.5
L’utilisation d’une contraception orale œstroprogestative est associée à une réduction de risque de survenue des carcinomes séreux, endométrioïdes et à cellules claires, mais sans lien retrouvé avec les carcinomes mucineux. Cette réduction de risque est estimée à 15 % pour une utilisation de cinq ans, et de 36 à 45 % pour une prise prolongée pendant plus de dix ans.4
La ligature tubaire est associée à une diminution de risque de survenue de carcinome endométrioïde et à cellules claires, tandis que l’hystérectomie et des ménarches tardives (à 15 ans et plus) sont associées à une diminution de risque de carcinome à cellules claires uniquement.
L’endométriose est associée à un sur-risque de survenue de carcinome endométrioïde et à cellules claires.7
Un âge tardif de ménopause de plus de cinq ans par rapport à la moyenne (aux alentours de 50 ans) est associé à un sur-risque de survenue de carcinome endométrioïde et à cellules claires, mais sans lien observé pour les carcinomes séreux et mucineux.
Enfin, concernant les liens entre cancer de l’ovaire et allaitement maternel, les données sont contradictoires.
Impact de l’environnement
Le tabac est associé à un sur-risque de survenue de carcinome mucineux, mais à un risque diminué de carcinome à cellules claires.
Un lien est décrit entre utilisation de talc périnéal et cancer de l’ovaire : une large méta-analyse publiée en 2018 rapporte un sur-risque concernant les carcinomes séreux et endométrioïdes notamment.7
L’indice de masse corporelle n’est en revanche pas clairement associé à un sur-risque de cancer de l’ovaire. Les études montrant une relation entre régime méditerranéen et cancer de l’ovaire sont également très controversées.
Aucun lien n’est établi entre cancer de l’ovaire et consommation d’alcool.
Un sur-risque essentiellement génétique
Les nombreuses études épidémiologiques réalisées sur les facteurs de risque de cancer de l’ovaire ont montré un impact faible de l’environnement, et très modéré des facteurs liés aux hormones et à la reproduction. L’utilisation d’une contraception orale œstroprogestative constitue toute-fois un facteur protecteur, utilisable en prévention primaire.
Seuls les facteurs génétiques constituent un facteur de risque important, notamment la mutation de BRCA. L’annexectomie prophylactique est ainsi fortement recommandée dès l’âge de 40 ans en cas de mutation BRCA1, entre 45 et 47 ans pour BRCA2, et 50 ans pour PALB2.
1. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians 2018;68(6):394-424.
2. Kuchenbaecker KB, Hopper JL, Barnes DR, Phillips K-A, Mooij TM, Roos-Blom MJ, et al. Risks of breast, ovarian, and contralateral breast cancer for BRCA1 and BRCA2 mutation carriers. JAMA 2017;317(23):2402.
3. Jones MR, Kamara D, Karlan BY, Pharoah PDP, Gayther SA. Genetic epidemiology of ovarian cancer and prospects for polygenic risk prediction. Gynecologic Oncology 2017;147(3):705-13.
4. Wentzensen N, Poole EM, Trabert B, White E, Arslan AA, Patel AV, et al. Ovarian cancer risk factors by histologic subtype: An analysis from the Ovarian Cancer Cohort Consortium. J Clin Oncol 2016;34(24):2888-98.
5. Bryk S, Katuwal S, Haltia UM, Tapper J, Tapanainen J, Pukkala E. Parity, menopausal hormone therapy, and risk of ovarian granulosa cell tumor - A population-based case-control study. Gynecologic Oncology 2021;163(3):593-7.
6. Pearce CL, Templeman C, Rossing MA, Lee A, Near AM, Webb PM, et al. Association between endometriosis and risk of histological subtypes of ovarian cancer: a pooled analysis of case–control studies. The Lancet Oncology 2012;13(4):385-94.
7. Berge W, Mundt K, Luu H, Boffetta P. Genital use of talc and risk of ovarian cancer: a meta-analysis. Eur J Cancer Prev 2018;27(3):248-57.