Bien que cet article cible la pathologie liée au virus respiratoire syncytial (VRS) chez le jeune enfant, il est très important de comprendre que, la réponse immune à ce virus étant en règle partielle et de courte durée, un sujet, enfant ou adulte (a fortiori les personnes ayant des facteurs de risque et/ou celles âgées de plus de 65ans), risque de faire plusieurs infections à VRS au cours de sa vie, voire au cours de la même année.
Le virus respiratoire syncytial (VRS)
Le VRS, humain, ubiquitaire, provoque chaque année des épidémies prévisibles avec une distribution mondiale relativement homogène1. La reconnaissance croissante de la pathologie qui lui est liée et du poids qu’elle représente en font une priorité importante de santé publique dans le monde entier. L’Organisation mondiale de la santé (OMS)2 a développé une feuille de route pour améliorer la surveillance des maladies liées au VRS, et pour faciliter la recherche et le développement de vaccins et d’anticorps monoclonaux (mAb) notamment dans les pays de ressources faibles ou moyennes.
Transmission du VRS
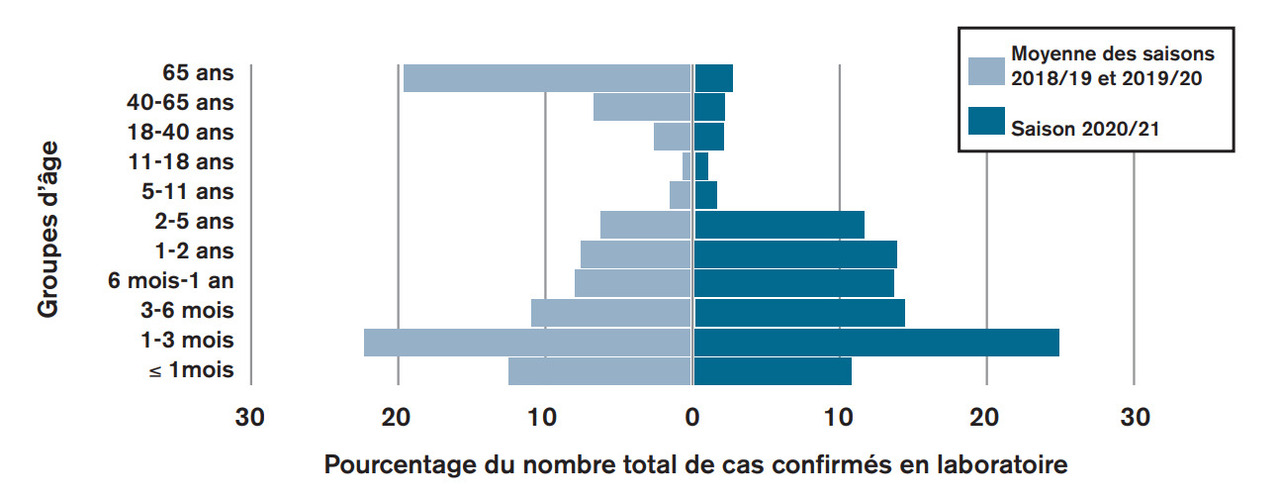
Le virus est essentiellement transmis grâce à la contamination directe des muqueuses de la bouche, du nez ou des yeux par gouttelettes de salive ou des sécrétions rhinopharyngées des personnes infectées. Il peut rester infectant sur les surfaces plusieurs heures. On admet que le nombre de reproductions est de l’ordre de 5 (celui de la grippe saisonnière est de l’ordre de 1,5), la contamination étant soit familiale (fratrie surtout, parents), soit en collectivité semi-fermée (crèche, nourrice familiale). On ne connaît pas de réservoir spécifique d’une tranche d’âge, comme le montre la figure 2. En intrafamilial, 40% (VRS-A) et 48% (VRS-B) des cas proviennent de sources extérieures à la maisonnée; un tiers des infections intra-familiales sont apportées par un membre de la famille. L’allaitement maternel est un facteur protecteur contre l’infection; le tabagisme, même passif, la promis[1]cuité au domicile sont des facteurs aggravants.
Épidémiologie du VRS
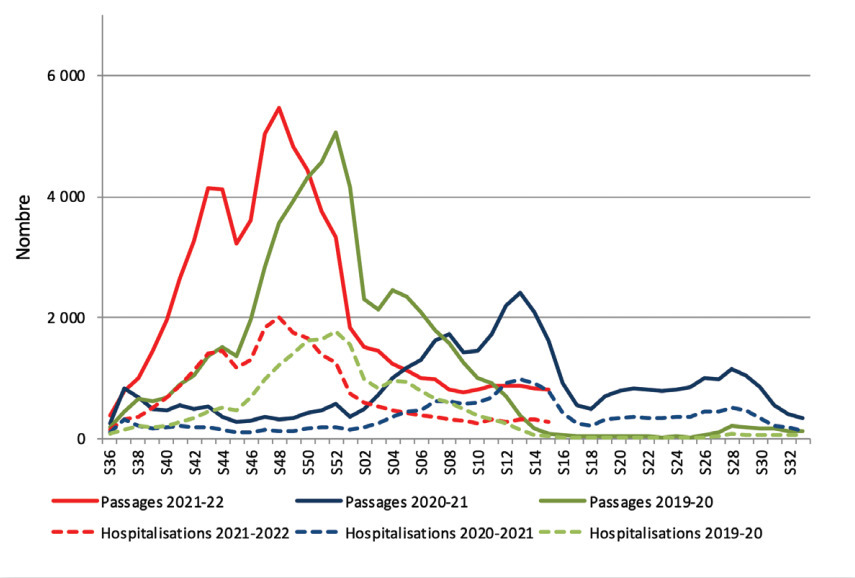
Le VRS touche particulièrement les deux extrêmes de la vie: très jeunes enfants et adultes vulnérables (facteurs de risque et plus de 65 ans). Le VRS est un virus quasi obligatoire de tous les enfants avant l’âge de 2 ans, dont 70% dès l’âge de 1 an. En France (période non pandémique), la saisonnalité est hivernale, comme dans tous les pays de l’hémisphère Nord. L’épidémie a lieu entre mi-octobre et mars de l’année suivante avec un pic en décembre. Ces dernières années, une augmentation de l’incidence de la bronchiolite est possiblement due à une circulation virale accentuée par une entrée précoce en collectivité, une densité de population importante dans les milieux urbains où les épidémies de bronchiolite débutent et sont les plus fortes (fig. 1). Les autres pays européens font des constats similaires, même si quelques variations dans la survenue et /ou l’intensité de l’épidémie sont observées. 1,2,3
La comparaison épidémiologique de co-circulation de divers virus respiratoires, selon la période annuelle de circulation et selon la tranche d’âge pédiatrique, montre que le VRS domine pendant l’automne et l’hiver chez les enfants de moins de 2ans, et même jusqu’à 4 ans. Chez les enfants de moins de 1an, parmi les bronchiolites consultant aux urgences pédiatriques, le VRS est le premier responsable (50%-70%) avec prédominance hivernale nette; d’autres virus respiratoires sont possibles.
Les co-infections à virus respiratoires sont possibles (rhinovirus, virus influenza…) mais sont un facteur de risque indépendant dans la survenue d’une infection sévère chez les enfants de moins de 2 ans.
Les conséquences de l’épidémie de SARS-Cov-2 sur la circulation du VRS pendant les saisons hivernales 2020-21 et 2021-22 sont sous-tendues par les mesures d’hygiène respiratoire, applicables chaque année à tous les virus respiratoires, devenues plus strictes (distanciation sociale dans certains lieux publics, mesures de confinement) pendant certaines périodes (semaines ou mois). En France, l’épidémie liée au VRS a été « écrasée», comme celle de la grippe. À la différence de cette dernière (complètement absente), un fort rebond a été observé pour le VRS avec une saison tardive printanière concernant des nourrissons d’âge plus élevé que d’habitude, voire des petits enfants (fig.2). Là encore, la France s’est alignée sur beaucoup d’autres pays des deux hémisphères. Les rhinovirus et les adénovirus, tous deux non enveloppés par une capsule lipidique, ont, eux, continué de circuler.
Surveillance
Santé publique France centralise les données sur l’épidémie de la bronchiolite de l’enfant de moins de 2 ans, dans toutes les régions de France métropolitaine, de La Réu[1]nion et de Mayotte. Elle s’appuie sur des réseaux de surveillance (consultations ambulatoires par SOS médecins, médecins libéraux, aux urgences et hospitalisations). Ceci est sous-tendu par des institutions (Institut Pasteur, Centre national de référence des virus des infections respiratoires des Hôpitaux civils de Lyon, Institut national de la santé et de la recherche médicale, SOS médecins, réseau Sentinelles, Société française de médecine d’urgence, Sorbonne Université (https://www.santepubliquefrance.fr/docs/virus-respiratoire-syncitial-vrs).
Ainsi, la saison épidémique de VRS 2021-2022 a débuté plus précocement que les années antérieures à la pandémie, dès mi-octobre avec près de six semaines d’avance, se terminant en semaine 6, du 7 février 2022. Le bulletin de la semaine 15, du 11 avril 2022, fait encore état de passages aux urgences (grâce au réseau OSCOUR®) pour bronchiolite dont 91% sont des enfants de moins de 1 an. Un tiers d’entre eux sera hospitalisé. Parmi les hospitalisés, 91% ont moins de 1 an (fig. 1).
Si la surveillance clinique de la bronchiolite est le moyen le plus simple et «sensible» d’approcher l’épidémiologie du VRS, mais non spécifique (d’autres virus respiratoires en étant aussi la cause), seule une surveillance virologique intensifiée permet de se faire une idée précise de la place du VRS dans la pathologie respiratoire haute et basse du jeune enfant.
On dispose à l’heure actuelle dans de plus en plus de centres de RT-PCR («real time-polymerase chain reaction»), méthode spécifique la plus sensible pour la détection de l’infection à VRS, mais aussi de PCR multiplex permettant d’estimer le rôle de nombreux (de 15 à 20) virus respiratoires saisonniers ou annuels. La surveillance virologique des virus respiratoires demande à être développée en France. Ceci permettra de mieux évaluer l’importance du VRS dans la pathologie respiratoire aux deux extrêmes de la vie, les coûts afférents et les stratégies de prévention. Ainsi, la charge de soins représentée par le VRS dans les bronchiolites chez les enfants de moins de 1an consultant aux urgences hospitalières, notamment, sera plus précise. Il serait intéressant d’utiliser des tests diagnostiques virologiques spécifiques et sensibles, peu onéreux, accessibles à l’endroit des soins pour tout médecin amené à prendre en charge des bronchiolites.
L’OMS appuie ces mesures dans le monde afin, en priorité, de diminuer la mortalité des enfants âgés de moins de 5 ans (difficulté d’accès aux soins, manque de ressources) avec un programme large (https://www.who. int/teams/global-influenza-programme/global-respiratory-syncytial-virus-surveillance).
Enfin, de nouvelles mesures de prévention primaire étant en cours d’élaboration (anticorps monoclonaux, vaccins avec diverses stratégies), l’amélioration des méthodes de surveillance virologique constituent un point clef pour une estimation des bénéfices de santé publique de ces mesures de prévention et leur évaluation ultérieure.
Les facteurs de risque majorant la sévérité de l’expression clinique
Chez la plupart des enfants, la bronchiolite évolue favorablement en dix à quinze jours. Cependant, certains nourrissons plus fragiles présentent une détresse respiratoire, responsable, chez les plus jeunes, d’une difficulté à boire leurs biberons, d’hypoxie ou d’apnées. Ces complications peuvent nécessiter leur hospitalisation. Le VRS est une cause importante de décès de jeunes enfants dans le monde, surtout en cas de recours limité aux soins, soit 2,3% de la mortalité chez l’enfant entre 0 et 27 jours et 6,7% chez l’enfant entre 28 et 364 jours.6
La grande majorité des bronchiolites, y compris les plus graves, touche des enfants à terme sans problème de santé sous-jacent.6 Les facteurs de risque de présenter une forme grave de bronchiolite sont un âge inférieur à 3 mois, une prématurité, le petit poids de naissance, le tabagisme maternel pendant la grossesse, une pathologie cardiaque ou respiratoire chronique sous-jacente.7 Des facteurs environnementaux favorisent également l’obstruction bronchique comme le tabagisme passif et la pollution atmosphérique.
Prise en charge ambulatoire de l’infection à VRS
On estime qu’un enfant sur cinq infecté par le VRS avant l’âge de 2 ans nécessitera des soins ambulatoires8 et un enfant sur cinquante devra être hospitalisé avant l’âge de 1 an.9 D’autres études américaines montrent que plus de 95% des soins chez les jeunes enfants infectés par le VRS sont ambulatoires.
Le traitement de l’infection respiratoire à VRS est essentiellement symptomatique. Des recommandations de prise en charge ambulatoire ont été publiées en 2019 par la Haute Autorité de santé (HAS).
Les hospitalisations associées à l’infection à VRS
Le VRS est une cause majeure d’hospitalisation des jeunes enfants dans le monde. Les études récentes ont cherché à décrire l’ensemble des pathologies respiratoires associées au VRS: les bronchiolites des nourrissons de moins de 1 an mais aussi les crises d’asthme touchant les enfants plus grands. L’étude Bronchiopic, réalisée en France sur huit années (de 2010 à 2018) a comptabilisé, en moyenne, 45225hospitalisations d’enfants de moins de 5 ans associées au VRS chaque année. Les hospitalisations associées au VRS sur une année représentent 22% à 28% des hospitalisations, toutes causes confondues, chez les enfants de moins de 1 an. La majorité (87%) de ces enfants n’a pas de pathologie sous-jacente. Au total, 69% ont moins de 1 an. Cette étude a également montré que les hospitalisations liées au VRS nécessitaient dans 3% des cas, une admission en soins intensifs (7% chez les enfants de moins de 3 mois) et entraînaient moins de 13 décès chaque saison dont deux tiers chez des enfants avec des facteurs de risque multiples.10
Ces résultats vont dans le sens d’une étude américaine conduite dans sept hôpitaux sur une saison épidémique (2015-2016) montrant que l’infection à VRS était associée à un tiers des hospitalisations pour détresse respiratoire aiguë des enfants de moins de 5 ans. Parmi ces enfants, 87% avaient moins de 2 ans, 50% moins de 6 mois et 67% n’avaient pas de pathologie sous-jacente. Le taux d’hospitalisations associées au VRS était de 2,9 pour 1 000 enfants de moins de 5 ans et de 14,7 pour 1000 enfants de moins de 6 mois et 25,1 pour 1000 enfants de moins de 1 mois.11
Les réhospitalisations dans les mois qui suivent un premier épisode hospitalisé
Les rechutes sont fréquentes pendant les deux premières années de vie. À partir du troisième épisode de bronchiolite, on parle d’asthme du nourrisson. L’étude Bronchiopic montre que, dans les trois mois suivant une hospitalisation initiale liée au VRS, 21% des enfants (dont 64% ont moins de 1 an) seront réhospitalisés et près de la moitié (12%) pour une autre infection à VRS, ce taux doublant chez les enfants prématurés (21,6%) comparés aux enfants nés à terme (11,1%).6
Les conséquences respiratoires à moyen et long terme des bronchiolites
De larges études épidémiologiques ont montré la relation non équivoque entre l’infection à VRS et la survenue ultérieure de sifflements («wheezing») durant l’enfance. Le VRS serait un inducteur de changements prolongés de contrôle neuro-immun dans les voies aériennes plus que responsables d’une sensibilisation allergique. Différents virus respiratoires sont à l’origine d’exacerbations chez les enfants asthmatiques avec des pré[1]valences variables : les entérovirus, métapneumovirus, rhinovirus et le VRS prédominent chez le jeune enfant.
L’estimation des coûts directs des hospitalisations associées au VRS
L’estimation des coûts directs des hospitalisations associées au VRS chez les enfants de moins de 5ans en France a été réalisée dans l’étude Bronchiopic.6 Le coût annuel moyen a été de 116 millions d’euros (M€) avec une augmentation progressive entre 2010-2011 (93,2 M€) et 2017- 2018 (124,1 M€). Le coût moyen d’une hospitalisation a été de 2289 € (en l’absence de facteur de risque: 2 208 €; en présence d’au moins un facteur de risque : 2947 €). Les nourrissons de moins de 1an ont représenté 80% de l’impact économique; nés à terme, ils ont généré 66% du coût total, là encore, avec une augmentation entre 2010-2011 (52,5 M€) et 2017-2018 (85,6 M€). L’ensemble des nourrissons cumulant ceux nés à terme et ceux d’âge gestation[1]nel inconnu représente 89% du coût total (2010-2011 : 83,3 M€; 2017-2018: 110,2 M€).
Tout jeune enfant ayant des facteurs de risque (prématurité en premier lieu, notamment avant 32 semaines de gestation; autres facteurs de risque : cardiopathie congénitale, dysplasie bronchopulmonaire, syndrome de Down…), par l’allongement possible de son hospitalisation justifiera des coûts plus élevés. Ces données ne prennent pas en compte les coûts de réhospitalisation dans les trois mois qui suivent. Plusieurs études dans différents pays européens et le Royaume-Uni vont dans le même sens en termes de coûts d’hospitalisation. Chaque pays doit conduire sa propre analyse des coûts globaux pour sous-tendre les décisions de santé publique.
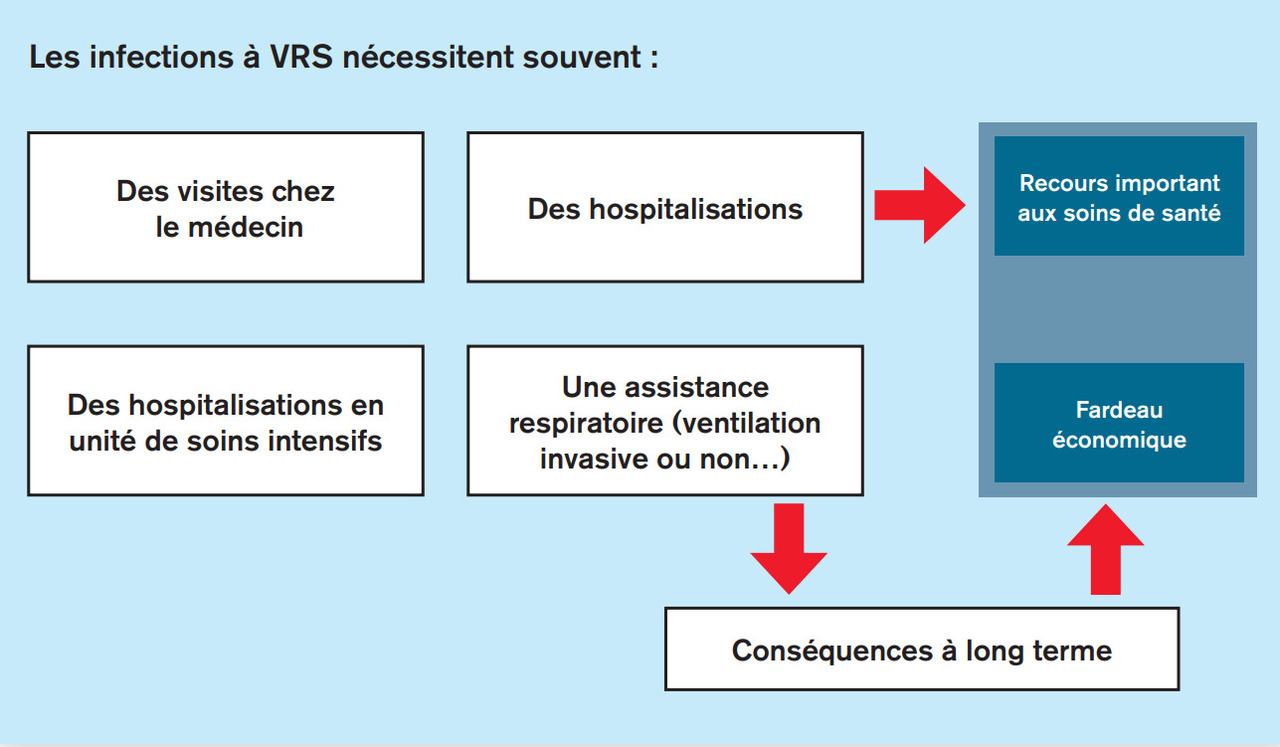
Les coûts afférents aux passages aux urgences et aux soins ambulatoires dans les différents secteurs de santé sont nettement moins bien connus en France. L’étude Bronchiopic 2, en cours, permettra de quantifier leur importance. Un coût est également induit par les otites moyennes aiguës du jeune nourrisson, dont le VRS est un agent, avec un risque d’excès de consommation antibiotique, comme pour les pneumonies qui peuvent compliquer la bronchiolite. À moyen et long terme, les épisodes de sifflement récurrents sont une source additionnelle de coûts ambulatoires et hospitaliers. Une vision utile globale de santé publique justifie que ces coûts soient pris en considération au moins chez les enfants de moins de 1 an (fig. 3). Enfin, à l’échelle d’une famille, plusieurs études constatent, outre l’absentéisme induit possible, un coût sociétal émotionnel (insomnie, fatigue, stress…) dans les quatre semaines suivant le premier épisode de bronchiolite.
CONCLUSION
Chaque année, l’ensemble des services de soins ambulatoires et hospitaliers supportent la charge aiguë d’activité saisonnière du VRS avec sa conséquence la plus immédiate et perceptible: la bronchiolite du très jeune enfant. Une estimation virologique plus précise est indispensable, non seulement réservée à quelques centres de référence, mais à l’échelle nationale, hospitalière, bien sûr, et ambulatoire aussi. La PCR (multiplex si possible) en est le pivot. Près de soixante-cinq ans après l’identification du VRS, nous approchons de mesures de prévention primaire (vaccins, anticorps monoclonaux) qui devraient permettre de réduire considérablement la pathologie induite par le VRS aux deux extrêmes de la vie, notamment la bronchiolite de l’enfant survenant avant l’âge de 1 an. Si la réponse immune induite par l’infection n’est pas encore complètement connue, une connaissance approfondie de la structure du VRS et de ses sites antigéniques les plus sensibles à la neutralisation par des anticorps, soit induits par la vaccination (immunisation active), soit administrés d’emblée en injection (immunisation passive), laisse entrevoir le bénéfice de ces démarches.
Cet article fait partie d'un supplément ayant bénéficié du soutien strictement institutionnel de Sanofi, sans intervention de leur part dans l’élaboration du sommaire, le choix des auteurs et la rédaction des articles.
Mejias A, Rodriguez-Fernandez R, Oliva S, Peeples ME, Ramilo O. The journey to a respiratory syncytial virus vaccine. Ann Allergy Asthma Immunol. 2020 Jul;125(1):36-46. doi: 10.1016/j.anai.2020.03.017.
2. OMS, virus respiratoire syncytial. https://apps.who.int/iris/browselocaleattribute=fr&type=mesh&rpp=55&authority=Respiratory%20Syncytial%20Viruses&etal=35&sort_by=1&order=ASC/10665/348866.
3. Bozzola E. Respiratory syncytial virus resurgence in Italy: The need to protect all neonates and young infants. Int J Environ Res Public Health. 2021 Dec 30;19(1):380. doi: 10.3390/ijerph19010380.
4. Smithgall M, Maykowski P, Zachariah P, Oberhardt M, Vargas CY, Reed C et al. Epidemiology, clinical features, and resource utilization associated with respiratory syncytial virus in the community and hospital. Influenza Other Respir Viruses. 2020 May; 14(3): 247–256. doi: 10.1111/irv.12723
5. Fourgeaud J, Toubiana J, Chappuy H, Delacourt C, Moulin F, Parize P et al. Impact of public health measures on the post-Covid-19 respiratory syncytial virus epidemics in France. Eur J Clin Microbiol Infect Dis. 2021 Nov;40(11):2389-95. doi: 10.1007/s10096-021-04323-1.
6. Shi T, McAllister DA, O’Brien KL, Simoes EAF, Madhi SA, Gessner BD et al. Global, regional, and national disease burden estimates of acute lower respiratory infections due to respiratory syncytial virus in young children in 2015: A systematic review and modelling study. Lancet. 2017;390(10098):946-58. doi: 10.1016/S0140-6736(17)30938-8).
7. Mansbach JM, Piedra PA, Stevenson MD, Sulklivan AF, Forgey TF, Clark S, et al. Prospective multicenter study of children with bronchiolitis requiring mechanical ventilation. Pediatrics. 2012Sept;130(3):e492-500. doi: 10.1542/peds.2012-0444.
8. Lively JY, Curns AT, Weinberg GA, Edwards KM, Staat MA, Prill MM, et al. Respiratory syncytial virus-associated outpatient visits among children younger than 24 months; J Pediatric Infect Dis Soc. 2019;8(3):284-6. doi: 10.1093/jpids/piz011.
9. McLaughlin JM, Khan F, Schmitt HJ, Agosti Y, Jodar L, Simões EAF et al. Respiratory syncytial virus–Associated hospitalization rates among US infants: A systematic review and meta-analysis. J Inf Dis, 2022;225(6):1100-11, https://doi.org/
10.1093/infdis/jiaa752. 10. Demont C, Petrica N, Bardoulat I, Duret S, Watier L, Chosidow A et al. Economic and disease burden of RSV- associated hospitalizations in young children in France, from 2010 through 2018. BMC Inf Dis. 2021 Aug 2;21(1):730. doi.org/10.1186/s12879-021-06399-8.
11. Rha B, Curns AT, Lively JY, Campbell AP, Englund JA, Boom JA et al. Respiratory syncytial virus-associated hospitalizations among young children: 2015-2016. Pediatrics. 2020 Jul;146(1):e20193611. doi: 10.1542/peds.2019-3611.
12. Casalegno JS, et al. Pyramide des âges des cas de VRS par saison épidémique (Hôpitaux universitaires de Lyon et Saint-Étienne, France, saisons 2018-2019 et 2019-2020 et saison 2020-2021. Euro Surveill. 2021;26(29).
En collaboration avec :
Dans cet article
- Le virus respiratoire syncytial (VRS)
- Épidémiologie du VRS
- Les facteurs de risque majorant la sévérité de l’expression clinique
- Prise en charge ambulatoire de l’infection à VRS
- Les hospitalisations associées à l’infection à VRS
- Les conséquences respiratoires à moyen et long terme des bronchiolites
- L’estimation des coûts directs des hospitalisations associées au VRS
- CONCLUSION