La fibrillation atriale (FA) se définit comme un trouble du rythme cardiaque caractérisé par une activité électrique atriale rapide et anarchique. Elle a été d’abord décrite cliniquement comme la coexistence d’un pouls rapide et irrégulier, souvent associé à une sténose mitrale. A ensuite été décrite la perte de la pulsatilité jugulaire, ce qui a conduit à poser l’hypothèse d’une inactivité des oreillettes. Einthoven enregistra pour la première fois l’électrocardiogramme d’un patient en FA, mais la réelle description électrocardiographique d’une activité atriale irrégulière rapide et anarchique a été réalisée en 1908 par trois auteurs (Lewis à Londres, Rothberger et Winterberg à Vienne). Sur le plan épidémiologique, la FA est aujourd’hui le trouble du rythme le plus répandu. Il entraîne des conséquences lourdes en termes de morbidité et de mortalité, ce qui en fait un problème de santé publique mondial. Sur le plan physiopathologique, de gros progrès ont été faits pour comprendre les mécanismes permettant d’initier et de maintenir cette activité chaotique.
Épidémiologie1
Incidences et prévalences globales
L’épidémiologie de la FA et de ses conséquences a surtout été établie dans les pays occidentaux. Il s’agit de l’arythmie cliniquement significative la plus fréquente, et l’on estimait en 2010 que plus de 30 millions de patients étaient atteints ; un tiers de ces patients étaient des femmes et deux tiers des hommes ; cela représente environ 1 à 4 % de la population générale dans les pays occidentaux et plus de 13 % des patients de plus de 80 ans (v . tableau résumé ).
La prévalence comme l’incidence de la FA ont augmenté sur les dernières décennies. Cette augmentation se retrouve à des degrés divers quels que soient l’âge, le sexe ou le niveau de développement économique du pays, à tel point que certains auteurs parlent d’une « épidémie » de FA. Dans les pays occidentaux, la FA concerne 1 adulte sur 4 au cours de sa vie (lifetime risk). La construction de modèles permet d’estimer que, dans 30 à 40 ans, la FA touchera plus de 8 millions de patients aux États-Unis, 18 millions en Europe, 700 000 au Japon ou 9 millions en Chine. Les estimations en Inde ou en Afrique sont moins précises, mais la conjonction du vieillissement de la population et de l’augmentation des facteurs de risque cardiovasculaire devrait là encore entraîner une augmentation des cas de FA.
Ces études épidémiologiques souffrent de plusieurs imperfections : analyses transversales à un temps donné, non-représentativité de la population incluse, surreprésentation des populations vivant en zone urbaine, non-prise en compte de l’évolutivité de pathologies intriquées comme les pathologies rhumatismales… Elles concordent néanmoins sur cette augmentation progressive de la FA ; cette dernière est reliée à une augmentation parallèle des facteurs de risque de FA, en particulier au vieillissement de la population, mais aussi à de meilleurs outils de détection de la FA silencieuse, notamment après un épisode cérébral. Il faut enfin pointer l’existence de disparités régionales : la FA semble particulièrement présente dans les populations d’origine caucasienne ; ce dernier élément a notamment été retrouvé au sein de populations de patients porteurs de défibrillateurs implantables.
La prévalence comme l’incidence de la FA ont augmenté sur les dernières décennies. Cette augmentation se retrouve à des degrés divers quels que soient l’âge, le sexe ou le niveau de développement économique du pays, à tel point que certains auteurs parlent d’une « épidémie » de FA. Dans les pays occidentaux, la FA concerne 1 adulte sur 4 au cours de sa vie (lifetime risk). La construction de modèles permet d’estimer que, dans 30 à 40 ans, la FA touchera plus de 8 millions de patients aux États-Unis, 18 millions en Europe, 700 000 au Japon ou 9 millions en Chine. Les estimations en Inde ou en Afrique sont moins précises, mais la conjonction du vieillissement de la population et de l’augmentation des facteurs de risque cardiovasculaire devrait là encore entraîner une augmentation des cas de FA.
Ces études épidémiologiques souffrent de plusieurs imperfections : analyses transversales à un temps donné, non-représentativité de la population incluse, surreprésentation des populations vivant en zone urbaine, non-prise en compte de l’évolutivité de pathologies intriquées comme les pathologies rhumatismales… Elles concordent néanmoins sur cette augmentation progressive de la FA ; cette dernière est reliée à une augmentation parallèle des facteurs de risque de FA, en particulier au vieillissement de la population, mais aussi à de meilleurs outils de détection de la FA silencieuse, notamment après un épisode cérébral. Il faut enfin pointer l’existence de disparités régionales : la FA semble particulièrement présente dans les populations d’origine caucasienne ; ce dernier élément a notamment été retrouvé au sein de populations de patients porteurs de défibrillateurs implantables.
Facteurs de risque
L’incidence et la prévalence de la FA sont conditionnées par plusieurs facteurs de risque : l’âge, le sexe, l’obésité, l’hypertension artérielle, le diabète, la présence d’une atteinte coronarienne, d’une insuffisance cardiaque ou d’une cardiopathie rhumatismale et/ou valvulaire.
Dans les pays occidentaux, il existe une claire corrélation entre l’âge et la survenue de FA ; 70 % des cas de FA sont observés après 65 ans, et l’on estime que la prévalence de la FA double à chaque décennie de la vie. Le sexe masculin est un facteur de risque retrouvé dans la quasi-totalité des études, avec un sex-ratio allant de 1,1 à 3,3. Dans une étude estimant la prévalence mondiale globale de la FA, celle-ci intéressait 596/100 000 hommes et 373/100 000 femmes (sex-ratio de 1,6). L’obésité et le surpoids (indice de masse corporelle > 25 kg/m²) augmentent le risque de survenue de FA d’un facteur 1,6. L’obésité augmente aussi le risque de récurrence de 31 % des épisodes de FA. Dans l’étude australienne LEGACY,2 une prise en charge efficace et pérenne de l’obésité chez des patients bénéficiant d’une ablation de FA doublait le taux de succès de la procédure, c’est-à dire le maintien en rythme sinusal. L’hypertension est retrouvée chez plus de la moitié des patients ayant une FA, et le diabète dans 1 cas sur 5. La prise en charge individuelle d’un seul de ces facteurs n’est toutefois pas suffisante dans la plupart des cas pour observer un effet sur la FA. À l’inverse, dans l’étude RACE-3,3 la prise en charge combinée et agressive de l’ensemble des facteurs de risque a permis un meilleur maintien du rythme sinusal (75 % vs 63 %) chez des patients ayant une FA symptomatique associée à des facteurs de risque multiples.
Concernant l’insuffisance cardiaque et la coronaropathie, on note que ces pathologies et la FA partagent les mêmes facteurs de risque. De plus, la FA et l’insuffisance cardiaque interagissent, et l’on considère que la FA peut être une cause comme une conséquence de l’insuffisance cardiaque, et réciproquement. Chez les patients insuffisants cardiaques, le risque de développer une FA est triplé par rapport à la population générale. De plus, le fait d’avoir une association des deux pathologies augmente la mortalité de manière importante au moment du passage en FA (odds ratio [OR] > 2 ; on parle alors de FA incidente). À plus long terme, l’augmentation de mortalité est plus modeste (OR : 1,1-1,4 ; on parle de FA prévalente). Le contrôle de la FA dans des populations sélectionnées de patients insuffisants cardiaques a été associé à une amélioration de la fonction cardiaque et de la survie.
Un quart des patients en FA ont une cardiopathie valvulaire, en particulier rhumatismale, associée. Ces tableaux cliniques sont particulièrement fréquents en Afrique et en Asie, où le rhumatisme articulaire aigu est encore très fréquent.
D’autres facteurs de risque moins fréquents sont classiquement retrouvés : pour les FA aiguës, l’hyperthyroïdie, l’hypokaliémie, la consommation aiguë d’alcool ou encore les phénomènes inflammatoires prononcés. Concernant l’activité physique, la relation est non linéaire, avec un effet protecteur d’une activité physique modérée et un effet délétère d’une trop grande sédentarité ou, au contraire, d’un niveau d’activité très élevé.
Dans les pays occidentaux, il existe une claire corrélation entre l’âge et la survenue de FA ; 70 % des cas de FA sont observés après 65 ans, et l’on estime que la prévalence de la FA double à chaque décennie de la vie. Le sexe masculin est un facteur de risque retrouvé dans la quasi-totalité des études, avec un sex-ratio allant de 1,1 à 3,3. Dans une étude estimant la prévalence mondiale globale de la FA, celle-ci intéressait 596/100 000 hommes et 373/100 000 femmes (sex-ratio de 1,6). L’obésité et le surpoids (indice de masse corporelle > 25 kg/m²) augmentent le risque de survenue de FA d’un facteur 1,6. L’obésité augmente aussi le risque de récurrence de 31 % des épisodes de FA. Dans l’étude australienne LEGACY,2 une prise en charge efficace et pérenne de l’obésité chez des patients bénéficiant d’une ablation de FA doublait le taux de succès de la procédure, c’est-à dire le maintien en rythme sinusal. L’hypertension est retrouvée chez plus de la moitié des patients ayant une FA, et le diabète dans 1 cas sur 5. La prise en charge individuelle d’un seul de ces facteurs n’est toutefois pas suffisante dans la plupart des cas pour observer un effet sur la FA. À l’inverse, dans l’étude RACE-3,3 la prise en charge combinée et agressive de l’ensemble des facteurs de risque a permis un meilleur maintien du rythme sinusal (75 % vs 63 %) chez des patients ayant une FA symptomatique associée à des facteurs de risque multiples.
Concernant l’insuffisance cardiaque et la coronaropathie, on note que ces pathologies et la FA partagent les mêmes facteurs de risque. De plus, la FA et l’insuffisance cardiaque interagissent, et l’on considère que la FA peut être une cause comme une conséquence de l’insuffisance cardiaque, et réciproquement. Chez les patients insuffisants cardiaques, le risque de développer une FA est triplé par rapport à la population générale. De plus, le fait d’avoir une association des deux pathologies augmente la mortalité de manière importante au moment du passage en FA (odds ratio [OR] > 2 ; on parle alors de FA incidente). À plus long terme, l’augmentation de mortalité est plus modeste (OR : 1,1-1,4 ; on parle de FA prévalente). Le contrôle de la FA dans des populations sélectionnées de patients insuffisants cardiaques a été associé à une amélioration de la fonction cardiaque et de la survie.
Un quart des patients en FA ont une cardiopathie valvulaire, en particulier rhumatismale, associée. Ces tableaux cliniques sont particulièrement fréquents en Afrique et en Asie, où le rhumatisme articulaire aigu est encore très fréquent.
D’autres facteurs de risque moins fréquents sont classiquement retrouvés : pour les FA aiguës, l’hyperthyroïdie, l’hypokaliémie, la consommation aiguë d’alcool ou encore les phénomènes inflammatoires prononcés. Concernant l’activité physique, la relation est non linéaire, avec un effet protecteur d’une activité physique modérée et un effet délétère d’une trop grande sédentarité ou, au contraire, d’un niveau d’activité très élevé.
Conséquences et pronostic
La FA a des conséquences lourdes. Elle augmente la mortalité globale d’un facteur 2 chez les femmes et 1,5 chez les hommes. Cette surmortalité est essentiellement due à des événements cardiovasculaires (mort subite, insuffisance cardiaque) et non pas seulement à une augmentation des accidents vasculaires cérébraux (AVC).
Concernant ces derniers, on estime que la FA augmente d’un facteur 5 le risque de faire un AVC, et 20 à 30 % de ces derniers sont dus à de la FA, même si la relation temporelle entre les épisodes rythmiques et cérébraux n’est pas toujours claire. Le surrisque de faire un AVC attribuable à la FA dépend de facteurs résumés dans les scores CHADS2 et CHADS2-VASc2 (v . p. 903 ). Ces scores permettent de distinguer des populations qui ont un risque annuel d’AVC qui s’échelonne de 0 à 15 %. Les AVC dus à la FA ont classiquement un pronostic plus sombre, avec un surrisque de décès augmenté d’un facteur 1,7, un plus haut taux de séquelles et une durée d’hospitalisation plus longue.
La FA double le risque de développer une démence, y compris parmi les patients qui n’ont pas d’AVC. Plus largement, les performances cognitives déclinent plus rapidement chez les patients en FA qu’en rythme sinusal.
Comme précédemment signalé, il existe des liens forts entre insuffisance cardiaque et FA. Après un premier épisode de FA, 7,8 % des patients développeront une insuffisance cardiaque dans la première année et 20 % dans les 5 années qui suivent.
En termes de santé publique et d’économie de la santé, les coûts induits par la FA sont extrêmement lourds. On estime qu’entre 10 et 40 % des patients atteints de FA seront hospitalisés chaque année. Sur un plan économique, la prise en charge de la FA et de ses complications représente environ 1 % des dépenses de santé au Royaume-Uni et 6 à 26 milliards de dollars aux États-Unis. En Europe, l’étude Euro Heart Survey4 a permis de mesurer que le coût annuel de la FA s’échelonne de 1 500 à 3 200 euros par patient. Ces estimations rejoignent celle de l’étude française COCAF, qui retrouvait aussi un coût de 3 200 euros par an et par patient.5 Ces coûts sont probablement sous-estimés car ils ne prennent pas forcément en compte l’ensemble des complications engendrées par la FA. Il s’agit donc non seulement d’un problème de santé publique mais aussi d’un problème économique majeur.
Concernant ces derniers, on estime que la FA augmente d’un facteur 5 le risque de faire un AVC, et 20 à 30 % de ces derniers sont dus à de la FA, même si la relation temporelle entre les épisodes rythmiques et cérébraux n’est pas toujours claire. Le surrisque de faire un AVC attribuable à la FA dépend de facteurs résumés dans les scores CHADS2 et CHADS2-VASc2 (
La FA double le risque de développer une démence, y compris parmi les patients qui n’ont pas d’AVC. Plus largement, les performances cognitives déclinent plus rapidement chez les patients en FA qu’en rythme sinusal.
Comme précédemment signalé, il existe des liens forts entre insuffisance cardiaque et FA. Après un premier épisode de FA, 7,8 % des patients développeront une insuffisance cardiaque dans la première année et 20 % dans les 5 années qui suivent.
En termes de santé publique et d’économie de la santé, les coûts induits par la FA sont extrêmement lourds. On estime qu’entre 10 et 40 % des patients atteints de FA seront hospitalisés chaque année. Sur un plan économique, la prise en charge de la FA et de ses complications représente environ 1 % des dépenses de santé au Royaume-Uni et 6 à 26 milliards de dollars aux États-Unis. En Europe, l’étude Euro Heart Survey4 a permis de mesurer que le coût annuel de la FA s’échelonne de 1 500 à 3 200 euros par patient. Ces estimations rejoignent celle de l’étude française COCAF, qui retrouvait aussi un coût de 3 200 euros par an et par patient.5 Ces coûts sont probablement sous-estimés car ils ne prennent pas forcément en compte l’ensemble des complications engendrées par la FA. Il s’agit donc non seulement d’un problème de santé publique mais aussi d’un problème économique majeur.
Physiopathologie6
La FA est définie comme un trouble du rythme cardiaque qui se caractérise par une activité électrique atriale rapide et anarchique. Deux grandes théories coexistent pour expliquer ce trouble du rythme : la théorie focale et celle de la réentrée. La théorie focale stipule que certaines structures cellulaires peuvent produire des dépolarisations supplémentaires, et par là déclencher et maintenir la FA. La théorie de la réentrée pose l’hypothèse qu’un front de dépolarisation puisse se réactiver de manière périodique au sein du massif atrial. À ces deux grandes théories se sont ajoutées des connaissances supplémentaires sur l’homéostasie calcique, le métabolisme et la génétique de ce trouble du rythme complexe.
Facteurs favorisant la fibrillation
Les principaux facteurs de risque cardiovasculaire (hypertension, âge, diabète) induisent un remodelage atrial qui peut faire le lit de la FA (v. infra ).
Concernant le tonus vagal, celui-ci peut être augmenté au cours des déclenchements nocturnes de FA, dite FA vagale. Cette stimulation vagale active le courant atrial potassique dépendant de l’acétylcholine IK, Ach, ce qui va raccourcir le PA atrial et ses périodes réfractaires.
À l’opposé, la stimulation sympathique peut provoquer des activités déclenchées (v. infra ) et, là aussi, un raccourcissement du potentiel d’action secondaire à une activation conjointe des courants calciques et potassiques.
Formes génétiques de FA
La FA a été associée à un vieillissement pathologique de l’oreillette et a longtemps été considérée plus comme une pathologie dégénérative que génétique. Les principales avancées dans ce domaine ont été la mise en évidence de formes familiales de FA chez des patients jeunes ayant des mutations au sein des canaux ioniques membranaires déterminant le potentiel d’action (PA) myocardique atrial (canaux potassiques pour certains syndromes du QT court, canaux sodiques sur le syndrome de Brugada). La FA était dans ces familles un des modes d’expression d’une « canalopathie » pouvant atteindre l’électrophysiologie cardiaque de manière plus large. Plus récemment, des genome-wide association studies (GWAS) ont permis de suspecter une association entre certains variants et un risque accru de FA ;7 ces résultats demandent à être confirmés.Rôle du système nerveux autonome
Les hyperactivités vagales ou sympathiques peuvent déclencher une FA.Concernant le tonus vagal, celui-ci peut être augmenté au cours des déclenchements nocturnes de FA, dite FA vagale. Cette stimulation vagale active le courant atrial potassique dépendant de l’acétylcholine IK, Ach, ce qui va raccourcir le PA atrial et ses périodes réfractaires.
À l’opposé, la stimulation sympathique peut provoquer des activités déclenchées (
Initiation de la FA : influx ectopiques
Électrophysiologie des veines pulmonaires
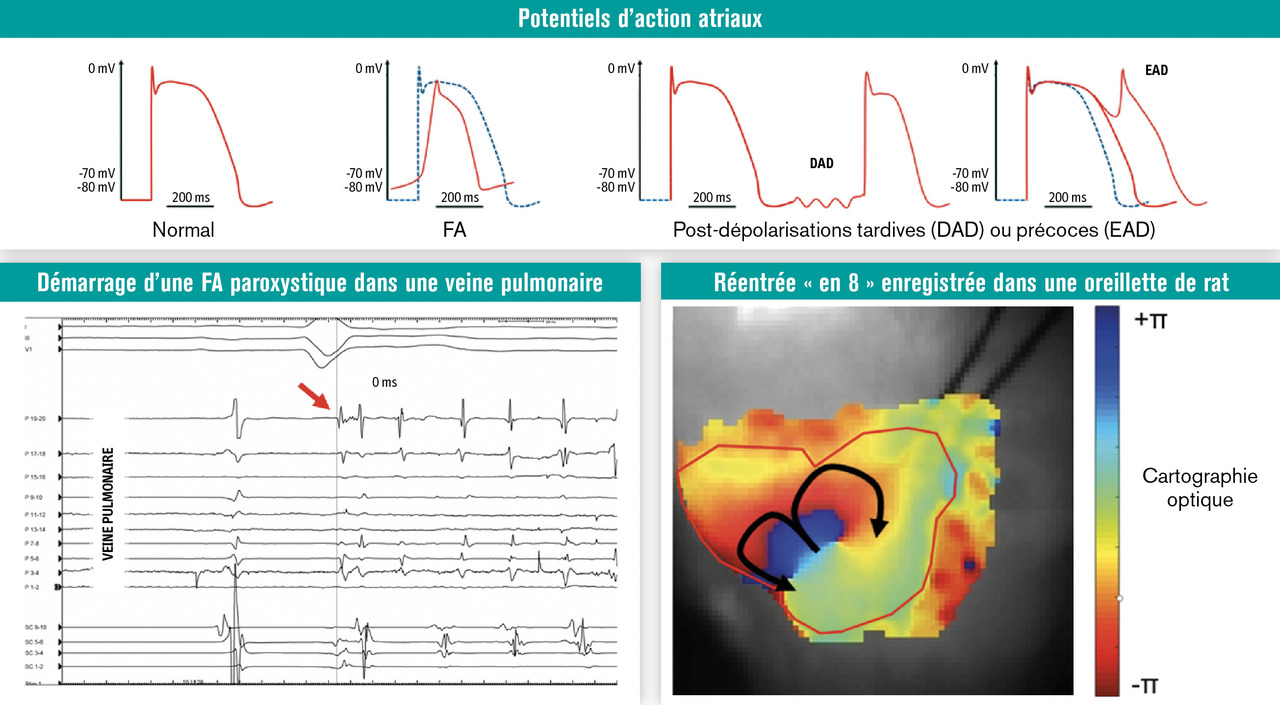
Les publications8 de M. Haissaguerre et de son équipe au milieu des années 1990 ont permis de mettre en évidence que les FA paroxystiques avaient pour origine des activités électriques anormales localisées dans les veines pulmonaires (Activités déclenchées
Les activités déclenchées correspondent à des PA supplémentaires provoquées par des anomalies présentes lors du PA précédent ; il s’agit donc de post-dépolarisations (Maintien de la FA
Les mécanismes de déclenchement et de perpétuation de la FA sont différents. Même si certains auteurs ont présenté l’hypothèse de la perpétuation des activités déclenchantes associées à une conduction anarchique (fibrillatoire) pour expliquer les épisodes prolongés de FA, il semble maintenant clair que les épisodes prolongés de FA s’accompagnent de changements tant au niveau des cellules myocardiques qu’au niveau de sa matrice extracellulaire, changements qui se traduisent anatomiquement par une dilatation de l’oreillette gauche. Ces modifications, appelées remodelage atrial, sont en elles-mêmes pro-arythmogènes, ce qui a fait dire que la FA entraînait la FA (“AF begets AF”9).
v . figure, partie C ). Plusieurs hypothèses mécanistiques concernant ces circuits ont été documentées. La première est l’existence sur les arythmies plus stables (flutter) de circuits tournant autour d’un ou plusieurs obstacles anatomiques ou fonctionnels électriquement neutres. Ces réentrées se perpétuent si leur longueur d’onde est au moins égale à la taille du circuit. Cette longueur d’onde λ dépend des vitesses de conduction (CV) et des périodes réfractaires (RR) selon la formule λ = CV × PR. Les antiarythmiques agissant sur les vitesses de conduction (classe I) ou sur les périodes réfractaires (classe III) peuvent agir sur ces circuits. Par la suite, d’autres mécanismes de réentrée ont été évoqués : G. Moe a émis l’hypothèse de vaguelettes plus ou moins nombreuses et instables se recyclant de manière aléatoire ;10 Allessie a présumé l’existence d’un circuit réentrant dominant rayonnant sur le reste de l’oreillette par une conduction fibrillante ;11 A. Winfree et P. Jalife ont théorisé puis documenté l’existence de réentrée spiroïde appelée rotor.12 Plus récemment, Allessie a aussi noté que des phénomènes de réentrée pouvaient être observés dans l’épaisseur du mur myocardique atrial entre épicarde et endocarde.13 L’étude de ces phénomènes et la caractérisation des points-clés permettant la perpétuation de ces circuits pourraient en théorie permettre soit d’adapter le traitement antiarythmique, soit de détruire par ablation les zones (ou isthmes) critiques. En pratique, si les preuves manquent encore concernant les patients qui sont en FA, la cartographie et l’ablation de ces isthmes critiques est une étape importante de la prise en charge rythmologique des patients qui ont des arythmies atriales organisées.
L’altération de la phase 0 est inconstante. Elle peut résulter d’une baisse de courant sodique soit fonctionnelle (due à une repolarisation incomplète en cas de cadence atriale élevée), soit à une baisse modérée de l’expression des canaux sodiques Nav1.5.
La disparition du notch en phase 1 est due à une baisse du courant potassique sortant transitoire Ito, lui-même secondaire à une baisse d’expression de la protéine Kv4.3. Par la suite, le raccourcissement des phases 2 et 3 est dû à la conjonction d’une baisse du courant dépolarisant calcique ICaL, et à un maintien ou à une augmentation des courants potassiques repolarisants (IKr et IKs sont maintenus, IK1, IKACh et IK2P sont augmentés).
Perpétuation de la FA et réentrée
Au-delà de la conduction anarchique des influx à partir d’un ou plusieurs foyers ectopiques, la perpétuation de la FA peut passer par un réensemencement circulaire du myocarde atrial par une vague de dépolarisation qu’on appelle circuit de réentrée (Remodelage électrophysiologique
Après l’initiation d’une FA, le potentiel d’action atrial va profondément s’altérer. Ce remodelage est en lui-même pro-arythmogène. La forme du PA est altérée : la phase 0 de dépolarisation est moins aiguë, la phase 1 (notch) est altérée alors que les phases 2 et 3 de plateau sont raccourcies avec un retour rapide au potentiel de repos.L’altération de la phase 0 est inconstante. Elle peut résulter d’une baisse de courant sodique soit fonctionnelle (due à une repolarisation incomplète en cas de cadence atriale élevée), soit à une baisse modérée de l’expression des canaux sodiques Nav1.5.
La disparition du notch en phase 1 est due à une baisse du courant potassique sortant transitoire Ito, lui-même secondaire à une baisse d’expression de la protéine Kv4.3. Par la suite, le raccourcissement des phases 2 et 3 est dû à la conjonction d’une baisse du courant dépolarisant calcique ICaL, et à un maintien ou à une augmentation des courants potassiques repolarisants (IKr et IKs sont maintenus, IK1, IKACh et IK2P sont augmentés).
Remodelage tissulaire
Au-delà des modifications cardiomyocytaires, la matrice extracellulaire est elle aussi profondément remaniée dans la FA. Ce remodelage est d’autant plus important que le trouble du rythme est ancien et qu’il s’associe à une surcharge de pression atriale, elle-même potentiellement secondaire à plusieurs facteurs (insuffisance cardiaque, hypertension artérielle…). Le remodelage de la matrice extracellulaire est médié par des cellules non cardiomyocytaires, les fibroblastes et les myofibroblastes, et dépend de plusieurs voies de signalisation endocrines (axe rénine-angiotensine-aldostérone) et paracrine (voie du transforming growth factor beta [TGF-β] et du platelet-derived growth factor B [PDGF-B]). Elles ont pour effet la production de collagène qui, en s’accumulant, forme des travées de fibroses au sein du myocarde atrial. Plus récemment, il a été démontré que le tissu adipeux péricardique pouvait jouer un rôle clé dans le remodelage tissulaire : les cellules progénitrices dérivées de l’épicarde ont la capacité de se différencier en adipocytes. Ce tissu adipeux épicardique est capable d’induire une fibrose atriale par un effet paracrine, là encore par des molécules proches du TGF-β.Remodelage intracellulaire
À la suite du passage en FA, les cadences atriales rapides et irrégulières vont entraîner un remodelage du métabolisme calcique intracellulaire. Celui-ci est retenu dans le réticulum sarcoplasmique pendant la diastole. À la suite du potentiel d’action, le courant calcique lent fait entrer une petite quantité de calcium dans le cytoplasme, calcium qui va lui-même déclencher un passage rapide et transitoire du calcium contenu dans le réticulum sarcoplasmique vers le cytoplasme, utilisant successivement le récepteur à la ryanodine (RyR2) puis la pompe SERCA2. En cas de FA, on observe une hausse de la concentration cytosolique de calcium (alors même que celle-ci est habituellement basse) mais aussi une baisse importante de ces transitoires calciques. Ces modifications ont plusieurs conséquences : elles activent des voies de signalisation proches de celles de l’insuffisance cardiaque (par exemple, la calcium calmoduline kinase [CaMKII]) ; elles participent à l’incompétence contractile du myocarde atrial ; elles ont des effets pro-arythmogènes par activation de l’échangeur sodium-calcium, qui va dépolariser le cardiomyocyte en faisant sortir un ion calcium contre l’entrée de 3 ions sodium.Conclusion
Au cours des deux dernières décennies, de grands progrès ont été fait dans la compréhension de la FA. La compréhension de cette maladie dont la définition même comporte une part de chaos (et donc de mystère) a permis d’apporter des traitements plus efficaces, en particulier pour ses formes paroxystiques. Concernant les formes persistantes, les données épidémiologiques et physiopathologiques actuelles témoignent d’une pathologie complexe et multifactorielle. Le traitement de cette cardiomyopathie atriale nécessite, pour être efficace, une prise en charge globale (ou « holistique » selon les dernières recommandations européennes) au-delà d’une approche électrophysiologique isolée.
Références
1. Hindricks G, et al; ESC Scientific Document Group. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association of Cardio-Thoracic Surgery (EACTS): the task force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J 2020;ehaa612.
2. Pathak RK, et al. Long-term effect of goal-directed weight management in an atrial fibrillation cohort: a long-term follow-up study (LEGACY).J Am Coll Cardiol 2015;65:2159-69.
3. Rienstra M, et al ; RACE 3 Investigators. Targeted therapy of underlying conditions improves sinus rhythm maintenance in patients with persistent atrial fibrillation: results of the RACE 3 trial. Eur Heart J 2018;39:2987-96.
4. Ringborg A, et al. Costs of atrial fibrillation in five European countries: results from the Euro Heart Survey on atrial fibrillation. Europace 2008;10:403-11.
5. Le Heuzey JY, et al. Cost of care distribution in atrial fibrillation patients: the COCAF study. Am Heart J 2004;147:121-6.
6. Proukhnitzky J, et al. Électrophysiologie fondamentale et clinique. Aspects moléculaires et cellulaires de la fibrillation atriale. In : Biologie et pathologie du cœur et des vaisseaux (3e éd). John Libbey – Eurotext, 11 avril 2019;ISBN 13:9782742015818.
7. Ellinor PT, et al. Meta-analysis identifies six new susceptibility loci for atrial fibrillation. Nat Genet 2012;44:670-5.
8. Haissaguerre M, et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med 1998;339:659-66.
9. Wijffels MC, Kirchhof CJ, Dorland R, Allessie MA. Atrial fibrillation begets atrial fibrillation. A study in awake chronically instrumented goats. Circulation 1995;92:1954-68.
10. Moe GK, Rheinboldt WC, Abildskov JA. A computer model of atrial fibrillation. Am Heart J 1964;67:200-20.
11. Allessie MA, Bonke FI, Schopman FJ. Circus movement in rabbit atrial muscle as a mechanism of tachycardia. III. The "leading circle" concept: a new model of circus movement in cardiac tissue without the involvement of an anatomical obstacle. Circ Res 1977;41:9-18.
12. Jalife J, Berenfeld O, Mansour M. Mother rotors and fibrillatory conduction: a mechanism of atrial fibrillation. Cardiovascular research 2002;54:204-16.
13. Eckstein J, et al. Time course and mechanisms of endo-epicardial electrical dissociation during atrial fibrillation in the goat. Cardiovasc Res 2011;89:816-24.
2. Pathak RK, et al. Long-term effect of goal-directed weight management in an atrial fibrillation cohort: a long-term follow-up study (LEGACY).J Am Coll Cardiol 2015;65:2159-69.
3. Rienstra M, et al ; RACE 3 Investigators. Targeted therapy of underlying conditions improves sinus rhythm maintenance in patients with persistent atrial fibrillation: results of the RACE 3 trial. Eur Heart J 2018;39:2987-96.
4. Ringborg A, et al. Costs of atrial fibrillation in five European countries: results from the Euro Heart Survey on atrial fibrillation. Europace 2008;10:403-11.
5. Le Heuzey JY, et al. Cost of care distribution in atrial fibrillation patients: the COCAF study. Am Heart J 2004;147:121-6.
6. Proukhnitzky J, et al. Électrophysiologie fondamentale et clinique. Aspects moléculaires et cellulaires de la fibrillation atriale. In : Biologie et pathologie du cœur et des vaisseaux (3e éd). John Libbey – Eurotext, 11 avril 2019;ISBN 13:9782742015818.
7. Ellinor PT, et al. Meta-analysis identifies six new susceptibility loci for atrial fibrillation. Nat Genet 2012;44:670-5.
8. Haissaguerre M, et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med 1998;339:659-66.
9. Wijffels MC, Kirchhof CJ, Dorland R, Allessie MA. Atrial fibrillation begets atrial fibrillation. A study in awake chronically instrumented goats. Circulation 1995;92:1954-68.
10. Moe GK, Rheinboldt WC, Abildskov JA. A computer model of atrial fibrillation. Am Heart J 1964;67:200-20.
11. Allessie MA, Bonke FI, Schopman FJ. Circus movement in rabbit atrial muscle as a mechanism of tachycardia. III. The "leading circle" concept: a new model of circus movement in cardiac tissue without the involvement of an anatomical obstacle. Circ Res 1977;41:9-18.
12. Jalife J, Berenfeld O, Mansour M. Mother rotors and fibrillatory conduction: a mechanism of atrial fibrillation. Cardiovascular research 2002;54:204-16.
13. Eckstein J, et al. Time course and mechanisms of endo-epicardial electrical dissociation during atrial fibrillation in the goat. Cardiovasc Res 2011;89:816-24.