Les vascularites sont un groupe de pathologies hétérogènes caractérisées par une inflammation de la paroi vasculaire. Elles sont classées en fonction de la taille des vaisseaux atteints.
Les vascularites des gros vaisseaux, qui touchent l’aorte et ses principales branches jusqu’à l’entrée dans les organes, sont l’artérite de Takayasu et l’artérite à cellules géantes (ACG).1 Cette dernière, anciennement dénommée maladie de Horton, est la plus fréquente des vascularites de l’adulte. Elle atteint avec prédilection les branches de l’artère carotide externe, en particulier l’artère temporale. Toutefois, les données de l’imagerie vasculaire, qui est de plus en plus utilisée pour le diagnostic de l’ACG, ont montré que cette vascularite atteignait également fréquemment l’aorte et ses branches, en particulier les artères des membres supérieurs.
Les vascularites des gros vaisseaux, qui touchent l’aorte et ses principales branches jusqu’à l’entrée dans les organes, sont l’artérite de Takayasu et l’artérite à cellules géantes (ACG).1 Cette dernière, anciennement dénommée maladie de Horton, est la plus fréquente des vascularites de l’adulte. Elle atteint avec prédilection les branches de l’artère carotide externe, en particulier l’artère temporale. Toutefois, les données de l’imagerie vasculaire, qui est de plus en plus utilisée pour le diagnostic de l’ACG, ont montré que cette vascularite atteignait également fréquemment l’aorte et ses branches, en particulier les artères des membres supérieurs.
Incidence et prévalence suivent un gradient Nord-Sud
L’ACG affecte les patients âgés de plus de 50 ans.2,3 Les femmes sont atteintes deux à trois fois plus fréquemment que les hommes.2,3
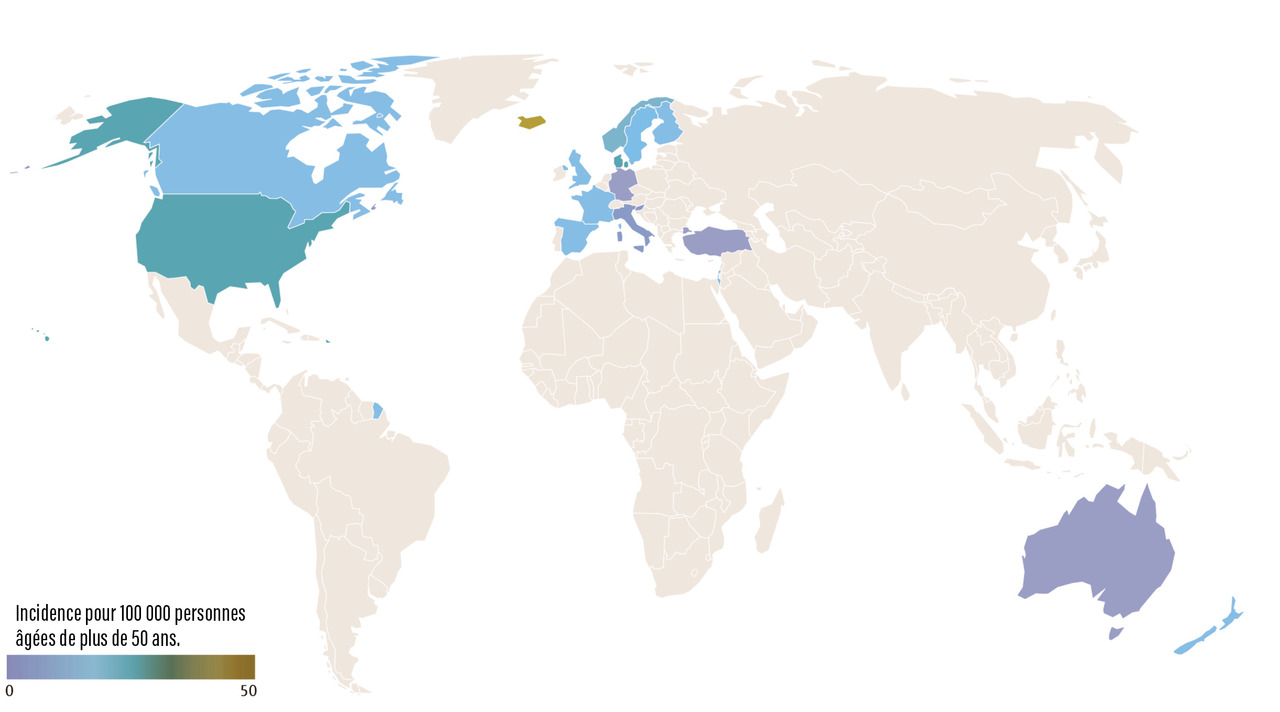
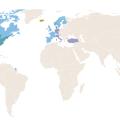
L’incidence de l’ACG suit un gradient Nord-Sud (fig. 1 ). La prévalence la plus élevée est observée dans les pays scandinaves et dans le comté d’Olmsted (Minnesota, États-Unis) où les populations ont une origine ethnique similaire. L’incidence annuelle y atteint 18,8 cas pour 100 000 personnes âgées de plus de 50 ans, ce qui suggère que la survenue de l’ACG est favorisée par des facteurs génétiques.4
L’ACG est moins fréquente chez les personnes d’origine africaine, asiatique, hispanique et du Moyen-Orient.5 L’incidence de l’ACG est deux à cinq fois plus élevée en Europe du Nord qu’en Europe du Sud.
Une étude récente a estimé l’incidence annuelle de l’ACG à 9,64 pour 100 000 personnes âgées de 50 ans ou plus en France métropolitaine et 2,91 dans les régions d’outre-mer.6 D’importantes disparités de taux d’incidence ont été observées entre les différentes régions de France et entre la France métropolitaine et les régions d’outre-mer. Plus que l’accès aux soins, il est probable que cela soit le reflet de facteurs génétiques dynamiques liés aux origines ethniques et/ou ancestrales des populations, en particulier les invasions vikings en provenance d’Europe du Nord où l’incidence de l’ACG est la plus élevée. Par ailleurs, les mouvements plus récents des populations maghrébines et africaines subsahariennes, chez qui l’incidence de l’ACG est beaucoup plus faible, et qui se sont majoritairement installées dans les grandes métropoles et davantage dans le sud de la France, expliquent en partie les taux d’incidence plus faible dans ces zones géographiques.6 Le taux d’incidence augmente régulièrement avec l’âge, jusqu’à un pic qui est plus tardif chez les hommes que chez les femmes (85 ans contre 80 ans).6
L’incidence de l’ACG suit un gradient Nord-Sud (
L’ACG est moins fréquente chez les personnes d’origine africaine, asiatique, hispanique et du Moyen-Orient.5 L’incidence de l’ACG est deux à cinq fois plus élevée en Europe du Nord qu’en Europe du Sud.
Une étude récente a estimé l’incidence annuelle de l’ACG à 9,64 pour 100 000 personnes âgées de 50 ans ou plus en France métropolitaine et 2,91 dans les régions d’outre-mer.6 D’importantes disparités de taux d’incidence ont été observées entre les différentes régions de France et entre la France métropolitaine et les régions d’outre-mer. Plus que l’accès aux soins, il est probable que cela soit le reflet de facteurs génétiques dynamiques liés aux origines ethniques et/ou ancestrales des populations, en particulier les invasions vikings en provenance d’Europe du Nord où l’incidence de l’ACG est la plus élevée. Par ailleurs, les mouvements plus récents des populations maghrébines et africaines subsahariennes, chez qui l’incidence de l’ACG est beaucoup plus faible, et qui se sont majoritairement installées dans les grandes métropoles et davantage dans le sud de la France, expliquent en partie les taux d’incidence plus faible dans ces zones géographiques.6 Le taux d’incidence augmente régulièrement avec l’âge, jusqu’à un pic qui est plus tardif chez les hommes que chez les femmes (85 ans contre 80 ans).6
Physiopathologie multifactorielle conduisant à une inflammation de l’ensemble de la paroi artérielle
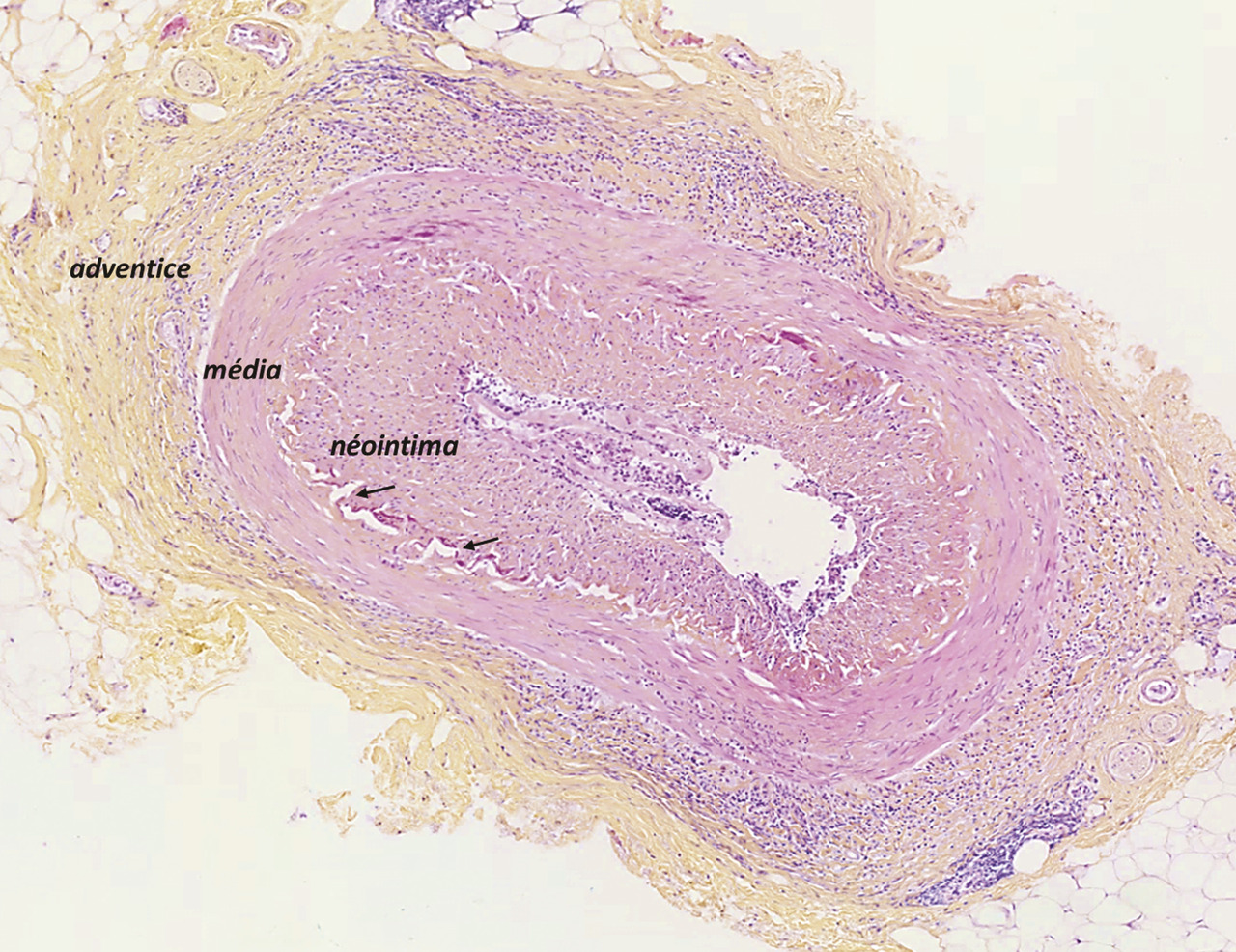
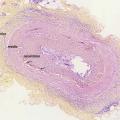
La physiopathologie de l’ACG est complexe et multifactorielle, impliquant un terrain génétique prédisposant, le rôle du vieillissement du système immunitaire et l’activation de la réponse immunitaire adaptative par un facteur déclenchant qui n’est pas clairement identifié. Ces mécanismes aboutissent à la survenue d’une inflammation de l’ensemble de la paroi artérielle (adventice, média et intima) appelée « panartérite ». L’infiltration inflammatoire est de nature granulomateuse, c’est-à-dire composée de lymphocytes T, de monocytes et macrophages et de cellules géantes résultant de la fusion de macrophages.
À l’inverse d’autres vascularites, il n’est observé ni nécrose fibrinoïde ni infiltrat riche en polynucléaires neutrophiles ou éosinophiles au cours de l’ACG.
De plus, cette maladie s’accompagne d’une hyperplasie de l’intima composée de myofibroblastes qui prolifèrent et synthétisent des protéines de la matrice extracellulaire.
Lafigure 2 montre une coupe d’artère temporale avec des lésions typiques d’ACG.
Ce processus conduit à la sténose, voire à l’occlusion des vaisseaux atteints, et donc aux manifestations « ischémiques » de la maladie : céphalées liées à l’atteinte de l’artère temporale et/ou occipitale, claudication des mâchoires liée à l’atteinte de l’artère maxillaire, signes visuels liés à l’atteinte de branches de l’artère ophtalmique, accidents vasculaires cérébraux liés à l’atteinte des artères vertébrales et plus rarement des carotides internes…
En revanche, les signes « systémiques » de l’ACG (asthénie, amaigrissement, fièvre, syndrome inflammatoire) sont liés à la production d’interleukine-6 (IL-6) en grande quantité.
À l’inverse d’autres vascularites, il n’est observé ni nécrose fibrinoïde ni infiltrat riche en polynucléaires neutrophiles ou éosinophiles au cours de l’ACG.
De plus, cette maladie s’accompagne d’une hyperplasie de l’intima composée de myofibroblastes qui prolifèrent et synthétisent des protéines de la matrice extracellulaire.
La
Ce processus conduit à la sténose, voire à l’occlusion des vaisseaux atteints, et donc aux manifestations « ischémiques » de la maladie : céphalées liées à l’atteinte de l’artère temporale et/ou occipitale, claudication des mâchoires liée à l’atteinte de l’artère maxillaire, signes visuels liés à l’atteinte de branches de l’artère ophtalmique, accidents vasculaires cérébraux liés à l’atteinte des artères vertébrales et plus rarement des carotides internes…
En revanche, les signes « systémiques » de l’ACG (asthénie, amaigrissement, fièvre, syndrome inflammatoire) sont liés à la production d’interleukine-6 (IL-6) en grande quantité.
Rôle du terrain génétique
Au cours des vingt dernières années, plusieurs études ont rapporté des polymorphismes génétiques affectant des gènes impliqués dans la réponse immunitaire et l’inflammation associées à un risque accru de développer une ACG. L’association la plus pertinente est celle avec les gènes du complexe majeur d’histocompatibilité (CMH) de classe II, ce qui souligne le rôle essentiel de l’immunité adaptative dans la physiopathologie de cette vascularite. En effet, il est possible que certains haplotypes de HLA-DR soient responsables de la sélection des peptides impliqués dans la pathogenèse de l’ACG, peptides qui sont ensuite présentés aux lymphocytes T CD4+.4
Rôle de l’environnement
L’incidence de l’ACG a une variation saisonnière, suggérant l’existence d’un facteur déclenchant infectieux. Le rôle potentiel de divers agents infectieux dans la pathogenèse de l’ACG a fait l’objet de nombreuses études qui ont envisagé un possible rôle du cytomégalovirus, du parvovirus B19, d’Herpes simplex, du para-influenza humain 1 ou encore de Chlamydia et, plus récemment, du virus varicelle-zona. Cependant, les résultats de ces études sont contradictoires et n’ont jamais été confirmés dans de plus grandes cohortes.7
Modèle physiopathologique en quatre étapes
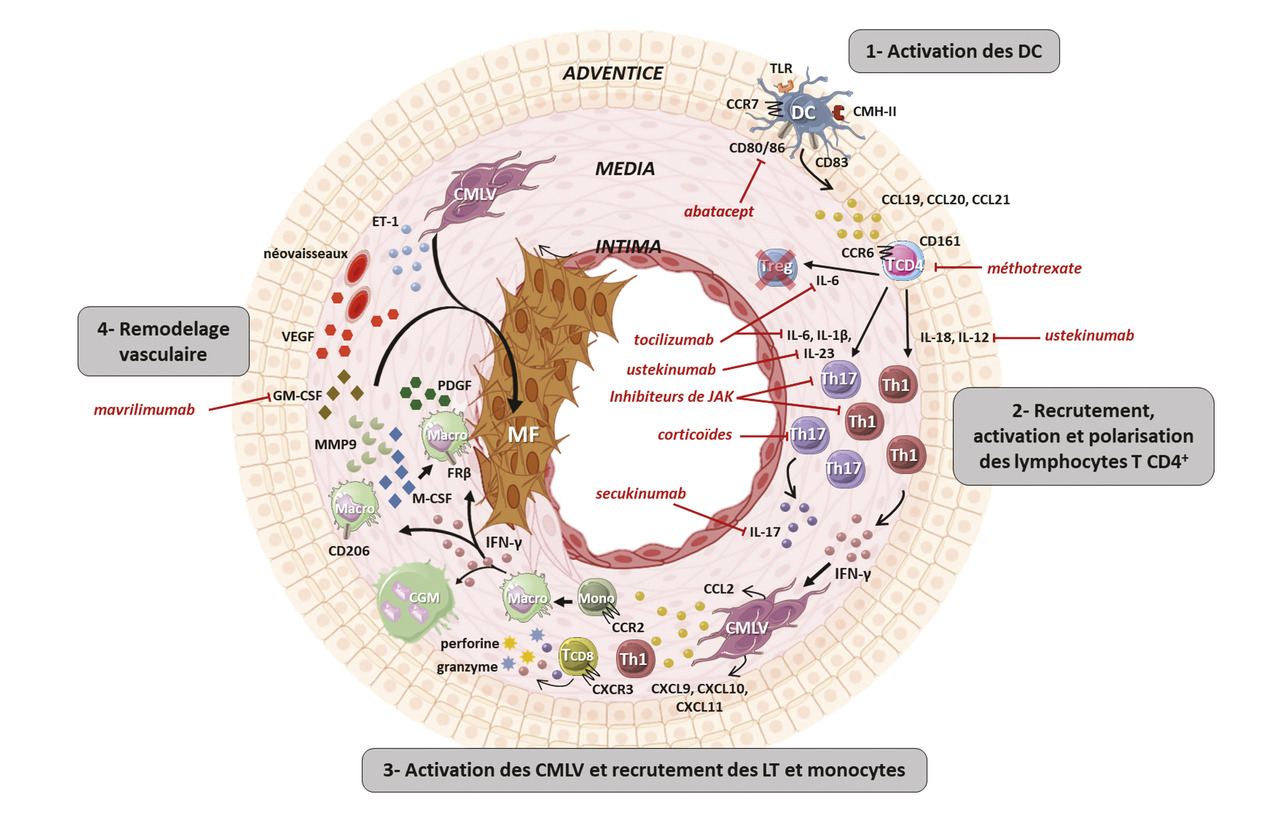
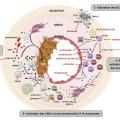
Le modèle physiopathologique de l’ACG peut se diviser en quatre phases, résumées dans la figure 3 .
À l’état physiologique, la seule cellule immunitaire présente dans la paroi artérielle, en faible nombre, est la cellule dendritique, uniquement dans l’adventice et à un état immature (S100+CD11c+CCR6+CD83-CMH-IIlow). Ces cellules dendritiques immatures jouent un rôle de sentinelle et phagocytent les antigènes de l’environnement proche.
Ensuite, la présence de cytokines pro-inflammatoires (IL-12, IL-18, IL-23, IL-6 et IL-1β) dans le micro-environnement polarise les lymphocytes T CD4 en lymphocytes T helper (Th)-1 et Th17 qui ont des fonctions pro-inflammatoires.11 Les lymphocytes Th1 sont générés en présence d’IL-12 et d’IL-18 et produisent de l’interféron-gamma (IFN-γ), tandis que les lymphocytes Th17 sont générés en présence d’IL-6, d’IL-1β et d’IL-23 et produisent de l’IL-17.12
Une fois dans le tissu artériel, les monocytes se différencient en macrophages qui, sous l’influence de l’IFN-γ, s’activent et fusionnent pour former des cellules géantes multinucléées, caractéristiques de l’ACG.14 Les populations de macrophages infiltrant la paroi artérielle sont hétérogènes. Schématiquement, on distingue les macrophages CD206+ qui se différencient en présence de GM-CSF et qui produisent de la métalloprotéinase 9 (MMP9) et du M-CSF (facteur de stimulation des colonies de macrophages). Ces macrophages contribuent surtout à la destruction de la paroi artérielle et facilitent la migration des cellules inflammatoires au sein de la paroi artérielle. De plus, on trouve des macrophages FRβ+, plus près de la néo-intima, qui se différencient en présence de M-CSF et produisent surtout des médiateurs impliqués dans le remodelage vasculaire, comme le facteur de croissance dérivé des plaquettes (PDGF).4
Les macrophages activés par l’IFN-γ et les CMLV jouent un rôle essentiel dans le remodelage vasculaire en favorisant l’angiogenèse via la production de facteur de croissance endothélial vasculaire (VEGF), la destruction des tissus via la production de métalloprotéases matricielles (MMP), en particulier MMP-9, et l’hyperplasie intimale via l’activation de la migration des CMLV de la média vers l’intima où elles deviennent des myofibroblastes qui y prolifèrent et produisent des protéines matricielles (collagène, fibronectine) sous l’influence du PDGF, l’endothéline 1 (ET-1) et d’autres facteurs non détaillés ici.4
À l’état physiologique, la seule cellule immunitaire présente dans la paroi artérielle, en faible nombre, est la cellule dendritique, uniquement dans l’adventice et à un état immature (S100+CD11c+CCR6+CD83-CMH-IIlow). Ces cellules dendritiques immatures jouent un rôle de sentinelle et phagocytent les antigènes de l’environnement proche.
Activation des cellules dendritiques
Dans les lésions d’ACG, les cellules dendritiques sont présentes dans l’ensemble de la paroi artérielle et à un état mature (S100+CD11c+CCR7+CD83+CD80/86+CMH-IIhigh). Le mécanisme aboutissant à l’activation des cellules dendritiques n’est pas clair mais passe probablement par celle de récepteurs aux signaux dangers appelés les « toll-like receptors » (TLR). Une fois activées, les cellules dendritiques produisent des chimiokines, en particulier CCL19 et CCL21 (ligands de CCR7) et CCL20 (ligand de CCR6), ce qui conduit au maintien des cellules dendritiques dans la paroi et au recrutement de lymphocytes T (LT) exprimant CCR6 au sein de la paroi artérielle.8Mobilisation des lymphocytes T CD4+
Dans la deuxième phase, les lymphocytes T CD4+ recrutés dans la paroi artérielle y sont activés par les cellules dendritiques qui expriment fortement le CMH-II et les molécules de costimulation CD80 et CD86.9 L’analyse du réarrangement du gène du TCR des LT CD4+ infiltrant la paroi des artères de sujets atteints d’ACG a mis en évidence une restriction oligoclonale du répertoire T, suggérant que les LT sont activés par un nombre restreint d’antigènes apprêtés et présentés par les cellules dendritiques matures.10Ensuite, la présence de cytokines pro-inflammatoires (IL-12, IL-18, IL-23, IL-6 et IL-1β) dans le micro-environnement polarise les lymphocytes T CD4 en lymphocytes T helper (Th)-1 et Th17 qui ont des fonctions pro-inflammatoires.11 Les lymphocytes Th1 sont générés en présence d’IL-12 et d’IL-18 et produisent de l’interféron-gamma (IFN-γ), tandis que les lymphocytes Th17 sont générés en présence d’IL-6, d’IL-1β et d’IL-23 et produisent de l’IL-17.12
Activation des cellules musculaires lisses vasculaires, recrutement des LT et monocytes
La forte infiltration lymphocytaire Th1 et Th17 dans la paroi artérielle conduit à la production de grandes quantités d’IFN-γ et d’IL-17. Le rôle de l’IL-17, qui disparaît rapidement après que la corticothérapie a été instaurée,13 n’est pas clair. Quant à l’IFN-γ, il induit la production de chimiokines (CCL2, CXCL9, CXCL10 et CXCL11) par les cellules musculaires lisses vasculaires (CMLV), qui aboutit au recrutement de lymphocytes Th1 supplémentaires et de lymphocytes T CD8+ exprimant CXCR3, le ligand de CXCL9, CXCL10 et CXCL11, et de monocytes puisqu’ils expriment CCR2, le ligand de CCL2.14,15 Les lymphocytes T CD8+ infiltrent la paroi artérielle et produisent eux aussi des cytokines (IL-17 et IFN-γ) et des molécules cytotoxiques (granzyme et perforine), ce qui contribue à l’entretien de l’inflammation vasculaire.15Une fois dans le tissu artériel, les monocytes se différencient en macrophages qui, sous l’influence de l’IFN-γ, s’activent et fusionnent pour former des cellules géantes multinucléées, caractéristiques de l’ACG.14 Les populations de macrophages infiltrant la paroi artérielle sont hétérogènes. Schématiquement, on distingue les macrophages CD206+ qui se différencient en présence de GM-CSF et qui produisent de la métalloprotéinase 9 (MMP9) et du M-CSF (facteur de stimulation des colonies de macrophages). Ces macrophages contribuent surtout à la destruction de la paroi artérielle et facilitent la migration des cellules inflammatoires au sein de la paroi artérielle. De plus, on trouve des macrophages FRβ+, plus près de la néo-intima, qui se différencient en présence de M-CSF et produisent surtout des médiateurs impliqués dans le remodelage vasculaire, comme le facteur de croissance dérivé des plaquettes (PDGF).4
Remodelage vasculaire
La dernière étape est celle du remodelage vasculaire conduisant au rétrécissement progressif de la lumière vasculaire dans les artères touchées et à l’apparition des signes ischémiques de l’ACG. Le remodelage vasculaire se caractérise par la destruction de la média et l’apparition d’une néo-intima hyperplasique composée de myofibroblastes et de protéines de la matrice extracellulaire, qui aboutit à la sténose, voire à l’occlusion de la lumière artérielle.2Les macrophages activés par l’IFN-γ et les CMLV jouent un rôle essentiel dans le remodelage vasculaire en favorisant l’angiogenèse via la production de facteur de croissance endothélial vasculaire (VEGF), la destruction des tissus via la production de métalloprotéases matricielles (MMP), en particulier MMP-9, et l’hyperplasie intimale via l’activation de la migration des CMLV de la média vers l’intima où elles deviennent des myofibroblastes qui y prolifèrent et produisent des protéines matricielles (collagène, fibronectine) sous l’influence du PDGF, l’endothéline 1 (ET-1) et d’autres facteurs non détaillés ici.4
Mécanismes impliqués dans l’entretien de l’inflammation et le remodelage vasculaire
Des mécanismes permettant d’entretenir l’inflammation et le remodelage vasculaire ont été récemment découverts. Ils permettent d’expliquer l’évolution chronique de l’ACG et sont des pistes de recherche pour le développement de nouveaux traitements.
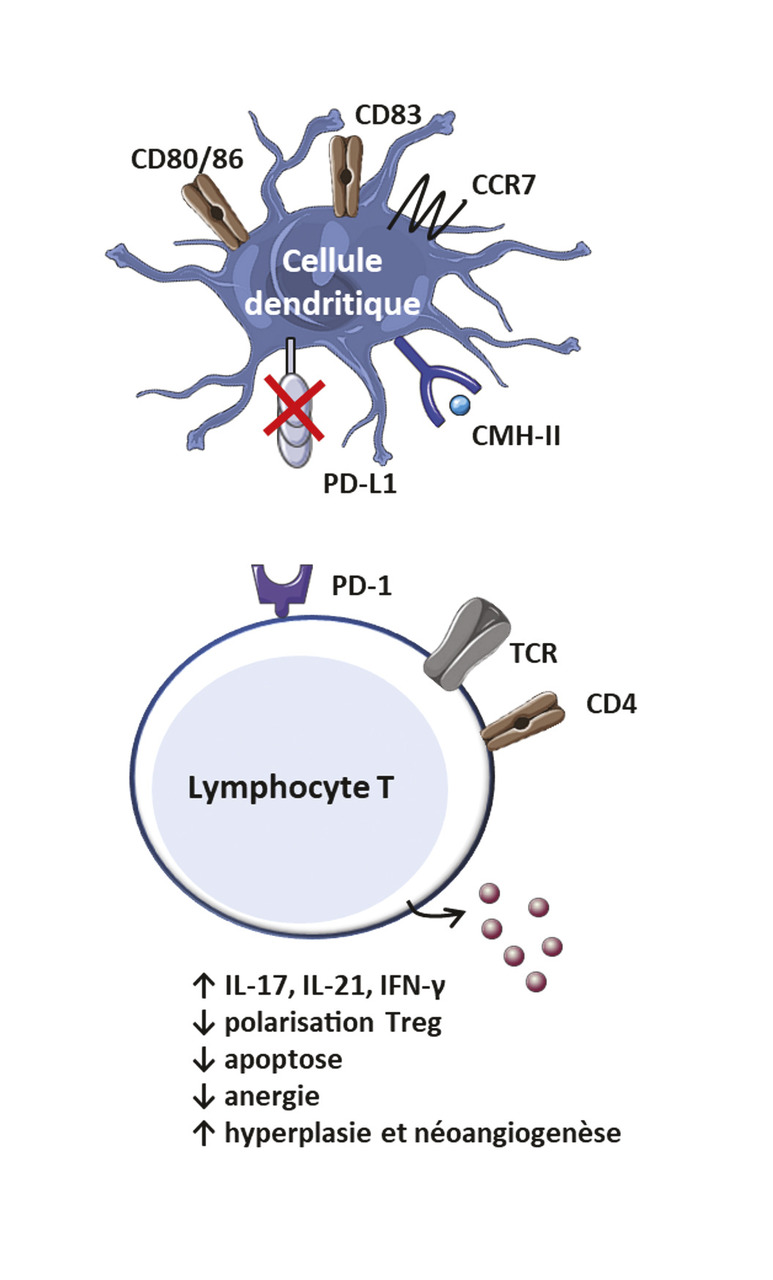
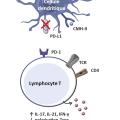
Un déficit au niveau du point de contrôle immunitaire PD-1/PD-L1 a été mis en évidence au cours de l’ACG. Programmed death 1 (PD-1) est une protéine de surface exprimée par les lymphocytes T activés et sa liaison à son ligand (PD-L1 [programmed death ligand] ou PD-L2), exprimé par les cellules présentatrices d’antigènes, induit la production d’IL-10, l’apoptose, l’anergie ou la polarisation des lymphocytes T en Treg. Ce système a donc une fonction immunosuppressive. Au cours de l’ACG, l’expression de PD-L1 par les cellules dendritiques est plus faible que chez les sujets sains, ce qui conduit à un défaut d’inhibition des lymphocytes T effecteurs PD-1+, producteurs d’IL-17, d’IL-21 et d’IFN-γ (fig. 4 ).16
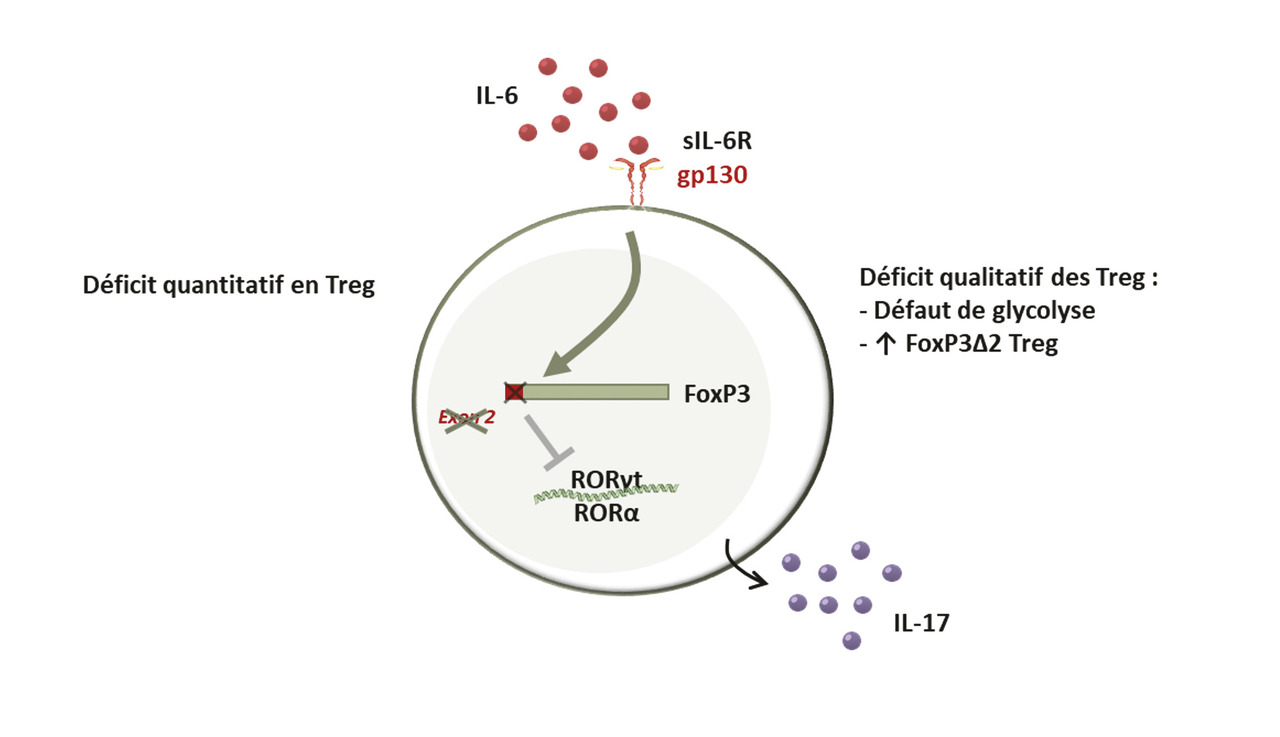
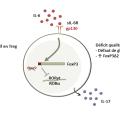
Les lymphocytes Treg jouent un rôle majeur dans les mécanismes de tolérance en raison de leur fonction immunosuppressive. Les Treg sont des cellules suppressives classiquement définies par une forte expression de la chaîne α de l’IL-2 (CD25) et du facteur de transcription FoxP3. Les Treg jouent un rôle décisif dans le maintien de la tolérance vis-à-vis du soi. Ils exercent leur fonction suppressive sur l’activation, la prolifération et les fonctions effectrices de l’ensemble des cellules immunitaires, et en tout premier lieu sur les lymphocytes T. Au cours de l’ACG, il existe un déficit quantitatif en lymphocytes Treg (CD4+CD25highFoxP3+) dans le sang des patients, comparativement à des sujets sains du même âge. De plus, les Treg sont absents des lésions artérielles d’ACG.11 Enfin, plusieurs études ont montré que la fonction immunosuppressive des Treg était altérée au cours de l’ACG comparativement à des sujets sains.17 Ce déficit quantitatif et fonctionnel des Treg au cours de l’ACG est lié à des défauts dans les mécanismes de la glycolyse, ainsi qu’à une augmentation de la proportion de Treg exprimant une isoforme hypofonctionnelle de FoxP3, dépourvue d’exon 2 (FoxP3Δ2), qui a une capacité d’immunosuppression altérée et produit des cytokines pro-inflammatoires comme l’IL-17.4, 17, 18 L’IL-6, qui est augmentée dans le sérum des patients atteints d’ACG, joue un rôle majeur dans l’altération de la réponse Treg au cours de l’ACG. En effet, le blocage de la signalisation de l’IL-6 par le tocilizumab, un anticorps monoclonal antirécepteur de l’IL-6, corrige le déficit quantitatif en Treg circulant, diminue la proportion de Treg déficients en exon 2 de FoxP3 et restaure une grande partie des fonctions immunosuppressives des Treg (fig. 5 ).17 En outre, l’IL-6 amplifie le recrutement des leucocytes au sein de la paroi artérielle.19
Le rôle majeur du GM-CSF dans la physiopathologie de l’ACG a été plus récemment décrit. Le GM-CSF est fortement exprimé dans les lésions d’ACG. Il est produit par les lymphocytes T, les macrophages et les péricytes. Le GM-CSF augmente l’activation des macrophages (CD83 et human leukocyte antigen-DR [HLA-DR]), leur niveau de production de cytokines pro-inflammatoires (IL-1β, IL-6, tumor necrosis factoralpha [TNF-α]), la polarisation des lymphocytes T en Th1, l’angiogenèse et la destruction tissulaire (ratio MMP9/TIMP1).20
D’autres types cellulaires sont également impliqués dans l’entretien de l’inflammation vasculaire, notamment les cellules T invariantes associées aux muqueuses (MAIT), les cellules T mémoires résidentes du tissu vasculaire et les cellules résidentes de paroi vasculaire (CMLV et MF). La voie Notch, impliquée dans l’interaction entre les lymphocytes T et les cellules résidentes de la paroi artérielle, est également impliquée dans l’inflammation chronique au cours de l’ACG.4
Un déficit au niveau du point de contrôle immunitaire PD-1/PD-L1 a été mis en évidence au cours de l’ACG. Programmed death 1 (PD-1) est une protéine de surface exprimée par les lymphocytes T activés et sa liaison à son ligand (PD-L1 [programmed death ligand] ou PD-L2), exprimé par les cellules présentatrices d’antigènes, induit la production d’IL-10, l’apoptose, l’anergie ou la polarisation des lymphocytes T en Treg. Ce système a donc une fonction immunosuppressive. Au cours de l’ACG, l’expression de PD-L1 par les cellules dendritiques est plus faible que chez les sujets sains, ce qui conduit à un défaut d’inhibition des lymphocytes T effecteurs PD-1+, producteurs d’IL-17, d’IL-21 et d’IFN-γ (
Les lymphocytes Treg jouent un rôle majeur dans les mécanismes de tolérance en raison de leur fonction immunosuppressive. Les Treg sont des cellules suppressives classiquement définies par une forte expression de la chaîne α de l’IL-2 (CD25) et du facteur de transcription FoxP3. Les Treg jouent un rôle décisif dans le maintien de la tolérance vis-à-vis du soi. Ils exercent leur fonction suppressive sur l’activation, la prolifération et les fonctions effectrices de l’ensemble des cellules immunitaires, et en tout premier lieu sur les lymphocytes T. Au cours de l’ACG, il existe un déficit quantitatif en lymphocytes Treg (CD4+CD25highFoxP3+) dans le sang des patients, comparativement à des sujets sains du même âge. De plus, les Treg sont absents des lésions artérielles d’ACG.11 Enfin, plusieurs études ont montré que la fonction immunosuppressive des Treg était altérée au cours de l’ACG comparativement à des sujets sains.17 Ce déficit quantitatif et fonctionnel des Treg au cours de l’ACG est lié à des défauts dans les mécanismes de la glycolyse, ainsi qu’à une augmentation de la proportion de Treg exprimant une isoforme hypofonctionnelle de FoxP3, dépourvue d’exon 2 (FoxP3Δ2), qui a une capacité d’immunosuppression altérée et produit des cytokines pro-inflammatoires comme l’IL-17.4, 17, 18 L’IL-6, qui est augmentée dans le sérum des patients atteints d’ACG, joue un rôle majeur dans l’altération de la réponse Treg au cours de l’ACG. En effet, le blocage de la signalisation de l’IL-6 par le tocilizumab, un anticorps monoclonal antirécepteur de l’IL-6, corrige le déficit quantitatif en Treg circulant, diminue la proportion de Treg déficients en exon 2 de FoxP3 et restaure une grande partie des fonctions immunosuppressives des Treg (
Le rôle majeur du GM-CSF dans la physiopathologie de l’ACG a été plus récemment décrit. Le GM-CSF est fortement exprimé dans les lésions d’ACG. Il est produit par les lymphocytes T, les macrophages et les péricytes. Le GM-CSF augmente l’activation des macrophages (CD83 et human leukocyte antigen-DR [HLA-DR]), leur niveau de production de cytokines pro-inflammatoires (IL-1β, IL-6, tumor necrosis factoralpha [TNF-α]), la polarisation des lymphocytes T en Th1, l’angiogenèse et la destruction tissulaire (ratio MMP9/TIMP1).20
D’autres types cellulaires sont également impliqués dans l’entretien de l’inflammation vasculaire, notamment les cellules T invariantes associées aux muqueuses (MAIT), les cellules T mémoires résidentes du tissu vasculaire et les cellules résidentes de paroi vasculaire (CMLV et MF). La voie Notch, impliquée dans l’interaction entre les lymphocytes T et les cellules résidentes de la paroi artérielle, est également impliquée dans l’inflammation chronique au cours de l’ACG.4
Une physiopathologie mieux connue ouvrant la voie à de nouvelles cibles thérapeutiques
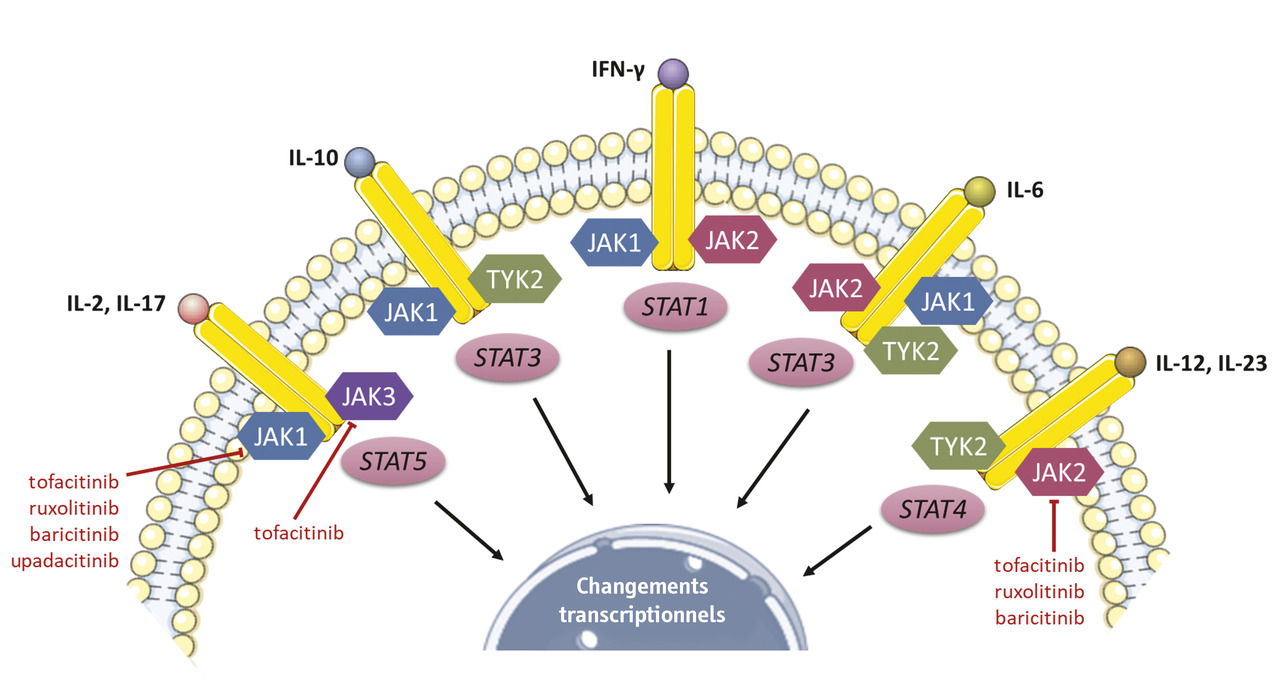
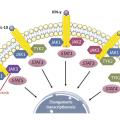
Ces dernières années, des progrès majeurs ont été faits dans la connaissance de la physiopathologie de l’ACG. Si le facteur déclenchant de la maladie n’est pas encore clairement identifié, les mécanismes impliqués dans l’inflammation et le remodelage vasculaire sont de mieux en mieux connus et ont permis d’identifier de nouvelles cibles thérapeutiques : l’activation du lymphocyte T (méthotrexate, abatacept), l’IL-6 (tocilizumab), l’IL-17 (sécukinumab), l’IL-12/23 (ustékinumab), le GM-CSF (mavrilimumab) ou les inhibiteurs des JAK (fig. 6 ), des protéines kinases redondantes et impliquées dans la signalisation de multiples cytokines (liste non exhaustive).
Références
1. Jennette JC. Overview of the 2012 revised International Chapel Hill Consensus Conference nomenclature of vasculitides. Clin Exp Nephrol 2013;17(5):603-6.
2. Salvarani C, Cantini F, Hunder GG. Polymyalgia rheumatica and giant-cell arteritis. Lancet 2008;372(9634):234-45.
3. Salvarani C, Macchioni P, Zizzi F, Mantovani W, Rossi F, Castri C, et al. Epidemiologic and immunogenetic aspects of polymyalgia rheumatica and giant cell arteritis in northern Italy. Arthritis and rheumatism 1991;34(3):351-6.
4. Greigert H, Genet C, Ramon A, Bonnotte B, Samson M. New insights into the pathogenesis of giant cell arteritis: Mechanisms involved in maintaining vascular inflammation. J Clin Med 2022;11(10):2905.
5. Borchers AT, Gershwin ME. Giant cell arteritis: A review of classification, pathophysiology, geoepidemiology and treatment. Autoimmun Rev 2012;11(6-7):A544-54.
6. Guittet L, de Boysson H, Cerasuolo D, Morello R, Sultan A, Deshayes S, et al. Whole-country and regional incidences of giant cell arteritis in french continental and overseas territories: A 7-year nationwide database analysis. ACR Open Rheumatol 2022;4(9):753-9.
7. Ly KH, Regent A, Tamby MC, Mouthon L. Pathogenesis of giant cell arteritis: More than just an inflammatory condition? Autoimmun Re. 2010;9(10):635-45.
8. Ma-Krupa W, Jeon MS, Spoerl S, Tedder TF, Goronzy JJ, Weyand CM. Activation of arterial wall dendritic cells and breakdown of self-tolerance in giant cell arteritis. J Exp Med 2004;199(2):173-83.
9. Brack A, Geisler A, Martinez-Taboada VM, Younge BR, Goronzy JJ, Weyand CM. Giant cell vasculitis is a T cell-dependent disease. Mol Med 1997;3(8):530-43.
10. Samson M, Corbera-Bellalta M, Audia S, Planas-Rigol E, Martin L, Cid MC, et al. Recent advances in our understanding of giant cell arteritis pathogenesis. Autoimmun Rev 2017;16(8):833-44.
11. Samson M, Audia S, Fraszczak J, Trad M, Ornetti P, Lakomy D, et al. Th1 and Th17 lymphocytes expressing CD161 are implicated in giant cell arteritis and polymyalgia rheumatica pathogenesis. Arthritis Rheum 2012;64(11):3788-98.
12. Samson M, Lakomy D, Audia S, Bonnotte B. T(H)17 lymphocytes: Induction, phenotype, functions, and implications in human disease and therapy. Rev Med Interne 2011;32(5):292-301.
13. Deng J, Younge BR, Olshen RA, Goronzy JJ, Weyand CM. Th17 and Th1 T-cell responses in giant cell arteritis. Circulation 2010;121(7):906-15.
14. Corbera-Bellalta M, Planas-Rigol E, Lozano E, Terrades-Garcia N, Alba MA, Prieto-Gonzalez S, et al. Blocking interferon gamma reduces expression of chemokines CXCL9, CXCL10 and CXCL11 and decreases macrophage infiltration in ex vivo cultured arteries from patients with giant cell arteritis. Ann Rheum Dis 2016;75(6):1177-86.
15. Samson M, Ly KH, Tournier B, Janikashvili N, Trad M, Ciudad M, et al. Involvement and prognosis value of CD8(+) T cells in giant cell arteritis. J Autoimmun 2016;72:73-83.
16. Zhang H, Watanabe R, Berry GJ, Vaglio A, Liao YJ, Warrington KJ, et al. Immunoinhibitory checkpoint deficiency in medium and large vessel vasculitis. Proc Natl Acad Sci U S A 2017;114(6):E970-E979.
17. Samson M, Greigert H, Ciudad M, Gerard C, Ghesquiere T, Trad M, et al. Improvement of Treg immune response after treatment with tocilizumab in giant cell arteritis. Clin Transl Immunology 2021;10(9):e1332.
18. Miyabe C, Miyabe Y, Strle K, Kim ND, Stone JH, Luster AD, et al. An expanded population of pathogenic regulatory T cells in giant cell arteritis is abrogated by IL-6 blockade therapy. Ann Rheum Dis 2017;76(5):898-905.
19. Espigol-Frigole G, Planas-Rigol E, Ohnuki H, Salvucci O, Kwak H, Ravichandran S, et al. Identification of IL-23p19 as an endothelial proinflammatory peptide that promotes gp130-STAT3 signaling. Sci Signal 2016;9(419):ra28.
20. Corbera-Bellalta M, Alba-Rovira R, Muralidharan S, Espigol-Frigole G, Rios-Garces R, Marco-Hernandez J, et al. Blocking GM-CSF receptor alpha with mavrilimumab reduces infiltrating cells, pro-inflammatory markers and neoangiogenesis in ex vivo cultured arteries from patients with giant cell arteritis. Ann Rheum Dis. 2022;81(4):524-36.
2. Salvarani C, Cantini F, Hunder GG. Polymyalgia rheumatica and giant-cell arteritis. Lancet 2008;372(9634):234-45.
3. Salvarani C, Macchioni P, Zizzi F, Mantovani W, Rossi F, Castri C, et al. Epidemiologic and immunogenetic aspects of polymyalgia rheumatica and giant cell arteritis in northern Italy. Arthritis and rheumatism 1991;34(3):351-6.
4. Greigert H, Genet C, Ramon A, Bonnotte B, Samson M. New insights into the pathogenesis of giant cell arteritis: Mechanisms involved in maintaining vascular inflammation. J Clin Med 2022;11(10):2905.
5. Borchers AT, Gershwin ME. Giant cell arteritis: A review of classification, pathophysiology, geoepidemiology and treatment. Autoimmun Rev 2012;11(6-7):A544-54.
6. Guittet L, de Boysson H, Cerasuolo D, Morello R, Sultan A, Deshayes S, et al. Whole-country and regional incidences of giant cell arteritis in french continental and overseas territories: A 7-year nationwide database analysis. ACR Open Rheumatol 2022;4(9):753-9.
7. Ly KH, Regent A, Tamby MC, Mouthon L. Pathogenesis of giant cell arteritis: More than just an inflammatory condition? Autoimmun Re. 2010;9(10):635-45.
8. Ma-Krupa W, Jeon MS, Spoerl S, Tedder TF, Goronzy JJ, Weyand CM. Activation of arterial wall dendritic cells and breakdown of self-tolerance in giant cell arteritis. J Exp Med 2004;199(2):173-83.
9. Brack A, Geisler A, Martinez-Taboada VM, Younge BR, Goronzy JJ, Weyand CM. Giant cell vasculitis is a T cell-dependent disease. Mol Med 1997;3(8):530-43.
10. Samson M, Corbera-Bellalta M, Audia S, Planas-Rigol E, Martin L, Cid MC, et al. Recent advances in our understanding of giant cell arteritis pathogenesis. Autoimmun Rev 2017;16(8):833-44.
11. Samson M, Audia S, Fraszczak J, Trad M, Ornetti P, Lakomy D, et al. Th1 and Th17 lymphocytes expressing CD161 are implicated in giant cell arteritis and polymyalgia rheumatica pathogenesis. Arthritis Rheum 2012;64(11):3788-98.
12. Samson M, Lakomy D, Audia S, Bonnotte B. T(H)17 lymphocytes: Induction, phenotype, functions, and implications in human disease and therapy. Rev Med Interne 2011;32(5):292-301.
13. Deng J, Younge BR, Olshen RA, Goronzy JJ, Weyand CM. Th17 and Th1 T-cell responses in giant cell arteritis. Circulation 2010;121(7):906-15.
14. Corbera-Bellalta M, Planas-Rigol E, Lozano E, Terrades-Garcia N, Alba MA, Prieto-Gonzalez S, et al. Blocking interferon gamma reduces expression of chemokines CXCL9, CXCL10 and CXCL11 and decreases macrophage infiltration in ex vivo cultured arteries from patients with giant cell arteritis. Ann Rheum Dis 2016;75(6):1177-86.
15. Samson M, Ly KH, Tournier B, Janikashvili N, Trad M, Ciudad M, et al. Involvement and prognosis value of CD8(+) T cells in giant cell arteritis. J Autoimmun 2016;72:73-83.
16. Zhang H, Watanabe R, Berry GJ, Vaglio A, Liao YJ, Warrington KJ, et al. Immunoinhibitory checkpoint deficiency in medium and large vessel vasculitis. Proc Natl Acad Sci U S A 2017;114(6):E970-E979.
17. Samson M, Greigert H, Ciudad M, Gerard C, Ghesquiere T, Trad M, et al. Improvement of Treg immune response after treatment with tocilizumab in giant cell arteritis. Clin Transl Immunology 2021;10(9):e1332.
18. Miyabe C, Miyabe Y, Strle K, Kim ND, Stone JH, Luster AD, et al. An expanded population of pathogenic regulatory T cells in giant cell arteritis is abrogated by IL-6 blockade therapy. Ann Rheum Dis 2017;76(5):898-905.
19. Espigol-Frigole G, Planas-Rigol E, Ohnuki H, Salvucci O, Kwak H, Ravichandran S, et al. Identification of IL-23p19 as an endothelial proinflammatory peptide that promotes gp130-STAT3 signaling. Sci Signal 2016;9(419):ra28.
20. Corbera-Bellalta M, Alba-Rovira R, Muralidharan S, Espigol-Frigole G, Rios-Garces R, Marco-Hernandez J, et al. Blocking GM-CSF receptor alpha with mavrilimumab reduces infiltrating cells, pro-inflammatory markers and neoangiogenesis in ex vivo cultured arteries from patients with giant cell arteritis. Ann Rheum Dis. 2022;81(4):524-36.