Avec près de 44 000 nouveaux cas annuels estimés en 2018 en France, dont 32 % étaient localisés au rectum, le cancer colorectal était le 3e cancer le plus fréquent chez l’homme, après ceux de la prostate et du poumon, et le 2e chez la femme, après le cancer du sein. À risque équivalent, le nombre de nouveaux cas devrait continuer à augmenter du seul fait du vieillissement de la population. L’évaluation de l’impact des actions préventives ou curatives menée au cours des dernières décennies, au regard de l’évolution des facteurs de risque ou des pratiques de diagnostic, nécessite un système d’observation épidémiologique dont les registres de cancers constituent un standard de référence. Leurs données fournissent les indicateurs de santé nécessaires aux cliniciens, chercheurs et responsables de santé publique, leur permettant de connaître l’évolution de la fréquence et du pronostic des cancers dans la population.
Méthodes : réseau, modélisation, statistiques et partenariats
L’étude de l’incidence et de la survie des cancers du rectum en France, et de leur évolution au cours des dernières décennies, repose sur une démarche méthodologique.
Les données d’incidence proviennent de registres
Les données d’incidence observées jusqu’en 2015 ont été extraites de la base commune des registres du réseau Francim. Elles ont été sélectionnées dans 22 registres généraux et 3 spécialisés (couvrant 22 % de la population métropolitaine, soit environ 14 millions de personnes) et ont été codées selon la Classification internationale des maladies pour l’oncologie, 3e édition (CIM-O-3). Pour modéliser l’incidence, la mortalité n’a pas été utilisée comme corrélat. Les tendances nationales de l’incidence ont été étudiées à l’aide de splines multidimensionnelles pénalisées dans le cadre de modèles de Poisson.1, 2
La survie nette estime la survie qui serait observée si le cancer était la seule cause de mortalité
Deux indicateurs clés permettant d’appréhender la mortalité due au cancer étudié ont été calculés : le taux de mortalité en excès et la survie nette.
Le taux de mortalité en excès est estimé par comparaison au taux de mortalité attendu en population générale. Il faut noter que ce taux en excès correspond à la mortalité non seulement directement mais aussi indirectement liée au cancer (par exemple du fait d’une toxicité à long terme du traitement). Quand ce taux est faible d’un point de vue mathématique (≤ 0,1), il traduit directement la probabilité de décéder dans l’année. La survie nette découle directement du taux de mortalité en excès et correspond à la survie qui serait observée si la seule cause de décès possible était le cancer étudié.
Ces indicateurs mesurent spécifiquement la mortalité due au cancer : eux seuls permettent d’effectuer des comparaisons (âge, sexe, pays…) ; ils sont essentiels en épidémiologie et en santé publique. La survie nette est mécaniquement supérieure ou égale à la survie observée. Aux âges élevés, pour un cancer de bon pronostic tel que le cancer du rectum, la survie nette est meilleure que la survie observée, du fait de la mortalité « autres causes ».
La méthode statistique d’estimation de la survie nette a utilisé une modélisation du taux de mortalité en excès fondée sur des splines multidimensionnelles pénalisées. Ces modèles ont été développés au sein du service de biostatistique-bio-informatique des Hospices civils de Lyon (HCL).3,4,5 Le statut vital des personnes incluses a été mis à jour au 30 juin 2018 selon une procédure standardisée.
La production des indicateurs de fréquence et de survie des cancers en France est le fruit d’un parte-nariat entre le réseau français des registres des cancers Francim, le service de biostatistique‑bio-informatique des HCL, Santé publique France (SPF) et l’Institut national du cancer (INCa).
Incidence : un risque élevé de cancer du rectum en France
Le nombre estimé de nouveaux cas de cancers du rectum en France atteignait 13 744 en 2018, dont 60 % chez l’homme.6 L’âge médian au diagnostic était de 69 ans chez l’homme et de 71 ans chez la femme. Les taux d’incidence standardisés monde étaient respectivement de 12,7 cas pour 100 000 personnes-années chez l’homme et de 6,9 cas pour 100 000 personnes-années chez la femme (
Entre 1990 et 2018, l’incidence du cancer du rectum a diminué chaque année de 1 % chez l’homme et de 0,5 % chez la femme. Le sexe ratio H/F a régulièrement diminué au cours du temps, passant de 2,1 à 1,8. Pour les deux sexes, la baisse d’incidence était plus marquée entre 2010 et 2018 qu’entre 1990 et 2018. Cette diminution concernait toutes les classes d’âge, mais elle était un peu supérieure chez les hommes de 80 ans (variation annuelle moyenne de -1,6 %) et chez les femmes de 70 et 80 ans mais ne s’observait pas chez les femmes de 40 ans.
Le risque cumulé d’être atteint de ce cancer entre 0 et 74 ans diminuait selon la cohorte de naissance chez l’homme de façon constante (de 2 à 1,5 % pour la cohorte des individus nés en 1920 et celle des individus nés en 1950) et de façon moindre chez la femme (de 1 à 0,8 %), respectivement pour les mêmes cohortes d’individus.
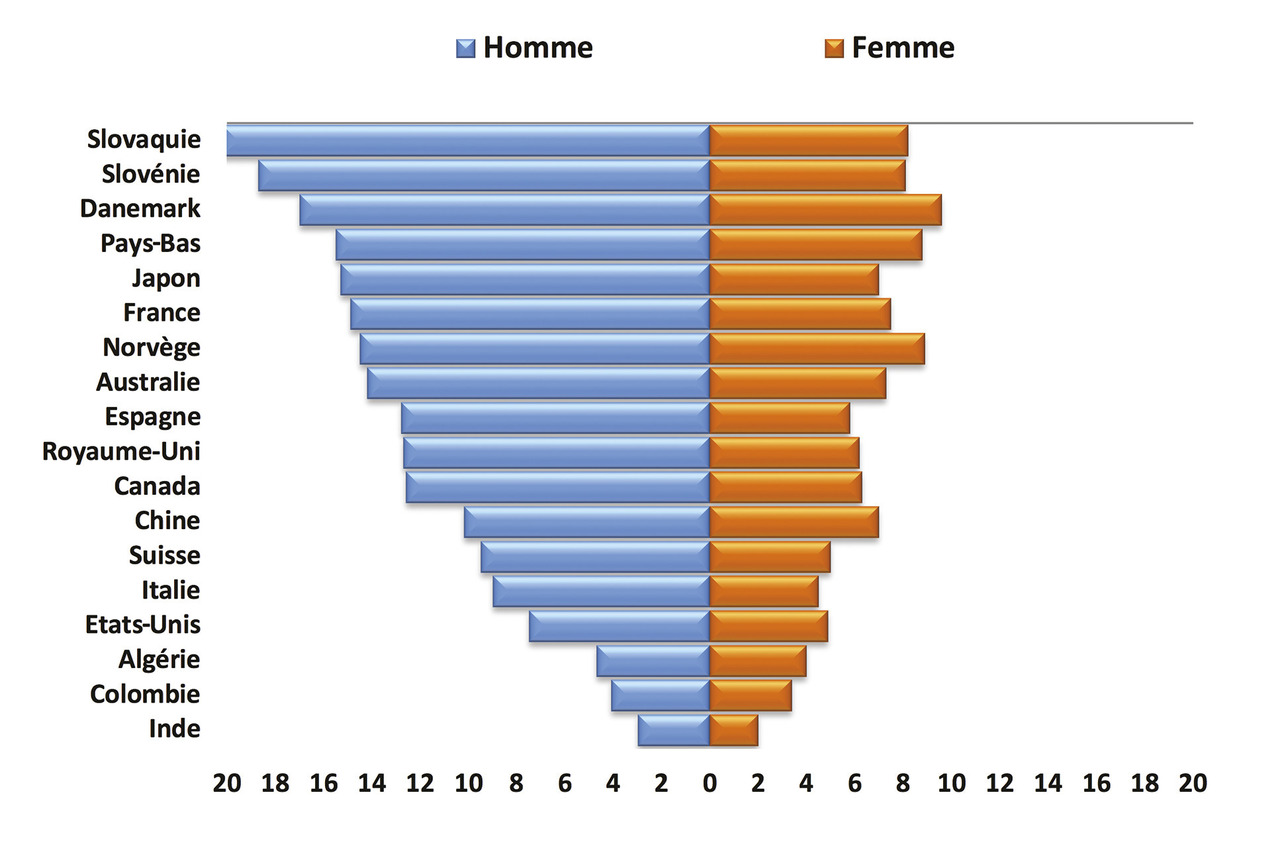
Le Centre international de recherche sur le cancer (CIRC) publie régulièrement, dans les volumes itératifs « Cancer Incidence in Five Continents », les données d’incidence provenant des registres internationaux de cancers. Ces publications de taux standardisés, dont la dernière concerne les cas diagnostiqués entre 2008 et 2012, permettent des comparaisons avec les autres régions du monde.8 Elles montrent que la France se situait parmi les pays à risque élevé de cancer du rectum (
Une augmentation de la survie nette plus marquée entre 1990 et 2005
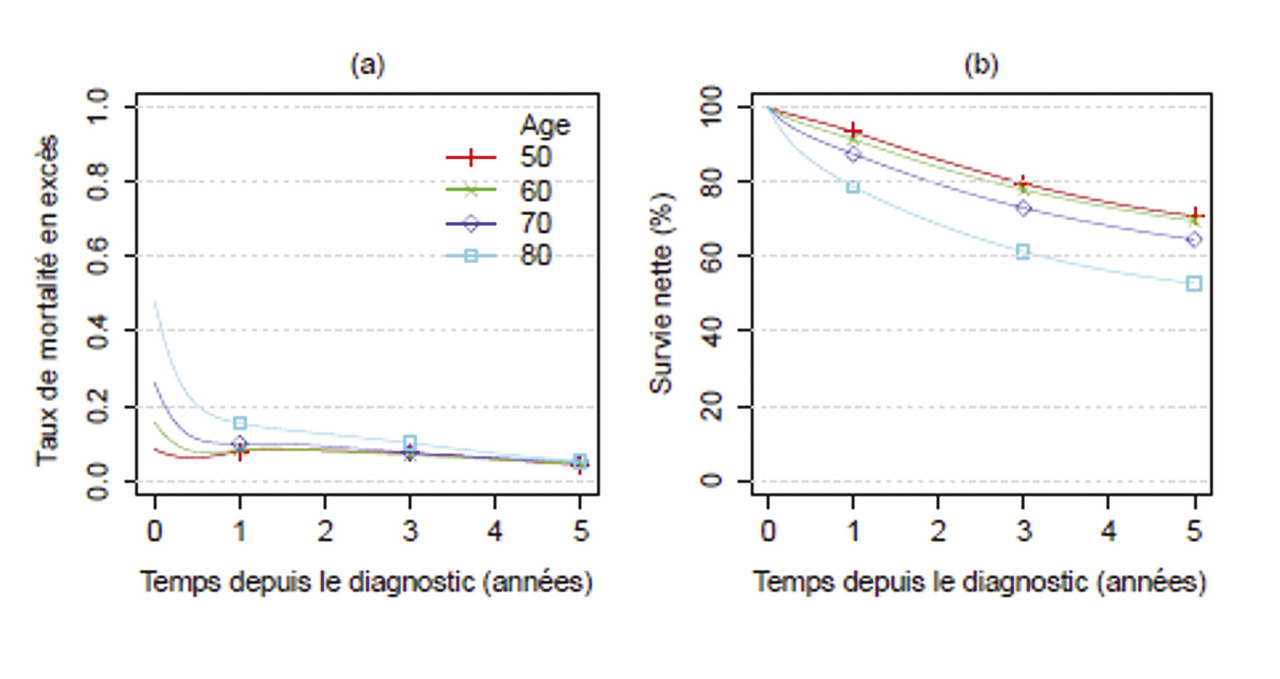
La survie nette à cinq ans était de 60 % chez l’homme et de 59 % chez la femme entre 2010 et 2015 (
La survie nette s’est améliorée entre 1990 et 2015, surtout entre 1990 et 2005. À cinq ans, elle est passée de 51 à 65 %. Ce gain était principalement dû à la réduction du taux de mortalité en excès dans l’année qui suivait le diagnostic (baisse de la mortalité précoce). Il a profité à tous les cas, quel que soit l’âge au moment du diagnostic, mais principalement aux individus diagnostiqués avant l’âge de 80 ans.
La survie nette à long terme a été analysée entre1989 et 2000 chez les personnes âgées de moins de 70 ans au moment du diagnostic. À dix ans, elle variait entre 54 %, pour les personnes de 50 ans, et 47 %, pour celles qui étaient âgées de 70 ans au diagnostic (
Des populations plus ou moins exposées et des facteurs de risque
Trois niveaux de risque de cancer colorectal sont définis, en fonction des antécédents personnels et familiaux.
La population à risque très élevé totalise 4 % des cancers colorectaux. Il s’agit des formes génétiques : le syndrome de Lynch, à transmission autosomique dominante (risque de cancer colorectal de 50 % chez l’homme et 35 % chez la femme) et les polyposes. La polypose adénomateuse familiale est, elle aussi, autosomique dominante (risque de cancer colorectal de 100 %), mais la polypose liée à MYH (impliquant le gène MYH) est autosomique récessive (risque de cancer colorectal proche de celui du syndrome de Lynch).
La population à risque élevé concentre de 15 à 20 % des cancers colorectaux. Elle se compose d’individus ayant des antécédents personnels ou familiaux au premier degré, de cancer colorectal ou d’adénome à risque (taille supérieure à 1 cm, composante villeuse, dysplasie de haut grade) ou une maladie inflammatoire chronique de l’intestin (MICI : maladie de Crohn et rectocolite inflammatoire). Pour les apparentés au premier degré de sujets porteurs d’un cancer colorectal, le risque relatif (RR) dépend du nombre d’apparentés atteints et de l’âge de diagnostic du cas index (RR = 1,5 si le cancer du cas index a été diagnostiqué après 60 ans ; 1,9 s’il l’a été avant 60 ans ; 3,2 avant 50 ans et 4 si au moins deux apparentés sont atteints).9 L’antécédent personnel de cancer colorectal confère un risque modéré de cancer colorectal métachrone de 1,5.10 Pour les apparentés au premier degré de patients porteurs d’adénomes, le risque de cancer colorectal augmente si le cas index avait développé un adénome supracentimétrique avant 60 ans (RR = 3,0) et très modérément (RR = 1,15) si le cas index avait plus de 60 ans au moment du diagnostic.11 L’antécédent personnel d’adénome confère un risque relatif modéré de cancer colorectal de 1,3 à 1,8, dépendant des caractéristiques des adénomes observés et des antécédents familiaux de cancer colorectal. Le risque dépend surtout du suivi endoscopique de ces patients : après résection d’un adénome à risque, le risque relatif de cancer colorectal est de 1 pour les patients suivis régulièrement et de 4,4 en l’absence de suivi.12 Le risque de cancer colorectal associé aux MICI est bien connu, il est de l’ordre de 1,5 et dépend de l’étendue de l’atteinte colique, de l’âge de début de la maladie et de son ancienneté.13
La population à risque moyen (80 % des cancers colorectaux) inclut des individus sans antécédents, asymptomatiques ; la très grande majorité des cancers survient alors sur des adénomes préexistants dont l’histoire naturelle est bien connue. Les adénomes coliques sont fréquents, seul un petit nombre se transforment en cancer. Là encore, les facteurs qui influencent la transformation d’un adénome en cancer sont la taille, la composante villeuse et la dysplasie de haut grade. La séquence adénome-cancer est bien décrite, et depuis longtemps14 : environ 10 % des adénomes se développent, pour atteindre ou dépasser la taille de 1 cm, à partir de laquelle le risque de transformation en cancer augmente : soit 5 % à dix ans et 25 % à vingt ans.
À chaque niveau de risque une stratégie de dépistage adaptée
La chromocoloscopie régulière, la chirurgie prophylactique, en fonction du risque, et la consultation d’oncogénétique concernent la population à risque très élevé. La coloscopie régulière s’applique à la population à risque élevé. Enfin, la recherche de saignement occulte dans les selles par test immunologique, suivie d’une coloscopie si le test est positif, est indiquée pour la population à risque moyen.
Des facteurs de risque liés au mode de vie et à l’environnement sont identifiés, tels que l’alcool, le tabac, la sédentarité, le surpoids, l’alimentation hypercalorique ou la consommation de viande rouge.15 Les risques relatifs de cancer colorectal liés à ces facteurs varient de 1,1 à 1,4 (
Le dépistage est insuffisant
Bien que l’incidence du cancer colorectal ait tendance à diminuer en France et que la survie s’améliore constamment depuis plus de vingt ans, de rapides progrès pourraient encore être obtenus, notamment en améliorant l’efficience du programme de dépistage de masse. Les cancers colorectaux sont, en très grande majorité, sporadiques, survenant dans la population à risque moyen. Le test immunologique de recherche de saignement occulte dans les selles permet de les dépister au stade précoce ou au stade de lésion précancéreuse (adénome), donc de réduire rapidement la mortalité et, à moyen terme, l’incidence16. Cependant, en France, la participation à ce dépistage est insuffisante, de l’ordre de 30 %, bien en deçà des 45 % définis par la Commission européenne comme le seuil minimal assurant l’efficience d’un programme de dépistage. Toutes les actions permettant d’augmenter cette participation doivent être menées. La prise en compte des facteurs alimentaires et des facteurs liés au mode de vie constituera à l’avenir un autre volet important de la prévention de ces cancers.
1. Defossez G, Le Guyader-Peyrou S, Uhry Z, Grosclaude P, Colonna M, Dantony E, et al. Estimations nationales de l’incidence et de la mortalité par cancer en France métropolitaine entre 1990 et 2018. Volume 1 – Tumeurs solides [en ligne]. 2019. Disponible sur : https://www.santepubliquefrance.fr/maladies-et-traumatismes/cancers/cancer-du-sein/documents/rapport-synthese/estimations-nationales-de-l-incidence-et-de-la-mortalite-par-cancer-en-france-metropolitaine-entre-1990-et-2018-volume-1-tumeurs-solides-etud
2. Defossez G, Uhry Z, Delafosse P, Dantony E, d’Almeida T, Plouvier S, et al. Cancer incidence and mortality trends in France over 1990-2018 for solid tumors: the sex gap is narrowing. BMC Cancer 2021;21:726.
3. Uhry Z, Dantony E, Roche L, Fauvernier M, Lecoffre C, Lafay L, et al. Survie des personnes atteintes de cancer en France métropolitaine 1989-2018 - Matériel et méthodes [en ligne]. 2020. Disponible sur : https://www.santepubliquefrance.fr/docs/survie-des-personnes-atteintes-de-cancer-en-france-metropolitaine-1989-2018-materiel-et-methodes
4. Remontet L, Uhry Z, Bossard N, Iwaz J, Belot A, Danieli C, et al. Flexible and s tructured survival model for a simultaneous estimation of non-linear and non-proportional effects and complex interactions between continuous variables: Performance of this multidimensional penalized spline approach in net survival trend analysis. Stat Methods Med Res 2019;28:2368-84.
5. Fauvernier M, Roche L, Uhry Z, Tron L, Bossard N, Remontet L, et al. Multidimensional penalized hazard model with continuous covariates: applications for studying trends and social inequalities in cancer survival. J R Stat Soc C 2019;68:1233-57.
6. Launoy G, Cariou M, Bouvier AM, Bouvir V, Lecoffre C, Lafay L, et al. Survie des personnes atteintes de cancer en France métropolitaine 1989-2018 – Côlon et rectum [en ligne]. 2020 ; Disponible sur : https://www.santepubliquefrance.fr/maladies-et-traumatismes/cancers/cancer-du-colon-rectum/documents/enquetes-etudes/survie-des-personnes-atteintes-de-cancer-en-france-metropolitaine-1989-2018-colon-et-rectum
7. Bouvier A, Trétarre B, Delafosse P, Grosclaude P, Jéhannin-Ligier K, Marrer E, et al. Stade au diagnostic des cancers du sein, du côlon et du rectum : Étude réalisée à partir des registres des cancers du réseau Francim [en ligne]. 2018. Disponible sur : https://www.santepubliquefrance.fr/maladies-et-traumatismes/cancers/cancer-du-sein/documents/rapport-synthese/stade-au-diagnostic-des-cancers-du-sein-du-colon-et-du-rectum-etude-realisee-a-partir-des-registres-des-cancers-du-reseau-francim
8. Bray F, Colombet M, Mery L, Piñeros M, Znaor A, Zanetti R, et al. Cancer Incidence in Five Continents, Vol. XI. Lyon : International Agency for Research on Cancer ; 2017.
9. Butterworth AS, Higgins JPT, Pharoah P. Relative and absolute risk of colorectal cancer for individuals with a family history: a meta-analysis. Eur J Cancer 2006;42:216-27.
10. Bouvier AM, Latournerie M, Jooste V, Lepage C, Cottet V, Faivre J. The lifelong risk of metachronous colorectal cancer justifies long-term colonoscopic follow-up. Eur J Cancer 2008; 44:522-7.
11. Cottet V, Pariente A, Nalet B, Lafon J, Milan C, Olschwang S, et al. Colonoscopic screening of first-degree relatives of patients with large adenomas: increased risk of colorectal tumors. Gastroenterology 2007;133:1086-92.
12. Cottet V, Jooste V, Fournel I, Bouvier AM, Faivre J, Bonithon-Kopp C. Long-term risk of colorectal cancer after adenoma removal: a population-based cohort study. Gut 2012;61:1180-6.
13. Peyrin-Biroulet L, Lepage C, Jooste V, Gueant JL, Faivre J, Bouvier AM. Colorectal cancer in inflammatory bowel diseases: A population-based study (1976-2008). Inflamm Bowel Dis 2012;18:2247-51.
14. Stryker SJ, Wolff BG, Culp CE, Libbe SD, Ilstrup DM, MacCarty RL. Natural history of untreated colonic polyps. Gastroenterology 1987;93:1009-13.
15. Centre international de recherche sur le cancer. Les cancers attribuables au mode de vie et à l’environnement en France métropolitaine [en ligne].2018. Disponible sur : https://gco.iarc.fr/includes/PAF/PAF_FR_report.pdf
16. Giorgi Rossi P, Vicentini M, Sacchettini C, Di Felice E, Caroli S, Ferrari F, et al. Impact of Screening Program on Incidence of Colorectal Cancer: A Cohort Study in Italy. Am J Gastroenterol 2015;110:1359-6