Les dernières recommandations européennes concernant la prise en charge des patientes avec un cancer de l’endomètre, publiées début 2021, ont notamment précisé les modalités de prise en charge chirurgicale.1 L’objectif de cet article est de présenter les dernières données concernant les voies d’abord et les stratégies de chirurgie ganglionnaire.
Priorité à une voie d’abord mini-invasive
La chirurgie par voie mini-invasive (cœlioscopique ou robot-assistée) est actuellement recommandée lorsqu’une chirurgie est envisagée, y compris pour les patientes du groupe à haut risque.
Cette préconisation se base notamment sur les résultats de l’essai randomisé LAP2 du Gynecologic Oncology Group (GOG) publié en 2009 et qui avait inclus des patientes avec un cancer de l’endomètre de stades I à IIA, opérées par hystérectomie et curages pelviens et lombo-aortiques.2 Parmi elles, 1 696 patientes avaient été incluses dans le bras cœlioscopie et 920 dans le bras laparotomie. D’après les auteurs, la voie d’abord cœlioscopique était associée à significativement moins de complications postopératoires modérées à sévères (14 % versus 21 % ; p < 0,0001) et à des durées d’hospitalisation plus courtes. Les mêmes auteurs ont ensuite publié en 2012, à partir de la même série, des résultats mettant en évidence l’absence d’altération de la survie liée à la voie cœlioscopique par rapport à la chirurgie ouverte.3
Ces données ont par la suite été confortées par plusieurs études. Ainsi, une étude de cohorte prospective scandinave publiée en 2019 a montré que la chirurgie mini-invasive dans la prise en charge des patientes avec un cancer de l’endomètre de stade précoce était associée, par rapport à la chirurgie ouverte, à une diminution des complications périopératoires et à une diminution de la mortalité ; il n’y avait pas de différence de survie entre les patientes prises en charge par voie cœlioscopique classique ou par cœlioscopie robot-assistée.4 Très récemment, en février 2022, une étude européenne a été publiée dans la revue Cancers ; elle reprend les données de 1 382 patientes opérées pour un cancer de l’endomètre, dont 451 (32,6 %) par cœlioscopie classique, 233 (16,9 %) par cœlioscopie robot-assistée, et 698 (50,5 %) par laparotomie ; d’après les auteurs, la voie d’abord n’est pas associée à une différence de survie globale ou sans récidive.5
Il est important de préciser que les dernières recommandations européennes concernant la prise en charge du cancer de l’endomètre1 n’émettent pas d’instruction particulière quant à l’utilisation du manipulateur utérin dans le contexte de chirurgie mini-invasive. La situation est donc différente de celle de la prise en charge du col de l’utérus6 depuis les résultats de l’essai LACC7 puis SUCCOR8 qui faisaient un lien entre l’utilisation d’un manipulateur utérin et une moins bonne survie. La vigilance doit cependant rester de mise concernant l’utilisation du manipulateur dans la prise en charge du cancer de l’endomètre. En effet, Padilla-Iserte et al. ont publié, en janvier 2021,9 les résultats d’une étude rétrospective multicentrique espagnole ayant inclus 2 661 femmes opérées d’un cancer de l’endomètre supposé de stade précoce avec hystérectomie par voie mini-invasive : 1 756 avec manipulateur utérin et 905 sans manipulateur utérin. Le taux de récidive est de 11,69 % dans le groupe manipulateur et de 7,4 % dans le groupe sans manipulateur (p < 0,001). L’utilisation d’un manipulateur utérin est associée à un risque de récidive plus important (hazard ratio ou risque relatif [HR] : 2,31 ; intervalle de confiance à 95 % [IC à 95 %] : 1,27-4,20 ; p = 0,006), à une moins bonne survie sans récidive (HR : 1,74 ; IC à 95 % : 0,57-0,97 ; p = 0,027) et à un taux de décès plus important (HR : 1,74 ; IC à 95 % : 1,07-2,83 ; p = 0,026). De nouvelles études prospectives sont nécessaires pour conforter ou infirmer ces résultats dans la prise en charge du cancer de l’endomètre.
Enfin, selon les dernières recommandations européennes, toute procédure risquant de favoriser une dissémination intra-abdominale de la maladie doit être évitée, notamment le morcellement. Aussi, l’extension de la maladie en dehors de l’utérus et du col (excepté l’envahissement ganglionnaire) est-elle une contre-indication relative à la voie mini-invasive.
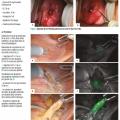
Détection du ganglion sentinelle par le vert d’indocyanine
Les nouvelles recommandations, par rapport à celles de 2016, ont considérablement élargi le champ des indications du ganglion sentinelle par rapport aux curages complets, que ce soit pour les types histologiques endométrioïdes ou non endométrioïdes.1
La chirurgie de stadification ganglionnaire comporte une procédure du ganglion sentinelle qui est :
- proposée pour les groupes à risque « bas » ou « intermédiaire ». La procédure peut cependant être évitée en cas d’absence d’envahissement myométrial ;
- recommandée pour les groupes à risque « haut intermédiaire » et « élevé », quel que soit le type histologique. Un curage pelvien homolatéral doit être réalisé en l’absence de détection du ganglion sentinelle.
Il est recommandé de réaliser la détection du ganglion sentinelle avec du vert d’indocyanine (
Si un envahissement ganglionnaire est mis en évidence en peropératoire, il n’est pas utile de réaliser les curages pelviens de façon systématique ; on procède alors à l’exérèse des adénopathies suspectes volumineuses, et le curage lombo-aortique est à discuter.
Ces recommandations se fondent sur une littérature internationale riche : la procédure du ganglion sentinelle avait d’abord été évaluée dans le protocole Senti-Endo publié en 2011 par Ballester et al.10 Les auteurs avaient démontré que cette procédure, en utilisant la double détection au colloïde radioactif et au bleu patenté, était associée, par patiente, à un taux de détection de 88,8 %, à une sensibilité de 82,3 % et à une valeur prédictive négative de 96,9 %. La méthode de détection du ganglion sentinelle par un nouveau colorant, le vert d’indocyanine, a été par la suite évaluée par l’essai prospectif FIRES, avec un taux de détection de 96 % (52 % en bilatéral).11 Plusieurs études ont ensuite mis en évidence une supériorité de la détection au vert par rapport au bleu, notamment chez les patientes obèses.12 L’essai randomisé FILM, publié en 2018, a conclu à un taux de détection bilatérale du ganglion sentinelle de 78 % avec le vert versus 31 % avec le bleu (p < 0,0001).13 De façon similaire, l’essai randomisé NCT02564276, publié par Rozenholc et al. en 2019, a mis en évidence un meilleur taux de détection du ganglion sentinelle avec le vert qu’avec le bleu (90,9 % versus 64,4 %, p < 0,00001).14 La procédure du ganglion sentinelle avec détection par le vert d’indocyanine a également été évaluée spécifiquement pour les patientes présentant un cancer de l’endomètre à haut risque. Dans cette indication, Persson et al. ont montré que le taux de détection bilatérale était de 96 % sans faux négatif sur une population de 102 patientes.15 Les mêmes auteurs ont publié deux ans plus tard une série plus importante de 257 patientes avec toujours des cancers de l’endomètre à haut risque ; le vert d’indocyanine permettait de détecter le ganglion sentinelle avec une sensibilité de 98 % et une valeur prédictive négative de 99,5 %.16 Ces résultats ont été confirmés par ceux de la cohorte multicentrique SENTOR qui concernait 156 patientes avec un cancer de l’endomètre à haut risque prises en charge par ganglion sentinelle puis curages systématiques ; la détection du ganglion sentinelle par le vert d’indocyanine était associée à une sensibilité de 96 % et une valeur prédictive négative de 99 %.17 Enfin, une étude multicentrique italienne, publiée en 2018, a montré que les survies sans récidive et globale étaient identiques selon que les patientes avec un cancer de l’endomètre à risque « moyen-haut » ou « haut » aient été prises en charge par curage systématique ou par ganglion sentinelle avec le vert d’indocyanine.18 Ces données concernant la survie ont été confirmées par une méta-analyse en 2019.19
Voie mini-invasive et procédure au vert d’indocyanine recommandées
La chirurgie par voie mini-invasive (cœlioscopique ou robot-assistée) est actuellement recommandée lorsqu’une chirurgie est envisagée, y compris pour les patientes du groupe à haut risque ; la place du manipulateur utérin dans cette indication doit encore être précisée par des études prospectives. La procédure du ganglion sentinelle au vert d’indocyanine est, par ailleurs, devenue la technique de référence pour la stadification ganglionnaire des stades FIGO I et II, quel que soit le type histologique. La prise en charge doit être assurée dans un établissement spécialisé par une équipe spécialisée dans les cancers gynécologiques.
1. Concin N, Matias-Guiu X, Vergote I, Cibula D, Mirza MR, Marnitz S, et al. ESGO/ESTRO/ESP guidelines for the management of patients with endometrial carcinoma. Int J Gynecol Cancer 2021;31(1):12-39.
2. Walker JL, Piedmonte MR, Spirtos NM, Eisenkop SM, Schlaerth JB, Mannel RS, et al. Recurrence and survival after random assignment to laparoscopy versus laparotomy for comprehensive surgical staging of uterine cancer: Gynecologic Oncology Group LAP2 Study. J Clin Oncol 2012;30(7):695-700.
3. Walker JL, Piedmonte MR, Spirtos NM, Eisenkop SM, Schlaerth JB, Mannel RS, et al. Laparoscopy compared with laparotomy for comprehensive surgical staging of uterine cancer: Gynecologic Oncology Group Study LAP2. J Clin Oncol 2009;27(32):5331-6.
4. Jørgensen SL, Mogensen O, Wu CS, Korsholm M, Lund K, Jensen PT. Survival after a nationwide introduction of robotic surgery in women with early-stage endometrial cancer: a population-based prospective cohort study. Eur J Cancer 2019;109:1-11.
5. Coronado PJ, Rychlik A, Baquedano L, García-Pineda V, Martínez-Maestre MA, Querleu D, et al. Survival analysis in endometrial carcinomas by type of surgical approach: A matched-pair study. Cancers (Basel) 2022;14(4):1081.
6. Querleu D, Cibula D, Concin N, Fagotti A, Ferrero A, Fotopoulou C, et al. Laparoscopic radical hysterectomy: a European Society of Gynaecological Oncology (ESGO) statement. Int J Gynecol Cancer 2020;30(1):15.
7. Ramirez PT, Frumovitz M, Pareja R, Lopez A, Vieira M, Ribeiro R, et al. Minimally invasive versus abdominal radical hysterectomy for cervical cancer. N Engl J Med 2018 15;379(20):1895-904.
8. Chiva L, Zanagnolo V, Querleu D, Martin-Calvo N, Arévalo-Serrano J, Căpîlna ME, et al.; SUCCOR study group. SUCCOR study: an international european cohort observational study comparing minimally invasive surgery versus open abdominal radical hysterectomy in patients with stage IB1 cervical cancer. Int J Gynecol Cancer 2020;30(9):1269-77.
9. Padilla-Iserte P, Lago V, Tauste C, Díaz-Feijoo B, Gil-Moreno A, Oliver R, et al. Spanish Society of Gynecology and Obstetrics Spanish Investigational Network Gynecologic Oncology Group. Impact of uterine manipulator on oncological outcome in endometrial cancer surgery. Am J Obstet Gynecol. 2021 Jan;224(1):65.e1-65.e11.
10. Ballester M, Dubernard G, Lécuru F, Heitz D, Mathevet P, Marret H, et al. Detection rate and diagnostic accuracy of sentinel-node biopsy in early-stage endometrial cancer: a prospective multicentre study (SENTI-ENDO). Lancet Oncol 2011;12(5):469-76.
11. Rossi EC, Kowalski LD, Scalici J, Cantrell L, Schuler K, Hanna RK, et al. A comparison of sentinel lymph node biopsy to lymphadenectomy for endometrial cancer staging (FIRES trial): a multicentre, prospective, cohort study. Lancet Oncol 2017;18(3):384-92.
12. Tanner EJ, Sinno AK, Stone RL, Levinson KL, Long KC, Fader AN. Factors associated with successful bilateral sentinel lymph node mapping in endometrial cancer. Gynecol Oncol 2015;138(3):542-7.
13. Frumovitz M, Plante M, Lee PS, Sandadi S, Lilja JF, Escobar PF, et al. Near-infrared fluorescence for detection of sentinel lymph nodes in women with cervical and uterine cancers (FILM): a randomised, phase 3, multicentre, non-inferiority trial. Lancet Oncol 2018;19(10):1394-403.
14. Rozenholc A, Samouelian V, Warkus T, Gauthier P, Provencher D, Sauthier P, et al. Green versus blue: Randomized controlled trial comparing indocyanine green with methylene blue for sentinel lymph node detection in endometrial cancer. Gynecol Oncol 2019;153(3):500-4.
15. Persson J, Geppert B, Lönnerfors C, Bollino M, Måsbäck A. Description of a reproducible anatomically based surgical algorithm for detection of pelvic sentinel lymph nodes in endometrial cancer. Gynecol Oncol 2017;147(1):120-5.
16. Persson J, Salehi S, Bollino M, Lönnerfors C, Falconer H, Geppert B. Pelvic Sentinel lymph node detection in High-Risk Endometrial Cancer (SHREC-trial)-the final step towards a paradigm shift in surgical staging. Eur J Cancer 2019;116:77-85.
17. Cusimano MC, Vicus D, Pulman K, Maganti M, Bernardini MQ, Bouchard-Fortier G, et al. Assessment of sentinel lymph node biopsy vs lymphadenectomy for intermediate and high-grade endometrial cancer staging. JAMA Surg 2021;156(2):157-64.
18. Buda A, Restaino S, Di Martino G, De Ponti E, Monterossi G, Dinoi G, et al. The impact of the type of nodal assessment on prognosis in patients with high-intermediate and high-risk ESMO/ESGO/ESTRO group endometrial cancer. A multicenter Italian study. Eur J Surg Oncol 2018;44(10):1562-7.
19. Bogani G, Murgia F, Ditto A, Raspagliesi F. Sentinel node mapping vs. lymphadenectomy in endometrial cancer: A systematic review and meta-analysis. Gynecol Oncol 2019;153(3):676-83.