La fièvre méditerranéenne familiale (FMF) est la maladie auto-inflammatoire monogénique la plus fréquente dans le monde. On estime qu’elle concerne plus de 150 000 cas dans le monde, entre 5 000 et 10 000 en France, et que sa prévalence est d’environ 1/1 000 en Turquie, où elle est la plus forte. Elle touche préférentiellement les populations originaires du Moyen-Orient et du bassin méditerranéen, principalement séfarades et turques – où la fréquence des porteurs de la mutation peut atteindre 1/5 – mais aussi arméniennes, arabes de l’Ouest et de l’Est et, dans une moindre mesure, les populations ashkénazes, libanaises, kurdes, druzes, italiennes, grecques, et même japonaises et chinoises.1 L’origine supposée de la FMF remonte à plus de trois mille ans en Mésopotamie. La maladie s’est ensuite propagée en Arménie et en Turquie dans l’Antiquité, puis dans d’autres pays éloignés, avec les migrations des populations dans le monde moderne. Des données récentes démontrent que les épidémies de peste historiques ont joué un rôle dans la sélection positive des mutations de la FMF dans les populations originaires du Moyen-Orient.2
Fièvre épisodique et signes d’inflammation variés
La FMF est caractérisée par des accès fébriles répétés, qui débutent dans 80 % des cas avant 20 ans, avec un âge médian de 4 ans. Ces accès se reproduisent pendant des mois, voire des années, de manière stéréotypée, et la présence d’au moins trois épisodes est nécessaire avant d’évoquer la possibilité d’une fièvre méditerranéenne familiale. Les épisodes de fièvre doivent être spontanément limités dans le temps, généralement d’une durée brève inférieure à quatre jours, et séparés par des intervalles d’apyrexie de durée variable. Ils sont parfois déclenchés par le stress, le sport, la fatigue ou certains aliments. Le nombre de crises par patient est très variable : d’une ou deux crises annuelles pour les patients les moins sévères, jusqu’à une crise par semaine pour les patients les plus grièvement atteints.3
Signes d’inflammation
Les signes cliniques d’inflammation associés sont nombreux.
Les douleurs thoraciques sont dues à une pleurésie ou, plus rarement, à une péricardite.
Les arthralgies et mono- ou oligo-arthrites non érosives touchent les grosses articulations des membres inférieurs.
L’orchite, le plus souvent unilatérale, peut mimer une torsion d’annexe. Elle est rare mais constitue un signe de sévérité de la poussée.
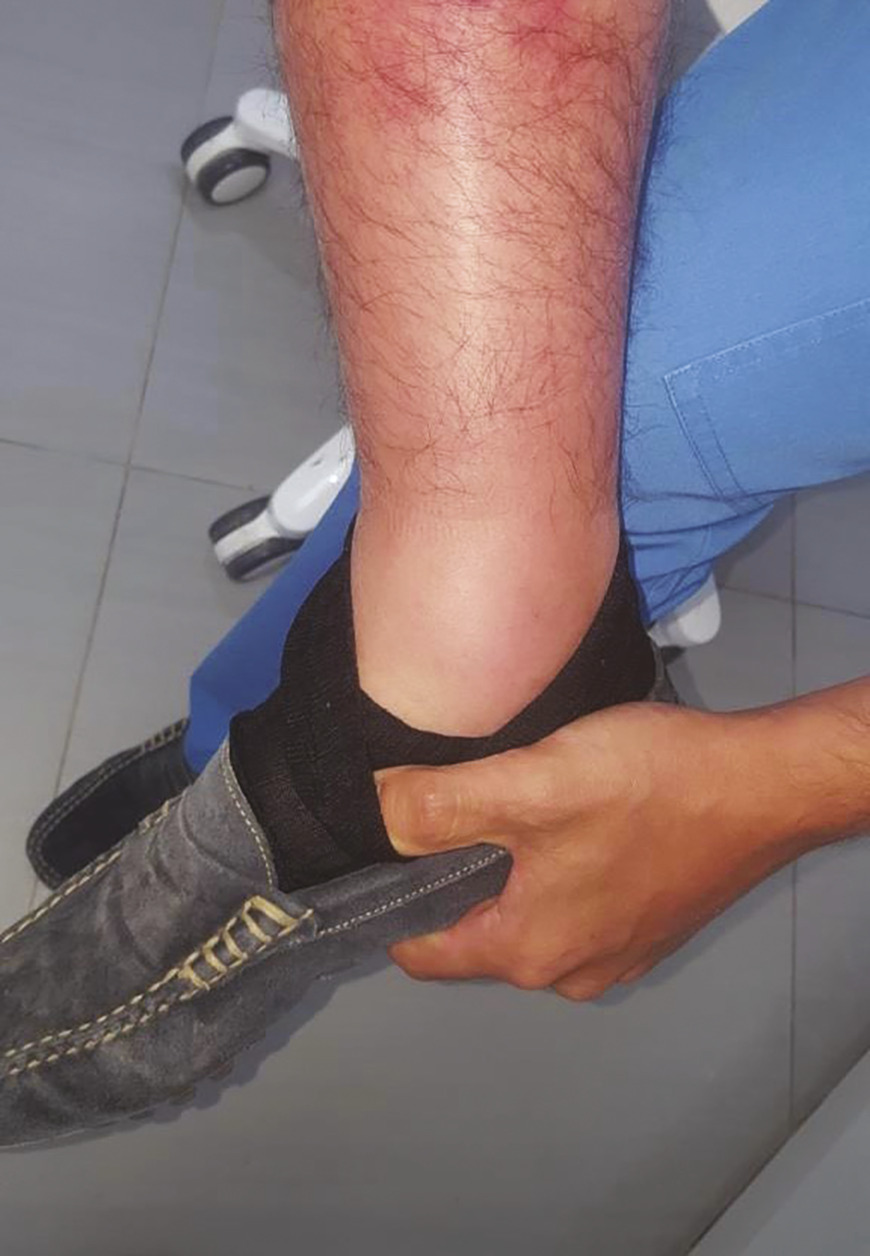
fig. 1 ) est presque pathognomonique d’une FMF, mais sa survenue est peu fréquente (de 7 à 10 %).4 Il est souvent accompagné d’une synovite en regard.
Les aphtes buccaux sont plus rares encore.
Les myalgies fébriles prolongées intenses durent quatre à six semaines, avec un syndrome inflammatoire sans élévation des enzymes musculaires. Cette présentation clinique est plus rare, le plus souvent révélatrice et associée à un purpura vasculaire devant faire évoquer une périartérite noueuse. La biopsie cutanée et musculaire n’est pas contributive ; l’imagerie par résonance magnétique (IRM) musculaire montre des hypersignaux musculaires se rehaussant après injection de gadolinium.5 Elle répond de manière spectaculaire à la corticothérapie.
Inflammation des séreuses
Les douleurs abdominales intenses et la péritonite aseptique, atteinte la plus fréquente (90 % des cas), peuvent mimer des tableaux pseudo-chirurgicaux et mener jusqu’à une appendicectomie blanche dans les cas les plus sévères. Les douleurs abdominales précèdent parfois la fièvre et peuvent persister un à deux jours après.Les douleurs thoraciques sont dues à une pleurésie ou, plus rarement, à une péricardite.
Les arthralgies et mono- ou oligo-arthrites non érosives touchent les grosses articulations des membres inférieurs.
L’orchite, le plus souvent unilatérale, peut mimer une torsion d’annexe. Elle est rare mais constitue un signe de sévérité de la poussée.
Inflammation cutanée
Le pseudo-érysipèle de la cheville (Les aphtes buccaux sont plus rares encore.
Inflammation musculaire
Les myalgies d’effort, survenant parfois en dehors des poussées, répondent bien aux anti-inflammatoires non stéroïdiens (AINS).Les myalgies fébriles prolongées intenses durent quatre à six semaines, avec un syndrome inflammatoire sans élévation des enzymes musculaires. Cette présentation clinique est plus rare, le plus souvent révélatrice et associée à un purpura vasculaire devant faire évoquer une périartérite noueuse. La biopsie cutanée et musculaire n’est pas contributive ; l’imagerie par résonance magnétique (IRM) musculaire montre des hypersignaux musculaires se rehaussant après injection de gadolinium.5 Elle répond de manière spectaculaire à la corticothérapie.
Présentations atypiques et maladies associées
Certaines maladies sont associées de manière non fortuite à la FMF, telles que :
– des vascularites, dont la plus fréquente est la vascularite à IgA, plus rarement la périartérite noueuse. Un purpura vasculaire ou un authentique purpura rhumatoïde (souvent compliqué) peut donc révéler la FMF.6,7 L’association avec la maladie de Behçet reste quant à elle controversée ;8
– les spondylarthropathies chroniques, principalement avec une atteinte axiale ou enthésitique, en l’absence de l’antigène HLA B7. Une sacro-iliite doit être recherchée dans ce contexte ;9,10
– d’authentiques colites ont été décrites chez des patients atteints de FMF, notamment en cas de mutations M694V ou M680I, avec des tableaux sévères et des signes extradigestifs fréquents ;11
– l’hidrosadénite suppurée est également fréquemment associée à la FMF.12
– des vascularites, dont la plus fréquente est la vascularite à IgA, plus rarement la périartérite noueuse. Un purpura vasculaire ou un authentique purpura rhumatoïde (souvent compliqué) peut donc révéler la FMF.6,7 L’association avec la maladie de Behçet reste quant à elle controversée ;8
– les spondylarthropathies chroniques, principalement avec une atteinte axiale ou enthésitique, en l’absence de l’antigène HLA B7. Une sacro-iliite doit être recherchée dans ce contexte ;9,10
– d’authentiques colites ont été décrites chez des patients atteints de FMF, notamment en cas de mutations M694V ou M680I, avec des tableaux sévères et des signes extradigestifs fréquents ;11
– l’hidrosadénite suppurée est également fréquemment associée à la FMF.12
Syndrome inflammatoire biologique pendant les accès fébriles
Le syndrome inflammatoire en poussée est constant (protéine C-réactive [CRP] élevée, hyperleucocytose à polynucléaires neutrophiles modérée), avec une normalisation de ces marqueurs en dehors des accès fébriles. Chez certains patients, une inflammation intercritique occulte peut persister, ce qui peut motiver une optimisation thérapeutique.3
Une maladie génétique
Transmission essentiellement autosomique récessive
La FMF est une maladie principalement à transmission autosomique récessive, secondaire à des mutations, découvertes en 1997 dans le gène MEVF, situé sur le chromosome 16, qui comprend dix exons et code pour une protéine appelée pyrine. Actuellement, il existe 391 variants de séquence de MEVF décrits dans la base de données Infevers (https://infevers.umai-montpellier.fr/web/), mais tous ne sont pas considérés comme associés à un phénotype évocateur de la maladie. Les principales mutations pathogènes sont situées dans l’exon 10 ; les plus fréquentes sont M694V, M694I, M680I, V726A, I962del et K965R. Les patients homozygotes pour M694V ou hétérozygotes composites avec des mutations situées entre les positions 680 et 694 de l’exon 10 sont considérés comme à risque de développer un phénotype plus sévère de la maladie. Les patients homozygotes pour M694V sont également à risque de développer plus précocement la maladie. A contrario, le variant E148Q situé sur l’exon 2 ne doit plus être considéré aujourd’hui comme pathogène mais comme un polymorphisme.13 Pour les individus ne descendant pas des populations à risque, un variant pathogène de MEVF n’est (presque) jamais retrouvé, d’où l’importance de réaliser un arbre généalogique remontant jusqu’aux grands-parents ou arrière-grands-parents.
Enfin, il existe des cas typiques mais très rares de FMF à transmission dominante, y compris chez des patients d’origine non méditerranéenne (exon 5, exon 8, M694del sur l’exon 10). Ainsi, en cas de suspicion clinique forte et d’efficacité de la colchicine, le séquençage d’autres exons que l’exon 10 peut être discuté en centre expert.14
Enfin, il existe des cas typiques mais très rares de FMF à transmission dominante, y compris chez des patients d’origine non méditerranéenne (exon 5, exon 8, M694del sur l’exon 10). Ainsi, en cas de suspicion clinique forte et d’efficacité de la colchicine, le séquençage d’autres exons que l’exon 10 peut être discuté en centre expert.14
Cas particulier des patients hétérozygotes
Bien que la FMF soit une maladie génétique autosomique récessive, un seul variant pathogène est retrouvé (principalement M694V) chez un certain nombre de patients avec des signes cliniques évocateurs de FMF, de PFAPA (fièvre périodique, aphtes, pharyngite, adénopathies), ou non spécifiques, associés à un syndrome inflammatoire biologique.15 Ces patients présentent habituellement un phénotype peu sévère, proche de celui des patients homozygotes ou hétérozygotes composites dans l’enfance, et répondent bien au traitement par colchicine. L’évolution semble plus favorable, et la colchicine pourrait être diminuée, voire arrêtée, après au moins trois ans sans symptômes ni inflammation.3 Une surveillance clinique et biologique reste cependant préconisée pendant plusieurs années, afin d’identifier les patients pour lesquels la reprise de colchicine serait nécessaire, en cas de réapparition de symptômes et/ou d’inflammation biologique, parfois décrites après plusieurs années de rémission.16 Un avis en centre d’expert est vivement conseillé pour ces cas particuliers de patients hétérozygotes.
Les principales hypothèses de survenue de symptômes auto-inflammatoires chez les patients porteurs d’une seule mutation sont : la présence de polymorphismes nucléotidiques sur l’autre allèle qui rendrait l’individu plus inflammatoire, la présence d’un variant de signification inconnue sur l’autre allèle, ou certains facteurs environnementaux déclencheurs (comme le rôle de micro-ARN ou du microbiote, encore débattu).17
Les principales hypothèses de survenue de symptômes auto-inflammatoires chez les patients porteurs d’une seule mutation sont : la présence de polymorphismes nucléotidiques sur l’autre allèle qui rendrait l’individu plus inflammatoire, la présence d’un variant de signification inconnue sur l’autre allèle, ou certains facteurs environnementaux déclencheurs (comme le rôle de micro-ARN ou du microbiote, encore débattu).17
Confirmation diagnostique
De nombreux critères cliniques diagnostiques ont été établis depuis 1997 : critères de Tel Hashomer et critères simplifiés de Livneh, critères pédiatriques de Yalcinkaya en 2009 et, plus récemment, critères de Gattorno en 2019 (tableau 1 ).18 Ces derniers sont mixtes, cliniques et génétiques, soulignant le caractère indispensable des résultats génétiques pour confirmer le diagnostic de FMF.
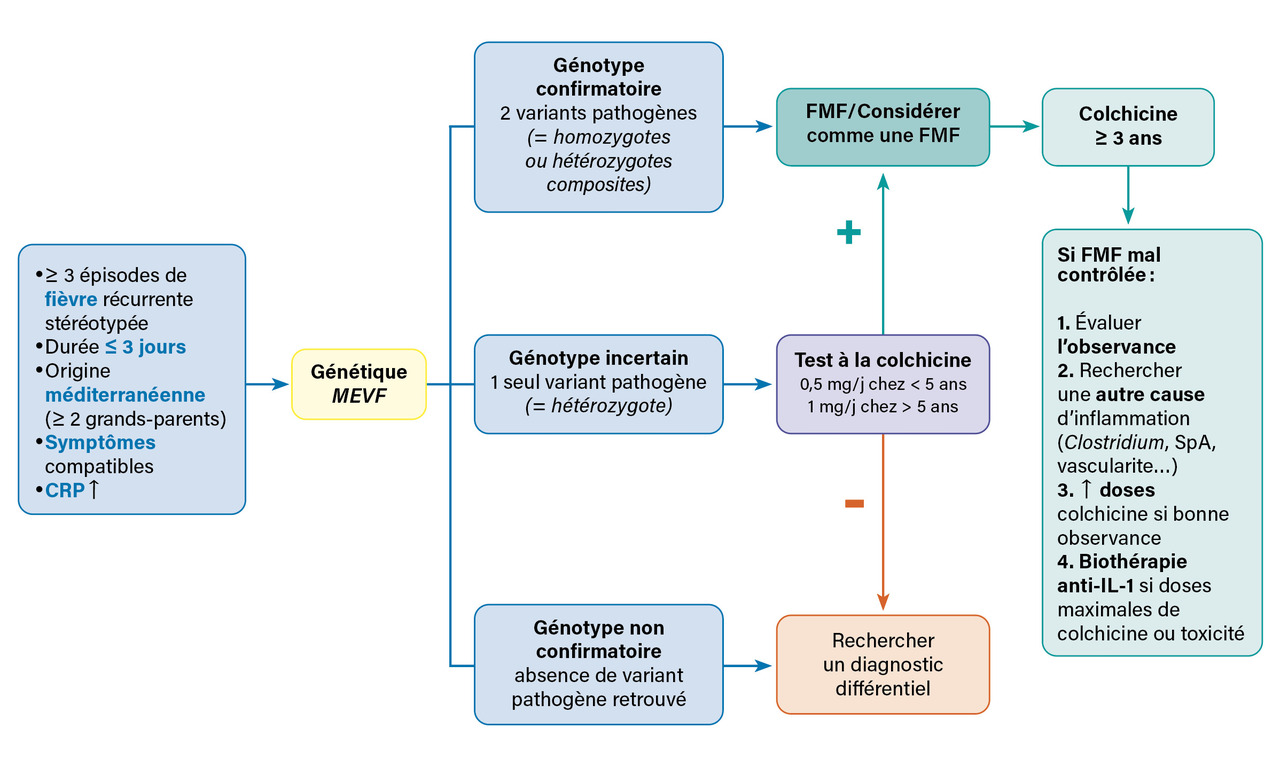
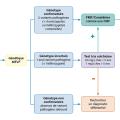
En pratique, chez un patient originaire du bassin méditerranéen présentant une fièvre récurrente stéréotypée, dont les symptômes associés et la durée sont compatibles avec une FMF, une analyse de l’exon 10 du gène MEVF (technique de Sanger) peut être demandée pour confirmer le diagnostic. On distingue trois cas de figure possibles au rendu des résultats génétiques (fig. 2 ) :3
– génotype confirmatoire : présence de deux variants pathogènes (homozygote ou hétérozygote composite). Le diagnostic de FMF est confirmé ;
– génotype non confirmatoire : absence de variant pathogène retrouvé. Les diagnostics différentiels doivent être recherchés ;
– génotype incertain : présence d’un seul variant pathogène (hétérozygote). Un test thérapeutique à la colchicine peut être proposé. En cas d’efficacité de la colchicine, une hétérozygotie FMF peut être considérée, jusqu’à preuve du contraire. En cas d’inefficacité, les diagnostics différentiels doivent être recherchés.
En pratique, chez un patient originaire du bassin méditerranéen présentant une fièvre récurrente stéréotypée, dont les symptômes associés et la durée sont compatibles avec une FMF, une analyse de l’exon 10 du gène MEVF (technique de Sanger) peut être demandée pour confirmer le diagnostic. On distingue trois cas de figure possibles au rendu des résultats génétiques (
– génotype confirmatoire : présence de deux variants pathogènes (homozygote ou hétérozygote composite). Le diagnostic de FMF est confirmé ;
– génotype non confirmatoire : absence de variant pathogène retrouvé. Les diagnostics différentiels doivent être recherchés ;
– génotype incertain : présence d’un seul variant pathogène (hétérozygote). Un test thérapeutique à la colchicine peut être proposé. En cas d’efficacité de la colchicine, une hétérozygotie FMF peut être considérée, jusqu’à preuve du contraire. En cas d’inefficacité, les diagnostics différentiels doivent être recherchés.
Dysrégulation du système immunitaire
Le gène MEVF est un gène régulateur du système immunitaire inné, qui code pour une protéine adaptatrice appelée pyrine, essentiellement exprimée dans la lignée monocytaire. En cas de signaux de danger, la pyrine, une fois activée, est capable de se lier à l’adaptateur ASC pour former une protéine « plate-forme » appelée inflammasome pyrine, à l’origine de la sécrétion de cytokines pro-inflammatoires telles que l’interleukine 1 (IL-1). Les mécanismes moléculaires sont de mieux en mieux connus.
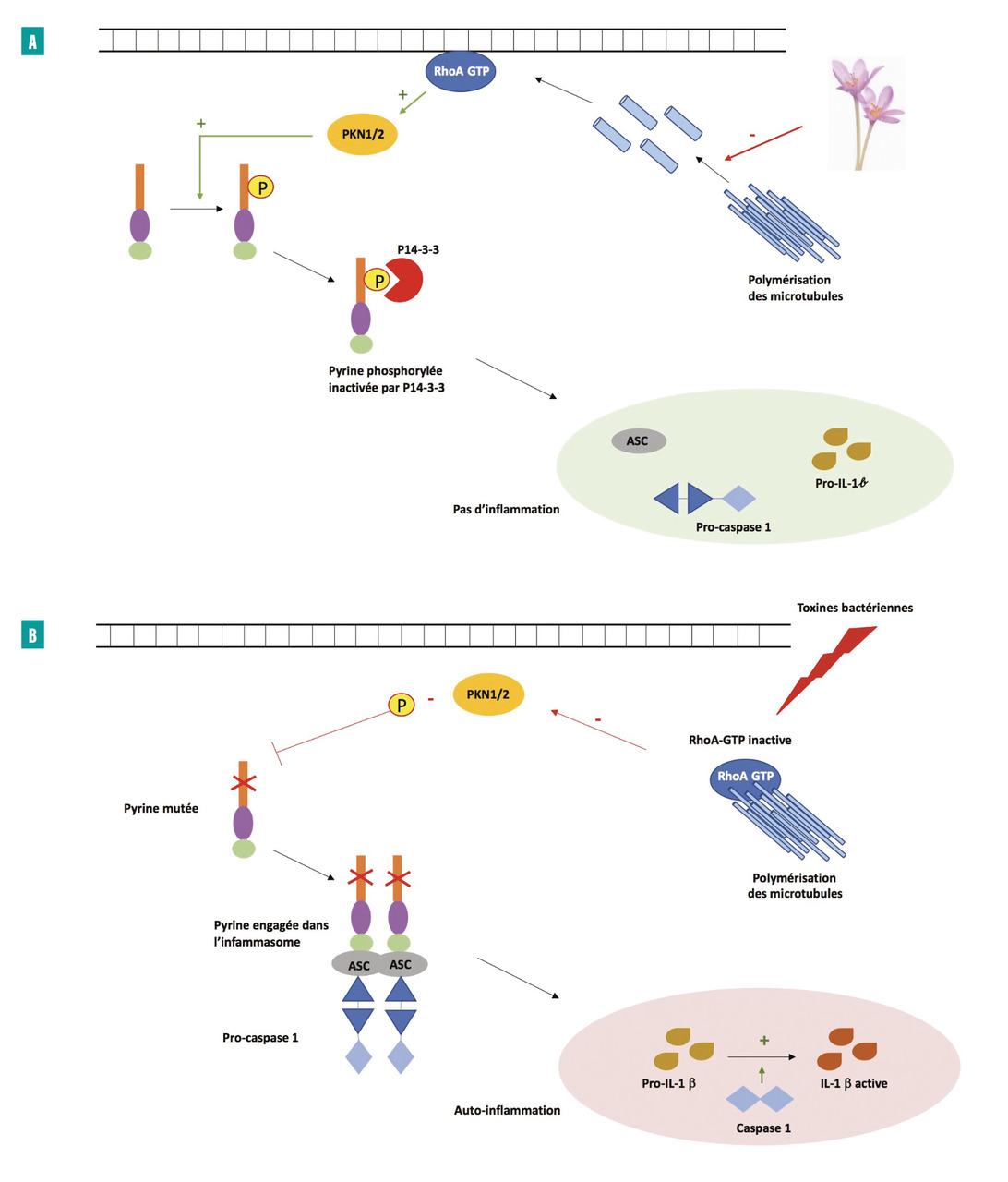
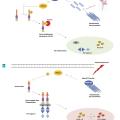
À l’état basal et en l’absence de signaux de danger, la pyrine est inhibée par une protéine de régulation transmembranaire appelée RhoA GTPase, par activation de protéines kinases (PKN1/2) qui phosphorylent la pyrine. Cette phosphorylation permet la fixation de la protéine 14-3-3 à la pyrine, et empêche son activation et la formation de l’inflammasome (fig. 3A ).19
En cas d’agression par certaines toxines bactériennes (comme celle de Clostridium difficile), la RhoA GTPase est inactivée. La protéine 14-3-3 ne peut fixer la pyrine, qui n’est donc plus phosphorylée, entraînant un changement conformationnel et une activation de la pyrine.20 La pyrine activée fixe alors l’adaptateur ASC, puis active la caspase 1, qui permet de transformer la protéine précurseur de l’IL-1β (pro-IL-1β) en IL-1β (IL-1β) active (fig. 3B ).
En cas de mutation du gène MEVF, et donc de la pyrine, la phosphorylation ne peut avoir lieu, conduisant ainsi à une activation constitutionnelle de l’inflammasome pyrine, responsable d’une sécrétion excessive d’IL-1 et d’une réponse inflammatoire inappropriée (fig. 3B ). D’un point de vue thérapeutique, la colchicine bloquerait la polymérisation des microtubules, à l’origine d’une libération et d’une activation de RhoA GTPase, entraînant une inhibition de l’inflammasome pyrine (fig. 3A ).22
À l’état basal et en l’absence de signaux de danger, la pyrine est inhibée par une protéine de régulation transmembranaire appelée RhoA GTPase, par activation de protéines kinases (PKN1/2) qui phosphorylent la pyrine. Cette phosphorylation permet la fixation de la protéine 14-3-3 à la pyrine, et empêche son activation et la formation de l’inflammasome (
En cas d’agression par certaines toxines bactériennes (comme celle de Clostridium difficile), la RhoA GTPase est inactivée. La protéine 14-3-3 ne peut fixer la pyrine, qui n’est donc plus phosphorylée, entraînant un changement conformationnel et une activation de la pyrine.20 La pyrine activée fixe alors l’adaptateur ASC, puis active la caspase 1, qui permet de transformer la protéine précurseur de l’IL-1β (pro-IL-1β) en IL-1β (IL-1β) active (
En cas de mutation du gène MEVF, et donc de la pyrine, la phosphorylation ne peut avoir lieu, conduisant ainsi à une activation constitutionnelle de l’inflammasome pyrine, responsable d’une sécrétion excessive d’IL-1 et d’une réponse inflammatoire inappropriée (
Prise en charge thérapeutique
Traitement symptomatique des poussées
Le traitement des poussées repose principalement sur l’alternance de paracétamol et d’AINS. En cas de douleurs résistantes aux traitements précédents (douleurs thoraciques, par exemple), des antalgiques de palier 2 comme le tramadol (à partir de 3 ans) peuvent être prescrits ponctuellement. Les corticoïdes ne sont pas indiqués en traitement des accès, en dehors de situations précises sévères. De même, la majoration transitoire des doses de colchicine n’est pas recommandée en cas de crises douloureuses. Un traitement par anti-IL-1 de courte durée d’action, l’anakinra, peut être utilisé uniquement sur prescription d’experts dans certaines situations, même s’il n’a pas encore été validé par des essais randomisés.23-25 La mise en place d’un projet d’accueil individualisé (PAI) à l’école est utile pour la prescription du traitement symptomatique des poussées et limiter l’absentéisme scolaire quand l’état de l’enfant le permet.
Traitement de fond
L’objectif du traitement de fond est l’arrêt des accès fébriles sans facteur déclenchant, d’éviter l’inflammation infraclinique, l’apparition d’amylose secondaire et de maintenir une qualité de vie. Le traitement principal est la colchicine, débutée à 0,5 mg/j chez l’enfant de moins de 5 ans et 1 mg/j chez l’enfant de plus de 5 ans, de préférence en fractionnant les doses les trois premières semaines pour éviter l’inconfort digestif. Les doses sont adaptées selon la tolérance digestive tous les trois mois, par palier de 0,25 mg/j chez l’enfant de moins de 10 ans (maximum 2 mg/j), et par palier de 0,5 mg/j chez l’enfant de plus de 10 ans (maximum 2,5 mg/j).3
Certains médicaments sont contre-indiqués en cas de traitement par colchicine, en particulier les macrolides et la pristinamycine, avec un risque de surdosage potentiellement mortel. De plus, la dose de colchicine doit être diminuée en cas d’insuffisance rénale ou hépatique.
En cas d’inefficacité, de toxicité ou de contre-indication (insuffisance rénale ou hépatocellulaire sévère) à la colchicine à doses maximales tolérées sur une période de trois à six mois, une biothérapie anti-IL-1 (anakinra ou canakinumab) peut être proposée en deuxième ligne par un médecin spécialiste.3
Une biothérapie de type anti-TNF-α (tumor necrosis factor) est utilisée préférentiellement en cas de maladie inflammatoire chronique intestinale ou rhumatologique associée.3
Le traitement par colchicine doit être maintenu en association avec la biothérapie, à la dose de 0,5 mg/j pour les moins de 5 ans et 1 mg/j pour les plus de 5 ans, sauf en cas de toxicité ou de contre-indication, situations qui restent exceptionnelles.
En cas d’inefficacité ou d’effet insuffisant de la colchicine, il est impératif de vérifier l’observance thérapeutique du patient. En effet, la résistance à la colchicine est rare (moins de 5 % des cas),26 et l’adhésion au traitement doit être certaine avant toute escalade thérapeutique : nombre d’oublis pas semaine, décompte des boîtes, voire dosage capillaire de colchicine.27
Certains médicaments sont contre-indiqués en cas de traitement par colchicine, en particulier les macrolides et la pristinamycine, avec un risque de surdosage potentiellement mortel. De plus, la dose de colchicine doit être diminuée en cas d’insuffisance rénale ou hépatique.
En cas d’inefficacité, de toxicité ou de contre-indication (insuffisance rénale ou hépatocellulaire sévère) à la colchicine à doses maximales tolérées sur une période de trois à six mois, une biothérapie anti-IL-1 (anakinra ou canakinumab) peut être proposée en deuxième ligne par un médecin spécialiste.3
Une biothérapie de type anti-TNF-α (tumor necrosis factor) est utilisée préférentiellement en cas de maladie inflammatoire chronique intestinale ou rhumatologique associée.3
Le traitement par colchicine doit être maintenu en association avec la biothérapie, à la dose de 0,5 mg/j pour les moins de 5 ans et 1 mg/j pour les plus de 5 ans, sauf en cas de toxicité ou de contre-indication, situations qui restent exceptionnelles.
En cas d’inefficacité ou d’effet insuffisant de la colchicine, il est impératif de vérifier l’observance thérapeutique du patient. En effet, la résistance à la colchicine est rare (moins de 5 % des cas),26 et l’adhésion au traitement doit être certaine avant toute escalade thérapeutique : nombre d’oublis pas semaine, décompte des boîtes, voire dosage capillaire de colchicine.27
Surveillance clinique et de la réponse au traitement 2 à 4 fois par an
La surveillance clinique et la réponse au traitement doivent être évaluées tous les trois à six mois. Un syndrome inflammatoire biologique doit être recherché annuellement, par le dosage de la CRP, avec initialement un dosage conjoint de la protéine SAA (sérum amyloïde A), pour vérifier l’absence de dissociation entre les poussées.3,28 Des critères ont été récemment établis pour définir les patients avec une FMF bien équilibrée ou insuffisamment contrôlée (tableau 2 ).3 La conduite à tenir en cas de FMF insuffisamment contrôlée est détaillée dans la figure 2 .3
L’amylose AA est la principale complication
La principale complication de la FMF est l’amylose AA secondaire, qui survient principalement à l’âge adulte chez des patients non ou insuffisamment traités, avec une inflammation chronique. Les autres facteurs de risque de développer une amylose AA sont l’homozygotie M694V, le sexe masculin, les antécédents familiaux d’amylose, et le pays d’origine (Arménie, Géorgie, Turquie).29
L’atteinte rénale est la plus fréquente (90 %) et la plus grave, le plus souvent révélée par une néphropathie glomérulaire chronique initialement silencieuse. Les atteintes digestive (diarrhée) et thyroïdienne (goitre) sont possibles mais plus rares, et les atteintes cardiaque et neurologique périphérique sont exceptionnelles.
Le dépistage de l’amylose AA s’effectue par la recherche d’une protéinurie et la surveillance de la fonction rénale annuellement.3 La confirmation diagnostique est histologique, révélant les dépôts amyloïdes par coloration au rouge congo, en privilégiant une biopsie sur des sites accessibles comme les glandes salivaires.
La coxite destructrice précoce est une forme rare mais engageant le pronostic fonctionnel, survenant plus volontiers chez les patients homozygotes M694V.10
L’hépatopathie chronique, l’hémopathie myéloïde et la péritonite chronique ou le mésothéliome péritonéal sont d’autres complications rares observées à un stade avancé chez l’adulte de plus de 50 ans.3,30-32
L’atteinte rénale est la plus fréquente (90 %) et la plus grave, le plus souvent révélée par une néphropathie glomérulaire chronique initialement silencieuse. Les atteintes digestive (diarrhée) et thyroïdienne (goitre) sont possibles mais plus rares, et les atteintes cardiaque et neurologique périphérique sont exceptionnelles.
Le dépistage de l’amylose AA s’effectue par la recherche d’une protéinurie et la surveillance de la fonction rénale annuellement.3 La confirmation diagnostique est histologique, révélant les dépôts amyloïdes par coloration au rouge congo, en privilégiant une biopsie sur des sites accessibles comme les glandes salivaires.
La coxite destructrice précoce est une forme rare mais engageant le pronostic fonctionnel, survenant plus volontiers chez les patients homozygotes M694V.10
L’hépatopathie chronique, l’hémopathie myéloïde et la péritonite chronique ou le mésothéliome péritonéal sont d’autres complications rares observées à un stade avancé chez l’adulte de plus de 50 ans.3,30-32
Références
1. Ben-Chetrit E, Touitou I. Familial mediterranean fever in the world. Arthritis Rheum 2009;61(10):1447-53.
2. Park YH, Remmers EF, Lee W, Ombrello AK, Chung LK, Shilei Z, et al. Ancient familial mediterranean fever mutations in human pyrin and resistance to Yersinia pestis. Nat Immunol 2020;21(8):857-67.
3. Georgin-Lavialle S, Boffa JJ, Cuisset L, Grateau G, Monfort JB, Savey L, et al. PNDS « Fièvre méditerranéenne familiale » 2022. Haute Autorité de santé. https://vu.fr/awujD
4. Gezgin Yildirim D, Seven MB, Gönen S, Söylemezoğlu O. Erysipelas-like erythema in children with familial mediterranean fever. Clin Exp Rheumatol 2020;38 Suppl 127(5):101-4.
5. Aviran N, Amarilyo G, Lakovsky Y, Tal R, Garkaby J, Haviv R, et al. Magnetic resonance findings may aid in diagnosis of protracted febrile myalgia syndrome: A retrospective, multicenter study. Orphanet J Rare Dis 2022;17(1):15.
6. Abbara S, Monfort JB, Savey L, Moguelet P, Saadoun D, Bachmeyer C, et al. Vasculitis and familial Mediterranean fever: Description of 22 French adults from the juvenile inflammatory rheumatism cohort. Front Med (Lausanne) 2022;9:1000167.
7. Abbara S, Grateau G, Ducharme-Bénard S, Saadoun D, Georgin-Lavialle S. Association of vasculitis and familial Mediterranean fever. Front Immunol 2019;10:763.
8. Watad A, Tiosano S, Yahav D, Comaneshter D, Shoenfeld Y, Cohen AD, et al. Behçet’s disease and familial Mediterranean fever: Two sides of the same coin or just an association? A cross-sectional study. Eur J Intern Med 2017;39:75-8.
9. Acer Kasman S, Duruöz MT. Spondyloarthritis in familial Mediterranean fever: A cohort study. Rheumatol Int 2022;42(10):1729-39.
10. Kaçmaz H, Aldemir E, Tanatar A, Karadağ ŞG, Çakan M, Sönmez HE, et al. Sacroiliitis in children and adolescents with familial Mediterranean fever. Adv Rheumatol 2021;61(1):29.
11. Papadopoulos VP, Antoniadou C, Ritis K, Skendros P. MEFV mutations in IBD patients: A systematic review and meta- analysis. J Gastrointestin Liver Dis 2022;31(1):85-97.
12. Abbara S, Georgin-Lavialle S, Stankovic Stojanovic K, Bachmeyer C, Senet P, Buob D, et al. Association of hidradenitis suppurativa and familial Mediterranean fever: A case series of 6 patients. Joint Bone Spine 2017;84(2):159-62.
13. Giancane G, Ter Haar NM, Wulffraat N, Vastert SJ, Barron K, Hentgen V, et al. Evidence-based recommendations for genetic diagnosis of familial Mediterranean fever. Ann Rheum Dis 2015;74(4):635-41.
14. Sarrabay G, Touitou I. Dominant familial mediterranean fever. Rheumatology (Oxford) 2017;56(2):173-5.
15. Sönmez HE, Batu ED, Bilginer Y, Özen S. Discontinuing colchicine in symptomatic carriers for MEFV (Mediterranean FeVer) variants. Clin Rheumatol 2017;36(2):421-5.
16. Ben-Zvi I, Krichely-Vachdi T, Feld O, Lidar M, Kivity S, Livneh A. Colchicine-free remission in familial Mediterranean fever: Featuring a unique subset of the disease-a case control study. Orphanet J Rare Dis 2014;9:3.
17. Ozen S. Update in familial Mediterranean fever. Curr Opin Rheumatol 2021;33(5):398-402.
18. Gattorno M, Hofer M, Federici S, Vanoni F, Bovis F, Aksentijevich I, et al. Classification criteria for autoinflammatory recurrent fevers. Ann Rheum Dis 2019;78(8):1025-32.
19. Park YH, Wood G, Kastner DL, Chae JJ. Pyrin inflammasome activation and RhoA signaling in the autoinflammatory diseases FMF and HIDS. Nat Immunol 2016;17(8):914-21.
20. Xu H, Yang J, Gao W, Li L, Li P, Zhang L, et al. Innate immune sensing of bacterial modifications of Rho GTPases by the Pyrin inflammasome. Nature 2014;513(7517):237-41.
21. Magnotti F, Lefeuvre L, Benezech S, Malsot T, Waeckel L, Martin A, et al. Pyrin dephosphorylation is sufficient to trigger inflammasome activation in familial mediterranean fever patients. EMBO Mol Med 2019;11(11):e10547.
22. Van Gorp H, Saavedra PHV, de Vasconcelos NM, Van Opdenbosch N, Vande Walle L, Matusiak M, et al. Familial mediterranean fever mutations lift the obligatory requirement for microtubules in Pyrin inflammasome activation. Proc Natl Acad Sci USA 2016;113(50):14384-9.
23. Sag E, Akal F, Atalay E, Akca UK, Demir S, Demirel D, et al. Anti-IL1 treatment in colchicine-resistant paediatric FMF patients: Real life data from the HELIOS registry. Rheumatology (Oxford) 2020;59(11):3324-9.
24. Babaoglu H, Varan O, Kucuk H, Atas N, Satis H, Salman R, et al. On demand use of anakinra for attacks of familial Mediterranean fever (FMF). Clin Rheumatol 2019;38(2):577-81.
25. Hentgen V, Koné-Paut I, Belot A, Galeotti C, Grateau G, Carbasse A, et al. Long-term follow-up and optimization of interleukin-1 inhibitors in the management of monogenic autoinflammatory diseases: Real-life data from the JIR cohort. Front Pharmacol 2020;11:568865.
26. Ozen S, Demirkaya E, Erer B, Livneh A, Ben-Chetrit E, Giancane G, et al. EULAR recommendations for the management of familial Mediterranean fever. Ann Rheum Dis 2016;75(4):644-51.
27. Georgin-Lavialle S, Abe E, Larabi A, Savey L, Ducharme-Bénard S, Hentgen V, et al. Could we measure hair colchicine to assess colchicine observance in familial mediterranean fever? Rheumatology (Oxford) 2021;60(3):1563-4.
28. Çakan M, Karadağ ŞG, Tanatar A, Sönmez HE, Ayaz NA. The value of serum amyloid a levels in familial mediterranean fever to identify occult inflammation during asymptomatic periods. J Clin Rheumatol 2021;27(1):1-4.
29. Akar S, Yuksel F, Tunca M, Soysal O, Solmaz D, Gerdan V, et al. Familial mediterranean fever: Risk factors, causes of death, and prognosis in the colchicine era. Medicine (Baltimore) 2012;91(3):131-6.
30. Talerico R, Cardillo C, De Vito F, Schinzari F, Soldato M, Giustiniani MC, et al. Mesothelioma in familial mediterranean fever with colchicine intolerance: A case report and literature review. Front Immunol 2020;11:889.
31. Awad F, Georgin-Lavialle S, Brignier A, Derrieux C, Aouba A, Stankovic-Stojanovic K, et al. Chronic myelomonocytic leukemia as a cause of fatal uncontrolled inflammation in familial mediterranean fever. Orphanet J Rare Dis 2015;10:76.
32. Fraisse T, Savey L, Hentgen V, Rossi-Semerano L, Koné-Paut I, Grateau G, et al. Non-amyloid liver involvement in familial mediterranean fever: A systematic literature review. Liver Int 2020;40(6):1269-77.
2. Park YH, Remmers EF, Lee W, Ombrello AK, Chung LK, Shilei Z, et al. Ancient familial mediterranean fever mutations in human pyrin and resistance to Yersinia pestis. Nat Immunol 2020;21(8):857-67.
3. Georgin-Lavialle S, Boffa JJ, Cuisset L, Grateau G, Monfort JB, Savey L, et al. PNDS « Fièvre méditerranéenne familiale » 2022. Haute Autorité de santé. https://vu.fr/awujD
4. Gezgin Yildirim D, Seven MB, Gönen S, Söylemezoğlu O. Erysipelas-like erythema in children with familial mediterranean fever. Clin Exp Rheumatol 2020;38 Suppl 127(5):101-4.
5. Aviran N, Amarilyo G, Lakovsky Y, Tal R, Garkaby J, Haviv R, et al. Magnetic resonance findings may aid in diagnosis of protracted febrile myalgia syndrome: A retrospective, multicenter study. Orphanet J Rare Dis 2022;17(1):15.
6. Abbara S, Monfort JB, Savey L, Moguelet P, Saadoun D, Bachmeyer C, et al. Vasculitis and familial Mediterranean fever: Description of 22 French adults from the juvenile inflammatory rheumatism cohort. Front Med (Lausanne) 2022;9:1000167.
7. Abbara S, Grateau G, Ducharme-Bénard S, Saadoun D, Georgin-Lavialle S. Association of vasculitis and familial Mediterranean fever. Front Immunol 2019;10:763.
8. Watad A, Tiosano S, Yahav D, Comaneshter D, Shoenfeld Y, Cohen AD, et al. Behçet’s disease and familial Mediterranean fever: Two sides of the same coin or just an association? A cross-sectional study. Eur J Intern Med 2017;39:75-8.
9. Acer Kasman S, Duruöz MT. Spondyloarthritis in familial Mediterranean fever: A cohort study. Rheumatol Int 2022;42(10):1729-39.
10. Kaçmaz H, Aldemir E, Tanatar A, Karadağ ŞG, Çakan M, Sönmez HE, et al. Sacroiliitis in children and adolescents with familial Mediterranean fever. Adv Rheumatol 2021;61(1):29.
11. Papadopoulos VP, Antoniadou C, Ritis K, Skendros P. MEFV mutations in IBD patients: A systematic review and meta- analysis. J Gastrointestin Liver Dis 2022;31(1):85-97.
12. Abbara S, Georgin-Lavialle S, Stankovic Stojanovic K, Bachmeyer C, Senet P, Buob D, et al. Association of hidradenitis suppurativa and familial Mediterranean fever: A case series of 6 patients. Joint Bone Spine 2017;84(2):159-62.
13. Giancane G, Ter Haar NM, Wulffraat N, Vastert SJ, Barron K, Hentgen V, et al. Evidence-based recommendations for genetic diagnosis of familial Mediterranean fever. Ann Rheum Dis 2015;74(4):635-41.
14. Sarrabay G, Touitou I. Dominant familial mediterranean fever. Rheumatology (Oxford) 2017;56(2):173-5.
15. Sönmez HE, Batu ED, Bilginer Y, Özen S. Discontinuing colchicine in symptomatic carriers for MEFV (Mediterranean FeVer) variants. Clin Rheumatol 2017;36(2):421-5.
16. Ben-Zvi I, Krichely-Vachdi T, Feld O, Lidar M, Kivity S, Livneh A. Colchicine-free remission in familial Mediterranean fever: Featuring a unique subset of the disease-a case control study. Orphanet J Rare Dis 2014;9:3.
17. Ozen S. Update in familial Mediterranean fever. Curr Opin Rheumatol 2021;33(5):398-402.
18. Gattorno M, Hofer M, Federici S, Vanoni F, Bovis F, Aksentijevich I, et al. Classification criteria for autoinflammatory recurrent fevers. Ann Rheum Dis 2019;78(8):1025-32.
19. Park YH, Wood G, Kastner DL, Chae JJ. Pyrin inflammasome activation and RhoA signaling in the autoinflammatory diseases FMF and HIDS. Nat Immunol 2016;17(8):914-21.
20. Xu H, Yang J, Gao W, Li L, Li P, Zhang L, et al. Innate immune sensing of bacterial modifications of Rho GTPases by the Pyrin inflammasome. Nature 2014;513(7517):237-41.
21. Magnotti F, Lefeuvre L, Benezech S, Malsot T, Waeckel L, Martin A, et al. Pyrin dephosphorylation is sufficient to trigger inflammasome activation in familial mediterranean fever patients. EMBO Mol Med 2019;11(11):e10547.
22. Van Gorp H, Saavedra PHV, de Vasconcelos NM, Van Opdenbosch N, Vande Walle L, Matusiak M, et al. Familial mediterranean fever mutations lift the obligatory requirement for microtubules in Pyrin inflammasome activation. Proc Natl Acad Sci USA 2016;113(50):14384-9.
23. Sag E, Akal F, Atalay E, Akca UK, Demir S, Demirel D, et al. Anti-IL1 treatment in colchicine-resistant paediatric FMF patients: Real life data from the HELIOS registry. Rheumatology (Oxford) 2020;59(11):3324-9.
24. Babaoglu H, Varan O, Kucuk H, Atas N, Satis H, Salman R, et al. On demand use of anakinra for attacks of familial Mediterranean fever (FMF). Clin Rheumatol 2019;38(2):577-81.
25. Hentgen V, Koné-Paut I, Belot A, Galeotti C, Grateau G, Carbasse A, et al. Long-term follow-up and optimization of interleukin-1 inhibitors in the management of monogenic autoinflammatory diseases: Real-life data from the JIR cohort. Front Pharmacol 2020;11:568865.
26. Ozen S, Demirkaya E, Erer B, Livneh A, Ben-Chetrit E, Giancane G, et al. EULAR recommendations for the management of familial Mediterranean fever. Ann Rheum Dis 2016;75(4):644-51.
27. Georgin-Lavialle S, Abe E, Larabi A, Savey L, Ducharme-Bénard S, Hentgen V, et al. Could we measure hair colchicine to assess colchicine observance in familial mediterranean fever? Rheumatology (Oxford) 2021;60(3):1563-4.
28. Çakan M, Karadağ ŞG, Tanatar A, Sönmez HE, Ayaz NA. The value of serum amyloid a levels in familial mediterranean fever to identify occult inflammation during asymptomatic periods. J Clin Rheumatol 2021;27(1):1-4.
29. Akar S, Yuksel F, Tunca M, Soysal O, Solmaz D, Gerdan V, et al. Familial mediterranean fever: Risk factors, causes of death, and prognosis in the colchicine era. Medicine (Baltimore) 2012;91(3):131-6.
30. Talerico R, Cardillo C, De Vito F, Schinzari F, Soldato M, Giustiniani MC, et al. Mesothelioma in familial mediterranean fever with colchicine intolerance: A case report and literature review. Front Immunol 2020;11:889.
31. Awad F, Georgin-Lavialle S, Brignier A, Derrieux C, Aouba A, Stankovic-Stojanovic K, et al. Chronic myelomonocytic leukemia as a cause of fatal uncontrolled inflammation in familial mediterranean fever. Orphanet J Rare Dis 2015;10:76.
32. Fraisse T, Savey L, Hentgen V, Rossi-Semerano L, Koné-Paut I, Grateau G, et al. Non-amyloid liver involvement in familial mediterranean fever: A systematic literature review. Liver Int 2020;40(6):1269-77.