La fistule anale est connue, et opérée, depuis des siècles. En effet, Charaf-ed-Din (1404-1468), célèbre chirurgien turc du XVe siècle, déclarait déjà : « La fistule anale ne doit être opérée que si elle n’est ni pénétrante ni chronique. On peut employer la méthode de la ligature, suivant Hippocrate, ou l’incision du trajet. Celle-ci ne doit jamais intéresser le sphincter anal sous peine de provoquer l’incontinence ».1
La fistule anale est une suppuration peu fréquente dont l’incidence annuelle oscille entre 12 et 28 pour 100 000. Le sex-ratio est de 2 à 3 hommes pour une femme. L’âge moyen de survenue se situe entre 20 et 50 ans.
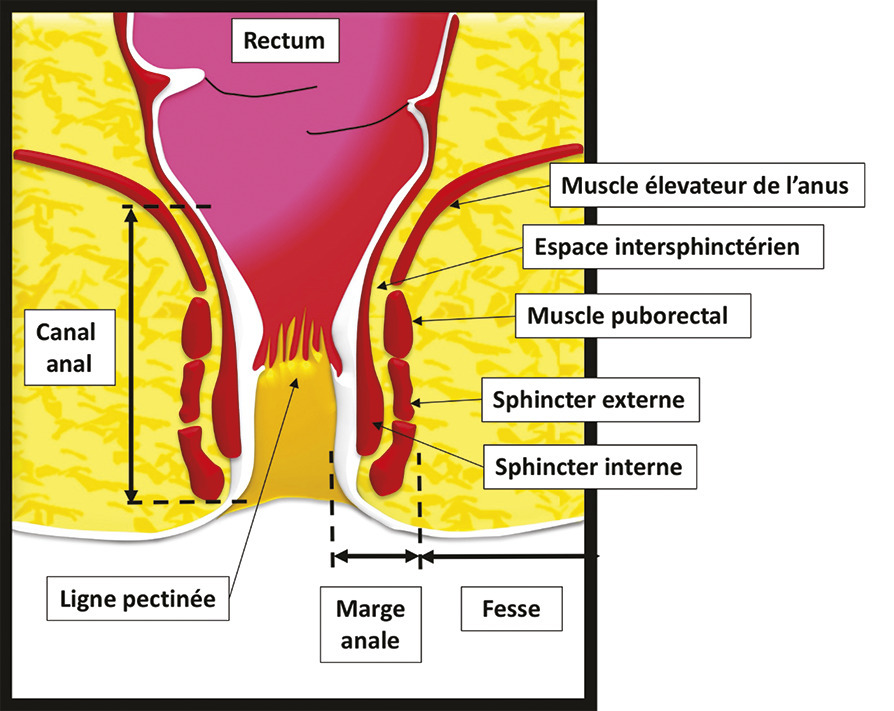
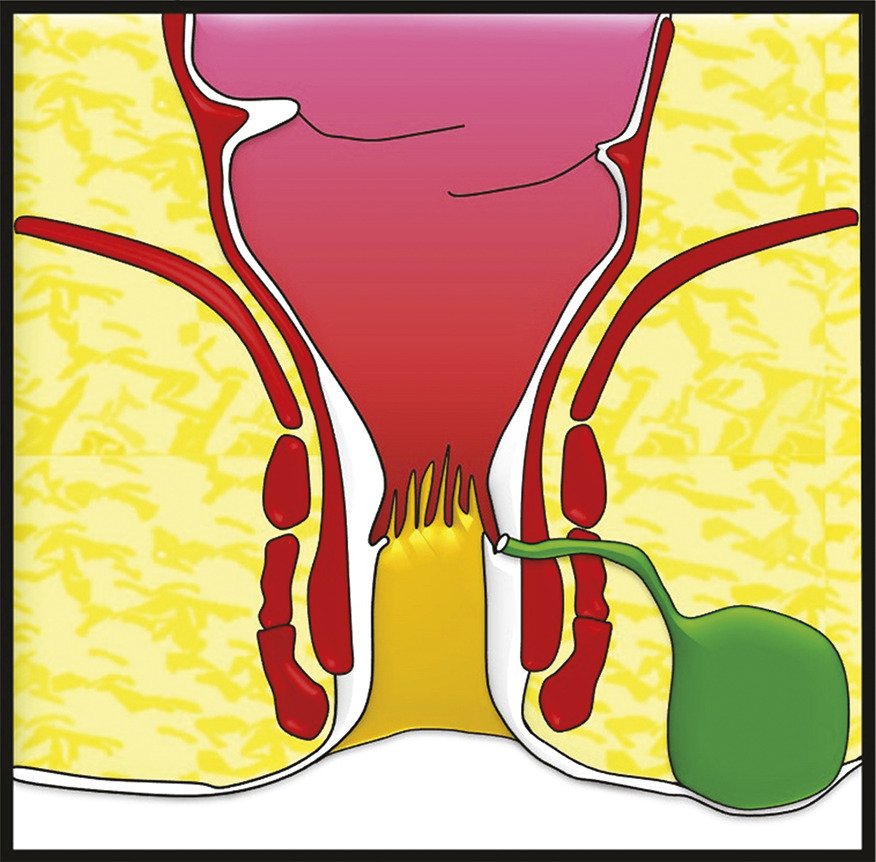
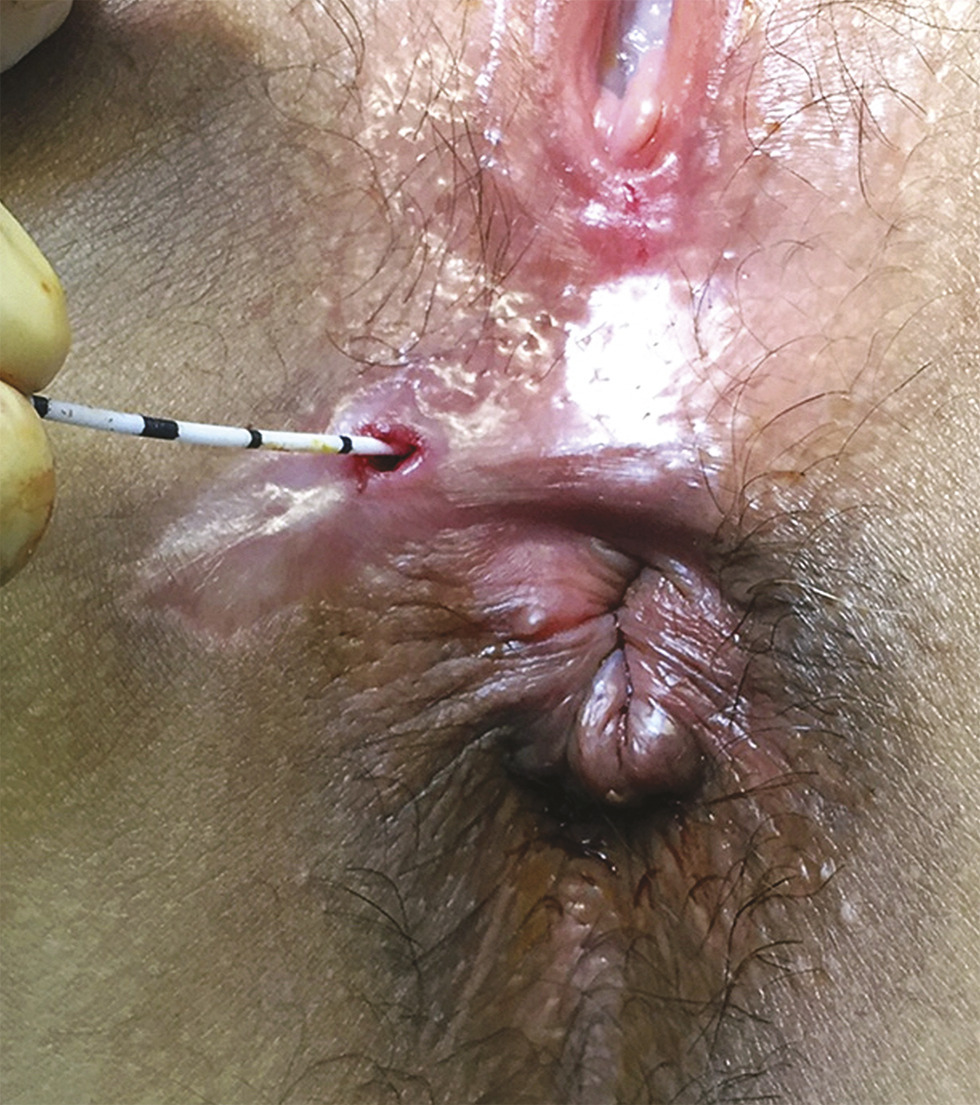
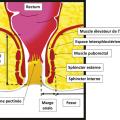
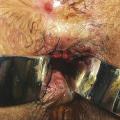
La fistule anale est due à l’infection d’une glande située dans le canal anal, au niveau d’une des cryptes de la ligne pectinée (fig. 1 ). Le plus souvent, elle se caractérise par un orifice primaire endo-anal cryptique qui communique, via un trajet fistuleux, avec la peau de la marge anale ou de la fesse. Elle traverse ainsi le sphincter anal et se manifeste alors par un abcès et/ou un orifice secondaire cutané (fig. 2 ).
Son traitement habituel est la fistulotomie : cette technique consiste à mettre à plat le trajet fistuleux par la section des fibres musculaires du sphincter, et ce en un ou plusieurs temps opératoires. Elle est très efficace, avec un taux de guérison supérieur à 95 %. Cependant, dans certains cas, cette fistulotomie expose à un risque d’incontinence séquellaire (encadré ).2 Ce risque a donc amené à chercher des alternatives techniques visant à assécher la suppuration sans prendre de risque d’incontinence. Cette recherche a bénéficié de l’imagination fertile de certains chirurgiens ainsi que des fabricants de dispositifs médicaux ; il est ainsi parfois difficile de s’y retrouver. Une synthèse de ces techniques qui se sont beaucoup développées durant les trois dernières décennies est ici proposée.
La fistule anale est une suppuration peu fréquente dont l’incidence annuelle oscille entre 12 et 28 pour 100 000. Le sex-ratio est de 2 à 3 hommes pour une femme. L’âge moyen de survenue se situe entre 20 et 50 ans.
La fistule anale est due à l’infection d’une glande située dans le canal anal, au niveau d’une des cryptes de la ligne pectinée (
Son traitement habituel est la fistulotomie : cette technique consiste à mettre à plat le trajet fistuleux par la section des fibres musculaires du sphincter, et ce en un ou plusieurs temps opératoires. Elle est très efficace, avec un taux de guérison supérieur à 95 %. Cependant, dans certains cas, cette fistulotomie expose à un risque d’incontinence séquellaire (
Les techniques d’hier sont en voie d’abandon
Lambeau rectal d’avancement
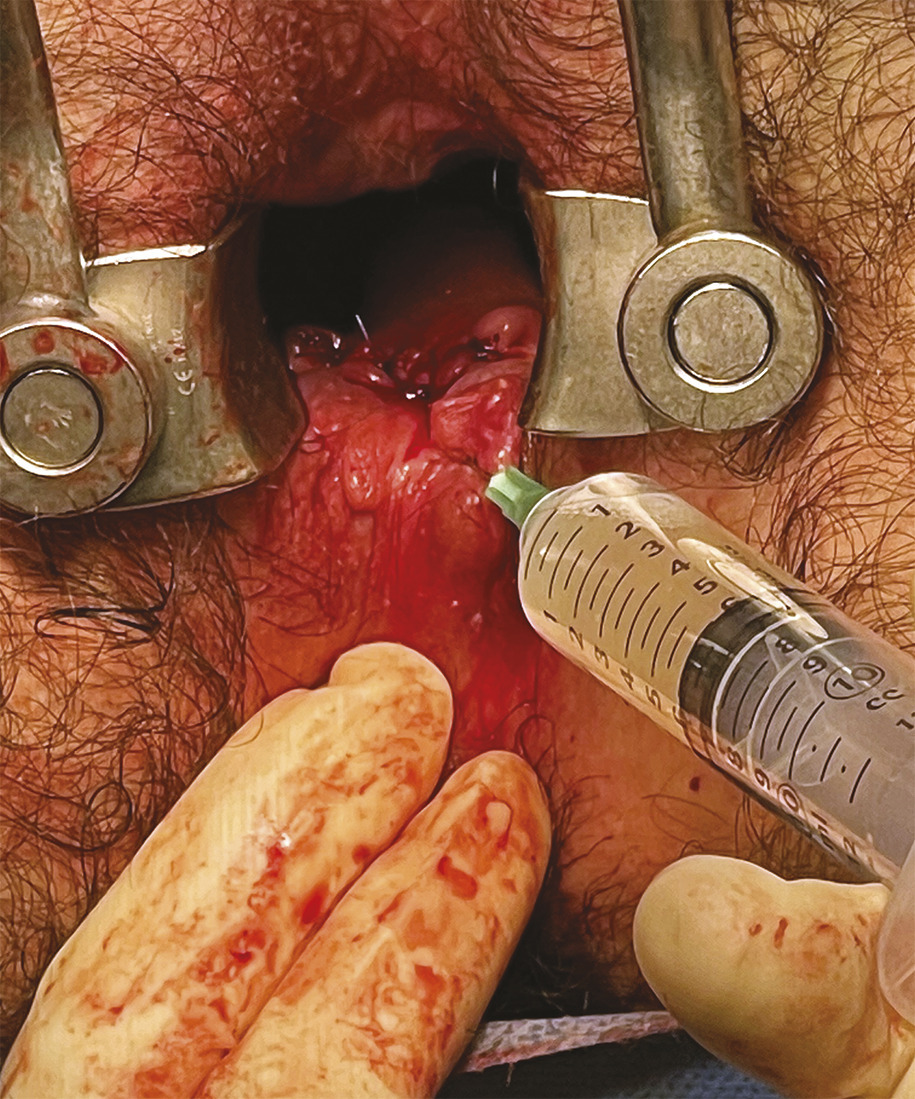
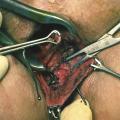
Proposée au début du XXe siècle, la technique du lambeau rectal d’avancement a été véritablement diffusée à partir de 1980 par un chirurgien américain, David Rothenberger, qui travaillait à l’université du Minnesota.3 Elle consiste à obturer l’orifice primaire de la fistule par l’abaissement d’un lambeau de muqueuse, de sous-muqueuse et de musculeuse qui est suturé de part et d’autre de cet orifice (fig. 3 ).
Les causes d’échec principales sont le lâchage de suture, la nécrose, l’hématome et la surinfection.
Cette technique est encore pratiquée aujourd’hui (tableau ), mais elle peut se solder par des troubles séquellaires de la continence dans 5 à 10 % des cas.4
Les causes d’échec principales sont le lâchage de suture, la nécrose, l’hématome et la surinfection.
Cette technique est encore pratiquée aujourd’hui (
Injection de colle biologique
L’injection de colle biologique dans le trajet fistuleux a été proposée pour la première fois en 1991 par un chirurgien danois, Allan Hjortrup, au Bispebjerg Hospital de Copenhague.5 Elle consiste à injecter des facteurs de coagulation associés à de l’aprotinine dans le trajet fistuleux. Une fois en place, la colle s’organise sous la forme d’un réseau de fibrine adhérent, qui est secondairement colonisé par les fibroblastes du patient.
La cause d’échec principale est la migration précoce de la colle via les orifices primaire endo-anal ou secondaire de sortie de la fistule.
La technique est simple de réalisation, mais elle est en perte de vitesse du fait de résultats décevants (tableau ).6
La cause d’échec principale est la migration précoce de la colle via les orifices primaire endo-anal ou secondaire de sortie de la fistule.
La technique est simple de réalisation, mais elle est en perte de vitesse du fait de résultats décevants (
Plug dans le trajet fistuleux
La mise en place d’un plug dans le trajet fistuleux a été réalisée pour la première fois en 2006 par un chirurgien américain, Eric Johnson, à Atlanta.7 Ce « bouchon » en forme de cône allongé est constitué de sous-muqueuse lyophilisée d’intestin de porc. Sa consistance semi-solide vise à pallier l’inconvénient de la consistance liquide responsable des fuites de colle. Il est mis en place dans le trajet fistuleux, suturé au niveau de son orifice primaire, puis secondairement remplacé par le tissu collagène du patient.
La cause d’échec principale est l’expulsion précoce.
La non-confirmation des bons résultats des premières publications (tableau ) et son coût élevé expliquent que ce dispositif soit en voie d’abandon.6
La cause d’échec principale est l’expulsion précoce.
La non-confirmation des bons résultats des premières publications (
Injection de pâte biologique
Dans le même ordre d’idée, l’injection d’une pâte biologique, plus consistante et donc moins « mobile » que la colle, a été testée en 2009 par une chirurgienne anglaise, Rebecca Himpson, au St Mark’s Hospital de Londres.8 Là encore, son efficacité modeste (tableau ) et son coût élevé ont freiné le développement du produit.9
Trois gestes pratiqués aujourd’hui
Ligature intersphinctérienne du trajet fistuleux
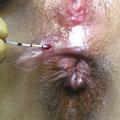
La ligature intersphinctérienne du trajet fistuleux ou LIFT (ligation of intersphincteric fistula tract) a été mise au point en 2007 par un chirurgien thaïlandais, Arun Rojanasakul, à Bangkok.10 Elle consiste à aborder le trajet fistuleux via l’espace intersphinctérien, à le sectionner et à suturer chacune de ses extrémités (fig. 4 ).
À l’instar du lambeau d’avancement, c’est une technique chirurgicale pure, certes plus compliquée à réaliser qu’une injection de colle biologique ou la mise en place d’un plug ; elle n’a néanmoins l’inconvénient ni de leur coût ni de la « pression marketing » des laboratoires qui les commercialisent.
La cause d’échec principale est probablement la non-éradication de la glande infectée responsable.
Ses résultats sont intéressants et ont été reproduits par plusieurs équipes (tableau )4 si bien que c’est une technique encore pratiquée aujourd’hui.
À l’instar du lambeau d’avancement, c’est une technique chirurgicale pure, certes plus compliquée à réaliser qu’une injection de colle biologique ou la mise en place d’un plug ; elle n’a néanmoins l’inconvénient ni de leur coût ni de la « pression marketing » des laboratoires qui les commercialisent.
La cause d’échec principale est probablement la non-éradication de la glande infectée responsable.
Ses résultats sont intéressants et ont été reproduits par plusieurs équipes (
Traitement par laser du trajet fistuleux
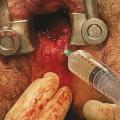
Le traitement par laser du trajet fistuleux ou FiLaC (fistula laser closure) a été proposé en 2011 par un chirurgien allemand, Arne Wilhelm, à Cologne.11 Il consiste à coaguler les parois du trajet fistuleux à l’aide d’une sonde laser introduite par l’orifice secondaire et ainsi en obtenir l’accolement, qui aboutit à l’obturation du trajet fistuleux (fig. 5 ). Il a été introduit en France par Nicolas Lemarchand et Manuel Aubert au sein du service de proctologie du groupe hospitalier Paris Saint-Joseph.
Il a le mérite d’être simple de réalisation, mais les sondes sont coûteuses et sa place par rapport aux autres techniques dans l’algorithme thérapeutique reste à préciser (tableau ).12
Il a le mérite d’être simple de réalisation, mais les sondes sont coûteuses et sa place par rapport aux autres techniques dans l’algorithme thérapeutique reste à préciser (
Technique du clip
La technique du clip a été proposée en 2012 par le chirurgien allemand Ruediger Prosst, à Stuttgart.13 Le but est de fermer l’orifice primaire de la fistule et ainsi obtenir l’asséchement du trajet fistuleux.
Les résultats sont intéressants (tableau ),14 mais, là encore, le coût élevé du dispositif est sans doute un frein à la diffusion de la technique, qui n’est pas actuellement utilisée en France.
Les résultats sont intéressants (
Deux nouveautés d’avenir pour l’épargne sphinctérienne
Traitement vidéo-assisté par endoscopie du trajet fistuleux
Le traitement vidéo-assisté par endoscopie du trajet fistuleux ou VAAFT (video-assisted anal fistula treatment), initié en 2011 par le chirurgien italien Piercarlo Meinero, à Gênes, se déroule en deux temps :15 le temps diagnostique consiste à examiner le trajet fistuleux et ses extensions secondaires ; le temps thérapeutique vise à détruire l’épithélium des parois du trajet afin d’en obtenir l’avivement, l’accolement et l’obturation.
Le fistuloscope nécessaire pour cette technique est coûteux, si bien que cette technique n’est pas encore diffusée en France. Cependant, elle est intéressante puisqu’elle fournit les premières images endo-fistuleuses, qui devraient aider à mieux appréhender certaines causes d’échec des traitements.16
Le fistuloscope nécessaire pour cette technique est coûteux, si bien que cette technique n’est pas encore diffusée en France. Cependant, elle est intéressante puisqu’elle fournit les premières images endo-fistuleuses, qui devraient aider à mieux appréhender certaines causes d’échec des traitements.16
Médecine régénérative
Les injections périfistuleuses de tissu adipeux, de fraction vasculaire stromale autologue, de plasma enrichi en plaquettes et/ou de cellules souches mésenchymateuses (fig. 6 ), regroupées sous le terme prometteur de « médecine régénérative », sont les dernières-nées des techniques d’épargne sphinctérienne. Ces divers produits font l’objet d’un nombre grandissant de publications. Cependant, le recul est pour l’instant insuffisant pour en apprécier la réelle efficacité et surtout la place dans l’algorithme thérapeutique.17
De nouvelles techniques séduisantes, dont les résultats sont à améliorer
Ces diverses techniques d’épargne sphinctérienne sont séduisantes parce qu’elles protègent du risque d’incontinence anale. Les patients sont extrêmement demandeurs de ces techniques, malgré leur risque d’échec,18 et cela explique l’engouement dont elles font l’objet.19
Pour autant, leurs résultats posent deux problèmes. D’une part, les bons ou très bons résultats initiaux ne sont quasiment jamais confirmés par les publications ultérieures ; ce point a été bien résumé par le chirurgien anglais John Nicholls : « Initial reports of success in the majority of patients, declining as the number of publications increases » (« Des rapports initiaux de succès chez la majorité des patients, qui diminuent à mesure que le nombre de publications augmente »).20 D’autre part, les taux de guérison grâce à ces techniques sont toujours moins bons que ceux des fistulotomies (de 55 à 75 % de guérison versus plus de 95 %), y compris lorsque l’on considère les publications les plus « optimistes ».
En pratique, cela ne signifie pas qu’il faut les abandonner (d’ailleurs, les patients nous en empêcheraient !), ces techniques restent aussi la seule alternative dans certains cas.
En revanche, il faut améliorer leurs résultats. Cela passe notamment par une meilleure compréhension des causes d’échec, une sélection optimale des trajets fistuleux, une mise en condition optimisée des patients avant et après le geste, ainsi que par des améliorations techniques.
L’écrivain anglais Laurence Sterne (1713-1768), original mais clairvoyant, soulignait que, dans tout projet, « si la cause est bonne, c’est de la persévérance. Si la cause est mauvaise, c’est de l’obstination ». Dans le cas présent, la cause est bonne, il faut donc continuer avec persévérance.
Pour autant, leurs résultats posent deux problèmes. D’une part, les bons ou très bons résultats initiaux ne sont quasiment jamais confirmés par les publications ultérieures ; ce point a été bien résumé par le chirurgien anglais John Nicholls : « Initial reports of success in the majority of patients, declining as the number of publications increases » (« Des rapports initiaux de succès chez la majorité des patients, qui diminuent à mesure que le nombre de publications augmente »).20 D’autre part, les taux de guérison grâce à ces techniques sont toujours moins bons que ceux des fistulotomies (de 55 à 75 % de guérison versus plus de 95 %), y compris lorsque l’on considère les publications les plus « optimistes ».
En pratique, cela ne signifie pas qu’il faut les abandonner (d’ailleurs, les patients nous en empêcheraient !), ces techniques restent aussi la seule alternative dans certains cas.
En revanche, il faut améliorer leurs résultats. Cela passe notamment par une meilleure compréhension des causes d’échec, une sélection optimale des trajets fistuleux, une mise en condition optimisée des patients avant et après le geste, ainsi que par des améliorations techniques.
L’écrivain anglais Laurence Sterne (1713-1768), original mais clairvoyant, soulignait que, dans tout projet, « si la cause est bonne, c’est de la persévérance. Si la cause est mauvaise, c’est de l’obstination ». Dans le cas présent, la cause est bonne, il faut donc continuer avec persévérance.
Encadre
Situations à risque d’incontinence anale postopératoire en cas de fistulotomie
Trajet fistuleux antérieur
Trajet fistuleux haut situé
Fistule complexe
Âge avancé
Sexe féminin
Hypotonie anale de repos préopératoire
Lésions sphinctériennes préalables (cause obstétricale, chirurgicale, etc.)
Diarrhée chronique (syndrome de l’intestin irritable, diabète sucré, etc.)
Maladie de Crohn
Références
1. La chirurgie de Charaf-ed-Din (1404-1468). In : Huard P, Grmek M. Le premier manuscrit chirurgical turc. Paris, Éditions Roger Dacosta, 1960;126.
2. de Parades V, Zeitoun JD, Atienza P. La fistule anale cryptoglandulaire. J Visc Surg 2010;147(4):265-77.
3. Rothenberger DA, Christenson CE, Balcos EG, Schottler JL, Nemer FD, Nivatvongs S, et al. Endorectal advancement flap for treatment of simple rectovaginal fistula. Dis Colon Rectum 1982;25(4):297-300.
4. Stellingwerf ME, van Praag EM, Tozer PJ, Bemelman WA, Buskens CJ. Systematic review and meta-analysis of endorectal advancement flap and ligation of the intersphincteric fistula tract for cryptoglandular and Crohn’s high perianal fistulas. BJS Open 2019;3(3):231-41.
5. Hjortrup A, Moesgaard F, Kjaergard J. Fibrin adhesive in the treatment of perineal fistulas. Dis Colon Rectum 1991;34(9):752-4.
6. Cirocchi R, Trastulli S, Morelli U, Desiderio J, Boselli C, Parisi A, et al. The treatment of anal fistulas with biologically derived products: Is innovation better than conventional surgical treatment? An update. Tech Coloproctol 2013;17(3):259-73.
7. Johnson EK, Gaw JU, Armstrong DN. Efficacy of anal fistula plug vs. fibrin glue in closure of anorectal fistulas. Dis Colon Rectum 2006;49(3):371-6.
8. Himpson RC, Cohen CR, Sibbons P, Phillips RK. An experimentally successful new sphincter- conserving treatment for anal fistula. Dis Colon Rectum 2009;52(4):602-8.
9. Vollebregt PF, Vander Mijnsbrugge GJ, Molenaar CBH, Felt-Bersma RJF. Efficacy of Permacol injection for perianal fistulas in a tertiary referral population: Poor outcome in patients with complex fistulas. Colorectal Dis 2021;23(8):2119-26.
10. Rojanasakul A, Pattanaarun J, Sahakitrungruang C, Tantiphlachiva K. Total anal sphincter saving technique for fistula-in-ano; the ligation of intersphincteric fistula tract. J Med Assoc Thai 2007;90(3):581-6.
11. Wilhelm A. A new technique for sphincter-preserving anal fistula repair using a novel radial emitting laser probe. Tech Coloproctol 2011;15(4):445-9.
12. Frountzas M, Stergios K, Nikolaou C, Bellos I, Schizas D, Linardoutsos D, et al. Could FiLaC™ be effective in the treatment of anal fistulas? A systematic review of observational studies and proportional meta-analysis. Colorectal Dis 2020;22(12):1874-84.
13. Prosst RL, Ehni W. The OTSC® Proctology clip system for anorectal fistula closure: The ‘anal fistula claw’: Case report. Minim Invasive Ther Allied Technol 2012;21(4):307-12.
14. Prosst R. Minimally invasive surgical clip closure of anorectal fistulas: Current status of OTSC Proctology. Minim Invasive Ther Allied Technol 2019;28(5):261-7.
15. Meinero P, Mori L. Video-assisted anal fistula treatment (VAAFT): A novel sphincter-saving procedure for treating complex anal fistulas. Tech Coloproctol 2011;15(4):417-22.
16. Tian Z, Li YL, Nan SJ, Xiu WC, Wang YQ. Video-assisted anal fistula treatment for complex anorectal fistulas in adults: A systematic review and meta-analysis. Tech Coloproctol 2022;26(10):783-95.
17. Barré A, Fathallah N, Thierry ML, Benfredj P, Pommaret E, Spindler L, et al. Injection de tissu adipeux et de fraction vasculaire stromale autologue dans le traitement des fistules ano-périnéales : l’avenir de la thérapie régénérative ? Hépato-Gastro & Oncologie Digestive 2022;29(5):565-72.
18. Ellis CN. Sphincter-preserving fistula management: What patients want. Dis Colon Rectum 2010;53(12):1652-5.
19. Litta F, Bracchitta S, Naldini G, Mistrangelo M, Tricomi N, La Torre M, et al.; SICCR (Società Italiana di Chirurgia Colo-Rettale) FISSIT Study Group. FISSIT (Fistula Surgery in Italy) study: A retrospective survey on the surgical management of anal fistulas in Italy over the last 15 years. Surgery 2021;170(3):689-95.
20. Nicholls J. Anal fistula. Colorectal Dis 2012;14(5):535.
2. de Parades V, Zeitoun JD, Atienza P. La fistule anale cryptoglandulaire. J Visc Surg 2010;147(4):265-77.
3. Rothenberger DA, Christenson CE, Balcos EG, Schottler JL, Nemer FD, Nivatvongs S, et al. Endorectal advancement flap for treatment of simple rectovaginal fistula. Dis Colon Rectum 1982;25(4):297-300.
4. Stellingwerf ME, van Praag EM, Tozer PJ, Bemelman WA, Buskens CJ. Systematic review and meta-analysis of endorectal advancement flap and ligation of the intersphincteric fistula tract for cryptoglandular and Crohn’s high perianal fistulas. BJS Open 2019;3(3):231-41.
5. Hjortrup A, Moesgaard F, Kjaergard J. Fibrin adhesive in the treatment of perineal fistulas. Dis Colon Rectum 1991;34(9):752-4.
6. Cirocchi R, Trastulli S, Morelli U, Desiderio J, Boselli C, Parisi A, et al. The treatment of anal fistulas with biologically derived products: Is innovation better than conventional surgical treatment? An update. Tech Coloproctol 2013;17(3):259-73.
7. Johnson EK, Gaw JU, Armstrong DN. Efficacy of anal fistula plug vs. fibrin glue in closure of anorectal fistulas. Dis Colon Rectum 2006;49(3):371-6.
8. Himpson RC, Cohen CR, Sibbons P, Phillips RK. An experimentally successful new sphincter- conserving treatment for anal fistula. Dis Colon Rectum 2009;52(4):602-8.
9. Vollebregt PF, Vander Mijnsbrugge GJ, Molenaar CBH, Felt-Bersma RJF. Efficacy of Permacol injection for perianal fistulas in a tertiary referral population: Poor outcome in patients with complex fistulas. Colorectal Dis 2021;23(8):2119-26.
10. Rojanasakul A, Pattanaarun J, Sahakitrungruang C, Tantiphlachiva K. Total anal sphincter saving technique for fistula-in-ano; the ligation of intersphincteric fistula tract. J Med Assoc Thai 2007;90(3):581-6.
11. Wilhelm A. A new technique for sphincter-preserving anal fistula repair using a novel radial emitting laser probe. Tech Coloproctol 2011;15(4):445-9.
12. Frountzas M, Stergios K, Nikolaou C, Bellos I, Schizas D, Linardoutsos D, et al. Could FiLaC™ be effective in the treatment of anal fistulas? A systematic review of observational studies and proportional meta-analysis. Colorectal Dis 2020;22(12):1874-84.
13. Prosst RL, Ehni W. The OTSC® Proctology clip system for anorectal fistula closure: The ‘anal fistula claw’: Case report. Minim Invasive Ther Allied Technol 2012;21(4):307-12.
14. Prosst R. Minimally invasive surgical clip closure of anorectal fistulas: Current status of OTSC Proctology. Minim Invasive Ther Allied Technol 2019;28(5):261-7.
15. Meinero P, Mori L. Video-assisted anal fistula treatment (VAAFT): A novel sphincter-saving procedure for treating complex anal fistulas. Tech Coloproctol 2011;15(4):417-22.
16. Tian Z, Li YL, Nan SJ, Xiu WC, Wang YQ. Video-assisted anal fistula treatment for complex anorectal fistulas in adults: A systematic review and meta-analysis. Tech Coloproctol 2022;26(10):783-95.
17. Barré A, Fathallah N, Thierry ML, Benfredj P, Pommaret E, Spindler L, et al. Injection de tissu adipeux et de fraction vasculaire stromale autologue dans le traitement des fistules ano-périnéales : l’avenir de la thérapie régénérative ? Hépato-Gastro & Oncologie Digestive 2022;29(5):565-72.
18. Ellis CN. Sphincter-preserving fistula management: What patients want. Dis Colon Rectum 2010;53(12):1652-5.
19. Litta F, Bracchitta S, Naldini G, Mistrangelo M, Tricomi N, La Torre M, et al.; SICCR (Società Italiana di Chirurgia Colo-Rettale) FISSIT Study Group. FISSIT (Fistula Surgery in Italy) study: A retrospective survey on the surgical management of anal fistulas in Italy over the last 15 years. Surgery 2021;170(3):689-95.
20. Nicholls J. Anal fistula. Colorectal Dis 2012;14(5):535.

 Encadrés
Encadrés