Le pronostic du diabète de type 1 a été transformé par la découverte de l’insuline en 1921, puis ses évolutions en termes d’adminis- tration (stylos injecteurs, pompes) et d’autosurveillance (glycémies capillaires, enregistrements glycémiques continus).
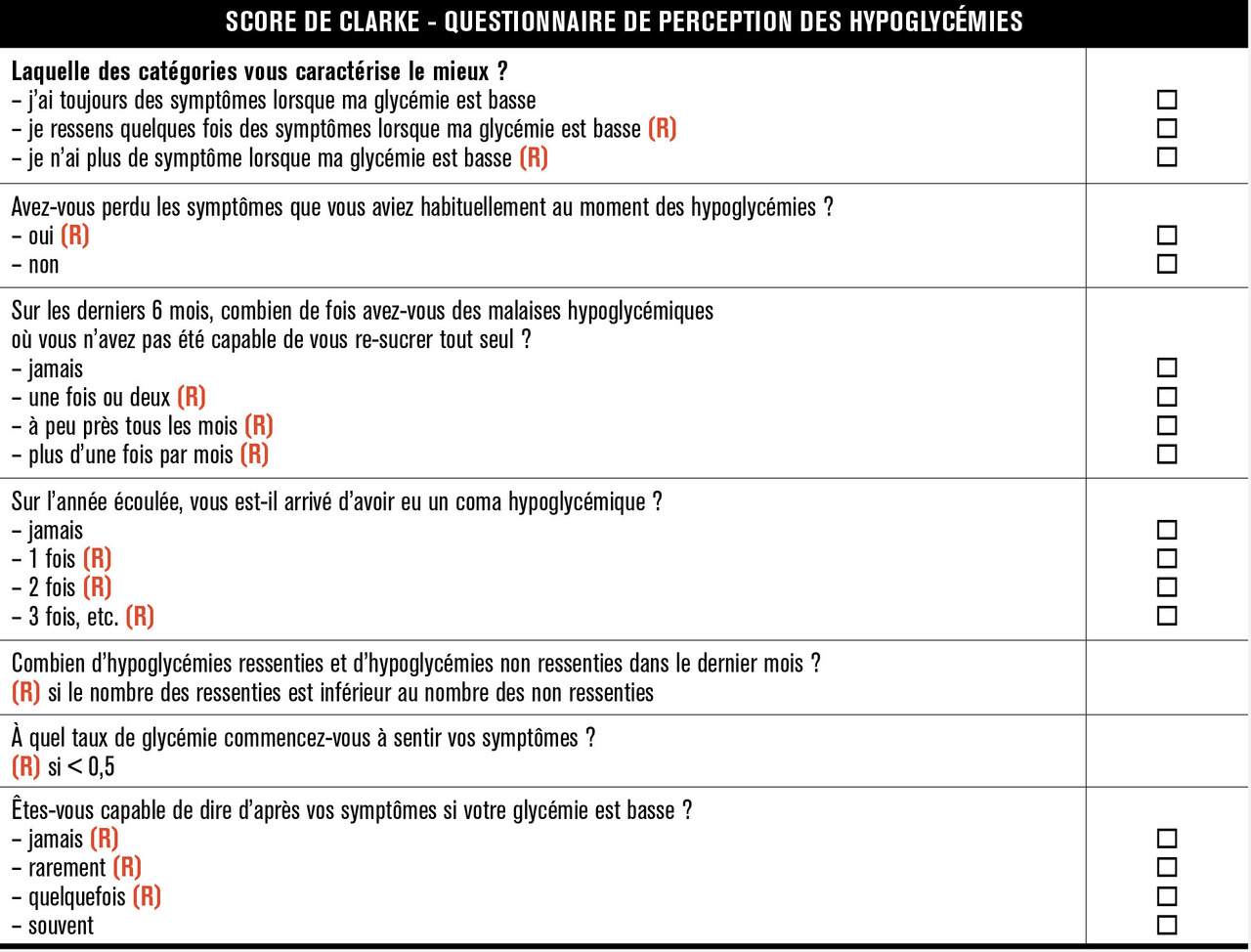
L’objectif d’une valeur d’hémoglobine glyquée (HbA1c) inférieure à 7 % afin d’éviter les complications chroniques de la maladie a toutefois entraîné une fréquence accrue d’hypoglycémies dont la mortalité atteint 4 %, en particulier lorsqu’elles ne sont plus ressenties.1
C’est pourquoi, à côté de l’approche technologique, s’est développée une approche biologique ayant pour but de restaurer la sécrétion d’insuline et le glucose sensing, c’est-à-dire la capacité endogène à adapter automatiquement cette sécrétion d’insuline à la glycémie ambiante.
Cette approche biologique consiste à greffer des cellules insulino-sécrétrices, encore appelées cellules β, soit sous forme de greffe d’un pancréas entier, soit sous forme uniquement des îlots de Langerhans disséminés au sein du pancréas exocrine.
L’objectif d’une valeur d’hémoglobine glyquée (HbA1c) inférieure à 7 % afin d’éviter les complications chroniques de la maladie a toutefois entraîné une fréquence accrue d’hypoglycémies dont la mortalité atteint 4 %, en particulier lorsqu’elles ne sont plus ressenties.1
C’est pourquoi, à côté de l’approche technologique, s’est développée une approche biologique ayant pour but de restaurer la sécrétion d’insuline et le glucose sensing, c’est-à-dire la capacité endogène à adapter automatiquement cette sécrétion d’insuline à la glycémie ambiante.
Cette approche biologique consiste à greffer des cellules insulino-sécrétrices, encore appelées cellules β, soit sous forme de greffe d’un pancréas entier, soit sous forme uniquement des îlots de Langerhans disséminés au sein du pancréas exocrine.
Modalités de la greffe
La greffe de cellules β peut se concevoir à partir d’un donneur (allogreffe), situation la plus fréquente, ou du patient lui-même (autogreffe) en cas de pancréatectomie. En cas d’allogreffe, le pancréas est prélevé chez un donneur en état de mort cérébrale selon les dispositions légales en vigueur et attribué par l’Agence de la biomédecine à un receveur inscrit sur la liste d’attente. Les deux types d’allogreffe, pancréas entier et îlots de Langerhans, nécessitent un traitement immunosuppresseur, à la différence d’une autogreffe. Ce traitement comporte une phase d’induction par un anticorps anti-lymphocytes ou un anti-récepteur de l’inter- leukine 2 et une phase de maintenance associant un inhibiteur des calcineurines à plus ou moins forte dose, le tacrolimus et soit du mycophénolate, soit un inhibiteur de mTOR. Toute greffe requiert une évaluation préalable du rapport bénéfices-risques et une inscription sur liste d’attente ; après la greffe, une surveillance hebdomadaire est nécessaire le premier mois, puis mensuelle la première année, et tri- mestrielle tant que le greffon est fonctionnel.
Greffe de pancréas
Modalités pratiques
La greffe de pancréas entier est une procédure de routine pratiquée dans quelques centres hospitaliers universitaires en France depuis les années 1980. Il s’agit d’une intervention assez lourde qui exige un bon état vasculaire car les anastomoses sont effectuées sur les axes iliaques. Elle nécessite 2 à 3 semaines d’hospitalisation et se complique dans près de 30 % des cas de la nécessité d’une réintervention avec perte du greffon pancréatique dans environ 10 % des cas.
Résultats
Plus de 45 000 greffes de pancréas ont été pratiquées dans le monde. La survie du patient est de 95 % à 1 an et 83 % à 5 ans. L’insulino-indépendance est constatée dans 80 à 85 % des cas à 1 an et 50 à 70 % des cas à 5 ans. Le plus souvent combinée à une greffe de rein, la greffe de pancréas peut également se pratiquer de façon isolée ou après une greffe de rein mais ses résultats sont plutôt moins bons.2
Greffe d’îlots de Langerhans
Allogreffe
Modalités pratiques
Contrairement à d’autres pays (Canada, Belgique, Grande-Bretagne), la greffe d’îlots de Langerhans n’est autorisée en France en 2018 que dans le cadre d’essais cliniques, bien qu’elle soit pratiquée depuis plus de 20 ans. Une procédure d’autorisation est cepen- dant en cours. Cette thérapie cellulaire nécessite l’isolement des îlots dans un laboratoire agréé pour séparer les cellules endocrines insulino-sécrétrices des cellules exocrines par une dissociation enzymatique suivie d’une purification par centrifugation. Seul un pancréas sur deux conduit à une préparation quantitativement et qualitativement suffisante pour permettre une greffe. La greffe elle-même consiste à injecter une préparation d’îlots dans la veine porte soit par voie percutanée sous anesthésie locale, soit par une mini-laparatomie sous anesthésie générale. L’intervention doit être répétée une deuxième, voire une troisième fois pour obtenir l’insulino-indépendance, le nombre d’îlots provenant d’un seul pancréas étant insuffisant pour obtenir celle-ci. Selon les centres et le degré d’hyper-immunisation du patient, la durée de la période d’injections dure de 3 à plusieurs mois. Cette greffe d’îlots peut être réalisée de façon isolée ou après une greffe de rein (voire simultanément).Résultats
Environ 1 000 patients ayant reçu une greffe d’îlots ont été répertoriés dans le registre international des greffes qui collige les résultats européens et américains. La survie du patient à 1 an est de 100 % et à 5 ans et 10 ans et de 96 % . En intention de traiter, le pourcentage d’insulino-indépendance à 1 an avec une HbA1c normale est de l’ordre de 70 %, à 5 ans de 30 à 50 %,3 à 10 ans de 20 à 25 % avec le protocole princeps d’Edmonton. Plus de 70 % des patients gardent une fonction du greffon à 10 ans, malgré la nécessité d’un retour à l’insuline.Autogreffe
Spécificités pratiques
L’isolement des îlots de Langerhans s’effectue selon les mêmes modalités. Bien que la masse cellullaire endocrine obtenue soit en général modeste, la période d’ischémie froide (temps écoulé entre le prélèvement du pancréas et l’isolement), souvent beaucoup plus courte, favorise la bonne fonction des îlots. La prépa- ration peut être moins pure, voire non purifiée, ce qui pourrait contribuer à la viabilité du greffon. Celui-ci peut être injecté en intraportal comme en allogreffe ou en intramusculaire au niveau de l’avant-bras sous anesthésie locale (essai clinique en cours), ce qui a l’avantage d’une extrême simplicité.Résultats
L’autogreffe intraportale, surtout pratiquée aux États-Unis, permet d’obtenir une insulino-indépendance dans 40 % des cas après pancréatectomie totale. Les résultats de l’autogreffe intramusculaire, réalisée en général après une pancréatectomie partielle, sont en cours d’évaluation.Risques et bénéfices
Risques
Les risques liés à la procédure et au traitement immunosuppresseur sont résumés dans le tableau 1 .
Bénéfices
Malgré ces risques qui justifient une surveillance régulière, de nombreux bénéfices ont été démontrés en termes de qualité de vie (insulino-indépendance et disparition des hypoglycémies sévères) et de prévention des complications du diabète (en greffe de pancréas comme en greffe d’îlots).
La transplantation insulaire permet d’obtenir un contrôle métabolique plus satisfaisant que la pompe implantable ou que l’insulinothérapie optimisée, au prix d’effets indésirables cepen- dant plus nombreux.4 La greffe d’îlots pancréatiques a par ailleurs démontré ses effets favorables sur la survenue de nouvelles complications rétinopathiques, sur l’amélioration de la neuropathie et la stabilisation de la fonction rénale, au moins avec le protocole d’Edmonton qui comporte de très faibles doses de tacrolimus. Il existe un risque d’hyper-immunisation en particulier avec la greffe d’îlots seuls lorsque le traitement immunosuppresseur est interrompu en cas de perte de greffon. Cela ne semble toutefois pas impacter l’accès à une greffe rénale.
La transplantation insulaire permet d’obtenir un contrôle métabolique plus satisfaisant que la pompe implantable ou que l’insulinothérapie optimisée, au prix d’effets indésirables cepen- dant plus nombreux.4 La greffe d’îlots pancréatiques a par ailleurs démontré ses effets favorables sur la survenue de nouvelles complications rétinopathiques, sur l’amélioration de la neuropathie et la stabilisation de la fonction rénale, au moins avec le protocole d’Edmonton qui comporte de très faibles doses de tacrolimus. Il existe un risque d’hyper-immunisation en particulier avec la greffe d’îlots seuls lorsque le traitement immunosuppresseur est interrompu en cas de perte de greffon. Cela ne semble toutefois pas impacter l’accès à une greffe rénale.
Indications respectives de la greffe de pancréas ou d’îlots
Allogreffe
Les contre-indications à une allogreffe (c’est-à-dire les facteurs ne permettant pas d’envisager un rapport bénéfice-risque favorable) sont résumées dans le tableau 2 et les indications respectives de l’allogreffe d’îlots et de pancréas dans le tableau 3 .5, 6
Une allogreffe d’îlots est également indiquée chez les patients diabétiques de type 1 recevant déjà une immunosuppression pour une autre greffe, notamment de rein, où elle donne d’excellents résultats.
Citons la situation particulière de la greffe d’îlots après une greffe pulmonaire dans le cadre du diabète insulinopénique de la mucoviscidose.
Greffe de pancréas
La greffe de pancréas est classiquement proposée chez des personnes atteintes d’un diabète de type 1 jeunes (moins de 55 ans) ayant peu de complications macro-angiopathiques, en insuffisance rénale terminale et qui vont pouvoir bénéficier d’une dou- ble greffe rein-pancréas. Elle est éga- lement possible avant ou après une greffe de rein, mais elle est moins souvent pratiquée, dans cette indication.Allogreffe d’îlots
La greffe d’îlots seuls est indiquée chez des personnes ayant un diabète de type 1 instable et/ou des hypoglycémies sévères et non ressenties, après l’échec des approches technologiques de type multi-injections ou pompe et capteur.Une allogreffe d’îlots est également indiquée chez les patients diabétiques de type 1 recevant déjà une immunosuppression pour une autre greffe, notamment de rein, où elle donne d’excellents résultats.
Citons la situation particulière de la greffe d’îlots après une greffe pulmonaire dans le cadre du diabète insulinopénique de la mucoviscidose.
Autogreffe
L’autogreffe d’îlots est proposée après chirurgie pancréatique totale ou partielle pour prévenir le diabète insulinopénique.
Conclusion et perspectives
La greffe de pancréas est généralement proposée combinée à une greffe de rein chez un patient jeune diabétique de type 1 en insuffisance rénale terminale. La procédure est lourde, grevée de complications initiales non négligeables mais donne de bons résultats à long terme. L’allogreffe d’îlots de Langerhans est une procédure dont la maîtrise repose sur la qualité de l’isolement et le nombre des îlots greffés. Elle donne de bons résultats dans les diabètes insulinoprives instables ou compliqués d’hy- poglycémies non ressenties, au prix d’un traitement immunosuppresseur. Elle est proposée chez des patients diabétiques de type 1 après une greffe de rein ou en cas d’instabilité glycémique, après échec d’une insulinothérapie optimisée par pompe et capteur. L’autogreffe d’îlots (sans immunosuppression) est proposée après chirurgie pancréatique pour prévenir un diabète insulinopénique. Les perspectives thérapeutiques visent à se passer du traitement immunosuppresseur et à disposer d’une source de cellules β illimitée par l’encapsulation de ces cellules, la greffe associée de cellules hématopoïétiques, la xénotransplantation et les cellules souches. Cependant, aucune de ces étapes n’est réellement parvenue au stade clinique à l’heure actuelle.
Références
1. Choudhary P, Rickels MR, Senior PA, et al. Evidence-informed clinical practice recommendations for treatment of type 1 diabetes complicated by problematic hypoglycemia. Diabetes Care 2015;38:1016-29.
2. Gruessner AC. 2011 update on pancreas transplantation: comprehensive trend analysis of 25,000 cases followed up over the course of twenty-four years at the International Pancreas Transplant Registry (IPTR). Rev Diabet Stud 2011;8:6-16.
3. Benomar K, Chetboun M, Espiard S, et al. Purity of islet preparations and 5-year metabolic outcome of allogenic islet transplantation. Am J Transplant 2018:8:945-1.
4. Lablanche S, Vantyghem MC, Kessler L, et al. Islet transplantation versus insulin therapy in patients with type 1 diabetes with severe hypoglycaemia or poorly controlled glycaemia after kidney transplantation (TRIMECO): a multicentre, randomised controlled trial. Lancet Diabetes Endocrinol 2018 doi: 10.1016/S2213-8587(18)30078-0.
5. Rickels MR, Stock PG, de Koning EJP, et al. Defining Outcomes for β-Cell Replacement Therapy in the Treatment of Diabetes: a Consensus Report on the Igls Criteria from the IPITA/EPITA Opinion Leaders Workshop. Transplantation 2018 Mar 9. doi: 10.1097/TP.0000000000002158.
6. Wojtusciszyn A, Branchereau J, Esposito L, et al. Indications for islet or pancreas transplantation: A statement of the working group TREPID. Diabet and Metab 2018 under acceptation.
2. Gruessner AC. 2011 update on pancreas transplantation: comprehensive trend analysis of 25,000 cases followed up over the course of twenty-four years at the International Pancreas Transplant Registry (IPTR). Rev Diabet Stud 2011;8:6-16.
3. Benomar K, Chetboun M, Espiard S, et al. Purity of islet preparations and 5-year metabolic outcome of allogenic islet transplantation. Am J Transplant 2018:8:945-1.
4. Lablanche S, Vantyghem MC, Kessler L, et al. Islet transplantation versus insulin therapy in patients with type 1 diabetes with severe hypoglycaemia or poorly controlled glycaemia after kidney transplantation (TRIMECO): a multicentre, randomised controlled trial. Lancet Diabetes Endocrinol 2018 doi: 10.1016/S2213-8587(18)30078-0.
5. Rickels MR, Stock PG, de Koning EJP, et al. Defining Outcomes for β-Cell Replacement Therapy in the Treatment of Diabetes: a Consensus Report on the Igls Criteria from the IPITA/EPITA Opinion Leaders Workshop. Transplantation 2018 Mar 9. doi: 10.1097/TP.0000000000002158.
6. Wojtusciszyn A, Branchereau J, Esposito L, et al. Indications for islet or pancreas transplantation: A statement of the working group TREPID. Diabet and Metab 2018 under acceptation.