L’infection par le virus de l’hépatite B (VHB) reste un problème majeur de santé publique responsable d’une morbidité et d’une mortalité importantes.1 Les enjeux de son traitement sont la prévention de l’infection par la vaccination, le dépistage des hépatites chroniques et les problèmes posés par les traitements actuels.Environ 254 millions de personnes dans le monde sont porteuses chroniques du VHB, avec des variations géographiques importantes en termes de prévalence. Celle-ci décroît dans un certain nombre de pays de forte endémie du fait des améliorations socio-économiques, de la diffusion de la vaccination et sans doute aussi du fait de l’efficacité des traitements antiviraux. Une évaluation de la prévalence de l’antigène HBs (Ag HBs) en France a été réalisée en 2003-2004 chez les assurés sociaux par l’Institut de veille sanitaire : 0,67 % de la population française (soit environ 300 000 Français) avait une infection chronique par le VHB et la moitié l’ignorait. La prévalence était plus élevée chez les hommes (1,2 %) que chez les femmes (0,19 %) et en cas de naissance hors de France.Par ailleurs, la prévalence élevée du VHB chez les migrants et réfugiés modifie la prévalence et l’incidence du VHB dans certains pays européens comme l’Italie et l’Allemagne. La mortalité liée au VHB en rapport avec les cirrhoses et les carcinomes hépatocellulaires a augmenté entre 1990 et 2013 de 33 %, responsable de plus de 686 000 décès en 2013 dans le monde.2
Cycle viral du VHB et histoire naturelle de l’infection
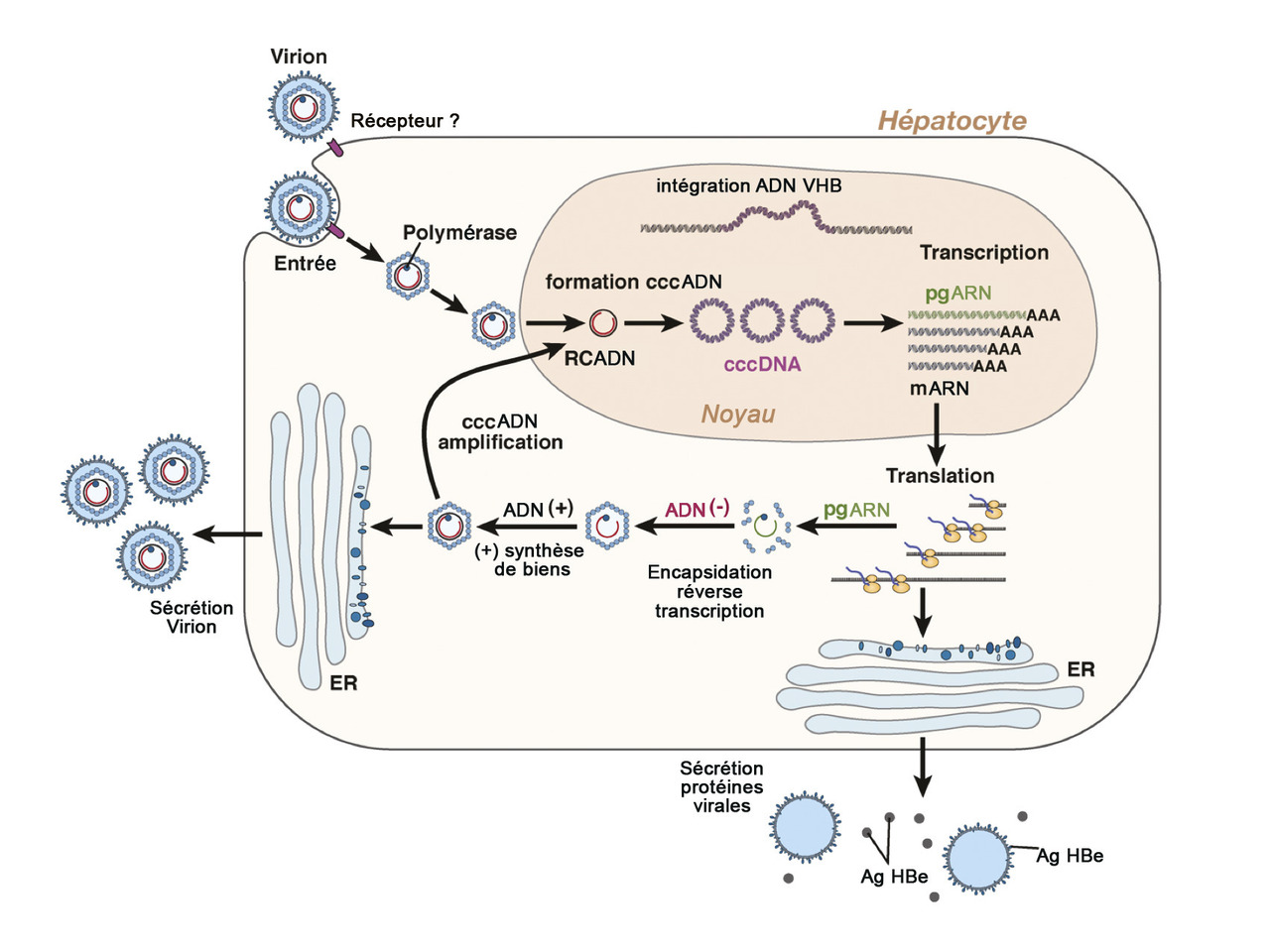
Le VHB appartient à la famille des Hepadnaviridae. Il s’agit d’un virus à ADN qui chez l’hôte se réplique et s’assemble exclusivement dans l’hépatocyte (v. figure3 ). Les virions non cytopathogènes sont relargués par les voies de sécrétion cellulaire. Le génome viral très compact formé d’un ADN double brin comporte quatre zones de lecture ouvertes codant sept protéines : l’antigène HBe, l’antigène HBc, la polymérase VHB ayant une activité transcriptase inverse, les trois glycoprotéines de surface (preS1/préS2/Ag HBs) et l’antigène HBx qui est un régulateur de la transcription nécessaire à l’initiation de l’infection.
Cycle viral
Après son entrée dans l’hépatocyte, la nucléocapside est transportée dans le noyau pour libérer l’ADN viral qui est converti en ADN super-enroulé (cccADN), puis est emballé par des histones formant un mini-chromosome qui sert de modèle transcriptionnel à la base de la synthèse de toutes les protéines virales et responsable de la perpétuation de l’infection. L’ARN prégénomique, d’une part, code les protéines de la capside et la polymérase virale et, d’autre part est transcrit en inverse en nouvel ADN dans la capside virale. Cet ADN viral dans le cytoplasme est soit recyclé dans le noyau pour perpétuer le pool d’ADN super-enroulé, soit enveloppé et sécrété par le réticulum endoplasmique. La cellule infectée produit non seulement des particules virales complètes mais aussi une grande quantité de particules virales incomplètes non infectieuses. L’intégration du génome viral dans l’ADN de la cellule hôte se produit de façon aléatoire et n’est pas requise pour la réplication virale, mais constitue l’un des mécanismes importants impliqués dans la survenue du carcinome hépatocellulaire.4 Les mutations du génome viral sont fréquentes, responsables de la coexistence de plusieurs espèces virales, appelées quasi-espèces, qui vont évoluer en fonction de la pression de l’environnement, de la réponse immunitaire et des traitements antiviraux. On connaît neuf génotypes (A-I) et plusieurs sous-types.
Réponse immunitaire
Le rôle de la réponse immunitaire est essentiel au cours de l’infection par le virus de l’hépatite B et responsable de l’essentiel des lésions hépatiques et des manifestations cliniques. Au cours de l’infection aiguë spontanément résolutive, la réponse immunitaire innée et adaptative est rapide et efficace. La clairance virale fait intervenir une réponse robuste des lymphocytes T, entraînant d’une part une réponse cytolytique et un effet antiviral propre par l’expression des cytokines antivirales, et d’autre part l’induction des lymphocytes B produisant des anticorps neutralisants empêchant la diffusion du virus. La disparition rapide des hépatocytes infectés entraînent une dilution de l’ADN super-enroulé. Quand l’infection devient chronique, on observe une altération des réponses des lymphocytes T qui dépendent fortement de l’âge. Ainsi, les enfants ou les jeunes adultes infectés chroniques ont un profil immunologique moins altéré que celui des adultes plus âgés, faisant évoquer le concept d’immunotolérance. La persistance du VHB est liée à une altération des lymphocytes T à la fois globale et spécifique du virus sans que l’on puisse identifier de signature spécifique des différentes phases de l’infection.
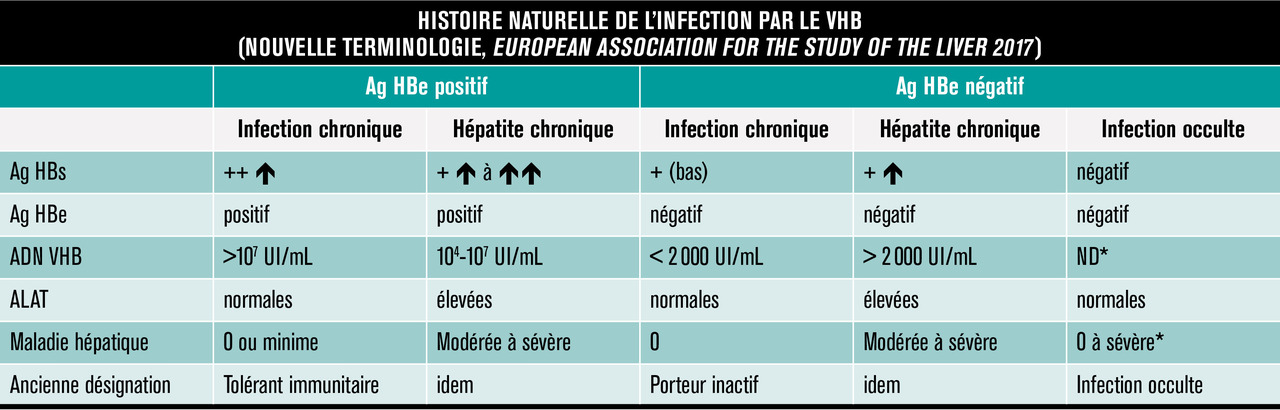
Cinq phases
L’infection chronique est un processus dynamique reflétant les interactions entre le VHB et la réponse immunitaire de l’hôte, et les patients infectés par le VHB n’ont pas tous une hépatite chronique. Les récentes recommandations de l’European Association for the Study of the Liver (EASL) ont défini une nouvelle terminologie pour définir les différentes phases de l’histoire naturelle du VHB.1L’histoire naturelle du VHB peut être divisée en cinq phases reposant d’une part sur la présence d’une infection ou d’une hépatite et d’autre part sur la présence ou l’absence de l’antigène HBe (tableau 1 ). Les patients Ag HBe négatifs (anticorps anti-HBe positifs) représentent le plus grand nombre des patients infectés par le VHB dans le monde. Au sein de ce groupe, la distinction entre les patients infectés (ex-porteurs inactifs du VHB) et ceux ayant une hépatite est parfois difficile. La cinquième phase de l’histoire naturelle du VHB est l’infection occulte VHB. Elle est caractérisée par l’absence d’antigène HBs, et la présence des anticorps anti-HBc avec ou sans anticorps anti-HBs. Les patients ont des transaminases normales et, souvent mais pas constamment, un ADN du VHB sérique indétectable. L’ADN du VHB est présent sous sa forme super-enroulée dans le foie des patients. La perte de l’antigène HBs avant la survenue de la cirrhose est associée à un risque minime de cirrhose, de décompensation ou de carcinome hépatocellulaire et à une amélioration de la survie. En revanche, si la cirrhose est présente au moment de la perte de l’antigène HBs, le patient reste à risque de développer un carcinome hépatocellulaire, et une surveillance biannuelle doit être poursuivie. Chez ces patients, une immunosuppression peut entraîner une réactivation du virus.
Vaccination
La vaccination contre le VHB est disponible depuis 35 ans. Elle est hautement immunogène, et son innocuité semble totale même si de rares complications ont été rapportées (polyradiculonévrites, myélite transverse ou sclérose en plaques), mais la responsabilité du vaccin n’est pas prouvée (arrêt de la cour de justice de juillet 2016). Seules les fébricules et les douleurs au point d’injection peuvent lui être reprochées dans 10 à 15 % des cas, constamment réversibles en 48 heures. Si l’objectif ultime est une vaccination universelle qui devrait être atteinte avec les récentes mesures de vaccination du jeune enfant, elle est aujourd’hui obligatoire pour le personnel de santé et les enfants nés de mères infectées (le dépistage d’Ag HBs est obligatoire chez les femmes enceintes depuis 1992) ; elle est fortement conseillée dans l’entourage des porteurs chroniques du virus, chez les sujets polytransfusés, les usagers de drogues par voie intraveineuse, les sujets à partenaires sexuels multiples, les sujets originaires ou ayant voyagé dans les régions de forte endémie (Afrique ou Asie), les sujets vivant en collectivité. La vaccination n’est pas contre-indiquée chez le nouveau-né et la femme enceinte. Certains facteurs acquis ou génétiques participent à la réponse vaccinale : la réponse est meilleure chez la femme et chez les sujets de moins de 50 ans. L’ensemble des situations d’immunosuppression diminue la qualité de la réponse en titres d’anticorps (qui conditionne la durée de la protection) et en pourcentage de réponses effectives : les hémodialysés, les transplantés, les alcooliques, les sujets traités par immunosuppresseurs, les patients infectés par le virus de l’immunodéficience humaine (VIH). Dans ces populations, le rôle de l’âge et du sexe sur la réponse vaccinale est maintenu. En cas d’échec d’une première vaccination, l’utilisation de schémas renforcés (double dose ou application locale d’imiquimod* en crème au moment de la vaccination5) doit être proposé. L’objectif de l’Organisation mondiale de la santé pour les années 2030 est une couverture vaccinale à plus de 90 % au niveau mondial. Il est donc important de maintenir une politique vaccinale forte.
Dépistage des hépatites chroniques liées au VHB
L’hépatite chronique B étant le plus souvent asymptomatique, le dépistage par la recherche de l’antigène HBs qui signe la présence du VHB (infection ou hépatite) doit être effectué d’une part chez tous les patients originaires des pays de forte endémie, d’autre part chez ceux ayant ou ayant eu des facteurs de risque de transmission du VHB (entourage d’un porteur chronique du virus, sujets polytransfusés, usagers de drogues par voie intraveineuse, sujets à partenaires sexuels multiples, sujets vivant en collectivité). Par ailleurs, la recherche d’une infection par le VHB ou d’une hépatite B doit être réalisée devant toute élévation des transaminases. Ce dépistage comprend la recherche de l’antigène HBs, de l’anticorps anti-HBc qui témoigne d’un contact avec le VHB et la recherche des anticorps anti-HBs neutralisants qui sont le témoin soit d’une guérison, soit d’une vaccination antérieure. La recherche de l’antigène et des anticorps anti-HBe et le dosage de l’ADN VHB ne sont effectués que dans un second temps chez les patients porteurs d’un antigène HBs ou d’un anticorps anti-HBc isolé pour éliminer une infection occulte par le VHB.
Traitement de l’hépatite chronique B
Buts du traitement
Le but principal est d’améliorer la survie et la qualité de vie des patients en empêchant la progression de la maladie hépatique et l’apparition d’un carcinome hépatocellulaire. Les autres buts du traitement sont de prévenir la transmission materno-fœtale, la réactivation du VHB et de prévenir et traiter les manifestations extra-hépatiques de l’infection par le VHB. L’atteinte de ces buts et la nécessité du traitement dépendent d’une part de la phase de l’histoire naturelle du VHB où se situe le patient, et d’autre part de son âge, de son origine ethnique, des lésions hépatiques présentes et des antécédents familiaux de carcinome hépatocellulaire.
Objectifs du traitement
Les objectifs des traitements sont : – d’induire une virosuppression prolongée avec un ADN VHB indétectable, ce qui se traduit, chez la majorité des patients, par une diminution des lésions nécrotico- inflammatoires et de la fibrose réduisant le risque de carcinome hépatocellulaire ; – d’obtenir une réponse biochimique avec une norma- lisation durable des transaminases, ce qui est obtenu chez la plupart des patients avec la virosuppression prolongée ; – d’obtenir une perte de l’antigène HBe, avec ou sans séroconversion anti-HBe, chez les patients Ag HBe positifs, ce qui représente un contrôle immunologique partiel de l’infection chronique, mais insuffisant pour arrêter le traitement ; – et surtout de parvenir à une perte de l’antigène HBs, avec ou sans séroconversion anti-HBs, qui est l’objectif optimal car il témoigne d’une profonde inhibition de toute réplication virale et de l’expression des protéines virales.La perte de l’antigène HBs, avec ou sans séroconversion anti-HBs, est considérée comme l’objectif principal rarement atteint avec les traitements actuels définissant la « guérison fonctionnelle ». Les séroconversions Ag HBs après perte de l’antigène HBs sont rares et surviennent le plus souvent en cas d’immunosuppression sévère. La perte prolongée (au mois 6-12 mois) de l’antigène HBs permet d’arrêter le traitement antiviral. Cependant, la persistance de l’ADN super-enroulé et de l’ADN VHB intégré dans le génome de l’hôte font que l’éradication complète de l’infection par le VHB ne peut être actuel- lement réalisée et que le risque de carcinome hépato- cellulaire, bien que diminué, persiste.6 Il semble aussi que la perte de l’antigène HBs, par rapport à la simple virosuppression, diminue de façon plus importante le risque de complications à long terme, et notamment le risque de carcinome hépatocellulaire, et ce d’autant plus que la perte de l’antigène HBs survient à un âge jeune et chez un patient sans cirrhose.7
Indications des traitements
Les patients ayant une hépatite chronique VHB, Ag HBe positif, ou négatif et ayant un ADN VHB supérieur à 2 000 UI/mL, des transaminases élevées (> limite supérieure de la normale [LSN]) et/ou des lésions nécrotico-inflammatoires ou une fibrose sur la biopsie hépatique ou appréciée par les tests non invasifs de fibrose (Fibroscan, Fibrotest, Fibromètre, FIB-4…) doivent être traités. Quand le titre d’ADN VHB est supérieur à 20 000 UI/mL et les transaminases élevés (> 2 x LSN) sans autre cause évidente, le traitement peut être débuté sans évaluation préalable des lésions hépatiques. Le traitement peut aussi être initié en cas de mani- festations extrahépatiques de l’infection par le VHB quel que soit l’ADN VHB ou le bilan hépatique. De même, les patients ayant une cirrhose doivent être traités quelles que soient leur virémie ou la valeur des transaminases. Les patients ayant une infection chronique VHB avec Ag HBe positif ont un ADN VHB très élevé supérieur à 107 UI/mL, peuvent avoir des transaminases constamment normales et n’avoir au niveau hépatique ni fibrose ni lésions nécrotico-inflammatoires. Cette phase est plus fréquente chez les patients contaminés par voie périnatale. Dans cette situation, il n’y a pas d’indication actuellement à proposer un traitement antiviral avant l’âge de 30 ans, sauf si les patients ont des antécédents familiaux de carcinome hépatocellulaire ou si l’objectif du traitement est de prévenir le risque de contamination car ces patients, fortement virémiques, sont contagieux. Les patients ayant une infection chronique VHB avec Ag HBs négatif (ex-porteurs inactifs) définis par un ADN VHB inférieur à 2 000 UI/mL, des transaminases constamment normales et de faibles lésions nécrotico-inflam- matoires ou de fibrose ne doivent pas être traités. Ces patients sont parfois difficiles à distinguer des patients ayant une hépatite chronique Ag HBe négatif. Cependant, les récentes recommandations de l’EASL proposent que les patients ayant des antécédents familiaux de cirrhose, de carcinome hépatocellulaire ou ayant des manifestations extrahépatiques puissent être traités par analogues nucléosidiques ou nucléotidiques même si tous les critères d’indication au traitement ne sont pas réunis.1Par ailleurs, les professionnels de santé pratiquant des actes à risque d’accidents d’exposition au sang, ayant une infection chronique VHB avec Ag HBs négatif et une charge virale supérieure à 200 UI/mL, doivent être traités par analogues nucléosidiques ou nucléotidiques afin de réduire le risque de transmission selon les recommandations de l’EASL.1 Le taux de virémie qui doit conduire à un traitement préventif varie d’un pays à l’autre, il est entre 200 et 10 000 UI/mL en France d’après les dernières recommandation du Haut Conseil de la santé publique.8 Enfin, les patients ayant une infection chronique par le VHB avec Ag HBs négatif et une infection par le VIH doivent être traités avec un traitement antirétroviral comprenant du ténofovir (ténofovir alafénamide fumarate ou ténofovir disoproxil). De même, les patients ayant une infection chronique VHB avec Ag HBs négatif et transplantés d’organes doivent être traités par analogues ténofovir ou entécavir. Les patients ayant une infection chronique VHB avec Ag HBs négatif (anticorps anti-HBc positif avec ou sans anticorps anti-HBs et le plus souvent un ADN VHB indétectable) recevant une chimiothérapie ou un traitement immunosuppresseur, y compris les corticothérapies prolongées de plus d’un mois, les immunothérapies par des anticorps ciblés, doivent être traités par les analogues entécavir ou ténofovir.9-12 Une réactivation du VHB chez ces patients peut en effet entraîner une élévation des transaminases et de la charge virale, voire une hépatite fulminante ou une hépatite chronique rapidement progressive. Le risque de réactivation est différent selon les traitements immunosuppresseurs utilisés et peut être classé en élevé (> 10 %), modéré (1-10 %) ou faible (> 1 %).13, 14 Le risque de réactivation est plus important chez les patients recevant une chimiothérapie en raison d’une hémopathie maligne et chez les transplantés de moelle, mais il peut aussi s’observer chez les patients sous chimiothérapie pour des tumeurs solides, chez les transplantés d’organes et chez ceux recevant un traitement immunosuppresseur pour des maladies inflammatoires digestives, rhumatismales ou dermatologiques.9 La réactivation du VHB a un impact sur la survie et la prise en charge du patient car elle peut aboutir à un traitement suboptimal en limitant l’utilisation des immunosuppresseurs. Les patients adultes ayant une hépatite B aiguë ne nécessitent pas de traitement spécifique dans la majorité des cas car la guérison spontanée survient dans 95 % des cas. Seuls les patients ayant une hépatite aiguë sévère avec des troubles de la coagulation doivent être traités par les analogues nucléosidiques ou nucléotidiques et éventuellement proposés à la transplantation hépatique.
Stratégies thérapeutiques
Il existe actuellement deux options thérapeutiques disponibles pour l’hépatite B : le traitement par interféron alpha de durée finie (de 48 à 72 semaines) et les traitements par les analogues nucléosidiques ou nucléotidiques de durée prolongée, voire infinie (plusieurs dizaines d’années). Actuellement, en France, seuls les analogues avec une forte barrière à la résistance sont utilisés : il s’agit de l’entécavir, du ténofovir disoproxil fumarate et bientôt du ténofovir alafénamide. Aucune mutation de résistance n’a été observée après 8 ans de traitement avec le ténofovir, et 1,2 % des patients sous entécavir ont développé une mutation de résistance après 5 ans de traitement. Les autres analogues nucléosidiques (lamivudine ou telbivudine) ou nucléotidiques (adéfovir) ne doivent plus être utilisés en France en raison des risques de mutation de résistance et donc d’échappement sous traitement. Les traitements par analogues nucléosidiques ou nucléotidiques, administrés par voie orale, sont les plus utilisés. L’avantage majeur de ces analogues à forte barrière à la résistance est d’induire une virosuppression prolongée et une réponse biochimique chez la grande majorité des patients avec une bonne tolérance (tableau 2 ).1, 15 La fonction rénale doit être surveillée durant le traitement de façon régulière, et la posologie adaptée en fonction de la clairance de la créatinine. Les traitements par analogues nucléosidiques sont les seules options pour les patients ayant une cirrhose décompensée, les transplantés d’organes, les patients ayant une hépatite aiguë sévère ou des manifestations extrahépatiques, ainsi que tous ceux ayant une immunodépression sévère. Les traitements par analogues nucléosidiques sont poursuivis à vie chez les patients cirrhotiques et jusqu’à la négativation de l’antigène HBs pour les autres patients. Le traitement par interféron alpha pégylé est peu utilisé du fait de son administration sous-cutanée, de ses nombreux effets indésirables et de la grande variabilité de la réponse. Son utilisation est limitée à certains sous-groupes de patients. Les patients ayant obtenu une virosuppression sous interféron doivent être surveillés au long cours du fait du risque de rechute.
Les futures options thérapeutiques
De nombreux développements sont en cours pour réaliser de nouvelles combinaisons avec comme objectif principal de pouvoir arrêter les traitements sans risque de rechute, de progression de la maladie hépatique et de carcinome hépatocellulaire.16 Une vraie guérison reste impossible car l’ADN VHB est intégré dans le génome de l’hôte. Les nouvelles options thérapeutiques, actuellement en évaluation préclinique ou à un stade précoce de développement, sont soit de nouveaux antiviraux directs, soit des traitements immunomodulateurs. Parmi les antiviraux directs ciblant les différentes étapes du cycle viral, les plus avancés sont les inhibiteurs d’entrée, les médicaments ciblant l’ADN super-enroulé, les ARN interférents et les oligonucléotides anti- sens ciblant les transcrits viraux et les inhibiteurs de nucléocapside. Les traitements immunomodulateurs ont pour objectif de restaurer la réponse immunitaire contre le VHB en association avec l’inhibition de la réplication du VHB. La restauration de l’immunité innée repose sur plusieurs approches dont les plus avancées sont l’utilisation d’agoniste des Toll-like récepteurs 7 (TLR7). La restauration de l’immunité adaptive repose sur de nouveaux vaccins thérapeutiques et l’utilisation de bloqueurs des signaux inhibiteurs PD-1 ou PDL-1 (check-point inhibiteurs). La « guérison » de l’hépatite B passera par la combinaison de ces différentes approches avec des antiviraux ciblant plusieurs cibles du cycle viral et la production d’antigènes viraux et des traitements immunomodulateurs pour restaurer les réponses immunitaires innées et adaptatives
* L’imiquimod en crème est disponible en France et indiqué pour le traitement local des verrues, des condylomes ano-génitaux, de certaines kératoses actiniques ou de petits épithéliomas basocellulaires. Son action passerait par une activité locale TLR-7 agoniste, responsable d’une stimulation de l’immunité adaptative dépendante des cellules dendritiques. Son efficacité a été montré en association avec un vaccin antigrippal dans un premier temps.
Références
1. European Association for the Study of the Liver. Electronic address eee, European Association for the Study of the L. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection. J Hepatol 2017;67:370-98.
2. Stanaway JD, Flaxman AD, Naghavi M, et al. The global burden of viral hepatitis from 1990 to 2013: findings from the Global Burden of Disease Study 2013. Lancet 2016;388:1081-8.
3. Zoulim F, Locarnini S. Hepatitis B virus resistance to nucleos(t)ide analogues. Gastroenterology 2009;137:1593-608.
4. Levrero M, Zucman-Rossi J. Mechanisms of HBV-induced hepatocellular carcinoma. J Hepatol 2016;64:S84-S101.
5. Hung IF, Zhang AJ, To KK, et al. Topical imiquimod before intradermal trivalent influenza vaccine for protection against heterologous non-vaccine and antigenically drifted viruses: a single-centre, double-blind, randomised, controlled phase 2b/3 trial. Lancet Infect Dis 2016;16:209-18.
6. Liu J, Yang HI, Lee MH, et al. Spontaneous seroclearance of hepatitis B seromarkers and subsequent risk of hepatocellular carcinoma. Gut 2014;63:1648-57.
7. Kim GA, Lim YS, An J, et al. HBsAg seroclearance after nucleoside analogue therapy in patients with chronic hepatitis B: clinical outcomes and durability. Gut 2014;63:1325-32.
8. Haut Conseil de la santé publique. Prévention de la transmission soignant-soigné des virus hématogènes VHB, VHC, VIH. Avis et Rapports, HCSP 2011;juin:1-37.
9. Hwang JP, Lok AS. Management of patients with hepatitis B who require immunosuppressive therapy. Nat Rev Gastroenterol Hepatol 2014;11:209-19.
10. Hoofnagle JH. Reactivation of hepatitis B. Hepatology 2009;49:S156-165.
11. Marzano A, Angelucci E, Andreone P, et al. Prophylaxis and treatment of hepatitis B in immunocompromised patients. Dig Liver Dis 2007;39:397-408.
12. Vigano M, Mangia G, Lampertico P. Management of patients with overt or resolved hepatitis B virus infection undergoing rituximab therapy. Expert Opin Biol Ther 2014;14:1019-31.
13. Papatheodoridis GV, Manolakopoulos S, Liaw YF, Lok A. Follow-up and indications for liver biopsy in HBeAg-negative chronic hepatitis B virus infection with persistently normal ALT: a systematic review. J Hepatol 2012;57:196-202.
14. Reddy KR, Beavers KL, Hammond SP, Lim JK, Falck-Ytter YT, American Gastroenterological Association I. American Gastroenterological Association Institute guideline on the prevention and treatment of hepatitis B virus reactivation during immunosuppressive drug therapy. Gastroenterology 2015;148:215-9.
15. European Association for the Study of the Liver. EASL clinical practice guidelines: Management of chronic hepatitis B virus infection. J Hepatol 2012;57:167-85.
16. Testoni B, Levrero M, Zoulim F. Challenges to a cure for HBV Infection. Semin Liver Dis 2017;37:231-42.
2. Stanaway JD, Flaxman AD, Naghavi M, et al. The global burden of viral hepatitis from 1990 to 2013: findings from the Global Burden of Disease Study 2013. Lancet 2016;388:1081-8.
3. Zoulim F, Locarnini S. Hepatitis B virus resistance to nucleos(t)ide analogues. Gastroenterology 2009;137:1593-608.
4. Levrero M, Zucman-Rossi J. Mechanisms of HBV-induced hepatocellular carcinoma. J Hepatol 2016;64:S84-S101.
5. Hung IF, Zhang AJ, To KK, et al. Topical imiquimod before intradermal trivalent influenza vaccine for protection against heterologous non-vaccine and antigenically drifted viruses: a single-centre, double-blind, randomised, controlled phase 2b/3 trial. Lancet Infect Dis 2016;16:209-18.
6. Liu J, Yang HI, Lee MH, et al. Spontaneous seroclearance of hepatitis B seromarkers and subsequent risk of hepatocellular carcinoma. Gut 2014;63:1648-57.
7. Kim GA, Lim YS, An J, et al. HBsAg seroclearance after nucleoside analogue therapy in patients with chronic hepatitis B: clinical outcomes and durability. Gut 2014;63:1325-32.
8. Haut Conseil de la santé publique. Prévention de la transmission soignant-soigné des virus hématogènes VHB, VHC, VIH. Avis et Rapports, HCSP 2011;juin:1-37.
9. Hwang JP, Lok AS. Management of patients with hepatitis B who require immunosuppressive therapy. Nat Rev Gastroenterol Hepatol 2014;11:209-19.
10. Hoofnagle JH. Reactivation of hepatitis B. Hepatology 2009;49:S156-165.
11. Marzano A, Angelucci E, Andreone P, et al. Prophylaxis and treatment of hepatitis B in immunocompromised patients. Dig Liver Dis 2007;39:397-408.
12. Vigano M, Mangia G, Lampertico P. Management of patients with overt or resolved hepatitis B virus infection undergoing rituximab therapy. Expert Opin Biol Ther 2014;14:1019-31.
13. Papatheodoridis GV, Manolakopoulos S, Liaw YF, Lok A. Follow-up and indications for liver biopsy in HBeAg-negative chronic hepatitis B virus infection with persistently normal ALT: a systematic review. J Hepatol 2012;57:196-202.
14. Reddy KR, Beavers KL, Hammond SP, Lim JK, Falck-Ytter YT, American Gastroenterological Association I. American Gastroenterological Association Institute guideline on the prevention and treatment of hepatitis B virus reactivation during immunosuppressive drug therapy. Gastroenterology 2015;148:215-9.
15. European Association for the Study of the Liver. EASL clinical practice guidelines: Management of chronic hepatitis B virus infection. J Hepatol 2012;57:167-85.
16. Testoni B, Levrero M, Zoulim F. Challenges to a cure for HBV Infection. Semin Liver Dis 2017;37:231-42.