Désormais première cause d’hépatite aiguë virale en France
Découvert au début des années 1980 à la suite de la survenue d’une épidémie d’hépatite cholestatique dans les rangs de soldats soviétiques en Afghanistan, ce virus « non-A et non-B » à transmission entérique est désormais considéré comme la première cause d’hépatite aiguë d’origine virale au monde. La reconnaissance de son endémicité en Europe de l’Ouest a fait évoluer son statut de maladie émergente vers celui d’hépatite virale autochtone dont le spectre de pathogénicité n’est désormais plus limité au foie.
Structure du virus et différents génotypes
Le virus de l’hépatite E (VHE) appartient à la famille des Hepeviridae, genre Orthohepevirus.1 Il s’agit d’un petit virus à capside icosaédrique d’environ 27 à 34 nm de diamètre. Son génome est un acide ribonucléique (ARN) simple brin de polarité positive d’environ 7,2 kb. Il existe trois cadres ouverts de lecture retrouvés pour tous les génotypes (open reading frames [ORF]) : ORF1, ORF2 et ORF3. ORF1 code une polyprotéine non structurale possédant une activité méthyl- et guanyl-transférase, une activité cystéine protéase, une hélicase et une ARN-polymérase ARN-dépendante. Elle assure la réplication du génome viral dans les cellules infectées. ORF2 code la protéine de capside qui porte les épitopes immunogènes. Enfin, ORF3 code une phosphoprotéine intervenant dans l’interaction du virus avec les membranes lipidiques et le bourgeon- nement des virions à la surface des cellules infectées. Le VHE a une grande variabilité génomique, générant une population relativement hétérogène de variants au sein d’un même hôte infecté. On parle de quasi-espèce.
Sept génotypes viraux
Sept génotypes différents sont décrits pour le VHE, dont cinq sont reconnus comme pouvant infecter l’homme. Les génotypes 1 et 2, strictement humains, sont endémiques dans les pays en développement, principalement l’Asie de l’Est et du Sud. Ils sont impliqués dans des épidémies de grande ampleur mais aussi dans des cas sporadiques dans des pays à faible niveau d’hygiène, via le péril fécal et la consommation d’eau contaminée. Les infections à génotypes 1 et 2 touchent principalement les sujets jeunes (15-35 ans).1Le génotype 3, endémique dans les pays industrialisés et notamment en Europe de l’Ouest, et le génotype 4, principalement retrouvé en Chine, diffèrent des génotypes 1 et 2 par leur transmission essentiellement zoonotique. Leur réservoir inclut de nombreux mammifères domestiques et sauvages (porc, sanglier, cervidés, lapin) à partir desquels l’homme peut se contaminer par contact direct avec les animaux infectés ou par l’ingestion de viande et d’abats insuffisamment cuits. Ainsi, parmi les exploitations porcines de l’ouest de la France, la séroprévalence pour le VHE atteint 65 % des animaux et un quart des fermes possèdent au moins un animal réplicant le virus. Plus rarement, des contaminations par des produits dérivés du sang, voire exceptionnellement des organes transplantés, ont été rapportées. En France, on estime qu’un don de sang sur 2 218 contient de l’ARN du VHE. Seuls certains types de plasma destinés à des patients à risque de forme grave (immunodéprimés) sont actuellement testés pour le virus.Le génotype 7, également zoonotique, a été impliqué dans des cas sporadiques d’hépatite E dans la péninsule Arabique via la consommation de lait et de viande de camélidés.
En France, 100 000 cas par an
Sur les données du Centre national de référence (CNR), on estime l’incidence de l’infection à VHE à 100 000 cas par an en France, faisant du virus de l’hépatite E la première cause d’hépatite virale sur le territoire. Ce virus doit donc être recherché en première intention devant la survenue d’une hépatite aiguë en France métropolitaine. Hors contexte de retour de voyage à l’étranger, le génotype 3 est quasi exclusivement retrouvé. La séroprévalence des anticorps anti-VHE est de 22,4 % chez les donneurs de sang, mais est très hétérogène d’un département à l’autre.2 Ainsi, alors qu’elle n’est que de 8 % en Haute-Loire, elle peut atteindre 86,4 % dans le département de l’Ariège sans qu’une explication à cette séroprévalence élevée ne soit retrouvée. Les zones de plus forte prévalence (supérieure à 30 %) sont représentées par la région Occitanie, la région Provence-Alpes-Côte d’Azur, la Corse et une partie de la région Grand Est (Meuse et Moselle). L’ARN du VHE est détecté chez 1 sur 2 218 donneurs de sang.1 Contrairement à certains États comme les Pays-Bas, un dépistage systématique du VHE chez les donneurs de sang n’a pas été recommandé.La séropositivité anti-VHE est plus élevée chez les hommes, de plus de 45 ans, ainsi que chez les personnes consommant régulièrement du gibier, de la saucisse de foie (figatellu), des abats ou des huîtres. À l’inverse, la consommation d’eau en bouteille semble être un facteur protecteur, reflet de la multiplicité des voies de contamination.
Comment faire le diagnostic ?
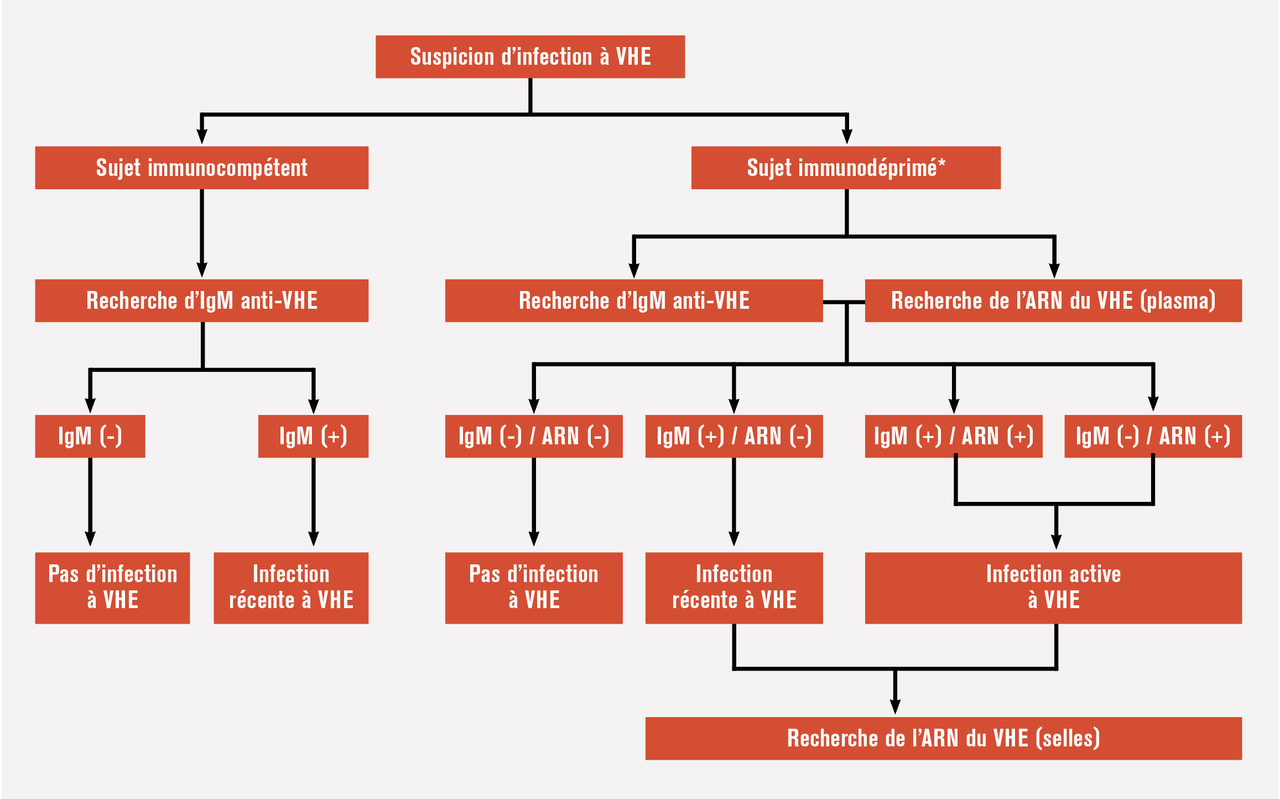
Les performances diagnostiques des différents tests sérologiques ont longtemps été sous-optimaux et très hétérogènes, expliquant en partie l’apparente augmentation de prévalence des anticorps anti-VHE à travers le monde. Malgré la grande variabilité du génome viral, un seul sérotype est décrit. Les anticorps anti-VHE sont détectés par techniques immuno-enzymatiques (enzyme immunoassay [EIA], enzyme-linked immunosorbent assay [ELISA]). Chez l’immunocompétent, la positivité des immunoglobulines M (IgM) anti-VHE signe une infection aiguë avec une spécificité et une sensibilité de 99,6 % et 97,7 % respectivement.3 Chez l’immunodéprimé, la sensibilité est moins bonne (85 %), justifiant la réalisation d’un test de détection directe du génome viral en cas de suspicion diagnostique (fig. 1 ).Chez l’immunocompétent, la détection d’IgG seule marque une infection passée. Leur intérêt chez les patients immunodéprimés est limité puisque des cas de réinfections ont été décrits chez des patients trans- plantés pourtant porteurs d’IgG anti-VHE. Néanmoins, la réascension du taux d’IgG pourrait être un marqueur de réinfection.La détection et la quantification de l’ARN du VHE sont réalisées par reverse transcriptase polymerase chain reaction (RT-PCR) quantitative utilisant des amorces ciblant ORF3.4 Elle peut être réalisée dans le sang et dans les selles. Le seuil de détection est actuellement d’environ 100 copies/mL (technique CNR). Des tests de détection antigénique, reconnaissant la protéine de capside ORF2, sont disponibles mais n’ont pas d’application validée en pratique courante. Bien que très spécifique, leur sensibilité est inférieure aux techniques de PCR (sensibilité de l’ordre de 91 %, avec un seuil diagnostique entre 1 000 et 100 000 copies/mL). Ils pourraient être intéressants pour confirmer une infection dans des laboratoires ne disposant pas de technique de biologie moléculaire.La caractérisation du génotype viral est réalisée par séquençage d’un fragment de 345 nucléotides au sein du gène ORF2. Le génotypage n’a pas d’impact sur la prise en charge des patients. Ces techniques de séquençage sont limitées à certains laboratoires spécialisés à des fins épidémiologiques, notamment pour identifier une source d’infection. Néanmoins, chez les patients chroniquement infectés en échec de traitement, des mutations au sein de la polymérase virale ont été décrites. L’intérêt de leur recherche dans ce contexte est en cours d’évaluation.
Histoire naturelle de la maladie
Infections aiguës
La période d’incubation est de 2 à 6 semaines. À l’issue de cette phase se développe une hépatite cholestatique chez 5 à 30 % des sujets. L’ARN du virus est détectable dans le sang et les selles pendant 4 à 6 semaines. L’apparition des IgM anti-VHE est contemporaine du pic de cytolyse. Elles restent détectables pendant 6 à 9 mois. La réponse humorale IgG peut être différée mais persiste pendant plusieurs années. La majorité des hépatites aiguës à VHE sont asymptomatiques. Lorsqu’elle est présente, l’hépatite cholestatique est généralement résolutive en 2 à 6 semaines. Chez 0,5 à 4 % des patients, l’infection peut évoluer vers l’insuffisance hépatocellulaire. Ces formes graves sont favorisées par une hépatopathie chronique préexistante et associées à une mortalité d’environ 70 %. La ribavirine a été utilisée dans ce contexte pour une courte période. Dans les pays en voie de développement, les infections à génotype 1 et 2 sont responsables d’une morbidité spécifique chez la femme enceinte, avec un taux de mortalité de 15 à 25 % du fait d’hépatites fulminantes ou de complications obstétricales (fausses couches, accouchements prématurés). Ces formes sévères se développent prin- cipalement aux deuxième et troisième trimestres de grossesse. Des transmissions materno-fœtales sont également possibles, avec une morbi-mortalité importante chez le nouveau-né. Cette pathogénicité n’est pas retrouvée pour les génotypes 3 et 4 sans que les mécanismes explicatifs ne soient encore élucidés.
Infections chroniques
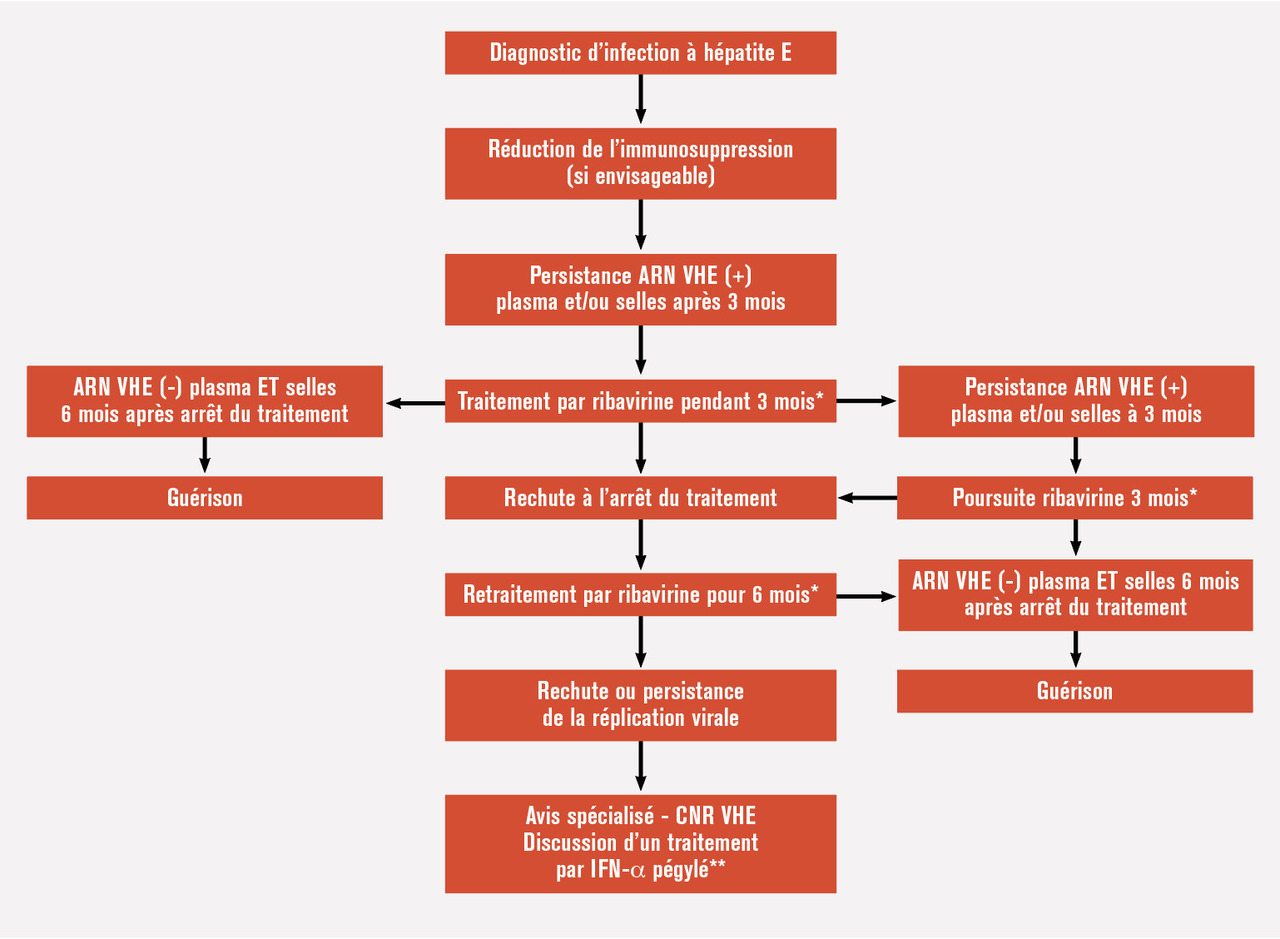
Des formes d’infections chroniques à VHE ont été décrites chez des patients immunodéprimés infectés par les génotypes 3 et 4, c’est-à-dire les transplantés d’organes solides ou de cellules souches, les patients infectés par le virus de l’immunodéficience humaine ayant un nombre de lymphocytes CD4 bas, les patients d’oncohématologie sous chimiothérapie ou les patients recevant une biothérapie immunosuppressive. Ces formes chroniques sont définies par la persistance de l’ARN viral dans le sang et/ou les selles des patients 3 mois après le diagnostic. Elles sont favorisées par l’utilisation du tacrolimus, un nombre de lymphocytes bas et une réponse cellulaire T anti-VHE spécifique déficiente. Chez les patients transplantés, 60 % des infections à VHE évoluent vers la chronicité, avec un risque de fibrose hépatique rapidement évolutive et de cirrhose. Il n’est pas recommandé de rechercher systématiquement le VHE avant d’instaurer un traitement immunosuppresseur. En revanche, le VHE doit être recherché systé- matiquement chez tout patient, particulièrement tout patient immunodéprimé, ayant une cytolyse hépatique.La réduction de l’immunosuppression, lorsqu’elle est envisageable, permet une clairance virale dans un peu plus de 30 % des cas. Chez les patients restants, un traitement par ribavirine de 3 mois permet une élimination du virus dans plus de 80 % des cas. La guérison est alors définie par la négativité de l’ARN viral dans le sang et dans les selles 6 mois après l’arrêt du traitement.5 Une réinfection endogène étant possible chez les patients gardant une excrétion fécale isolée du VHE, le traitement doit être prolongé dans cette condition (fig. 2 ).6 Chez les patients rechuteurs, un second traitement de 6 mois leur est proposé.La principale toxicité de la ribavirine est l’apparition d’une anémie hémolytique dose-dépendante, majorée par des traitements associés aplasiants (azathioprine, mycophénolate) nécessitant l’introduction d’érythropoïétine parfois à forte posologie, voire un support transfusionnel. La posologie de la ribavirine doit être adaptée à la fonction rénale. Des échecs de traitement par ribavirine ont été rapportés. Ils peuvent nécessiter la recherche de mutations spécifiques au sein du génome du virus. La seule alternative à la ribavirine dont l’efficacité soit démontrée in vitro et in vivo est l’interféron alpha pégylé. Néanmoins, son utilisation est associée à la survenue de rejets chez les transplantés d’organes.
Manifestations extrahépatiques
Des manifestations extrahépatiques ont été associées à l’infection par le virus de l’hépatite E, notamment neurologiques (syndrome de Guillain-Barré et syndrome de Parsonage-Turner principalement), hématologiques (anémie arégénérative ou hémolytique, érythroblastopénie, thrombopénie, cryoglobulinémie), rénales (insuf- fisance rénale aiguë, glomérulonéphrites avec ou sans cryoglobulinémie) ou pancréatiques.7 Ainsi, 5 à 11 % des syndromes de Guillain-Barré et plus de 10 % des syndromes de Parsonage-Turner sont associés à une infection récente par le VHE dans les pays d’Europe de l’Ouest.8 Ces patients ont généralement peu ou pas d’anomalies hépatiques, et la symptomatologie neurologique domine le tableau clinique. Le mécanisme physiopathologique est incertain mais pourrait correspondre à une réaction immune croisée entre les antigènes du virus et des épitopes portés par les tissus nerveux. Par ailleurs, il a été récemment mis en évidence que le VHE pouvait franchir la barrière hématoméningée et se multiplier au sein de lignées cellulaires neurales, soutenant l’hypothèse d’un neurotropisme spécifique de certaines souches virales. Une présence plus élevée d’anticorps anti-VHE est aussi rapportée dans les myasthénies.
Prise en charge
La prise en charge des hépatites E est liée au statut immunitaire du patient (v. tableau) .
Prévention
L’amélioration de la qualité de l’eau est un élément essentiel de la lutte contre les épidémies de VHE de génotypes 1 et 2 dans les zones d’endémie. Concernant le VHE de génotypes 3 et 4, il est généralement inactivé après cuisson à 70 °C pendant plus de 20 minutes et donc prévenu par une cuisson à cœur des aliments issus d’animaux potentiellement vecteurs. La prévention des sujets à risque repose ainsi sur l’évitement de la consommation de viande ou d’abats crus ou insuffisamment cuits.Un vaccin a été élaboré mais n’est actuellement disponible qu’en Chine. Bien que conçu contre les génotypes 1 et 4, il permettrait le développement d’une réponse immune protectrice contre tous les génotypes.
Références
1. Kamar N, Izopet J, Pavio N, et al. Hepatitis E virus infection. Nat Rev Dis Primers 2017;3:17086.
2. Mansuy JM, Gallian P, Dimeglio C, et al. A nationwide survey of hepatitis E viral infection in French blood donors. Hepatology 2016;63:1145-54.
3. Abravanel F, Chapuy-Regaud S, Lhomme S, et al. Performance of anti-HEV assays for diagnosing acute hepatitis E in immunocompromised patients. J Clin Virol 2013;58:624-8.
4. Abravanel F, Sandres-Saune K, Lhomme S, Dubois M, Mansuy JM, Izopet J. Genotype 3 diversity and quantification of hepatitis E virus RNA. J Clin Microbiol 2012;50:897-902.
5. Kamar N, Izopet J, Tripon S, et al. Ribavirin for chronic hepatitis E virus infection in transplant recipients. N Engl J Med 2014;370:1111-20.
6. Abravanel F, Lhomme S, Rostaing L, Kamar N, Izopet J. Protracted fecal shedding of HEV during ribavirin therapy predicts treatment relapse. Clin Infect Dis 2015;60:96-9.
7. Kamar N, Marion O, Abravanel F, Izopet J, Dalton HR. Extrahepatic manifestations of hepatitis E virus. Liver Int 2016;36:467-72.
8. Dalton HR, Kamar N, van Eijk JJJ, et al. Hepatitis E virus and neurological injury. Nat Rev Neurol 2016;12:77-85.
2. Mansuy JM, Gallian P, Dimeglio C, et al. A nationwide survey of hepatitis E viral infection in French blood donors. Hepatology 2016;63:1145-54.
3. Abravanel F, Chapuy-Regaud S, Lhomme S, et al. Performance of anti-HEV assays for diagnosing acute hepatitis E in immunocompromised patients. J Clin Virol 2013;58:624-8.
4. Abravanel F, Sandres-Saune K, Lhomme S, Dubois M, Mansuy JM, Izopet J. Genotype 3 diversity and quantification of hepatitis E virus RNA. J Clin Microbiol 2012;50:897-902.
5. Kamar N, Izopet J, Tripon S, et al. Ribavirin for chronic hepatitis E virus infection in transplant recipients. N Engl J Med 2014;370:1111-20.
6. Abravanel F, Lhomme S, Rostaing L, Kamar N, Izopet J. Protracted fecal shedding of HEV during ribavirin therapy predicts treatment relapse. Clin Infect Dis 2015;60:96-9.
7. Kamar N, Marion O, Abravanel F, Izopet J, Dalton HR. Extrahepatic manifestations of hepatitis E virus. Liver Int 2016;36:467-72.
8. Dalton HR, Kamar N, van Eijk JJJ, et al. Hepatitis E virus and neurological injury. Nat Rev Neurol 2016;12:77-85.