L’imagerie des lésions ovariennes repose sur le triptyque : échographie endovaginale avec Doppler, imagerie par résonance magnétique (IRM) et tomodensitométrie (TDM). Si l’échographie reste l’examen de première intention, en fonction de la question posée et du type de lésion découverte, la réalisation d’une IRM pelvienne ou d’une TDM peut s’avérer nécessaire.
Détecter et reconnaître une masse ovarienne non suspecte
Aucun dépistage n’est à ce jour efficace, et donc recommandé, pour le cancer de l’ovaire. L’examen d’imagerie qui permet de détecter et de reconnaître une masse ovarienne est l’échographie endovaginale avec Doppler. Pratiquée à l’aide d’une sonde endovaginale à n’importe quel moment du cycle, elle permet d’avoir une excellente résolution spatiale et d’identifier une masse latéro-utérine suspectée à l’examen clinique. La performance de l’échographie endovaginale pour le diagnostic des masses ovariennes est excellente, avec une sensibilité de 93 % et une spécificité de 89 % lorsqu’elle est réalisée par un radiologue expert.1, 2
Critères échographiques pour caractériser une masse ovarienne
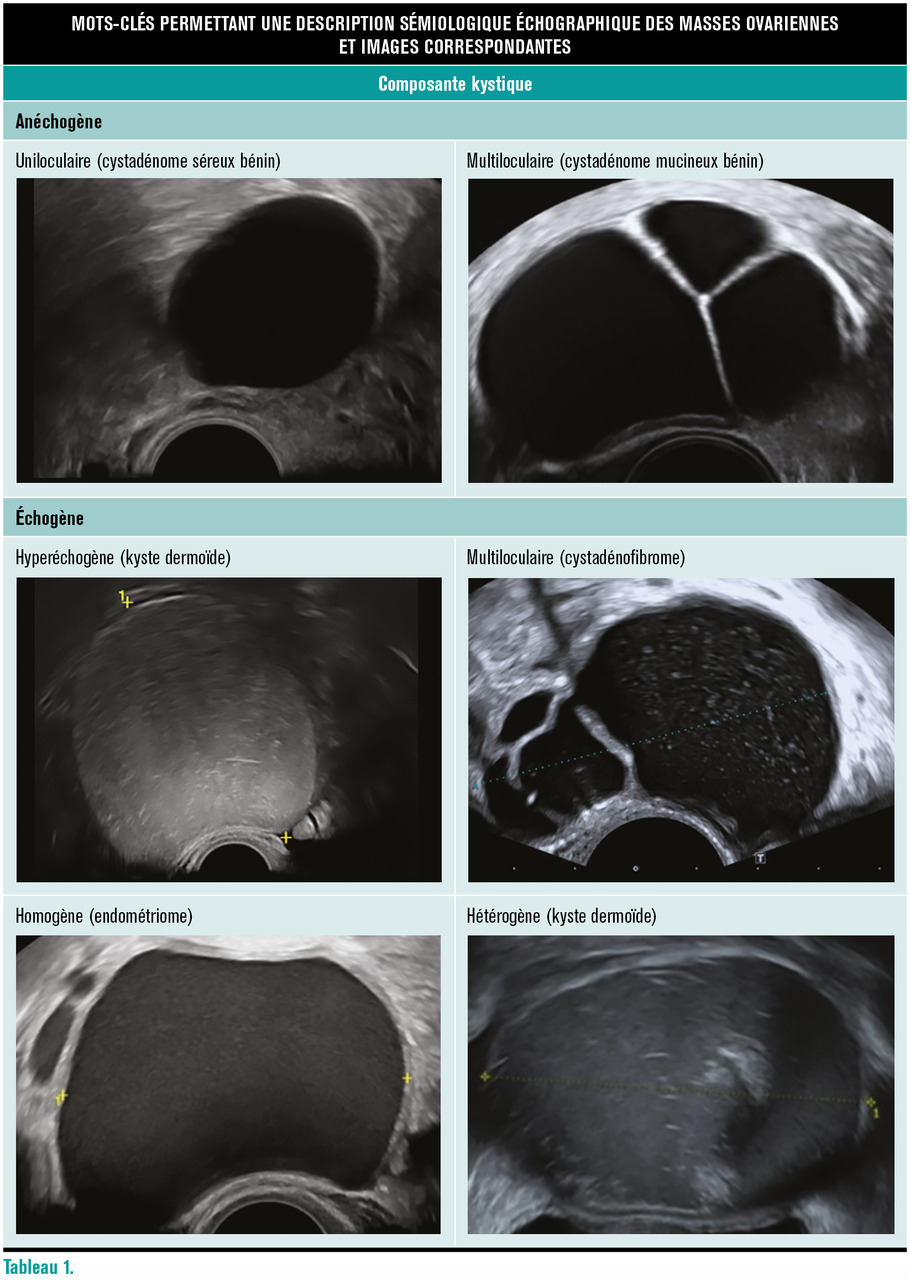
La sémiologie descriptive des masses ovariennes en échographie repose tout d’abord sur l’identification de sa composante majoritaire : kystique pure, à prédominance kystique, à prédominance solide, solide pure.
En cas de portion kystique, il faut décrire sa morphologie (uniloculaire, multiloculaire) et son échogénicité (anéchogène, échogène, homogène ou hétérogène).
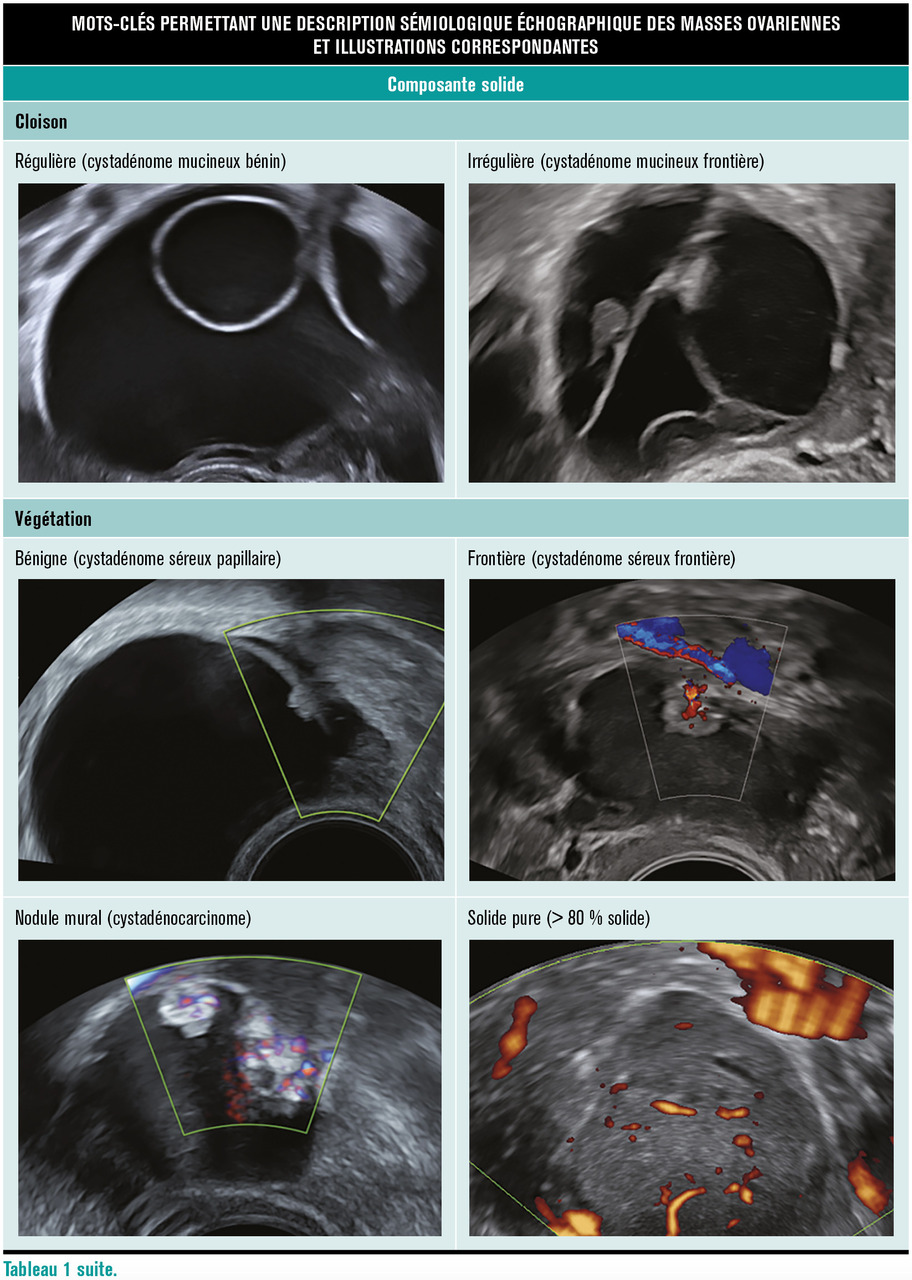
Il existe trois types de portions tissulaires : cloison irrégulière, végétations, nodule mural. L’étude de leur vascularisation (absente, faible, modérée, intense) contribue à l’évaluation du risque de malignité de ces lésions (
Les autres éléments essentiels dans la description d’une masse ovarienne en échographie sont sa topographie, sa taille, son caractère uni- ou bilatéral, la présence d’une ascite (en faveur de la malignité), la présence d’un éventuel cône d’ombre postérieur et la persistance de parenchyme ovarien sain (tous deux en faveur de la bénignité).
Les masses ovariennes peuvent être regroupées en six tableaux permettant d’évoquer des gammes diagnostiques : kystique uniloculaire liquidien pur, kystique uniloculaire liquidien impur, kystique multiloculaire sans portion tissulaire, kystique uni- ou multiloculaire avec végétations, masse mixte hétérogène avec nodule mural, et masse purement solide.
Évaluer le risque de malignité : des outils performants
La performance diagnostique de l’échographie endovaginale est meilleure si elle est réalisée par un opérateur expert.2
Un praticien non expert peut s’aider de l’application de « règles simples » (
Il existe également de nombreux scores prédictifs de malignité des masses ovariennes en échographie, dont l’un des plus connus est la classification O-RADS US (Ovarian-Adnexal Reporting and Data System Ultrasound) (
Quand recourir à un examen de deuxième intention ?
L’IRM pelvienne améliore la caractérisation tissulaire
L’IRM pelvienne est indiquée en cas de masse annexielle complexe ou indéterminée en échographie, ce qui représente entre 20 et 25 % des cas (
L’American College of Radiology recommande de réaliser une IRM pelvienne pour améliorer la caractérisation des masses classées O-RADS US 4. Elle permet une meilleure caractérisation tissulaire (limite principale de l’échographie pelvienne) et, en raison de sa meilleure spécificité, de reclasser certaines lésions bénignes qui étaient indéterminées, voire suspectes, en échographie.7
Il peut être aussi utile de réaliser une IRM pelvienne en cas de lésion classée O-RADS US 5 pour distinguer les lésions primitives et secondaires des masses malignes d’autre origine.
Une IRM pelvienne doit être réalisée en cas de lésion volumineuse (> 7-10 cm, O-RADS US 3) afin de ne pas méconnaître une composante solide suspecte non visualisée à l’échographie.
Il n’y a pas d’indication à réaliser une IRM pelvienne pour les masses O-RADS US 2.
On dénombre quatre lésions ovariennes les plus fréquentes (
Le scanner est réservé au bilan d’extension et en cas de doute
Le scanner a un rôle clé dans le bilan d’extension des cancers de l’ovaire mais n’est pas recommandé en pratique courante pour la caractérisation des masses annexielles du fait de sa moins bonne performance pour la caractérisation tissulaire et de l’irradiation induite.
En revanche, il peut s’avérer utile en cas de doute sur la présence de calcifications, qui peuvent être présentes par exemple dans les tératomes matures kystiques, tumeurs de Brenner, fibromes ovariens, ou bien sous forme de calcosphérites dans les tumeurs épithéliales séreuses le plus souvent. Le scanner abdomino-pelvien peut aussi permettre de détecter une composante graisseuse évocatrice de tumeur germinale.
En cas d’impossibilité de réaliser une échographie ou une IRM pelvienne, le scanner abdomino-pelvien avec injection de produit de contraste iodé permet de différencier les masses annexielles malignes et bénignes, avec une performance diagnostique de 92,9 %, notamment en détectant une portion tissulaire irrégulière, de l’ascite ou des métastases ganglionnaires ou péritonéales.8
Explorer une masse dite « indéterminée » ou suspecte en échographie
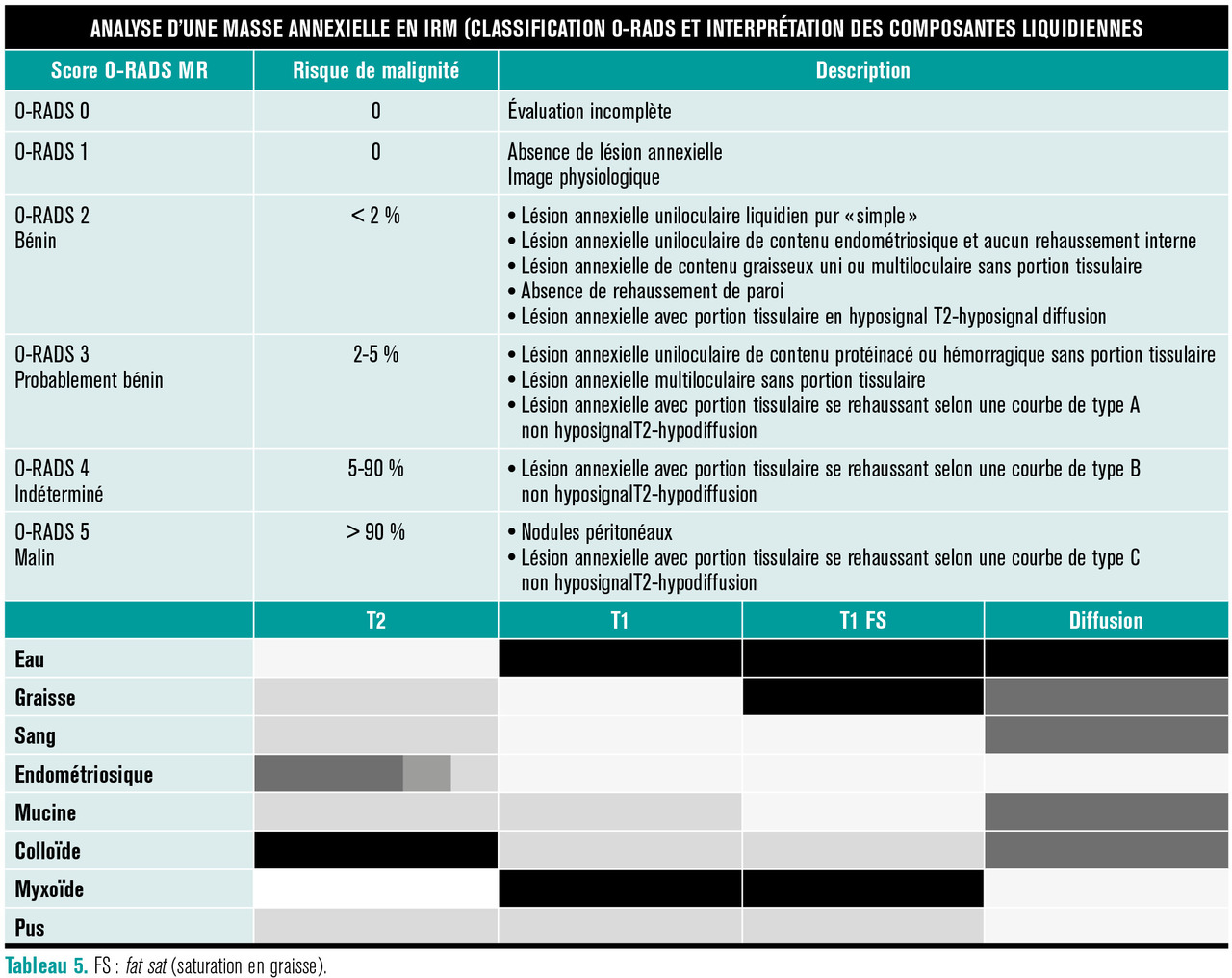
L’IRM pelvienne doit comprendre des séquences morphologiques classiques en pondération T2, T1 et T1 avec saturation de la graisse (fat sat [FS]) ainsi que des séquences fonctionnelles de diffusion et de perfusion permettant le calcul de courbes de rehaussement. L’analyse de la masse, de la portion liquidienne et d’une éventuelle portion tissulaire permet de lui attribuer un score O-RADS MR (ou O-RADS-IRM), pronostic du risque de malignité, afin de garantir la meilleure prise en charge possible (
Une portion tissulaire se rehausse après injection de gadolinium, il en existe trois types : les végétations, les cloisons irrégulières et les portions solides. En présence d’une portion tissulaire, il faut la caractériser pour évaluer son risque de malignité.
Si la portion tissulaire est en hyposignal T2 franc et hyposignal diffusion, la masse est typiquement bénigne (O-RADS MR 2).
Si la portion solide ne remplit pas ces deux critères, il faut réaliser des courbes de rehaussement, permettant de classer O-RADS MR 3 en cas de courbe de type 1, O-RADS MR 4 en cas de courbe de type 2 et O-RADS MR 5 en cas de courbe de type 3.
Il existe de nombreux types histologiques des tumeurs ovariennes, regroupées en 4 catégories principales : les tumeurs épithéliales (60 %), les tumeurs germinales (20-25 %) [
Bilan d’extension d’un cancer de l’ovaire
Le carcinome épithélial, qu’il soit ovarien ou tubaire, représente 90 % des cancers de l’ovaire, et est dans 70 % des cas un carcinome séreux de haut grade. Le bilan d’extension du cancer de l’ovaire repose principalement sur le scanner thoraco-abdomino-pelvien (TDM-TAP) avec injection de produit de contraste et la cœlioscopie diagnostique.9
L’IRM thoraco-abdomino-pelvienne a une meilleure sensibilité que le scanner en raison de sa meilleure résolution en contraste ; elle peut être un complément utile dans le bilan d’extension.10
En raison de son caractère peu symptomatique, le diagnostic de cancer de l’ovaire se fait à un stade avancé (stades III et IV) dans plus de 70 % des cas, c’est-à-dire avec une extension péritonéale extrapelvienne ou des métastases ganglionnaires rétropéritonéales.
La première étape du bilan d’extension consiste à évaluer la résécabilité des atteintes afin d’orienter la prise en charge vers une chirurgie de cytoréduction ou une chimiothérapie néoadjuvante. Les atteintes potentiellement non résécables sont les suivantes : extension extra-abdominale de la maladie (notamment les métastases pulmonaires) ; métastases parenchymateuses abdomino-pelviennes ; atteinte de l’arrière cavité de l’épiploon, de la plaque hilaire hépatique ; rétraction de la racine du mésentère et adénopathies rétro-péritonéales lombo-aortiques sus-rénales.9 Certaines atteintes comme l’extension au trigone vésical ou à plus de trois segments digestifs distants nécessitent une expertise chirurgicale.
Le facteur pronostique principal étant le caractère complet de la chirurgie de cytoréduction, il est essentiel de réaliser une description exhaustive des lésions, notamment celles non visibles par le chirurgien en cœlioscopie diagnostique.
La carcinose péritonéale touche préférentiellement la coupole diaphragmatique droite, les gouttières paracoliques, le pelvis et le grand omentum, réalisant classiquement un « gâteau épiploïque » ; il existe un score quantitatif d’évaluation de la charge tumorale utilisé en radiologie et en chirurgie appelé peritoneal cancer index (PCI). D’autres scores prédisant la résécabilité existent en chirurgie, comme le score de Fagotti.
1. Brun JL, Fritel X, Aubard Y, Borghese B, Bourdel N, Chabbert-Buffet N, et al. Management of presumed benign ovarian tumors: updated French guidelines. Eur J Obstet Gynecol Reprod Biol 2014;183:52-8. https://doi.org/10.1016/j.ejogrb.2014.10.012
2. Meys EMJ, Kaijser J, Kruitwagen RFPM, Slangen BFM, Van Calster B Aertgeerts B, et al. Subjective assessment versus ultrasound models to diagnose ovarian cancer: A systematic review and meta-analysis. Eur J Cancer 2016;58:17-29. https://doi.org/10.1016/j.ejca.2016.01.007
3. Timmerman D, Valentin L, Bourne TH, Collins WP, Verrelst H, Vergote I ; International Ovarian Tumor Analysis Group. Terms, definitions and measurements to describe the sonographic features of adnexal tumors: a consensus opinion from the International Ovarian Tumor Analysis (IOTA) Group. Ultrasound Obstet Gynecol 2000;16:500-5. https://doi.org/10.1046/j.1469-0705.2000.00287.x
4. Timmerman D, Ameye L, Fischerova D, Epstein E, Melis GB, Guerriero S, et al. (2010) Simple ultrasound rules to distinguish between benign and malignant adnexal masses before surgery: prospective validation by IOTA group. BMJ 2010;341:c6839. https://doi.org/10.1136/bmj.c6839
5. Timmerman D, Van Calster B, Testa A, Savelli L, Fischerola D, Froyman W, et al. Predicting the risk of malignancy in adnexal masses based on the Simple Rules from the International Ovarian Tumor Analysis group. Am J Obstet Gynecol 2016;214:424-37. https://doi.org/10.1016/j.ajog.2016.01.007
6. Andreotti RF, Timmerman D, Strachowski LM, Froyman W, Benacerraf BR, Bennett GL, et al. O-RADS US Risk Stratification and Management System: A Consensus Guideline from the ACR Ovarian-Adnexal Reporting and Data System Committee. Radiology 2020;294:168-85. https://doi.org/10.1148/radiol.2019191150
7. Anthoulakis C, Nikoloudis N. Pelvic MRI as the “gold standard” in the subsequent evaluation of ultrasound-indeterminate adnexal lesions: a systematic review. Gynecol Oncol 2014;132:661-8. https://doi.org/10.1016/j.ygyno.2013.10.022
8. Tsili AC, Tsampoulas C, Argyropoulou M, Navrozoglou I, Alamanos Y, Paraskevaidis E, Efremidis SC. Comparative evaluation of multidetector CT and MR imaging in the differentiation of adnexal masses. Eur Radiol 2008;18:1049-57. https://doi.org/10.1007/s00330-007-0842-4
9. Thomassin-Naggara I, Daraï E, Lécuru F, Fournier L. Diagnostic value of imaging (ultrasonography, doppler, CT, MR, PET-CT) for the diagnosis of a suspicious ovarian mass and staging of ovarian, tubal or primary peritoneal cancer: Article drafted from the French Guidelines in oncology entitled “Initial management of patients with epithelial ovarian cancer” developed by FRANCOGYN, CNGOF, SFOG, GINECO-ARCAGY under the aegis of CNGOF and endorsed by INCa. Gynecol Obstet Fertil Senol 2019;47:123-33. https://doi.org/10.1016/j.gofs.2018.12.012
10. Low RN, Barone RM, Lucero J. Comparison of MRI and CT for predicting the Peritoneal Cancer Index (PCI) preoperatively in patients being considered for cytoreductive surgical procedures. Ann Surg Oncol 2015;22(5):1708-15. https://pubmed.ncbi.nlm.nih.gov/25201499/. Accessed 31 May 2022