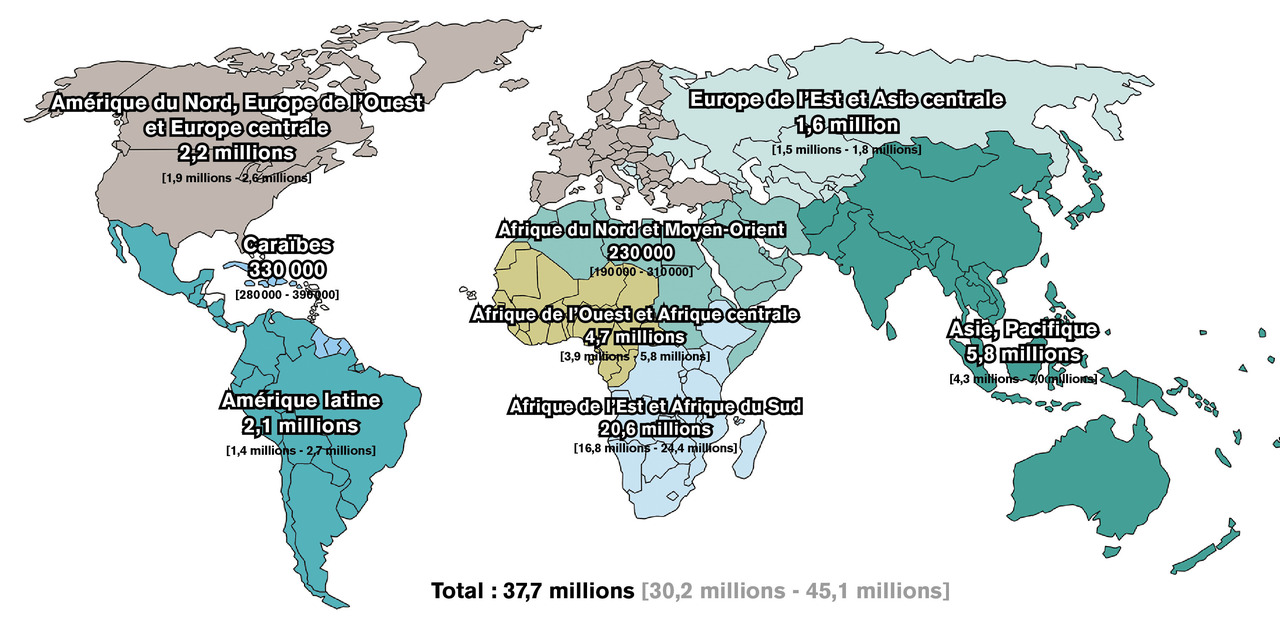
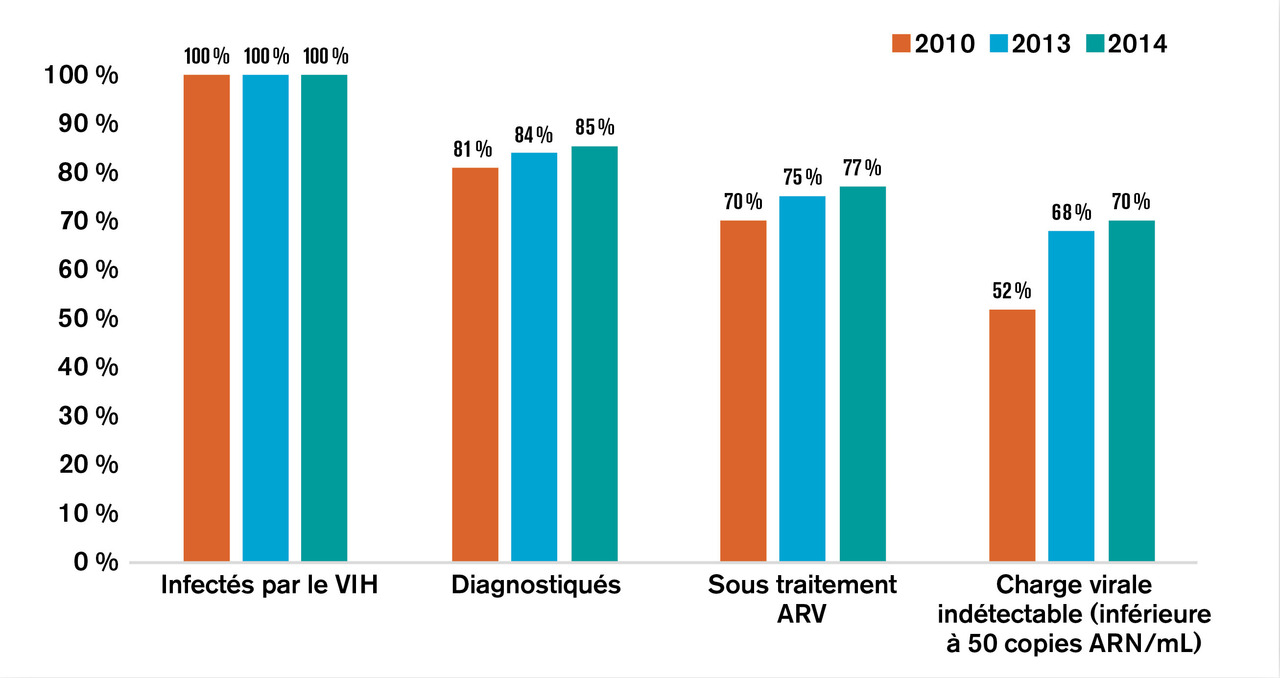
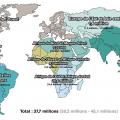
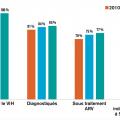
En 2020, dans le monde (fig. 1 ), on estime à 37,7 millions le nombre de personnes vivant avec le virus de l’immunodéficience humaine (PvVIH), dont 36 millions d’adultes et 1,7 million d’enfants de moins de 15 ans.1 Parmi cette population, dont la majorité vit en Afrique subsaharienne, environ 1 personne sur 5 ignore son statut vis-à-vis du VIH, soit 8 millions de personnes. De plus, environ 1,5 million d’individus se contaminent chaque année. Enfin, 680 000 PvVIH sont décédées de l’infection par le VIH en 2020. Ces chiffres alarmants ont été récemment publiés par l’ONUSIDA, dont l’objectif 90-90-90 n’est toujours pas atteint (soit 90 % des PvVIH connaissent leur statut vis-à-vis du VIH, 90 % d’entre elles ont accès à un traitement antirétroviral efficace et 90 % des PvVIH traitées ont une charge virale plasmatique indétectable). En effet, en 2020, sur l’ensemble des PvVIH, 84 % connaissaient leur statut, 73 % avaient accès à un traitement et 66 % avaient une charge virale indétectable.
Les populations clés totalisent 62 % des nouvelles contaminations dans le monde, avec un risque de contracter la maladie 13 fois plus élevé chez les transgenres, 26 fois plus élevé chez les hommes ayant des relations sexuelles avec des hommes (HSH), 29 fois plus élevé chez les usagers de drogues injectables (UDI) et jusqu’à 30 fois plus chez les travailleurs du sexe.
Les populations clés totalisent 62 % des nouvelles contaminations dans le monde, avec un risque de contracter la maladie 13 fois plus élevé chez les transgenres, 26 fois plus élevé chez les hommes ayant des relations sexuelles avec des hommes (HSH), 29 fois plus élevé chez les usagers de drogues injectables (UDI) et jusqu’à 30 fois plus chez les travailleurs du sexe.
Épidémiologie et dépistage de l’infection par le VIH : qu’en est-il en France ?
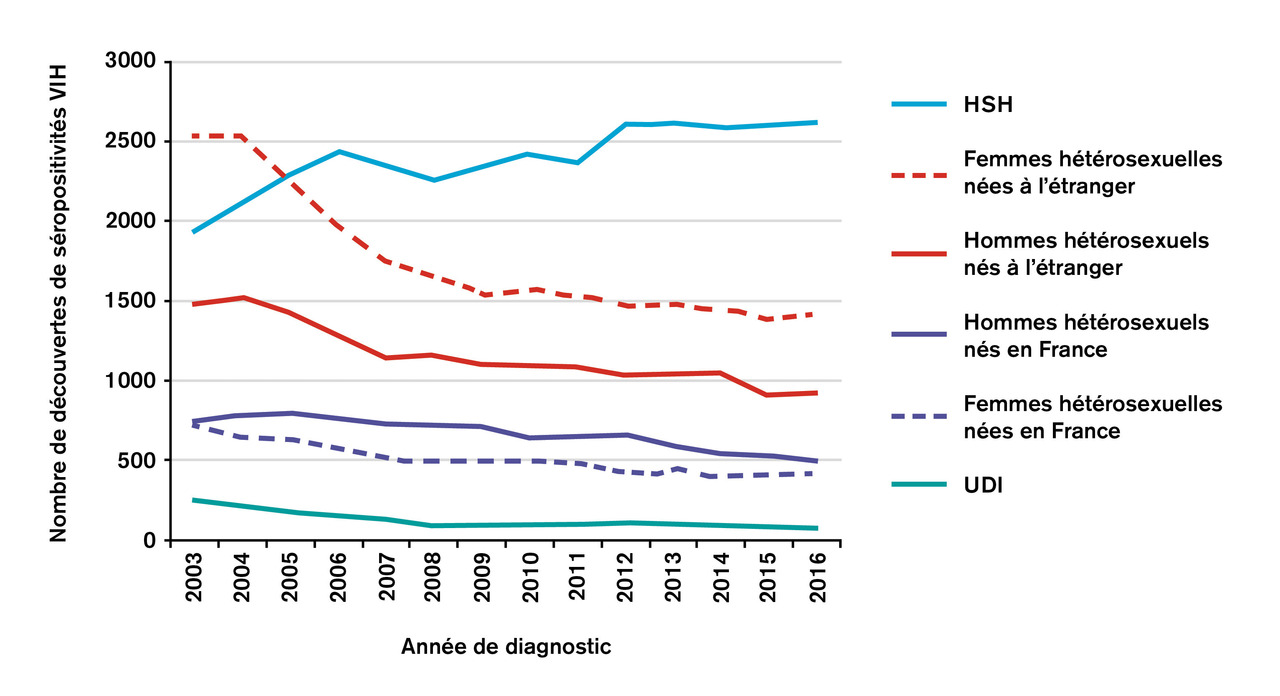
En France2, on estime que 173 000 (170 800-174 500) personnes sont infectées par le VIH, avec une augmentation régulière de la prévalence, due au nombre annuel de sujets nouvellement contaminés, qui est toujours supérieur à celui des PvVIH qui décèdent chaque année. La déclaration obligatoire de l’infection par le VIH permet d’estimer le nombre de nouvelles contaminations à environ 6 000 par an, chiffre qui reste stable malgré une discrète inflexion en 2018. En revanche, la dynamique de l’épidémie a changé puisque l’on ne parle plus d’épidémie française mais d’épidémies territoriales hétérogènes et de populations clés. En effet, l’épidémie, bien que présente sur tout le territoire français, est majoritairement concentrée dans les grandes agglomérations et particulièrement en Île-de-France, avec plus de 40 % des nouveaux cas diagnostiqués prédominant chez les HSH (41,6 %) et les hétérosexuels nés à l’étranger (32,5 %) (fig. 2 ).
Parmi les nouveaux patients diagnostiqués, on note une diminution chez les HSH nés en France et les hommes hétérosexuels nés en France ou à l’étranger. En revanche, la situation reste préoccupante pour les femmes et les HSH nés à l’étranger, avec une augmentation de l’incidence ces dernières années.
Afin de faire régresser l’épidémie en France, le dépistage, donc la connaissance du statut de chaque individu vis-à-vis du VIH, reste la clé du système de prévention. Son usage est largement ancré dans la pratique médicale et communautaire, avec une offre qui s’est diversifiée ces dernières années mais qui reste insuffisante (tableau ). Outre les tests sérologiques de dernière génération (5,8 millions/an) qui peuvent être réalisés sans ordonnance, les tests rapides d’orientation diagnostique (TROD) ont été développés afin d’aller au plus près des populations ciblées (65 000 tests en 2018). Enfin, des autotests sont disponibles en pharmacie, avec 79 500 autotests vendus en 2019 (en hausse de 6 % par rapport à 2018). Ces trois modalités de dépistage sont jugées complémentaires et font partie de l’offre préventive diversifiée.
Parmi les nouveaux patients diagnostiqués, on note une diminution chez les HSH nés en France et les hommes hétérosexuels nés en France ou à l’étranger. En revanche, la situation reste préoccupante pour les femmes et les HSH nés à l’étranger, avec une augmentation de l’incidence ces dernières années.
Afin de faire régresser l’épidémie en France, le dépistage, donc la connaissance du statut de chaque individu vis-à-vis du VIH, reste la clé du système de prévention. Son usage est largement ancré dans la pratique médicale et communautaire, avec une offre qui s’est diversifiée ces dernières années mais qui reste insuffisante (
Quelle politique de dépistage ?
En France, l’épidémie atteint essentiellement des groupes de population dites populations clés : HSH, femmes et hommes hétérosexuels nés à l’étranger (Afrique subsaharienne et territoires français d’Amérique [TFA]), usagers de drogues injectables. Les campagnes institutionnelles encouragent le dépistage au moins une fois dans la vie entre 15 et 70 ans pour la population générale. Quant aux populations clés, il est recommandé de dépister au minimum une fois par an les HSH et les personnes issues de pays à forte endémie.
Afin de faciliter le dépistage, l’offre de soins s’est élargie de façon à devenir plus accessible aux populations clés : professionnels de santé des secteurs publics et privés, structures associatives habilitées par les agences régionales de santé, centres gratuits d’information, de dépistage et de diagnostic du VIH, des hépatites et des infections sexuellement transmissibles (CeGIDD) sont encouragés à mener des actions « hors les murs », au plus près des populations vulnérables (prisons, foyers de migrants, maisons des femmes, jeunes…). Malgré la diversification des méthodes et structures de dépistage, le rendement demeure insuffisant, avec un taux de patients dépistés à un stade tardif de la maladie (lymphocytes CD4 inférieurs à 200/mm3 ou sida) trop élevé (environ 29 %), et de nombreuses opportunités de dépistage manquées (consultation médicale, passage aux urgences hospitalières, chez le pharmacien). Parallèlement, le dépistage d’autres infections sexuellement transmissibles (IST) est indispensable au maintien d’une bonne santé sexuelle. Il comporte :
– dépistage de l’hépatite A et vaccination (épidémie dans les populations HSH) ;
– dépistage de l’hépatite B et vaccination ;
– dépistage de l’hépatite C (à adapter en fonction des pratiques sexuelles et de la prise de risques) et traitement ;
– dépistage de la syphilis (à adapter en fonction des pratiques sexuelles et de la prise de risques) et traitement ;
– dépistage des infections à Chlamydia trachomatis et gonocoque (à rechercher par PCR dans les urines, par prélèvement dans la gorge et l’anus, à adapter en fonction des pratiques sexuelles et de la prise de risques) et traitement.
En complément, la vaccination contre les papillomavirus (HPV) doit être proposée systématiquement aux jeunes femmes, idéalement avant le début de la sexualité et au plus tard à 19 ans, ainsi qu’aux HSH jusqu’à l’âge de 26 ans. Depuis début 2021, l’indication a été élargie pour les garçons de 11 à 14 révolus (rattrapage possible entre 15 et 19 ans révolus).
Afin de faciliter le dépistage, l’offre de soins s’est élargie de façon à devenir plus accessible aux populations clés : professionnels de santé des secteurs publics et privés, structures associatives habilitées par les agences régionales de santé, centres gratuits d’information, de dépistage et de diagnostic du VIH, des hépatites et des infections sexuellement transmissibles (CeGIDD) sont encouragés à mener des actions « hors les murs », au plus près des populations vulnérables (prisons, foyers de migrants, maisons des femmes, jeunes…). Malgré la diversification des méthodes et structures de dépistage, le rendement demeure insuffisant, avec un taux de patients dépistés à un stade tardif de la maladie (lymphocytes CD4 inférieurs à 200/mm3 ou sida) trop élevé (environ 29 %), et de nombreuses opportunités de dépistage manquées (consultation médicale, passage aux urgences hospitalières, chez le pharmacien). Parallèlement, le dépistage d’autres infections sexuellement transmissibles (IST) est indispensable au maintien d’une bonne santé sexuelle. Il comporte :
– dépistage de l’hépatite A et vaccination (épidémie dans les populations HSH) ;
– dépistage de l’hépatite B et vaccination ;
– dépistage de l’hépatite C (à adapter en fonction des pratiques sexuelles et de la prise de risques) et traitement ;
– dépistage de la syphilis (à adapter en fonction des pratiques sexuelles et de la prise de risques) et traitement ;
– dépistage des infections à Chlamydia trachomatis et gonocoque (à rechercher par PCR dans les urines, par prélèvement dans la gorge et l’anus, à adapter en fonction des pratiques sexuelles et de la prise de risques) et traitement.
En complément, la vaccination contre les papillomavirus (HPV) doit être proposée systématiquement aux jeunes femmes, idéalement avant le début de la sexualité et au plus tard à 19 ans, ainsi qu’aux HSH jusqu’à l’âge de 26 ans. Depuis début 2021, l’indication a été élargie pour les garçons de 11 à 14 révolus (rattrapage possible entre 15 et 19 ans révolus).
De nombreux moyens de prévention disponibles en France
Les outils de prévention disponibles en France font partie du dispositif de prévention diversifiée.
Le préservatif masculin joue un rôle majeur
Indispensable au dispositif de prévention diversifiée, le préservatif est le seul moyen de prévention contre le VIH qui protège des autres infections sexuellement transmissibles, accessible à tous, hommes et femmes, dans les relations entre hommes ou hétérosexuelles. De plus, il agit comme moyen de contraception pour les couples hétérosexuels et est peu onéreux. La promotion du préservatif, l’apprentissage de son usage dès le début de la sexualité et ses qualités préventives, y compris dans le cadre de la PrEP, restent donc d’actualité. Il est complémentaire des autres méthodes du dispositif de prévention de la transmission du VIH.
Quant au préservatif féminin, disponible depuis 1991, il est peu accessible et onéreux, ce qui rend sa promotion et son utilisation peu fréquentes (2-4 %).
Quant au préservatif féminin, disponible depuis 1991, il est peu accessible et onéreux, ce qui rend sa promotion et son utilisation peu fréquentes (2-4 %).
Les limites du préservatif
L’efficacité préventive théorique du préservatif est de 98 %, mais son efficacité réelle varie en fonction des IST, des pratiques sexuelles et du type de rapport (vaginal ou anal). La réduction du risque lié au VIH est de 80 % lors de rapports hétérosexuels et de 64 % au cours des rapports homosexuels masculins.3, 4 Cette perte d’efficacité est essentiellement due au mésusage du préservatif, aux ruptures, aux glissements ou à une lubrification insuffisante. De plus, le préservatif peut être vécu comme inconfortable ou associé à des représentations négatives, comme le multipartenariat ou la relation occasionnelle.La circoncision masculine
La circoncision masculine médicalisée et volontaire a montré une efficacité notable dans des pays à forte endémie et a donc sa place dans le cadre de la stratégie de prévention diversifiée. Néanmoins, les pouvoirs publics français n’ont pas retenu cette pratique.
Prévention chez les usagers de drogues par injection
Un ensemble d’interventions est mis à disposition des usagers de drogues par injection pour prévenir l’infection par le VIH : matériel à usage unique, traitements de substitution, information sur la réduction des risques, dépistage et traitement de l’infection par le VIH, des IST et des hépatites virales. Malgré ces dispositifs, des améliorations en termes d’accès à ces moyens sont attendues, en particulier dans les foyers, les centres de rétention et de détention.
Le traitement comme outil de prévention ou TasP
La prévention diversifiée a démontré de réels bénéfices avec, en tout premier lieu, le traitement antirétroviral comme outil (Treatment as Prevention [TasP]).5-7 L’objectif de ce dernier est de réduire la quantité de virus (mesurée par la charge virale plasmatique) présent dans l’organisme, pour restaurer et/ou maintenir le système immunitaire. Le traitement antirétroviral permet d’obtenir une charge virale plasmatique indétectable (quantité de virus inférieure à 50 copies ARN/mL) chez des personnes dépistées et traitées pour leur infection par le VIH. Il associe un bénéfice non seulement individuel, en termes de morbi-mortalité, avec une espérance de vie comparable à celle de la population générale (pour un individu dépisté, traité et dont la charge virale est contrôlée), mais aussi collectif, en prévention du risque de transmission virale. En d’autres termes, un patient dépisté pour une infection par le VIH, bénéficiant d’un traitement antirétroviral efficace, ayant un suivi régulier et dont la charge virale de VIH est indétectable depuis plus de six mois ne risque pas de transmettre la maladie (U = U : undetectable = untransmissible). Ce risque est négligeable, tant pour les couples hétérosexuels que pour les couples d’hommes ; cela constitue un argument majeur afin de promouvoir le dépistage précoce et l’accès à un traitement immédiat (en anglais, Test and Treat), central dans la stratégie globale de prévention de la transmission du VIH.
fig. 3 ).
Quelles sont les limites du TasP ?
Le traitement universel comme outil de prévention de la transmission du VIH se heurte aux inégalités d’accès aux soins, notamment dans les pays à ressources limitées, au délai encore trop long entre l’infection par le VIH et son diagnostic (délai médian de 3,3 ans [écart interquartile : 1,2-5,7]), au délai entre le diagnostic et la mise sous traitement (délai médian de 1 à 5 mois) et enfin au délai entre la mise sous traitement et le contrôle de la charge virale du VIH (délai médian de 5 mois).8 À cette cascade de prises en charge qui retarde les objectifs fixés par l’ONUSIDA (90-90-90) s’ajoutent les diagnostics tardifs (on parle d’épidémie cachée), qui entraînent une perte de chance, à la fois pour l’individu et pour la collectivité (Prévention de la transmission mère-enfant (PTME)
Aujourd’hui, la majorité des femmes infectées par le VIH suivent un traitement antirétroviral avant de débuter une grossesse.9 Proposer un dépistage de l’infection par le VIH à toute femme enceinte est une obligation légale, et le traitement antirétroviral, quel que soit le terme de la grossesse, est le cas échéant indiqué. On retiendra que, plus la charge virale de la mère est élevée, plus le risque de transmission de l’infection VIH à l’enfant l’est. En revanche, le risque de transmission est quasi nul chez une femme dépistée, suivie, traitée et dont la charge virale est contrôlée (stratégie du TasP).
Limites du dispositif : encore trop d’enfants infectés
La primo-infection durant la grossesse ou l’allaitement, le diagnostic tardif de l’infection à VIH chez la femme enceinte ou encore le défaut d’observance du traitement antirétroviral constituent un risque majeur de transmission du VIH de la mère à l’enfant. L’accès des femmes au dépistage et aux traitements, en particulier dans les pays à faibles ressources, reste insuffisant, avec 1,8 million d’enfants de moins de 15 ans infectés par le VIH en 2020.Traitement post-exposition (TPE)
Le traitement post-exposition fait partie intégrante de la stratégie de prévention diversifiée, pour réduire le risque d’infection par le VIH à l’échelle individuelle. Il s’agit d’un traitement antirétroviral, introduit idéalement dans les 4 heures et avant 48 heures après une prise de risque élevé et qui sera poursuivi pendant 4 semaines.
Les limites du TPE
Il est important de rappeler qu’en cas d’exposition sexuelle, le risque de contamination par le VIH varie en fonction des pratiques sexuelles (risque 35 fois plus élevé du rapport anal réceptif comparé au rapport vaginal réceptif) et de la charge virale du patient source (plus sa charge virale plasmatique est élevée, plus le risque augmente). Le TPE se heurte à un retard de prise en charge (supérieur à 72 heures après l’exposition), à un défaut de communication au grand public par les autorités sanitaires compétentes et à un manque de formation à l’évaluation des risques des professionnels de santé.Prophylaxie préexposition : des antirétroviraux en prévention
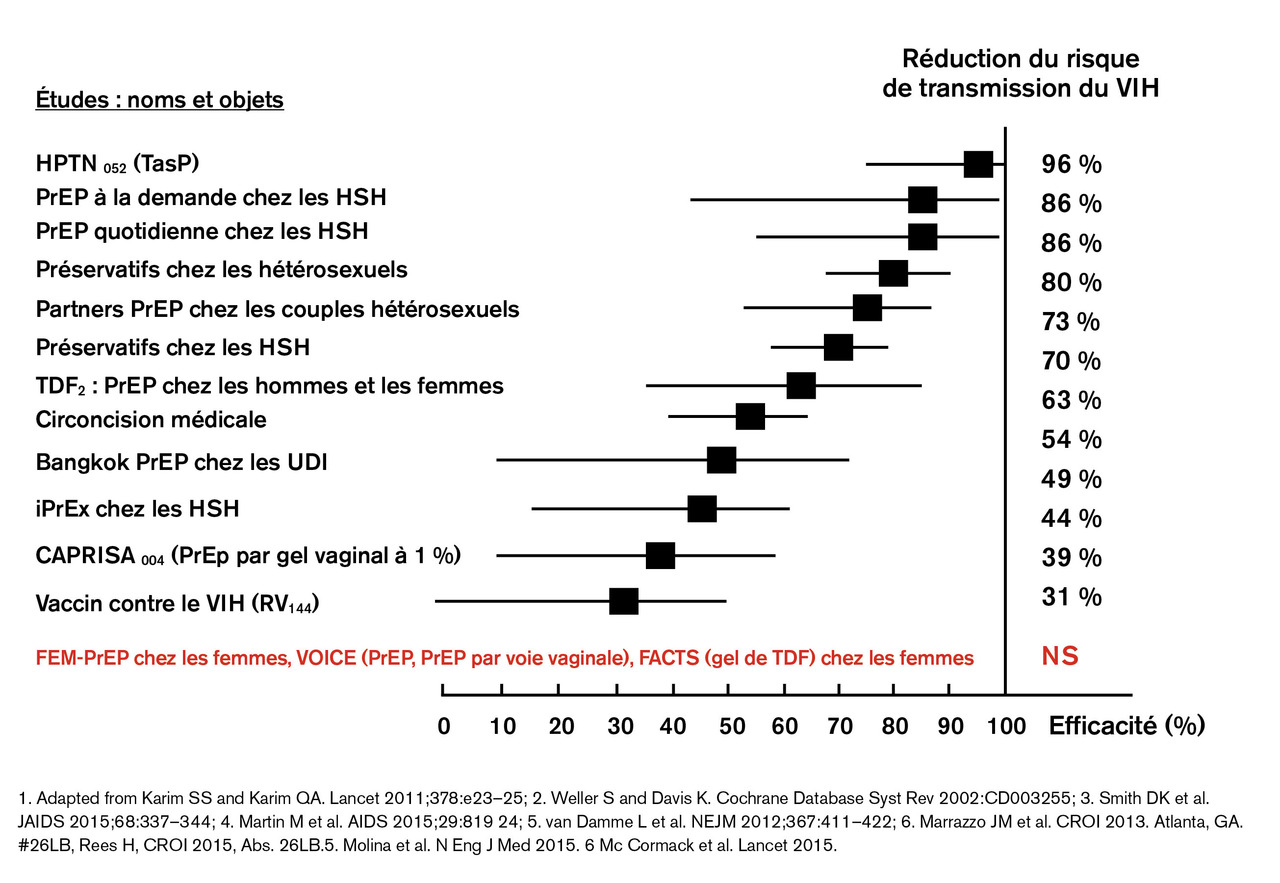
La prophylaxie préexposition10, 11, ou PrEP, consiste à utiliser des antirétroviraux en prévention de l’infection par le VIH, chez des personnes non infectées (v. focus p. 957 ). Cet outil de la prévention diversifiée a démontré son excellente efficacité pour réduire l’incidence de l’infection à VIH dans des populations clés à forte incidence, notamment les HSH (fig. 4 ). Dès lors, la PrEP a été reconnue par les autorités sanitaires comme un pilier de la stratégie de prévention de l’infection par le VIH et bénéficie à ce titre d’un remboursement intégral. À ce jour, près de 32 000 personnes, majoritairement des HSH, ont bénéficié de la PrEP. Pour autant, son usage reste insuffisant. Une enquête récente auprès des HSH a montré que, parmi les individus éligibles à la PrEP, seule 1 personne sur 5 l’utilise ; les facteurs limitants sont le manque d’information sur l’outil, les difficultés d’accès à la PrEP en dehors des grandes villes ou encore la sous-estimation des prises de risques par des individus qui ne se sentent pas concernés. Sous l’impulsion du Conseil national du sida12, un certain nombre de mesures sanitaires sont actuellement débattues ou ont récemment été prises afin de pallier ces insuffisances :
– élargissement des indications de la PrEP à tous et toutes, comme un choix de prévention pour se protéger du VIH ;
– élargissement des campagnes de promotion de la PrEP non seulement aux populations cibles mais aussi à l’ensemble de la population ;
– élargissement de l’offre avec ouverture de la primoprescription de la PrEP à TOUS les médecins ;
– renforcement de la formation en santé sexuelle des professionnels de santé.
– élargissement des indications de la PrEP à tous et toutes, comme un choix de prévention pour se protéger du VIH ;
– élargissement des campagnes de promotion de la PrEP non seulement aux populations cibles mais aussi à l’ensemble de la population ;
– élargissement de l’offre avec ouverture de la primoprescription de la PrEP à TOUS les médecins ;
– renforcement de la formation en santé sexuelle des professionnels de santé.
Limites : le recours à la PrEP reste sous optimal
Ce dispositif, déployé par les autorités sanitaires françaises depuis 2016, constitue un outil majeur dans la stratégie de lutte contre le VIH mais reste sous-optimal. Bien que majoritairement utilisé par les HSH, son utilisation est insuffisante dans cette population cible et nécessiterait une plus grande promotion de la part des pouvoirs publics. De plus, il semblerait essentiel d’élargir l’accès du public à la PrEP et ses indications, idéalement à toute personne sexuellement active, et de former un maximum de professionnels de santé en santé sexuelle.Et dans le reste du monde ?
Dans le cadre de la pandémie mondiale, l’ONUSIDA avait fixé pour 2020 les objectifs 90-90-90, à savoir 90 % de PvVIH diagnostiquées, 90 % des personnes diagnostiquées sous traitement antirétroviral efficace et 90 % des personnes traitées par antirétroviraux avec une charge virale contrôlée. Ces objectifs ambitieux n’ont à ce jour pas été atteints. Avec plus de 1,5 million de nouvelles contaminations en 2020 dans le monde, l’objectif de réduire ce nombre à 500 000 nouveaux cas, fixé par ONUSIDA, est loin d’être atteint. De nouvelles associations thérapeutiques par voie injectable de longue durée d’action sont actuellement en développement et pourraient, si leur coût le permet, offrir un réel bénéfice en termes de mise sous traitement, d’obtention du contrôle virologique et de réduction de la morbidité liée au VIH, notamment dans des pays à forte endémie, comme en Afrique.13
Enfin, en matière de prévention, l’ONUSIDA a fixé de nouveaux objectifs : 95-95-95, à savoir 95 % des populations clés ont accès à une prévention appropriée, 95 % des femmes enceintes ou allaitantes vivant avec VIH ont une charge virale contrôlée, 95 % des enfants exposés au VIH seront testés d’ici à 2025. Bien sûr, d’énormes disparités sont constatées en fonction des pays, reflets des inégalités entre les pays développés et ceux à ressources limitées, des inégalités entre les sexes, et de la stigmatisation, voire la criminalisation, des populations clés. Aussi, le rapport des Nations unies souligne que les pays dotés de lois et de politiques progressistes et de systèmes de santé forts ont obtenu les meilleurs résul-tats. A contrario, les pays dotés de lois répressives, qui n’adoptent pas une approche fondée sur les droits en matière de santé et qui criminalisent les populations clés, sont ceux dont les résultats sont les moins bons.
La pandémie mondiale de Covid-19, qui a concerné tous les individus, a affecté plus gravement les populations défavorisées, amplifié les inégalités socio-économiques, avec, par conséquent, un retard certain dans les efforts internationaux pour l’accès de tous au droit à la santé.
Enfin, en matière de prévention, l’ONUSIDA a fixé de nouveaux objectifs : 95-95-95, à savoir 95 % des populations clés ont accès à une prévention appropriée, 95 % des femmes enceintes ou allaitantes vivant avec VIH ont une charge virale contrôlée, 95 % des enfants exposés au VIH seront testés d’ici à 2025. Bien sûr, d’énormes disparités sont constatées en fonction des pays, reflets des inégalités entre les pays développés et ceux à ressources limitées, des inégalités entre les sexes, et de la stigmatisation, voire la criminalisation, des populations clés. Aussi, le rapport des Nations unies souligne que les pays dotés de lois et de politiques progressistes et de systèmes de santé forts ont obtenu les meilleurs résul-tats. A contrario, les pays dotés de lois répressives, qui n’adoptent pas une approche fondée sur les droits en matière de santé et qui criminalisent les populations clés, sont ceux dont les résultats sont les moins bons.
La pandémie mondiale de Covid-19, qui a concerné tous les individus, a affecté plus gravement les populations défavorisées, amplifié les inégalités socio-économiques, avec, par conséquent, un retard certain dans les efforts internationaux pour l’accès de tous au droit à la santé.
Références
1. ONUSIDA. Fiche d’information 2021. Statistiques mondiales sur le VIH. 2020. Disponible sur : https://www.unaids.org/sites/default/files/media_asset/UNAIDS_FactSheet_fr.pdf
2. CNS. Recommandation du groupe d’experts. Prise en charge médicale des personnes vivant avec le VIH. Prévention et dépistage. 2018. Disponible sur : https://cns.sante.fr/wp-content/uploads/2018/04/experts-vih_prevention-depistage.pdf
3. Stromdahl S, Hickson F, Pharris A, Sabido M, Baral S, Thorson A. A systematic review of evidence to inform HIV prevention interventions among men who have sex with men in Europe. Euro Surveill. 2015;20(15):21096.
4. Weller S, Davis K. Condom effectiveness in reducing heterosexual HIV transmission. Cochrane Database Syst Rev. 2002;(1):CD003255.
5. Quinn TC, Wawer MJ, Sewankambo N, Serwadda D, Li C, Wabwire-Mangen F, et al. Viral load and heterosexual transmission of human immunodeficiency virus type 1. Rakai Project Study Group. N Engl J Med. 2000;342(13):921-9.
6. Reynolds SJ, Makumbi F, Nakigozi G, Kagaayi J, Gray RH, Wawer M, et al. HIV-1 transmission among HIV-1 discordant couples before and after the introduction of antiretroviral therapy. AIDS. 2011;25(4):473-7.
7. Rodger AJ, Cambiano V, Bruun T, Vernazza P, Collins S, Degen O, et al. Risk of HIV transmission through condomless sex in serodifferent gay couples with the HIV-positive partner taking suppressive antiretroviral therapy (PARTNER): final results of a multicentre, prospective, observational study. Lancet. 2019;393(10189):2428-38.
8. Supervie V, Marty L, Lacombe JM, Dray-Spira R, Costagliola D, FHDH-ANRS CO4 study group. Looking Beyond the Cascade of HIV Care to End the AIDS Epidemic: Estimation of the Time Interval From HIV Infection to Viral Suppression. J Acquir Immune Defic Syndr. 2016;73(3):348-55.
9. Garcia PM, Kalish LA, Pitt J, Minkoff H, Quinn TC, Burchett SK, et al. Maternal levels of plasma human immunodeficiency virus type 1 RNA and the risk of perinatal transmission. Women and Infants Transmission Study Group. N Engl J Med. 1999;341(6):394-402.
10. McCormack S, Dunn DT, Desai M, Dolling DI, Gafos M, Gilson R, et al. Pre-exposure prophylaxis to prevent the acquisition of HIV-1 infection (PROUD): effectiveness results from the pilot phase of a pragmatic open-label randomised trial. Lancet. 2016;387(10013):53-60.
11. Molina JM, Capitant C, Spire B, Pialoux G, Cotte L, Charreau I, et al. On-Demand Preexposure Prophylaxis in Men at High Risk for HIV-1 Infection. N Engl J Med. 2015;373(23):2237-46.
12. CNS. Avis sur la place de la PrEP dans la prévention du VIH en France : changer de paradigme, changer d’échelle. 2021. Disponible sur : https://cns.sante.fr/wp-content/uploads/2021/05/2021-04-15_avis_fr_prevention.pdf
13. Phillips AN, Bansi-Matharu L, Cambiano V, Ehrenkranz P, Serenata C, Venter F, et al. The potential role of long-acting injectable cabotegravir-rilpivirine in the treatment of HIV in sub-Saharan Africa: a modelling analysis. Lancet Glob Health. 2021;9(5):e620-e7.
2. CNS. Recommandation du groupe d’experts. Prise en charge médicale des personnes vivant avec le VIH. Prévention et dépistage. 2018. Disponible sur : https://cns.sante.fr/wp-content/uploads/2018/04/experts-vih_prevention-depistage.pdf
3. Stromdahl S, Hickson F, Pharris A, Sabido M, Baral S, Thorson A. A systematic review of evidence to inform HIV prevention interventions among men who have sex with men in Europe. Euro Surveill. 2015;20(15):21096.
4. Weller S, Davis K. Condom effectiveness in reducing heterosexual HIV transmission. Cochrane Database Syst Rev. 2002;(1):CD003255.
5. Quinn TC, Wawer MJ, Sewankambo N, Serwadda D, Li C, Wabwire-Mangen F, et al. Viral load and heterosexual transmission of human immunodeficiency virus type 1. Rakai Project Study Group. N Engl J Med. 2000;342(13):921-9.
6. Reynolds SJ, Makumbi F, Nakigozi G, Kagaayi J, Gray RH, Wawer M, et al. HIV-1 transmission among HIV-1 discordant couples before and after the introduction of antiretroviral therapy. AIDS. 2011;25(4):473-7.
7. Rodger AJ, Cambiano V, Bruun T, Vernazza P, Collins S, Degen O, et al. Risk of HIV transmission through condomless sex in serodifferent gay couples with the HIV-positive partner taking suppressive antiretroviral therapy (PARTNER): final results of a multicentre, prospective, observational study. Lancet. 2019;393(10189):2428-38.
8. Supervie V, Marty L, Lacombe JM, Dray-Spira R, Costagliola D, FHDH-ANRS CO4 study group. Looking Beyond the Cascade of HIV Care to End the AIDS Epidemic: Estimation of the Time Interval From HIV Infection to Viral Suppression. J Acquir Immune Defic Syndr. 2016;73(3):348-55.
9. Garcia PM, Kalish LA, Pitt J, Minkoff H, Quinn TC, Burchett SK, et al. Maternal levels of plasma human immunodeficiency virus type 1 RNA and the risk of perinatal transmission. Women and Infants Transmission Study Group. N Engl J Med. 1999;341(6):394-402.
10. McCormack S, Dunn DT, Desai M, Dolling DI, Gafos M, Gilson R, et al. Pre-exposure prophylaxis to prevent the acquisition of HIV-1 infection (PROUD): effectiveness results from the pilot phase of a pragmatic open-label randomised trial. Lancet. 2016;387(10013):53-60.
11. Molina JM, Capitant C, Spire B, Pialoux G, Cotte L, Charreau I, et al. On-Demand Preexposure Prophylaxis in Men at High Risk for HIV-1 Infection. N Engl J Med. 2015;373(23):2237-46.
12. CNS. Avis sur la place de la PrEP dans la prévention du VIH en France : changer de paradigme, changer d’échelle. 2021. Disponible sur : https://cns.sante.fr/wp-content/uploads/2021/05/2021-04-15_avis_fr_prevention.pdf
13. Phillips AN, Bansi-Matharu L, Cambiano V, Ehrenkranz P, Serenata C, Venter F, et al. The potential role of long-acting injectable cabotegravir-rilpivirine in the treatment of HIV in sub-Saharan Africa: a modelling analysis. Lancet Glob Health. 2021;9(5):e620-e7.