Les infections cutanées graves et tout particulièrement les dermohypodermites bactériennes nécrosantes (DHBN) sont des infections qui peuvent mettre en jeu le pronostic vital et nécessitent, dans la majorité des cas, une hospitalisation en réanimation. La prise en charge repose sur trois éléments majeurs : la chirurgie en urgence pour débridement des tissus nécrotiques, une antibiothérapie probabiliste précoce et le traitement des défaillances d’organes si elles sont présentes.
Le panorama microbiologique des DHBN conditionne les traitements antimicrobiens.
Le panorama microbiologique des DHBN conditionne les traitements antimicrobiens.
La microbiologie dépend de nombreux critères
Infection de type 1 ou 2, localisation et contexte sont autant d’éléments permettant de classer la DHBN en fonction des germes probablement en cause. La microbiologie de ces infections est résumée dans le tableau .
Deux types de DHBN
Deux types de DHBN sont couramment différenciés :
– les DHBN de type 1, majoritaires, la plupart du temps plurimicrobiennes, impliquent toutes sortes d’espèces anaérobies ou aérobies et en particulier des bactéries à Gram positif, des bactéries à Gram négatif de la classe des entérobactéries et des germes anaérobies ;
– les infections de type 2 (environ 30 % des cas) concernent des infections monomicrobiennes impliquant majoritairement le streptocoque du groupe A (Streptococcus pyogenes). Ce dernier est associé à une mortalité moindre, comme le rapporte la plus grande étude prospective internationale récente sur les DHBN.1
– les DHBN de type 1, majoritaires, la plupart du temps plurimicrobiennes, impliquent toutes sortes d’espèces anaérobies ou aérobies et en particulier des bactéries à Gram positif, des bactéries à Gram négatif de la classe des entérobactéries et des germes anaérobies ;
– les infections de type 2 (environ 30 % des cas) concernent des infections monomicrobiennes impliquant majoritairement le streptocoque du groupe A (Streptococcus pyogenes). Ce dernier est associé à une mortalité moindre, comme le rapporte la plus grande étude prospective internationale récente sur les DHBN.1
Des germes différents selon la localisation de l’infection
En dehors de cette classification, les DHBN sont également classées en fonction de la localisation de l’infection, avec une écologie qui diffère.1-3
L’atteinte des membres est la plus fréquente et peut être pluri- ou monomicrobienne, avec en particulier une part importante d’infections à Streptococcus pyogenes.4 L’atteinte plurimicrobienne est prédominante chez des patients ayant de nombreuses comorbidités et notamment chez le patient diabétique.
Les germes retrouvés dans les atteintes abdomino-périnéales, couramment dénommées gangrène de Fournier, sont ceux présents dans le tractus digestif bas, plurimicrobien, avec une part importante d’anaérobies ; c’est aussi dans cette population que l’on observe les entérobactéries productrices de bêtalactamases à spectre élargi (BLSE).
Enfin, dans les atteintes cervicales, les infections polymicrobiennes sont prédominantes, avec des bactéries à Gram positif présentes au niveau de la peau et de la sphère oropharyngée (Streptococcus sp., Staphylococcus aureus) mais aussi des germes anaérobies tels que Bacteroides fragilis.
L’atteinte des membres est la plus fréquente et peut être pluri- ou monomicrobienne, avec en particulier une part importante d’infections à Streptococcus pyogenes.4 L’atteinte plurimicrobienne est prédominante chez des patients ayant de nombreuses comorbidités et notamment chez le patient diabétique.
Les germes retrouvés dans les atteintes abdomino-périnéales, couramment dénommées gangrène de Fournier, sont ceux présents dans le tractus digestif bas, plurimicrobien, avec une part importante d’anaérobies ; c’est aussi dans cette population que l’on observe les entérobactéries productrices de bêtalactamases à spectre élargi (BLSE).
Enfin, dans les atteintes cervicales, les infections polymicrobiennes sont prédominantes, avec des bactéries à Gram positif présentes au niveau de la peau et de la sphère oropharyngée (Streptococcus sp., Staphylococcus aureus) mais aussi des germes anaérobies tels que Bacteroides fragilis.
Le contexte est aussi à prendre en considération
Par ailleurs, la microbiologie dépend également de comorbidités particulières telles que le diabète ou la cirrhose, du terrain et des circonstances (morsure, toxicomanie…).5
Prélèvements microbiologiques profonds et multiples
Dans les DHBN, la proportion d’hémocultures positives varie de 10 à 30 % selon les études, ce qui implique la nécessité de réaliser ces examens précocement et de manière répétée.6, 7
Des prélèvements superficiels par écouvillonnage simple des lésions ne doivent pas être réalisés, car l’écologie retrouvée en superficie ne reflète pas celle retrouvée au niveau des tissus profonds.8
Pour maximiser la documentation microbiologique afin de guider l’antibiothérapie définitive, il est essentiel de réaliser des prélèvements microbiologiques profonds et multiples lors de la chirurgie première de débridement des tissus nécrotiques.9, 10
Si la prise en charge nécessite plusieurs reprises chirurgicales, de nouveaux prélèvements infectieux profonds doivent être réalisés car l’écologie et les niveaux de résistance peuvent varier au cours du temps.11
Des prélèvements superficiels par écouvillonnage simple des lésions ne doivent pas être réalisés, car l’écologie retrouvée en superficie ne reflète pas celle retrouvée au niveau des tissus profonds.8
Pour maximiser la documentation microbiologique afin de guider l’antibiothérapie définitive, il est essentiel de réaliser des prélèvements microbiologiques profonds et multiples lors de la chirurgie première de débridement des tissus nécrotiques.9, 10
Si la prise en charge nécessite plusieurs reprises chirurgicales, de nouveaux prélèvements infectieux profonds doivent être réalisés car l’écologie et les niveaux de résistance peuvent varier au cours du temps.11
Antibiothérapie à large spectre et possible avant la chirurgie
Il n’y a aucune étude randomisée contrôlée multicentrique dans ce domaine. Néanmoins, en extrapolant en partie les données existantes dans d’autres pathologies et en particulier dans le sepsis, de nombreuses sociétés savantes recommandent l’administration précoce d’une antibiothérapie adaptée en association avec une prise en charge chirurgicale précoce.9, 10, 12 Une étude rétrospective récente a mis en exergue le fait que l’administration précoce d’une antibiothérapie avant la prise en charge chirurgicale n’induit pas de négativité des prélèvements microbiologiques profonds ni de résistance bactérienne.13 Dans ce contexte, avec la réalisation précoce et répétée d’hémocultures, il semble raisonnable d’administrer l’antibiothérapie probabiliste le plus rapidement possible, et cela, même avant la chirurgie.
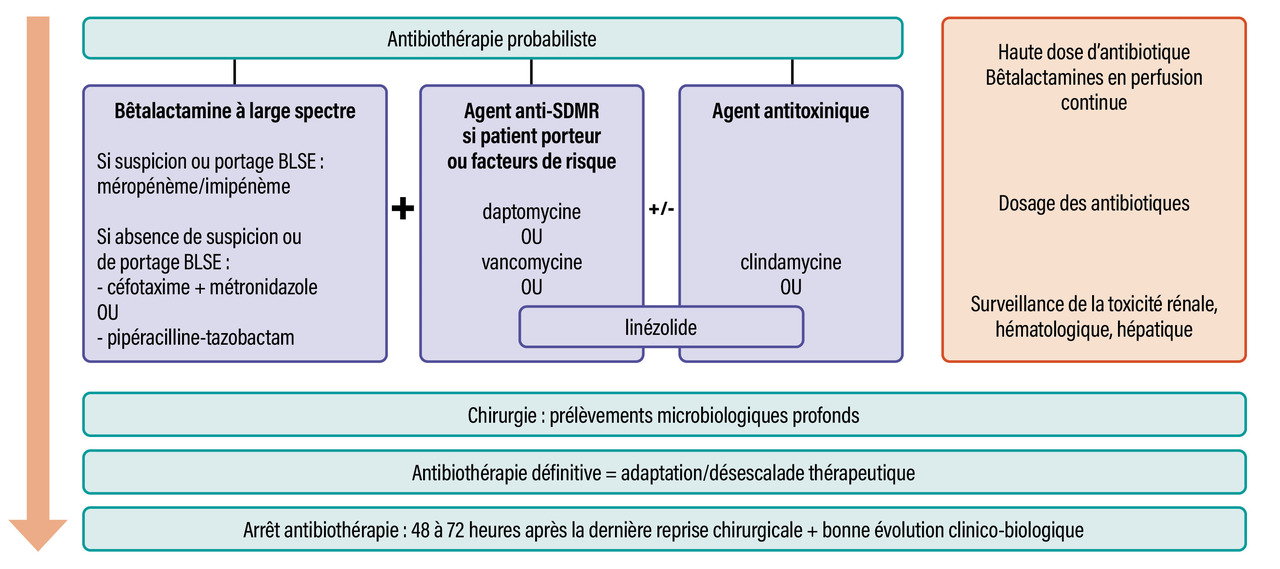
Une grande partie des DHBN étant polymicrobiennes, la majorité des sociétés savantes recommande l’administration d’une antibiothérapie probabiliste intraveineuse à large spectre.9, 10 Une bêtalactamine à large spectre, plus ou moins associée au métronidazole (imipénème, méropénème, pipéracilline-tazobactam, céfotaxime), semble le choix le plus rationnel. La vancomycine ou le linézolide doivent être ajoutés en cas de suspicion de Staphylococcus aureus résistant à la méticilline (SDMR) ; la mauvaise diffusion de la vancomycine au niveau des tissus mous fait privilégier le linézolide.
Ces choix doivent évidemment prendre en compte l’écologie locale de la structure de soins, les facteurs de risque de bactéries à Gram négatif résistantes et du portage (de plus en plus rare en France métropolitaine) de SDMR. Des données épidémiologiques d’outre-mer suggèrent une forte fréquence de SDMR avec une proportion importante de souches productrices de leucocidine de Panton-Valentine.14 En cas de risque accru de présence de bactéries à Gram négatif résistantes (plus fréquemment des entérobactéries BLSE), l’utilisation de carbapénèmes (méropénème ou imipénème) est ainsi recommandée. Les bactéries à Gram négatif et Gram positif résistantes peuvent aussi être traitées par de la tigécycline.15 L’utilisation d’aminosides doit se discuter en présence d’un état de choc septique, même si leur utilisation reste controversée dans les DHBN, compte tenu de leur mauvaise diffusion tissulaire.
Une grande partie des DHBN étant polymicrobiennes, la majorité des sociétés savantes recommande l’administration d’une antibiothérapie probabiliste intraveineuse à large spectre.9, 10 Une bêtalactamine à large spectre, plus ou moins associée au métronidazole (imipénème, méropénème, pipéracilline-tazobactam, céfotaxime), semble le choix le plus rationnel. La vancomycine ou le linézolide doivent être ajoutés en cas de suspicion de Staphylococcus aureus résistant à la méticilline (SDMR) ; la mauvaise diffusion de la vancomycine au niveau des tissus mous fait privilégier le linézolide.
Ces choix doivent évidemment prendre en compte l’écologie locale de la structure de soins, les facteurs de risque de bactéries à Gram négatif résistantes et du portage (de plus en plus rare en France métropolitaine) de SDMR. Des données épidémiologiques d’outre-mer suggèrent une forte fréquence de SDMR avec une proportion importante de souches productrices de leucocidine de Panton-Valentine.14 En cas de risque accru de présence de bactéries à Gram négatif résistantes (plus fréquemment des entérobactéries BLSE), l’utilisation de carbapénèmes (méropénème ou imipénème) est ainsi recommandée. Les bactéries à Gram négatif et Gram positif résistantes peuvent aussi être traitées par de la tigécycline.15 L’utilisation d’aminosides doit se discuter en présence d’un état de choc septique, même si leur utilisation reste controversée dans les DHBN, compte tenu de leur mauvaise diffusion tissulaire.
Adapter le traitement à l’antibiogramme
Dès réception des analyses microbiologiques des prélèvements chirurgicaux, la désescalade thérapeutique est essentielle. Cette dernière doit néanmoins être nuancée par l’état clinique du patient et le besoin d’une éventuelle reprise chirurgicale pour un nouveau débridement.
En cas d’infection de type 2 à Streptococcus pyogenes, une biantibiothérapie par pénicilline et clindamycine est à privilégier.10
En cas d’infection de type 1, la désescalade doit couvrir l’ensemble des germes retrouvés et doit aussi comprendre une couverture antianaérobies. La prise en charge antibiotique des DHBN est illustrée dans lafigure .
En cas d’infection de type 2 à Streptococcus pyogenes, une biantibiothérapie par pénicilline et clindamycine est à privilégier.10
En cas d’infection de type 1, la désescalade doit couvrir l’ensemble des germes retrouvés et doit aussi comprendre une couverture antianaérobies. La prise en charge antibiotique des DHBN est illustrée dans la
Au moins dix jours d’antibiothérapie ?
À l’instar du choix des traitements anti-infectieux, il n’existe aucune étude ayant évalué l’impact de la durée du traitement chez des patients ayant une DHBN. Les données de la littérature sont assez hétérogènes, certains auteurs privilégient une durée globale de traitement d’environ huit à dix jours alors que d’autres considèrent que l’arrêt des antibiotiques est acceptable quarante-huit à soixante-douze heures après la dernière reprise chirurgicale en l’absence de signe d’inflammation systémique.10,16,17 Néanmoins, une étude américaine récente a montré qu’une durée d’antibiothérapie prolongée (supérieure à 10 jours) était associée à un meilleur taux de guérison.18
Pharmacocinétique imposant des doses élevées d’antibiotiques
Plusieurs facteurs influencent l’efficacité des antibiotiques administrés. Au cours des états septiques, le volume de distribution étant drastiquement augmenté, il est souvent nécessaire d’augmenter les doses des antibiotiques.
De plus, la dysfonction majeure de la microcirculation tissulaire avec des territoires régionaux mal perfusés empêche la diffusion des antibiotiques. La pénétration des antibiotiques dans les zones de nécrose a été extrêmement peu évaluée dans les DHBN. Des extrapolations ont été faites avec les coulées de nécrose des pancréatites aiguës où une corrélation inverse est observée entre la pénétration des antibiotiques et le pourcentage de nécrose, le degré d’inflammation et la dysfonction microcirculatoire.19 Ainsi, dans ce contexte d’altération de la perfusion tissulaire majeure, de diffusion hasardeuse dans les tissus et de présence de nécrose, il est important d’administrer des doses élevées d’antibiotiques.
Il est recommandé de vérifier de manière régulière les concentrations plasmatiques des antibiotiques, ainsi que la tolérance rénale, hématologique ou hépatique.
Dans le cas particulier des bêtalactamines, l’administration intraveineuse continue permet une meilleure efficacité.
De plus, la dysfonction majeure de la microcirculation tissulaire avec des territoires régionaux mal perfusés empêche la diffusion des antibiotiques. La pénétration des antibiotiques dans les zones de nécrose a été extrêmement peu évaluée dans les DHBN. Des extrapolations ont été faites avec les coulées de nécrose des pancréatites aiguës où une corrélation inverse est observée entre la pénétration des antibiotiques et le pourcentage de nécrose, le degré d’inflammation et la dysfonction microcirculatoire.19 Ainsi, dans ce contexte d’altération de la perfusion tissulaire majeure, de diffusion hasardeuse dans les tissus et de présence de nécrose, il est important d’administrer des doses élevées d’antibiotiques.
Il est recommandé de vérifier de manière régulière les concentrations plasmatiques des antibiotiques, ainsi que la tolérance rénale, hématologique ou hépatique.
Dans le cas particulier des bêtalactamines, l’administration intraveineuse continue permet une meilleure efficacité.
Traitements du choc toxique
Le syndrome du choc toxique est une infection fulminante induite par des bactéries à Gram positif, typiquement Staphylococcus aureus, Streptococcus pyogenes ou encore Clostridium sp.20 Par exemple, au cours des DHBN, Streptococcus pyogenes est pourvoyeur dans un cas sur deux de ce syndrome. L’incidence reste néanmoins très faible (moins de 1 cas par an pour 100 000 habitants) mais la morbi-mortalité peut être extrêmement importante.
Les données, essentiellement issues d’étude in vitro, montrent que certaines molécules telles que la vancomycine, la clindamycine et le linézolide réduisent la production du superantigène impliqué dans la genèse de ce choc.21 Des cas rapportés ont décrit des effets intéressants sur le devenir des patients, mais il n’existe pas d’étude évaluant ces thérapies dans le cadre de DHBN avec syndrome du choc toxique.
Néanmoins, compte tenu des résultats des études précliniques, une grande partie des sociétés savantes recommande leur utilisation systématique en probabiliste, associée aux antibiotiques standard et en particulier aux bêtalactamines.7
La faible pénétration tissulaire de la vancomycine doit probablement faire privilégier les deux autres molécules (clindamycine ou linézolide). La clindamycine est la molécule la plus utilisée dans le monde et son efficacité est en partie due à sa bonne diffusion tissulaire, sa bactéricidie, sa propension à éliminer la production de toxines, son effet postantibiotique et sa capacité à réguler la synthèse de cytokines.22 L’usage de cette molécule doit être mis en balance avec sa faible activité en cas de souches de staphylocoques résistants à la méticilline et ses effets indésirables digestifs, dont les colites pseudomembraneuses. Le linézolide a globalement les mêmes effets protecteurs que la clindamycine. Son effet inhibiteur sur les souches de staphylocoques productrices de leucocidine de Panton-Valentine (PVL) et des toxines TSST-1 (toxic shock syndrom toxin) et alpha est extrêmement intéressant. De plus, la molécule reste généralement active sur les souches résistantes à la méticilline.
Le rôle des immunoglobulines intraveineuses spécifiques dans le traitement des DHBN demeure controversé. Même si les propriétés d’opsonisation des bactéries et surtout de neutralisation des toxines semblent séduisantes, une étude randomisée chez des patients souffrant de DHBN n’a pas montré de bénéfice en matière de mortalité.23 Néanmoins, une méta-analyse s’intéressant à l’impact des immunoglobulines chez des patients traités avec de la clindamycine dans un contexte de syndrome du choc toxique (avec ou sans DHBN associée) a mis en évidence une diminution significative de la mortalité.24
En l’absence de données plus solides, il semble difficile de recommander à l’heure actuelle l’utilisation systématique des immunoglobulines intraveineuses dans la population spécifique des DHBN.
Les données, essentiellement issues d’étude in vitro, montrent que certaines molécules telles que la vancomycine, la clindamycine et le linézolide réduisent la production du superantigène impliqué dans la genèse de ce choc.21 Des cas rapportés ont décrit des effets intéressants sur le devenir des patients, mais il n’existe pas d’étude évaluant ces thérapies dans le cadre de DHBN avec syndrome du choc toxique.
Néanmoins, compte tenu des résultats des études précliniques, une grande partie des sociétés savantes recommande leur utilisation systématique en probabiliste, associée aux antibiotiques standard et en particulier aux bêtalactamines.7
La faible pénétration tissulaire de la vancomycine doit probablement faire privilégier les deux autres molécules (clindamycine ou linézolide). La clindamycine est la molécule la plus utilisée dans le monde et son efficacité est en partie due à sa bonne diffusion tissulaire, sa bactéricidie, sa propension à éliminer la production de toxines, son effet postantibiotique et sa capacité à réguler la synthèse de cytokines.22 L’usage de cette molécule doit être mis en balance avec sa faible activité en cas de souches de staphylocoques résistants à la méticilline et ses effets indésirables digestifs, dont les colites pseudomembraneuses. Le linézolide a globalement les mêmes effets protecteurs que la clindamycine. Son effet inhibiteur sur les souches de staphylocoques productrices de leucocidine de Panton-Valentine (PVL) et des toxines TSST-1 (toxic shock syndrom toxin) et alpha est extrêmement intéressant. De plus, la molécule reste généralement active sur les souches résistantes à la méticilline.
Le rôle des immunoglobulines intraveineuses spécifiques dans le traitement des DHBN demeure controversé. Même si les propriétés d’opsonisation des bactéries et surtout de neutralisation des toxines semblent séduisantes, une étude randomisée chez des patients souffrant de DHBN n’a pas montré de bénéfice en matière de mortalité.23 Néanmoins, une méta-analyse s’intéressant à l’impact des immunoglobulines chez des patients traités avec de la clindamycine dans un contexte de syndrome du choc toxique (avec ou sans DHBN associée) a mis en évidence une diminution significative de la mortalité.24
En l’absence de données plus solides, il semble difficile de recommander à l’heure actuelle l’utilisation systématique des immunoglobulines intraveineuses dans la population spécifique des DHBN.
La microbiologie variée des DHBN complexifie le choix de l’antibiothérapie
Avec la chirurgie urgente et le traitement des défaillances d’organes, l’antibiothérapie est indispensable dans la prise en charge des DHBN. La microbiologie des DHBN étant variée, souvent polymicrobienne et dynamique à la fois dans le temps et au niveau des localisations, le choix des molécules est complexe. L’antibiothérapie probabiliste doit être précoce, intraveineuse, bactéricide, à large spectre et doit ainsi couvrir à la fois les bactéries à Gram positif, à Gram négatif et les anaérobies. L’adjonction d’un traitement antitoxinique systématique semble également raisonnable. L’écologie locale et les facteurs de risque de bactéries résistantes sont également à prendre en considération dans ce choix. L’utilisation de doses élevées, en perfusion continue, et une surveillance thérapeutique des antibiotiques sont aussi des éléments importants à prendre en compte. Enfin, une désescalade du spectre antibiotique adapté au résultat microbiologique est indispensable.
Références
1. INFECT study group, Madsen MB, Skrede S, Perner A, Arnell P, Nekludov M, et al. Patient’s characteristics and outcomes in necrotising soft-tissue infections: Results from a Scandinavian, multicentre, prospective cohort study. Intensive Care Med 2019;45(9):1241‑51.
2. Stevens DL, Bryant AE. Necrotizing soft-tissue infections. Longo DL, éditeur. N Engl J Med 2017;377(23):2253‑65.
3. Eckmann C, Montravers P. Current management of necrotizing soft-tissue infections. Curr Opin Infect Dis 2021;34(2):89‑95.
4. Horn DL, Roberts EA, Shen J, Chan JD, Bulger EM, Weiss NS, et al. Outcomes of β-hemolytic streptococcal necrotizing skin and soft-tissue infections and the impact of clindamycin resistance. Clin Infect Dis 2021;73(11):e4592‑8.
5. Eron LJ. Managing skin and soft tissue infections: Expert panel recommendations on key decision points. J Antimicrob Chemother 2003;52(90001):3i‑17.
6. Lipsky BA, Kollef MH, Miller LG, Sun X, Johannes RS, Tabak YP. Predicting bacteremia among patients hospitalized for skin and skin-structure infections: Derivation and validation of a risk score. Infect Control Hosp Epidemiol 2010;31(8):828‑37.
7. Sartelli M, Coccolini F, Kluger Y, Agastra E, Abu-Zidan FM, Abbas AES, et al. WSES/GAIS/WSIS/SIS-E/AAST global clinical pathways for patients with skin and soft tissue infections. World J Emerg Surg WJES 2022;17(1):3.
8. Prast‐Nielsen S, Tobin AM, Adamzik K, Powles A, Hugerth LW, Sweeney C, et al. Investigation of the skin microbiome: Swabs vs. biopsies. Br J Dermatol 2019;181(3):572‑9.
9. Sartelli M, Guirao X, Hardcastle TC, Kluger Y, Boermeester MA, Raşa K, et al. 2018 WSES/SIS-E consensus conference: Recommendations for the management of skin and soft-tissue infections. World J Emerg Surg WJES 2018;13:58.
10. Stevens DL, Bisno AL, Chambers HF, Dellinger EP, Goldstein EJC, Gorbach SL, et al. Practice guidelines for the diagnosis and management of skin and soft tissue infections: 2014 update by the Infectious Diseases Society of America. Clin Infect Dis 2014;59(2):e10-52.
11. Thy M, Tanaka S, Tran-Dinh A, Ribeiro L, Lortat-Jacob B, Donadio J, et al. Dynamic changes in microbial composition during necrotizing soft-tissue infections in ICU patients. Front Med 2021;7:609497.
12. Evans L, Rhodes A, Alhazzani W, Antonelli M, Coopersmith CM, French C, et al. Surviving sepsis campaign: International guidelines for management of sepsis and septic shock 2021. Crit Care Med 2021;49(11):e1063‑143.
13. Tanaka S, Thy M, Tashk P, Ribeiro L, Lortat-Jacob B, Hermieu JF, et al. Impact of prior antibiotic therapy on severe necrotizing soft-tissue infections in ICU patients: Results from a French retrospective and observational study. Eur J Clin Microbiol Infect Dis 2022;41(1):109-17.
14. Imauven O, Colot J, Couadau E, Moury PH, Preault A, Vincent F, et al. Paediatric and adult patients from New Caledonia Island admitted to the ICU for community-acquired Panton-Valentine leucocidin-producing Staphylococcus aureus infections. Sci Rep 2022;12(1):11024.
15. Montravers P, Bassetti M, Dupont H, Eckmann C, Heizmann WR, Guirao X, et al. Efficacy of tigecycline for the treatment of complicated skin and soft-tissue infections in real-life clinical practice from five European observational studies. J Antimicrob Chemother 2013;68 Suppl 2:ii15-24.
16. Faraklas I, Yang D, Eggerstedt M, Zhai Y, Liebel P, Graves G, et al. A multi-center review of care patterns and outcomes in necrotizing soft tissue infections. Surg Infect 2016;17(6):773‑8.
17. Sarani B, Strong M, Pascual J, Schwab CW. Necrotizing fasciitis: Current concepts and review of the literature. J Am Coll Surg 2009;208(2):279‑88.
18. Lake JG, Miller LG, Fritz SA. Antibiotic duration, but not abscess size, impacts clinical cure of limited skin and soft tissue infection after incision and drainage. Clin Infect Dis 2020;71(3):661‑3.
19. Foitzik T, Hotz HG, Kinzig M, Sörgel F, Buhr HJ. Influence of changes in pancreatic tissue morphology and capillary blood flow on antibiotic tissue concentrations in the pancreas during the progression of acute pancreatitis. Gut 1997;40(4):526‑30.
20. Darenberg J, Luca-Harari B, Jasir A, Sandgren A, Pettersson H, Schalén C, et al. Molecular and clinical characteristics of invasive group A streptococcal infection in Sweden. Clin Infect Dis 2007;45(4):450‑8.
21. Carapetis JR, Jacoby P, Carville K, Ang SJJ, Curtis N, Andrews R. Effectiveness of clindamycin and intravenous immunoglobulin, and risk of disease in contacts, in invasive group a streptococcal infections. Clin Infect Dis 2014;59(3):358‑65.
22. Stevens DL, Bryant AE, Hackett SP. Antibiotic effects on bacterial viability, toxin production, and host response. Clin Infect Dis 1995;20 Suppl 2:S154-157.
23. Madsen MB, Hjortrup PB, Hansen MB, Lange T, Norrby-Teglund A, Hyldegaard O, et al. Immunoglobulin G for patients with necrotising soft tissue infection (INSTINCT): A randomised, blinded, placebo-controlled trial. Intensive Care Med 2017;43(11):1585‑93.
24. Parks T, Wilson C, Curtis N, Norrby-Teglund A, Sriskandan S. Polyspecific Intravenous immunoglobulin in clindamycin-treated patients with streptococcal toxic shock syndrome: A systematic review and meta-analysis. Clin Infect Dis 2018;67(9):1434‑6.
2. Stevens DL, Bryant AE. Necrotizing soft-tissue infections. Longo DL, éditeur. N Engl J Med 2017;377(23):2253‑65.
3. Eckmann C, Montravers P. Current management of necrotizing soft-tissue infections. Curr Opin Infect Dis 2021;34(2):89‑95.
4. Horn DL, Roberts EA, Shen J, Chan JD, Bulger EM, Weiss NS, et al. Outcomes of β-hemolytic streptococcal necrotizing skin and soft-tissue infections and the impact of clindamycin resistance. Clin Infect Dis 2021;73(11):e4592‑8.
5. Eron LJ. Managing skin and soft tissue infections: Expert panel recommendations on key decision points. J Antimicrob Chemother 2003;52(90001):3i‑17.
6. Lipsky BA, Kollef MH, Miller LG, Sun X, Johannes RS, Tabak YP. Predicting bacteremia among patients hospitalized for skin and skin-structure infections: Derivation and validation of a risk score. Infect Control Hosp Epidemiol 2010;31(8):828‑37.
7. Sartelli M, Coccolini F, Kluger Y, Agastra E, Abu-Zidan FM, Abbas AES, et al. WSES/GAIS/WSIS/SIS-E/AAST global clinical pathways for patients with skin and soft tissue infections. World J Emerg Surg WJES 2022;17(1):3.
8. Prast‐Nielsen S, Tobin AM, Adamzik K, Powles A, Hugerth LW, Sweeney C, et al. Investigation of the skin microbiome: Swabs vs. biopsies. Br J Dermatol 2019;181(3):572‑9.
9. Sartelli M, Guirao X, Hardcastle TC, Kluger Y, Boermeester MA, Raşa K, et al. 2018 WSES/SIS-E consensus conference: Recommendations for the management of skin and soft-tissue infections. World J Emerg Surg WJES 2018;13:58.
10. Stevens DL, Bisno AL, Chambers HF, Dellinger EP, Goldstein EJC, Gorbach SL, et al. Practice guidelines for the diagnosis and management of skin and soft tissue infections: 2014 update by the Infectious Diseases Society of America. Clin Infect Dis 2014;59(2):e10-52.
11. Thy M, Tanaka S, Tran-Dinh A, Ribeiro L, Lortat-Jacob B, Donadio J, et al. Dynamic changes in microbial composition during necrotizing soft-tissue infections in ICU patients. Front Med 2021;7:609497.
12. Evans L, Rhodes A, Alhazzani W, Antonelli M, Coopersmith CM, French C, et al. Surviving sepsis campaign: International guidelines for management of sepsis and septic shock 2021. Crit Care Med 2021;49(11):e1063‑143.
13. Tanaka S, Thy M, Tashk P, Ribeiro L, Lortat-Jacob B, Hermieu JF, et al. Impact of prior antibiotic therapy on severe necrotizing soft-tissue infections in ICU patients: Results from a French retrospective and observational study. Eur J Clin Microbiol Infect Dis 2022;41(1):109-17.
14. Imauven O, Colot J, Couadau E, Moury PH, Preault A, Vincent F, et al. Paediatric and adult patients from New Caledonia Island admitted to the ICU for community-acquired Panton-Valentine leucocidin-producing Staphylococcus aureus infections. Sci Rep 2022;12(1):11024.
15. Montravers P, Bassetti M, Dupont H, Eckmann C, Heizmann WR, Guirao X, et al. Efficacy of tigecycline for the treatment of complicated skin and soft-tissue infections in real-life clinical practice from five European observational studies. J Antimicrob Chemother 2013;68 Suppl 2:ii15-24.
16. Faraklas I, Yang D, Eggerstedt M, Zhai Y, Liebel P, Graves G, et al. A multi-center review of care patterns and outcomes in necrotizing soft tissue infections. Surg Infect 2016;17(6):773‑8.
17. Sarani B, Strong M, Pascual J, Schwab CW. Necrotizing fasciitis: Current concepts and review of the literature. J Am Coll Surg 2009;208(2):279‑88.
18. Lake JG, Miller LG, Fritz SA. Antibiotic duration, but not abscess size, impacts clinical cure of limited skin and soft tissue infection after incision and drainage. Clin Infect Dis 2020;71(3):661‑3.
19. Foitzik T, Hotz HG, Kinzig M, Sörgel F, Buhr HJ. Influence of changes in pancreatic tissue morphology and capillary blood flow on antibiotic tissue concentrations in the pancreas during the progression of acute pancreatitis. Gut 1997;40(4):526‑30.
20. Darenberg J, Luca-Harari B, Jasir A, Sandgren A, Pettersson H, Schalén C, et al. Molecular and clinical characteristics of invasive group A streptococcal infection in Sweden. Clin Infect Dis 2007;45(4):450‑8.
21. Carapetis JR, Jacoby P, Carville K, Ang SJJ, Curtis N, Andrews R. Effectiveness of clindamycin and intravenous immunoglobulin, and risk of disease in contacts, in invasive group a streptococcal infections. Clin Infect Dis 2014;59(3):358‑65.
22. Stevens DL, Bryant AE, Hackett SP. Antibiotic effects on bacterial viability, toxin production, and host response. Clin Infect Dis 1995;20 Suppl 2:S154-157.
23. Madsen MB, Hjortrup PB, Hansen MB, Lange T, Norrby-Teglund A, Hyldegaard O, et al. Immunoglobulin G for patients with necrotising soft tissue infection (INSTINCT): A randomised, blinded, placebo-controlled trial. Intensive Care Med 2017;43(11):1585‑93.
24. Parks T, Wilson C, Curtis N, Norrby-Teglund A, Sriskandan S. Polyspecific Intravenous immunoglobulin in clindamycin-treated patients with streptococcal toxic shock syndrome: A systematic review and meta-analysis. Clin Infect Dis 2018;67(9):1434‑6.
Dans cet article
- La microbiologie dépend de nombreux critères
- Prélèvements microbiologiques profonds et multiples
- Antibiothérapie à large spectre et possible avant la chirurgie
- Adapter le traitement à l’antibiogramme
- Au moins dix jours d’antibiothérapie ?
- Pharmacocinétique imposant des doses élevées d’antibiotiques
- Traitements du choc toxique
- La microbiologie variée des DHBN complexifie le choix de l’antibiothérapie