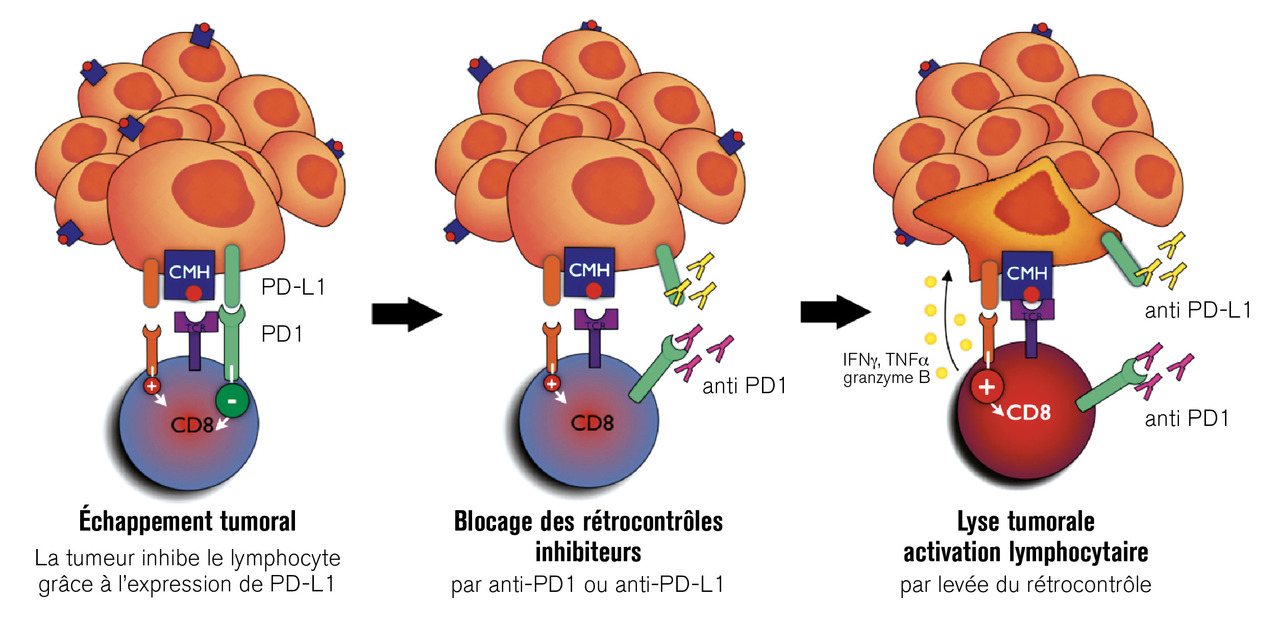
1 La surveillance immunitaire des cancers, qui est longtemps restée une hypothèse, est actuellement une réalité. On considère qu’il existe trois phases, les trois E : élimination des cellules cancéreuses par le système immunitaire ; équilibre entre cellules cancéreuses et système immunitaire ; échappement, correspondant à la phase clinique. Cet échappement est dû (au moins en partie) à un blocage de l’activation du système immunitaire par le micro-environnement tumoral par l’intermédiaire des récepteurs inhibiteurs du contrôle immunitaire.
2 L’immunothérapie par blocage des récepteurs inhibiteurs du contrôle immunitaire est un changement de paradigme. Pour la première fois, le traitement ne s’attaque pas directement à la tumeur, comme le font la chirurgie, la radiothérapie, la chimiothérapie et même l’immunothérapie par anticorps monoclonaux ou CAR-T cells dirigés contre les antigènes tumoraux. Il bloque les freins (récepteurs inhibiteurs du contrôle immunitaire) et restaure une réponse anticancéreuse du système immunitaire. Ainsi il ne s’oppose pas mais, au contraire, peut s’associer aux autres traitements dirigés contre la tumeur.
3 Pour la première fois, avec les inhibiteurs du contrôle immunitaire (ICI), une réponse clinique complète, durable et prolongée (plusieurs années) a pu être observée chez des patients a priori incurables, ce qui est une révolution dans le traitement des cancers sans espoir de guérison, avec une optique curative.
4 Cette réponse positive avec les ICI n’est pas observée dans tous les cancers, et parmi les cancers « sensibles » elle n’est observée pour l’instant que chez une minorité de patients, en particulier ceux dont les cellules tumorales expriment à leur surface les ligands du récepteur PD-1 sur les lymphocytes T (c’est-à-dire PD-L1 et PD-L2). Il est important d’identifier d’autres biomarqueurs et de caractériser les facteurs de résistance, de façon à optimiser l’utilisation de ces traitements coûteux.
5 Les effets indésirables des traitements par ICI sont fréquents mais le plus souvent sensibles à une interruption temporaire des traitements ou à un traitement médicamenteux, en particulier par corticoïdes. En effet, ces effets ne sont pas dus à une toxicité directe des médicaments (comme la chimiothérapie) mais à une réponse inflammatoire exagérée et/ou auto-immune, effets liés à une libération de la réponse immunitaire. Ces effets peuvent être retardés et observés même après l’arrêt du traitement. Ils justifient les cinq principes suivants : prévenir de leur existence ; anticiper en recherchant des facteurs de risque ; détecter ; traiter ; surveiller – ce qui nécessite une collaboration en réseau entre les différents acteurs.
6 Mélanome. L’immunothérapie par les ICI a bouleversé le traitement des formes graves de mélanome, l’association d’un anti-CTLA4 (nivolumab) et d’un anti-PD-1 (pembrolizumab) entraînant une réponse dans 57,6 % des mélanomes métastatiques, complète dans 23 % des cas. Cette réponse est durable et permet d’envisager l’arrêt du traitement. Le traitement par pembrolizumab permet une survie sans récidive à 3 ans dans 71,4 % des cas en situation adjuvante après chirurgie ganglionnaire (stade III) ou exérèse de métastase à distance (stade IV). Il présente des perspectives intéressantes comme traitement néo-adjuvant dans ces indications et comme traitement adjuvant dans des stades II à haut risque de récidive.
7 Cancer du poumon. Les ICI constituent, soit en monothérapie, soit en combinaison avec la chimiothérapie, la pierre angulaire des traitements des cancers du poumon non à petites cellules (CBNPC) [85 % des cancers du poumon]. En première ligne dans les cancers métastatiques sans addiction oncogénique, ils ont démontré aussi un bénéfice de survie dans les CBNPC localement avancés non opérables et font l’objet d’études de phase III comme traitement néo-adjuvant et adjuvant dans les cancers opérables. Les ICI ont permis, pour une fraction de patients, une évolution à long terme non imaginable auparavant, certains sans évidence de maladie résiduelle. Ils ont ainsi modifié l’image du cancer du poumon.
8 Les cancers des voies aériennes supérieures sont la 7e cause de cancer et récidivent ou métastasent dans 40 à 50 % des cas. Chez les patients atteints, l’immunothérapie par ICI a été une révolution, en obtenant une rémission durable et prolongée chez 10 à 20 % de ces patients jusqu’ici incurables.
9 Cancer de la vessie. Le traitement par ICI est un nouvel espoir dans le traitement des tumeurs de la vessie. Pour les tumeurs de la vessie infiltrant le muscle, c’est une indication de première ligne lorsqu’elles présentent un statut PD-L 1positif et de deuxième ligne pour les patients ne régressant pas ou progressant sous chimiothérapie ; dans les formes non métastatiques, le traitement est la chirurgie après chimiothérapie néo-adjuvante. Plusieurs essais d’ICI sont en cours. Pour les tumeurs de la vessie n’infiltrant pas le muscle, il n’existe pas à l’heure actuelle d’indications des ICI en dehors des essais cliniques.
10 Tout porte à croire que dans les dix années à venir la place de l’immunothérapie ne fera que croître, car de nouvelles perspectives permettent d’envisager de vaincre les résistances aux ICI : augmenter l’immunogénicité de la tumeur, certaines tumeurs étant peu ou pas antigéniques ; induire une réponse immunitaire spécifique par des vaccins, en particulier en utilisant des ARN messagers d’antigènes tumoraux ; bloquer d’autres récepteurs inhibiteurs que ceux des lymphocytes T, comme les récepteurs inhibiteurs présents à la surface des cellules de l’immunité innée (cellules NK, cellules dendritiques) ou des lymphocytes B ; cibler les lymphocytes T effecteurs de la réponse cytotoxique plutôt que les lymphocytes T régulateurs ; analyser l’impact du microbiote.
2 L’immunothérapie par blocage des récepteurs inhibiteurs du contrôle immunitaire est un changement de paradigme. Pour la première fois, le traitement ne s’attaque pas directement à la tumeur, comme le font la chirurgie, la radiothérapie, la chimiothérapie et même l’immunothérapie par anticorps monoclonaux ou CAR-T cells dirigés contre les antigènes tumoraux. Il bloque les freins (récepteurs inhibiteurs du contrôle immunitaire) et restaure une réponse anticancéreuse du système immunitaire. Ainsi il ne s’oppose pas mais, au contraire, peut s’associer aux autres traitements dirigés contre la tumeur.
3 Pour la première fois, avec les inhibiteurs du contrôle immunitaire (ICI), une réponse clinique complète, durable et prolongée (plusieurs années) a pu être observée chez des patients a priori incurables, ce qui est une révolution dans le traitement des cancers sans espoir de guérison, avec une optique curative.
4 Cette réponse positive avec les ICI n’est pas observée dans tous les cancers, et parmi les cancers « sensibles » elle n’est observée pour l’instant que chez une minorité de patients, en particulier ceux dont les cellules tumorales expriment à leur surface les ligands du récepteur PD-1 sur les lymphocytes T (c’est-à-dire PD-L1 et PD-L2). Il est important d’identifier d’autres biomarqueurs et de caractériser les facteurs de résistance, de façon à optimiser l’utilisation de ces traitements coûteux.
5 Les effets indésirables des traitements par ICI sont fréquents mais le plus souvent sensibles à une interruption temporaire des traitements ou à un traitement médicamenteux, en particulier par corticoïdes. En effet, ces effets ne sont pas dus à une toxicité directe des médicaments (comme la chimiothérapie) mais à une réponse inflammatoire exagérée et/ou auto-immune, effets liés à une libération de la réponse immunitaire. Ces effets peuvent être retardés et observés même après l’arrêt du traitement. Ils justifient les cinq principes suivants : prévenir de leur existence ; anticiper en recherchant des facteurs de risque ; détecter ; traiter ; surveiller – ce qui nécessite une collaboration en réseau entre les différents acteurs.
6 Mélanome. L’immunothérapie par les ICI a bouleversé le traitement des formes graves de mélanome, l’association d’un anti-CTLA4 (nivolumab) et d’un anti-PD-1 (pembrolizumab) entraînant une réponse dans 57,6 % des mélanomes métastatiques, complète dans 23 % des cas. Cette réponse est durable et permet d’envisager l’arrêt du traitement. Le traitement par pembrolizumab permet une survie sans récidive à 3 ans dans 71,4 % des cas en situation adjuvante après chirurgie ganglionnaire (stade III) ou exérèse de métastase à distance (stade IV). Il présente des perspectives intéressantes comme traitement néo-adjuvant dans ces indications et comme traitement adjuvant dans des stades II à haut risque de récidive.
7 Cancer du poumon. Les ICI constituent, soit en monothérapie, soit en combinaison avec la chimiothérapie, la pierre angulaire des traitements des cancers du poumon non à petites cellules (CBNPC) [85 % des cancers du poumon]. En première ligne dans les cancers métastatiques sans addiction oncogénique, ils ont démontré aussi un bénéfice de survie dans les CBNPC localement avancés non opérables et font l’objet d’études de phase III comme traitement néo-adjuvant et adjuvant dans les cancers opérables. Les ICI ont permis, pour une fraction de patients, une évolution à long terme non imaginable auparavant, certains sans évidence de maladie résiduelle. Ils ont ainsi modifié l’image du cancer du poumon.
8 Les cancers des voies aériennes supérieures sont la 7e cause de cancer et récidivent ou métastasent dans 40 à 50 % des cas. Chez les patients atteints, l’immunothérapie par ICI a été une révolution, en obtenant une rémission durable et prolongée chez 10 à 20 % de ces patients jusqu’ici incurables.
9 Cancer de la vessie. Le traitement par ICI est un nouvel espoir dans le traitement des tumeurs de la vessie. Pour les tumeurs de la vessie infiltrant le muscle, c’est une indication de première ligne lorsqu’elles présentent un statut PD-L 1positif et de deuxième ligne pour les patients ne régressant pas ou progressant sous chimiothérapie ; dans les formes non métastatiques, le traitement est la chirurgie après chimiothérapie néo-adjuvante. Plusieurs essais d’ICI sont en cours. Pour les tumeurs de la vessie n’infiltrant pas le muscle, il n’existe pas à l’heure actuelle d’indications des ICI en dehors des essais cliniques.
10 Tout porte à croire que dans les dix années à venir la place de l’immunothérapie ne fera que croître, car de nouvelles perspectives permettent d’envisager de vaincre les résistances aux ICI : augmenter l’immunogénicité de la tumeur, certaines tumeurs étant peu ou pas antigéniques ; induire une réponse immunitaire spécifique par des vaccins, en particulier en utilisant des ARN messagers d’antigènes tumoraux ; bloquer d’autres récepteurs inhibiteurs que ceux des lymphocytes T, comme les récepteurs inhibiteurs présents à la surface des cellules de l’immunité innée (cellules NK, cellules dendritiques) ou des lymphocytes B ; cibler les lymphocytes T effecteurs de la réponse cytotoxique plutôt que les lymphocytes T régulateurs ; analyser l’impact du microbiote.
Voir aussi
Lebranchu Y. L’immunothérapie des cancers honorée par un prix Nobel. Rev Prat 2019;69:243-6.