L’existence d’une horloge biologique circadienne (circa diem : environ un jour) chez l’humain explique la rythmicité de nombreuses fonctions physiologiques et biologiques, et de leur expression tout au long des 24 heures de la journée : succession de l’éveil et du sommeil, sécrétion d’hormones métaboliques, contrôle de la température corporelle, division des cellules, réparation de l’ADN.
Influence de l’horloge biologique sur les rythmes veille-sommeil
L’organisation de ces rythmes sur 24 heures semble indispensable à la vie, puisque la quasi-totalité des êtres vivants étudiés, de la bactérie à l’humain, possèdent un système circadien. Ce système est articulé autour d’une horloge principale, au niveau des noyaux suprachiasmatiques de l’hypothalamus, et d’horloges périphériques situées dans presque tous les tissus de l’organisme tels que la rétine, le foie, le cœur, le poumon, la peau. Ce réseau coordonné d’horloges harmonise le fonctionnement physiologique, psychologique et comportemental de l’organisme et en particulier du rythme veille-sommeil au cours des 24 heures.
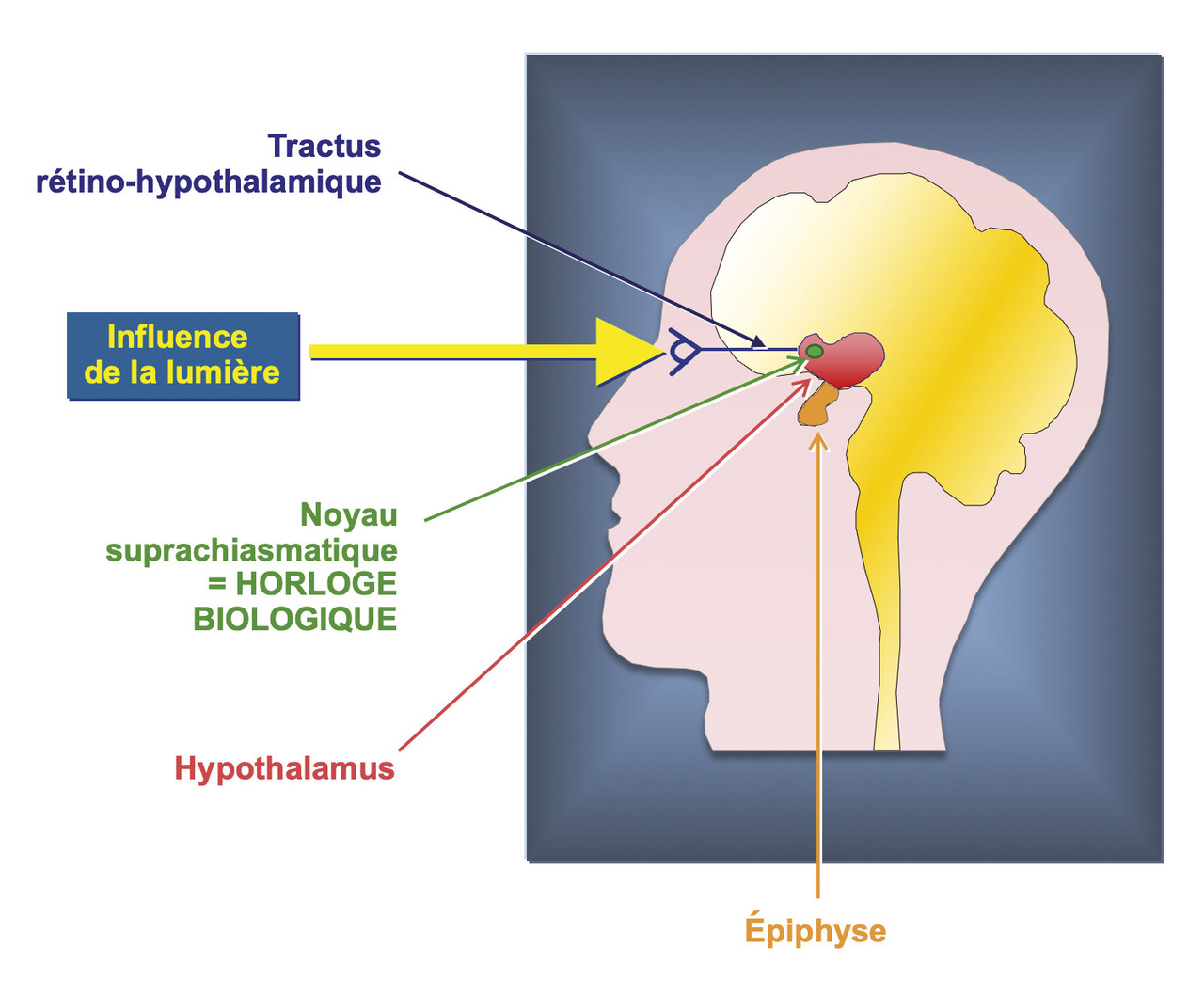
Le fonctionnement de l’horloge biologique est endogène et continue à s’exprimer, y compris lorsqu’un sujet est placé dans un environnement constant où rien ne distingue le jour de la nuit. L’activité circadienne des neurones du noyau suprachiasmatique est sous-tendue par le fonctionnement cyclique d’une dizaine de gènes dits « de l’horloge », responsables des rythmes d’activité électrique et biochimique des cellules avec une période proche de 24 heures.1 Mais l’horloge biologique est aussi influencée et synchronisée avec le cycle de rotation de la Terre autour de son axe, qui a une période d’exactement 24 heures. Le rythme de l’horloge endogène est cependant légèrement différent de 24 heures, en moyenne entre 23,5 et 24,5 heures chez le sujet sain.2 L’horloge doit donc être remise à l’heure quotidiennement pour être bien synchronisée avec le cycle jour-nuit. Chez les mammifères, c’est la lumière perçue par la rétine qui est le plus puissant synchroniseur de l’horloge circadienne.
Le fonctionnement de l’horloge biologique est endogène et continue à s’exprimer, y compris lorsqu’un sujet est placé dans un environnement constant où rien ne distingue le jour de la nuit. L’activité circadienne des neurones du noyau suprachiasmatique est sous-tendue par le fonctionnement cyclique d’une dizaine de gènes dits « de l’horloge », responsables des rythmes d’activité électrique et biochimique des cellules avec une période proche de 24 heures.1 Mais l’horloge biologique est aussi influencée et synchronisée avec le cycle de rotation de la Terre autour de son axe, qui a une période d’exactement 24 heures. Le rythme de l’horloge endogène est cependant légèrement différent de 24 heures, en moyenne entre 23,5 et 24,5 heures chez le sujet sain.2 L’horloge doit donc être remise à l’heure quotidiennement pour être bien synchronisée avec le cycle jour-nuit. Chez les mammifères, c’est la lumière perçue par la rétine qui est le plus puissant synchroniseur de l’horloge circadienne.
Fonctions contrôlées par l’horloge circadienne
La plupart des fonctions biologiques contrôlées par l’horloge circadienne s’expriment dans le temps, de manière optimale pour permettre, par exemple, un sommeil bien ancré de nuit et une veille de qualité de jour. Ainsi, l’horloge biologique circadienne favorise la vigilance, la performance, la mémoire pendant le jour par l’activation de fonctions liées à l’éveil (température corporelle, sécrétion de cortisol, structures impliquées dans la vigilance et la cognition) et l’inhibition de fonctions liées au sommeil (sécrétion de mélatonine indétectable).
Au contraire, au cours de la nuit, la libération de mélatonine, la chute de la température centrale jusqu’à son minimum entre 2 et 5 h du matin, l’inhibition de la sécrétion de cortisol et des structures impliquées dans l’éveil permettent l’installation et le maintien du sommeil profond et la rythmicité du sommeil paradoxal. L’horloge biologique circadienne est ainsi souvent comparée à un chef d’orchestre, harmonisant la physiologie interne en la synchronisant avec le temps et les conditions externes (température, lumière, environnement social).
La biologie moléculaire a permis de révéler qu’entre 8 et 20 % du génome est exprimé de manière rythmique selon les différents tissus de l’organisme. Les horloges périphériques possèdent aussi un rythme endogène propre, elles sont synchronisées entre elles et avec le cycle lumière-obscurité de 24 heures par l’horloge circadienne centrale. C’est grâce à ces horloges circadiennes périphériques que le système circadien est notamment impliqué dans le contrôle du rythme de la division cellulaire, de l’apoptose, de la prolifération des cellules cancéreuses3,4 et de la réparation de l’ADN.
Il est maintenant clair que l’intégrité des horloges circadiennes et leur synchronisation adéquate avec le cycle jour-nuit sont absolument cruciales pour la santé humaine, et que la perturbation du système circadien est impliquée dans certaines pathologies, dont le cancer.
Au contraire, au cours de la nuit, la libération de mélatonine, la chute de la température centrale jusqu’à son minimum entre 2 et 5 h du matin, l’inhibition de la sécrétion de cortisol et des structures impliquées dans l’éveil permettent l’installation et le maintien du sommeil profond et la rythmicité du sommeil paradoxal. L’horloge biologique circadienne est ainsi souvent comparée à un chef d’orchestre, harmonisant la physiologie interne en la synchronisant avec le temps et les conditions externes (température, lumière, environnement social).
La biologie moléculaire a permis de révéler qu’entre 8 et 20 % du génome est exprimé de manière rythmique selon les différents tissus de l’organisme. Les horloges périphériques possèdent aussi un rythme endogène propre, elles sont synchronisées entre elles et avec le cycle lumière-obscurité de 24 heures par l’horloge circadienne centrale. C’est grâce à ces horloges circadiennes périphériques que le système circadien est notamment impliqué dans le contrôle du rythme de la division cellulaire, de l’apoptose, de la prolifération des cellules cancéreuses3,4 et de la réparation de l’ADN.
Il est maintenant clair que l’intégrité des horloges circadiennes et leur synchronisation adéquate avec le cycle jour-nuit sont absolument cruciales pour la santé humaine, et que la perturbation du système circadien est impliquée dans certaines pathologies, dont le cancer.
Horloge biologique et insomnie : quand y penser ?
Devant une plainte d’insomnie chronique, il est donc logique de rechercher comment l’horloge biologique peut être impliquée dans le mauvais sommeil et être en décalage avec les habitudes de sommeil, soit « en retard », soit « en avance », soit complètement désynchronisée (en libre cours).
Syndrome de retard de phase
C’est le plus fréquent des troubles liés à l’horloge biologique. Le patient présente une insomnie d’endormissement au cours de ses jours de travail, avec une difficulté à se lever le matin à l’heure requise depuis au moins trois mois. Il a beaucoup de mal à être opérationnel dans l’heure qui suit le réveil, étant même parfois somnolent, d’une part par défaut de synchronisation de l’horloge, d’autre part par manque de sommeil. Pendant le week-end ou au cours des vacances, il se couche et se lève beaucoup plus tard et a beaucoup moins de plaintes d’endormissement.
Le retard de phase est fréquent chez les adolescents et jeunes adultes, concernant 10 à 20 % d’entre eux. La plupart des personnes atteintes de retard de phase ont un chronotype « du soir », c’est-à-dire qu’ils ont tendance à être en forme sur le plan cognitif, physique et relationnel en fin de journée. Des facteurs génétiques tels qu’un polymorphisme des gènes hPer3 de l’horloge circadienne sont associés au retard de phase.
Le retard de phase est fréquent chez les adolescents et jeunes adultes, concernant 10 à 20 % d’entre eux. La plupart des personnes atteintes de retard de phase ont un chronotype « du soir », c’est-à-dire qu’ils ont tendance à être en forme sur le plan cognitif, physique et relationnel en fin de journée. Des facteurs génétiques tels qu’un polymorphisme des gènes hPer3 de l’horloge circadienne sont associés au retard de phase.
Cas des adolescents en retard de phase
Cette situation a fait l’objet de nombreuses études en raison de ses conséquences académiques, avec risque d’échec scolaire, voire de désinsertion sociale.5 Certains l’expliquent par une modification endogène de la période de l’horloge qui augmenterait au moment de l’adolescence, ou par une sensibilité accrue à la lumière dans la soirée. D’autres émettent l’hypothèse qu’il existe une association à des troubles anxieux et thymiques favorisant le refuge dans la période de nuit. Tous évoquent des caractéristiques comportementales avec interactions sur les réseaux sociaux, effets de la lumière des écrans, dysfonctionnements familiaux et puberté. Les conséquences scolaires ont été considérées comme suffisamment importantes pour que plusieurs États américains aient retardé l’horaire de début des cours.
Syndrome d’avance de phase
Il est beaucoup plus rare et ne toucherait que 1 % des adultes à des degrés divers. Le patient présente une insomnie par réveil précoce, avec une incapacité à rester endormi jusqu’à l’heure souhaitée du réveil et une avance de l’envie de dormir dans la soirée avec difficultés à rester éveillé en début de soirée depuis au moins trois mois. Pendant le week-end ou au cours des vacances, il se couche et se lève beaucoup plus tôt, avec un éveil précoce, en pleine forme. L’avance de phase est plus fréquente chez les personnes plus âgées. La plupart des personnes atteintes d’avance de phase ont un chronotype « du matin », c’est-à-dire qu’elles ont tendance à être en forme sur le plan cognitif, physique et relationnel le matin. Des facteurs familiaux ont été montrés dans plusieurs cohortes. On évoque le raccourcissement de la période de l’horloge pour expliquer l’avance de phase, mais aussi une altération de l’horloge à être retardée. Cliniquement, ce sont souvent des personnes âgées vivant en institution et dont on avance l’heure du repas et de la fermeture des rideaux, et qui s’endorment précocement pour se réveiller en pleine nuit ayant suffisamment dormi.
Non-voyants et libre cours
En cas de désynchronisation de l’horloge biologique en libre cours ou « rythme différent de 24 heures », le patient présente des troubles d’insomnie et de somnolence dans la journée par périodes, en alternance avec des périodes de rémission, sans qu’elles soient explicables par différentes conditions de stress ou de prise en charge, l’endormissement se faisant progressivement de plus en plus tard, depuis au moins trois mois.
Cette désynchronisation est typiquement retrouvée chez les personnes non voyantes ne percevant pas du tout la lumière. L’horloge n’étant jamais stimulée par la lumière, elle s’exprime « en libre cours », c’est-à-dire sur son propre rythme, souvent supérieur à 24 heures. Cela explique pourquoi, à certaines périodes, leur rythme est très décalé, avec insomnie durant la nuit et somnolence dans la journée. Alors qu’à d’autres périodes le rythme de l’horloge correspond aux horaires nocturnes et le sommeil peut être bon, sans somnolence le jour. En interrogeant d’abord plus d’un millier d’aveugles à l’aide de questionnaires en braille, il a été mis en évidence une prévalence très élevée d’insomnie.6 En mesurant les rythmes salivaires et urinaires pendant plusieurs semaines chez une vingtaine de non-voyants, il a été confirmé que leur horloge se décale parfois d’une à deux heures par semaine.
Dans une autre étude, nous avons aussi interrogé les aveugles sur la façon dont, en rêve, ils perçoivent la lumière, et nous nous sommes rendus compte que la perception du rouge était très liée à la lumière, même chez les aveugles n’ayant jamais vu de leur vie.7
Les non-voyants qui ne perçoivent plus la lumière ont donc un risque élevé de désynchronisation de l’horloge biologique de type « libre cours » alternant des périodes d’insomnie et des périodes de bon sommeil. Cela indépendamment de toute autre condition psychologique, dépression ou anxiété, qui pourrait résulter de leur handicap. Une mélatonine spécifique commercialisée aux États-Unis et en Allemagne, le tasimeltéon, est reconnue comme efficace sur ces troubles spécifiques des non-voyants.8
Cette désynchronisation est typiquement retrouvée chez les personnes non voyantes ne percevant pas du tout la lumière. L’horloge n’étant jamais stimulée par la lumière, elle s’exprime « en libre cours », c’est-à-dire sur son propre rythme, souvent supérieur à 24 heures. Cela explique pourquoi, à certaines périodes, leur rythme est très décalé, avec insomnie durant la nuit et somnolence dans la journée. Alors qu’à d’autres périodes le rythme de l’horloge correspond aux horaires nocturnes et le sommeil peut être bon, sans somnolence le jour. En interrogeant d’abord plus d’un millier d’aveugles à l’aide de questionnaires en braille, il a été mis en évidence une prévalence très élevée d’insomnie.6 En mesurant les rythmes salivaires et urinaires pendant plusieurs semaines chez une vingtaine de non-voyants, il a été confirmé que leur horloge se décale parfois d’une à deux heures par semaine.
Dans une autre étude, nous avons aussi interrogé les aveugles sur la façon dont, en rêve, ils perçoivent la lumière, et nous nous sommes rendus compte que la perception du rouge était très liée à la lumière, même chez les aveugles n’ayant jamais vu de leur vie.7
Les non-voyants qui ne perçoivent plus la lumière ont donc un risque élevé de désynchronisation de l’horloge biologique de type « libre cours » alternant des périodes d’insomnie et des périodes de bon sommeil. Cela indépendamment de toute autre condition psychologique, dépression ou anxiété, qui pourrait résulter de leur handicap. Une mélatonine spécifique commercialisée aux États-Unis et en Allemagne, le tasimeltéon, est reconnue comme efficace sur ces troubles spécifiques des non-voyants.8
Horloge biologique et insomnie : comment les évaluer ?
L’évaluation spécifique de l’horloge biologique dans l’insomnie utilise les mêmes outils que ceux recommandés de manière générale dans l’insomnie et repose en particulier sur :
– l’agenda du sommeil, réalisé sur plusieurs semaines et montrant le décalage des horaires de coucher et de lever entre jours de travail et jours de repos, permettant d’évoquer le diagnostic (lire article « Premières consultations pour insomnie et démarche en médecine générale »page 266 ) ;
– l’actigraphie, qui est l’outil de référence pour évaluer l’horloge biologique et ses troubles puisqu’il permet d’objectiver ces décalages de phase et même de calculer des paramètres comme la période de l’horloge biologique ainsi que les périodes de moindre activité. Un capteur placé sur le poignet (comme une montre) enregistre en permanence les mouvements du bras, qui diminuent pendant le sommeil ;
– les questionnaires de type chronotype (dont le plus employé est le chronotype de Horne et Ostberg : https://vu.fr/HxrBX) sont souvent utilisés en recherche et parfois en clinique pour bien comprendre le caractère plus ou moins marqué « du soir » ou « du matin » des patients ;
– les outils connectés de type bracelets ou bagues connectés sont aussi de bons outils prospectifs dès lors que les rapports des patients sont accessibles pour évaluer ces décalages, car certains patients ont des périodes d’observation disponibles de plusieurs mois, voire plusieurs années.
– l’agenda du sommeil, réalisé sur plusieurs semaines et montrant le décalage des horaires de coucher et de lever entre jours de travail et jours de repos, permettant d’évoquer le diagnostic (lire article « Premières consultations pour insomnie et démarche en médecine générale »
– l’actigraphie, qui est l’outil de référence pour évaluer l’horloge biologique et ses troubles puisqu’il permet d’objectiver ces décalages de phase et même de calculer des paramètres comme la période de l’horloge biologique ainsi que les périodes de moindre activité. Un capteur placé sur le poignet (comme une montre) enregistre en permanence les mouvements du bras, qui diminuent pendant le sommeil ;
– les questionnaires de type chronotype (dont le plus employé est le chronotype de Horne et Ostberg : https://vu.fr/HxrBX) sont souvent utilisés en recherche et parfois en clinique pour bien comprendre le caractère plus ou moins marqué « du soir » ou « du matin » des patients ;
– les outils connectés de type bracelets ou bagues connectés sont aussi de bons outils prospectifs dès lors que les rapports des patients sont accessibles pour évaluer ces décalages, car certains patients ont des périodes d’observation disponibles de plusieurs mois, voire plusieurs années.
Insomnie et travail posté et de nuit : une désynchronisation répétée de l’horloge ?
Plusieurs millions de personnes en France travaillent avec des horaires variables et décalés (travail posté et/ou de nuit [TPN]) : cela concerne 20 à 25 % des professionnels. Plusieurs analyses récentes de la littérature, notamment celle réalisée par l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (ANSES),9 ont montré le risque très élevé d’insomnie lié à ces conditions de travail. L’insomnie touche entre 30 et 45 % des TPN versus 20 % de la population générale. Elle est responsable d’une diminution du temps de sommeil d’environ une heure par 24 heures chez les TPN, les exposant à une dette chronique de sommeil, qui a été mise en cause dans les comorbidités sévères liées au TPN : métaboliques, cardiovasculaires et risque de cancer du sein. Les rythmes de rotation les plus rapides sont responsables du plus grand nombre d’intolérance et de troubles du sommeil.
Quel est le rôle de la lumière ?
L’influence du rythme lumière/obscurité sur l’horloge biologique est forte. Mais il a été plus récemment montré que le circuit circadien de la lumière perçue par la rétine n’implique pas le système visuel classique. En effet, en plus des cônes et des bâtonnets impliqués dans la formation d’images, le système circadien utilise préférentiellement un deuxième système de cellules photosensibles : les cellules ganglionnaires à mélanopsine. Ces cellules ganglionnaires à mélanopsine projettent directement de la rétine vers le noyau suprachiasmatique, et ainsi permettent la synchronisation de l’horloge circadienne (figure ). Les effets de la lumière sur l’horloge circadienne dépendent de cinq paramètres principaux : heure de l’exposition lumineuse, intensité lumineuse, durée de l’exposition à la lumière, spectre de la lumière et historique lumineux.10,11 Dans ce contexte, la photothérapie, utilisant des lampes de haute intensité, est recommandée pour l’ensemble des troubles circadiens impliqués dans l’insomnie. En l’absence de maladies rétiniennes, l’exposition à la lumière le matin est proposée dans le retard de phase et les rythmes en libre cours, et en fin de journée dans les avances de phase. Pour l’insomnie des TPN, l’exposition conseillée dépend des rythmes de travail.
Tenir compte de l’horloge biologique dans la prise en charge de l’insomnie
Prodiguer des conseils en rapport avec l’horloge biologique fait partie des bonnes pratiques dans la prise en charge de l’insomnie. L’implication de l’horloge biologique est expliquée dans les thérapies cognitives et comportementales de l’insomnie, référence dans cette prise en charge.
Références
1. Reppert SM, Weaver DR. Coordination of circadian timing in mammals. Nature 2002;418(6901):935-41.
2. Czeisler CA, Duffy JF, Shanahan TL, Brown EN, Mitchell JF, Rimmer DW, et al. Stability, precision, and near-24-hour period of the human circadian pacemaker. Science 1999;284(5423):2177-81.
3. Granda TG, Liu XH, Smaaland R, Cermakian N, Filipski E, Sassone-Corsi P, et al. Circadian regulation of cell cycle and apoptosis proteins in mouse bone marrow and tumor. FASEB J: Official Publication of the Federation of American Societies for Experimental Biology 2005;19(2):304-6.
4. Collis SJ, Boulton SJ. Emerging links between the biological clock and the DNA damage response. Chromosoma 2007;116(4):331-9.
5. Feder MA, Baroni A. Just let me sleep in: Identifying and treating delayed sleep phase disorder in adolescents. Child Adolesc Psychiatr Clin N Am 2021;30(1):159-74.
6. Leger D, Guilleminault C, Defrance R, Domont A, Paillard M. Blindness and sleep patterns. Lancet 1996;348(9030):830-1.
7. Leger D, Guilleminault C, Santos C, Paillard M. Sleep/wake cycles in the dark: Sleep recorded by polysomnography in 26 totally blind subjects compared to controls. Clin Neurophysiol 2002;113(10):1607-14.
8. Quera Salva MA, Hartley S, Leger D, Dauvilliers YA. Non-24-hour sleep-wake rhythm disorder in the totally blind: Diagnosis and management. Front Neurol 2017;8:686.
9. Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (ANSES). Évaluation des risques sanitaires liés au travail de nuit. Avis de l’ANSES. Maisons-Alfort: ANSES, rapport d’expertise collective, juin 2016. https://www.anses.fr/en/system/files/AP2011SA0088Ra.pdf
10. Leger D, Duforez F, Gronfier C, et le groupe Consensus chronobiologie et sommeil de la Société française de recherche et médecine du sommeil (SFRMS). Le traitement par la lumière des troubles circadiens du rythme veille-sommeil. Presse Med 2018;47(11-12):1003-9.
11. Prayag AS, Jost S, Avouac P, Dumortier D, Gronfier C. Dynamics of non-visual responses in humans: As fast as lightning? Front Neurosci 2019;13:126.
2. Czeisler CA, Duffy JF, Shanahan TL, Brown EN, Mitchell JF, Rimmer DW, et al. Stability, precision, and near-24-hour period of the human circadian pacemaker. Science 1999;284(5423):2177-81.
3. Granda TG, Liu XH, Smaaland R, Cermakian N, Filipski E, Sassone-Corsi P, et al. Circadian regulation of cell cycle and apoptosis proteins in mouse bone marrow and tumor. FASEB J: Official Publication of the Federation of American Societies for Experimental Biology 2005;19(2):304-6.
4. Collis SJ, Boulton SJ. Emerging links between the biological clock and the DNA damage response. Chromosoma 2007;116(4):331-9.
5. Feder MA, Baroni A. Just let me sleep in: Identifying and treating delayed sleep phase disorder in adolescents. Child Adolesc Psychiatr Clin N Am 2021;30(1):159-74.
6. Leger D, Guilleminault C, Defrance R, Domont A, Paillard M. Blindness and sleep patterns. Lancet 1996;348(9030):830-1.
7. Leger D, Guilleminault C, Santos C, Paillard M. Sleep/wake cycles in the dark: Sleep recorded by polysomnography in 26 totally blind subjects compared to controls. Clin Neurophysiol 2002;113(10):1607-14.
8. Quera Salva MA, Hartley S, Leger D, Dauvilliers YA. Non-24-hour sleep-wake rhythm disorder in the totally blind: Diagnosis and management. Front Neurol 2017;8:686.
9. Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (ANSES). Évaluation des risques sanitaires liés au travail de nuit. Avis de l’ANSES. Maisons-Alfort: ANSES, rapport d’expertise collective, juin 2016. https://www.anses.fr/en/system/files/AP2011SA0088Ra.pdf
10. Leger D, Duforez F, Gronfier C, et le groupe Consensus chronobiologie et sommeil de la Société française de recherche et médecine du sommeil (SFRMS). Le traitement par la lumière des troubles circadiens du rythme veille-sommeil. Presse Med 2018;47(11-12):1003-9.
11. Prayag AS, Jost S, Avouac P, Dumortier D, Gronfier C. Dynamics of non-visual responses in humans: As fast as lightning? Front Neurosci 2019;13:126.
Dans cet article
- Influence de l’horloge biologique sur les rythmes veille-sommeil
- Fonctions contrôlées par l’horloge circadienne
- Horloge biologique et insomnie : quand y penser ?
- Horloge biologique et insomnie : comment les évaluer ?
- Insomnie et travail posté et de nuit : une désynchronisation répétée de l’horloge ?
- Quel est le rôle de la lumière ?
- Tenir compte de l’horloge biologique dans la prise en charge de l’insomnie