Lors de la réplication de l’ADN, l’ADN polymérase peut commettre des erreurs en incorporant un nucléotide incorrect dans le nouveau brin d’ADN et associer ainsi deux nucléotides non complémentaires. Ce mésappariement doit être corrigé afin de préserver l’intégrité de l’information génétique et éviter l’apparition et la transmission d’une mutation. Le système de réparation des mésappariements de l’ADN (mismatch repair, ou MMR) permet de repérer et réparer les erreurs d’appariements nucléotidiques du brin d’ADN nouvellement synthétisé. Le système MMR est indispensable au maintien de l’intégrité génétique.
Dans les tumeurs, ce système MMR peut être défaillant, permettant la survenue d’anomalies génétiques très nombreuses dans les cellules tumorales et conduisant à une instabilité de l’ADN avec accumulation de mutations somatiques (c’est-à-dire présentes dans les cellules tumorales), en opposition aux mutations constitutionnelles (présentes dans toutes les cellules de l’individu). Les microsatellites, séquences d’ADN formées par une répétition de motifs nucléotidiques d’une à quatre paires de base, sont particulièrement touchés par cette instabilité. L’instabilité des microsatellites est une manifestation phénotypique d’une défaillance du système MMR.
Deux techniques pour rechercher une instabilité des microsatellites somatique
La recherche d’instabilité des microsatellites somatique se fait sur tissu tumoral.
Il existe deux techniques pour la rechercher : l’immunohistochimie (IHC) qui étudie le statut du système MMR (proficient ou pMMR-IHC ; déficient ou dMMR-IHC), et la biologie moléculaire par PCR (polymerase chain reaction) [statut stable, ou MSS ; statut instable, ou MSI].
Immunohistochimie : un test accessible
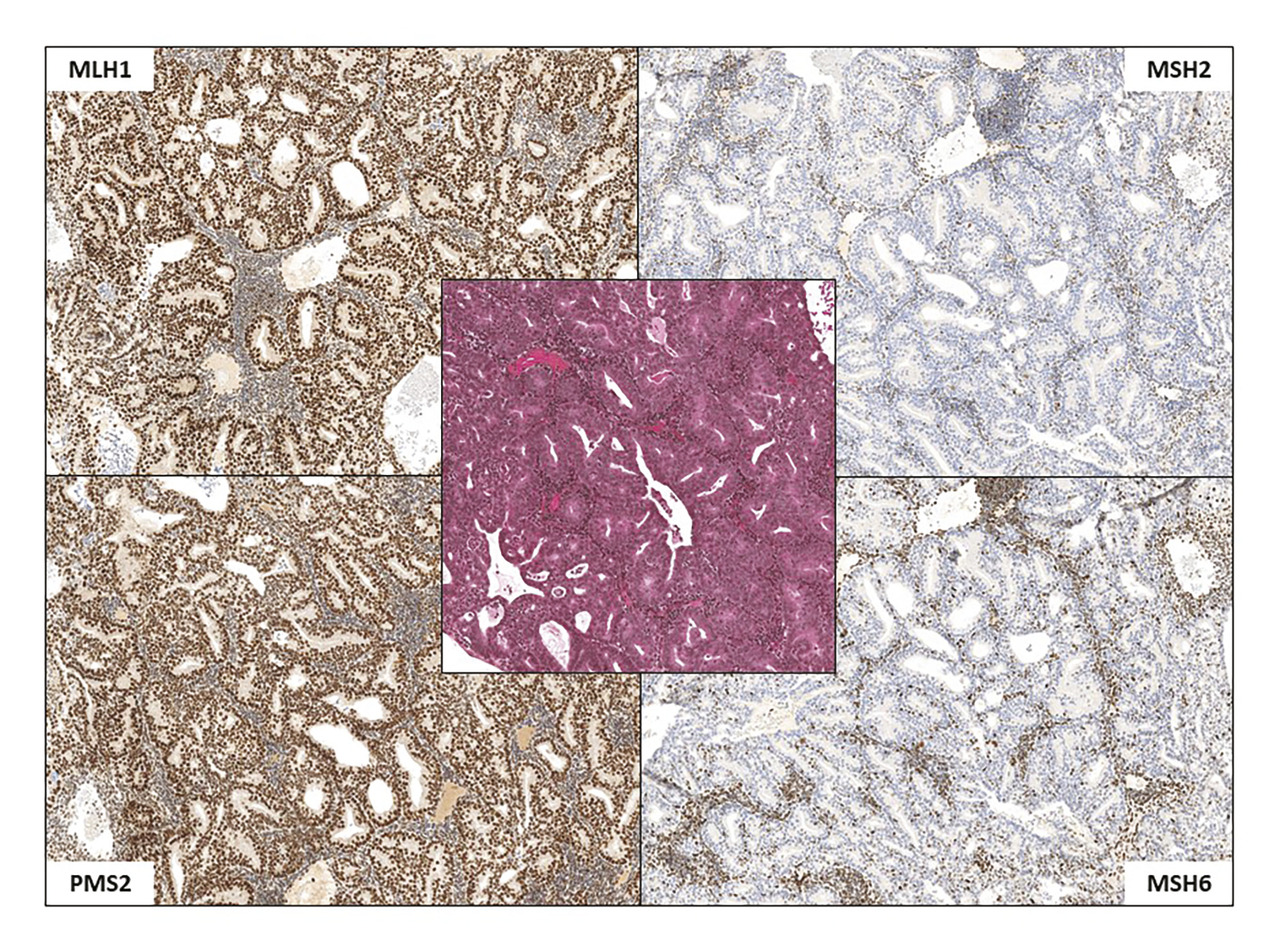
L’IHC est une technique couramment utilisée qui permet de détecter au microscope, à l’aide d’anticorps, la présence d’une protéine dans les cellules, dans le compartiment nucléaire, cytoplasmique ou membranaire selon la protéine recherchée. Cet examen est facile à réaliser même sur peu de matériel, disponible en routine dans tout laboratoire de pathologie, avec un résultat rapide dès le diagnostic.
Pour évaluer le statut MMR, il est recommandé d’utiliser quatre anticorps ciblant les protéines majeures du système MMR (MLH1, MSH2, MSH6, PMS2).1 Ces protéines sont normalement présentes dans le noyau des cellules et fonctionnent deux à deux en hétérodimères : MSH2 avec MSH6 ; MLH1 avec PMS2.
S’il existe une perte d’expression nucléaire d’au moins une protéine du système MMR, la tumeur a un statut dMMR-IHC (
En cas de conservation de l’expression des quatre protéines MMR, la tumeur a un statut pMMR-IHC.
Certains cas peuvent être d’interprétation délicate, équivoque ou douteuse.
Biologie moléculaire : cinq marqueurs nucléotidiques
Cette technique par PCR, réalisée dans un service ou une plateforme de biologie moléculaire, n’est possible que si l’échantillon contient un minimum de 20 % de cellules tumorales. Les délais de rendu des résultats sont plus longs que ceux de l’analyse par immunohistochimie.
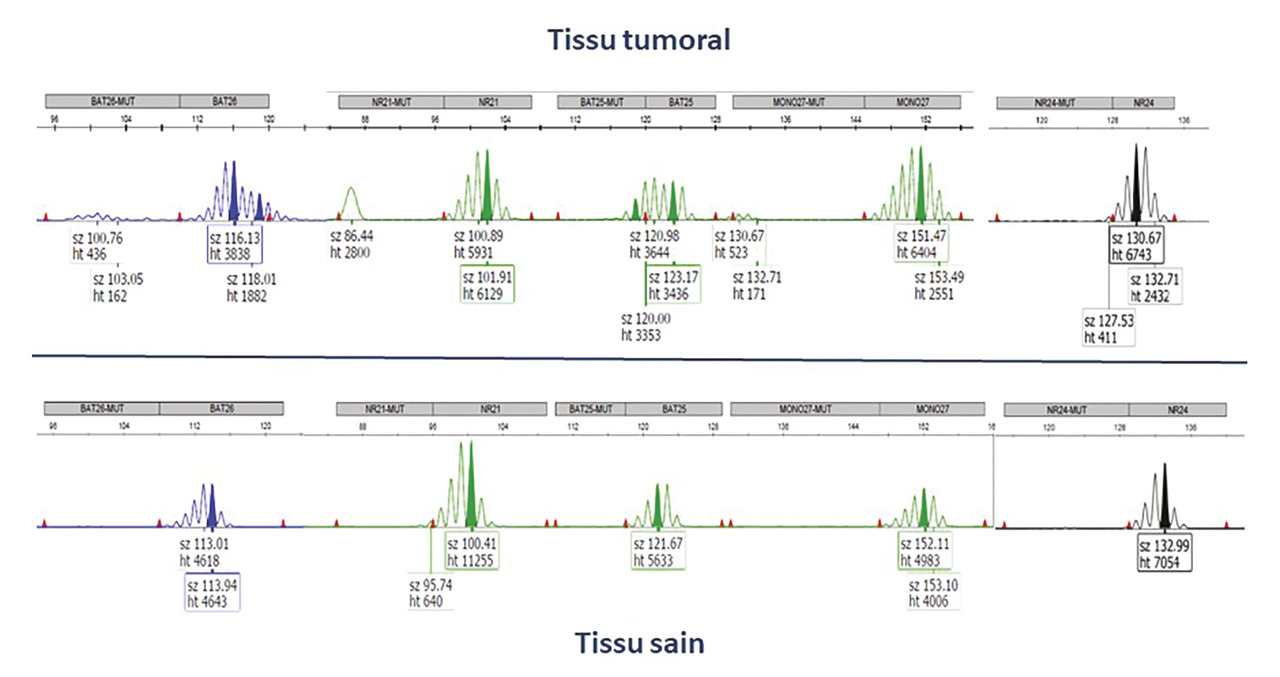
L’anatomopathologiste doit d’abord procéder à un examen préanalytique précisant la cellularité tumorale (ou la proportion de cellules tumorales dans le tissu) et localisant tissu tumoral et tissu sain. Après extraction, l’ADN est amplifié par PCR ; il est recommandé d’utiliser le panel NCI (National Cancer Institute) Pentaplex permettant la coamplification de cinq séquences d’ADN microsatellitaires (marqueurs nucléotidiques : BAT-25, BAT-26, NR21, NR22 ou NR27/Mono-27, NR24).1
L’instabilité des microsatellites est détectée par l’analyse des tailles de fragments sur électrophorèse capillaire. Pour le cancer de l’endomètre, une analyse comparative avec l’ADN de tissu non tumoral est recommandée.1
Si au moins deux marqueurs sur les cinq sont instables, la tumeur a un statut MSI (
Si aucun marqueur n’est instable, la tumeur a un statut MSS.
Si seul un marqueur sur les cinq est instable, une comparaison entre ADN tumoral et ADN non tumoral de la patiente est indispensable.
La présence d’instabilité des microsatellites somatique modifie la prise en charge
La recherche d’instabilité des microsatellites somatique dans les cancers de l’endomètre a un triple intérêt : elle permet de diagnostiquer un syndrome de Lynch, syndrome héréditaire de prédisposition au cancer, et de classer la tumeur, à visée à la fois pronostique et thérapeutique.
Diagnostic d’un syndrome de Lynch
Environ 30 % des cancers de l’endomètre ont un statut dMMR/MSI. Ce statut peut être sporadique (75 % des cas) ou être lié à un syndrome héréditaire (2 à 5 % des cancers de l’endomètre).2
Le syndrome de Lynch constitue une prédisposition héréditaire autosomique dominante au cancer. Les patients sont porteurs d’une mutation constitutionnelle d’un gène du système MMR sur un allèle ; il s’agit principalement des gènes MSH2, MLH1, MSH6 et exceptionnellement PMS2. Il suffit d’un événement génétique somatique sur l’autre allèle pour permettre le développement d’une tumeur. Dans ce syndrome, les patients peuvent développer à un âge jeune (avant 50-60 ans) des tumeurs dans différentes localisations (côlon, estomac, endomètre, ovaire, voies biliaires, voies urinaires, pancréas...).
Les cancers de l’endomètre survenant dans le cadre d’un syndrome de Lynch sont parfois inauguraux, et l’évaluation du statut microsatellitaire tumoral a une place centrale dans la stratégie diagnostique du syndrome de Lynch.
Adoption des classifications moléculaires pour évaluer le pronostic
Dans les années 1980, les cancers de l’endomètre ont été divisés en deux groupes anatomocliniques, de pronostic très différent :
– les cancers de type I, les plus fréquents (80 %), hormonodépendants, de type histologique endométrioïde et mucineux, de bon pronostic (survie globale à cinq ans de 80 %) ;
– les cancers de type II, non hormonodépendants, de type histologique séreux, à cellules claires ou carcinosarcome, de mauvais pronostic (survie globale à cinq ans de 40 %).
En 2013, The Cancer Genome Atlas (TCGA) a décrit quatre grands sous-groupes moléculaires dans le cancer de l’endomètre : le groupe « ultramuté » avec mutation de la polymerase epsilon (POLE) ; le groupe « hypermuté » MSI ; le groupe « faible nombre de copies » (ou NSMP, no specific molecular profile) et le groupe « nombre de copies élevé » avec p53 anormale.3 Le groupe « ultramuté » (POLE mutée) est de très bon pronostic, avec une survie à cinq ans autour de 95 % ; le groupe « nombre de copies élevé » (ou p53 anormale) est de pronostic péjoratif avec une survie à cinq ans autour de 40 %. Les deux autres groupes sont de pronostic intermédiaire.4 Dans la dernière version de sa classification des cancers de l’endomètre, l’Organisation mondiale de la santé (OMS) a intégré ces groupes moléculaires.5
De même, l’European Society of Gynaecological Oncology (ESGO), l’European Society for Radiotherapy and Oncology (ESTRO), et l’European Society of Pathology (ESP) ont ajouté, en 2021, les données moléculaires dans les groupes de risque pour permettre une prise en charge thérapeutique plus adaptée (
Instabilité des microsatellites : quel impact sur le traitement ?
Le traitement du cancer de l’endomètre est fondé sur la chirurgie, à laquelle peuvent s’ajouter la curiethérapie vaginale, la radiothérapie externe, un traitement anti-hormonal ou une chimiothérapie en fonction de différents critères.
Le statut MMR tumoral permet d’adapter le traitement du cancer de l’endomètre.
Ainsi, pour les tumeurs à haut risque dMMR/MSI, la chimiothérapie adjuvante n’apporte pas de bénéfice en matière de survie sans récidive.7
Par ailleurs, dans les cancers de l’endomètre avancés ou en récidive, un traitement par immunothérapie antitumorale peut être proposé : inhibiteurs de checkpoints immuns qui stimulent la réponse immunitaire de la patiente contre les cellules cancéreuses (anti-PD1, anti-PD-L1). Seules les tumeurs dMMR/MSI sont éligibles à cette option thérapeutique ; la réalisation des deux techniques d’évaluation (test MMR-IHC et test MSI) est donc nécessaire pour les identifier.
Stratégie d’analyse des microsatellites
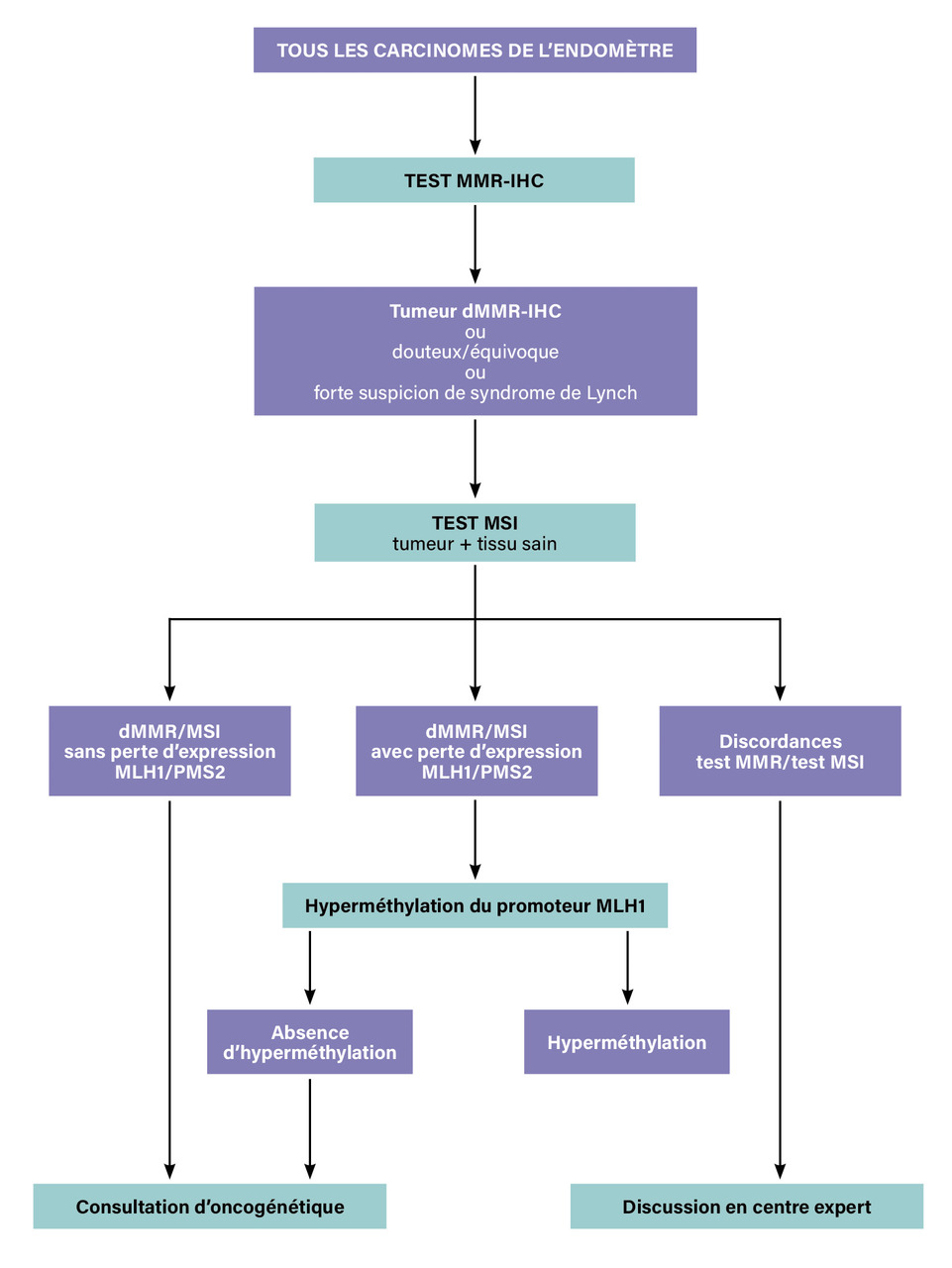
À la suite des récentes avancées en matière de diagnostic, de pronostic et de traitements dans le cancer de l’endomètre, l’Institut national du cancer (INCa) a publié, en novembre 2021, des recommandations1 sur l’évaluation du statut MMR tumoral : une évaluation systématique du statut MMR tumoral doit être réalisée dès le diagnostic pour tout cancer de l’endomètre, quels que soient le stade, l’âge et le contexte personnel et familial de la patiente.
En première intention, il est recommandé d’évaluer le statut MMR tumoral par IHC. En cas de statut dMMR-IHC ou de résultat équivoque (douteux), l’évaluation en biologie moléculaire est recommandée.
Les tumeurs dMMR-IHC avec perte d’expression de MLH1 en IHC doivent bénéficier d’une recherche d’hyperméthylation du promoteur MLH1 en biologie moléculaire ; si elle existe, le statut dMMR/MSI est sporadique et non héréditaire.
En cas de discordance entre les deux tests, le cas fait l’objet d’une discussion en centre expert.
S’il existe une forte suspicion de syndrome de Lynch, il est recommandé de réaliser d’emblée les deux tests.
Une consultation d’oncogénétique est indiquée en cas de suspicion de forme héréditaire, pour une analyse génétique constitutionnelle (
Recherche d’instabilité des microsatellites : désormais incontournable
L’évaluation du statut MMR, en immunohistochimie et/ou en biologie moléculaire est dorénavant recommandée et indispensable pour tout cancer de l’endomètre. Ce statut permet en effet d’optimiser les modalités de prise en charge des patientes.
1. Institut national du cancer (INCa). Évaluation du statut MMR tumoral. 2021, 213 pages.
2. Goodfellow PJ, Billingsley CC, Lankes HA, Ali S, Cohn DE, Broaddus RJ, et al. Combined microsatellite instability, MLH1 methylation analysis, and immunohistochemistry for Lynch syndrome screening in endometrial cancers from GOG210: An NRG Oncology and Gynecologic Oncology Group Study. J Am Soc Clin Oncol 2015;33(36):4301‑8.
3. Cancer Genome Atlas Research Network, Kandoth C, Schultz N, Cherniack AD, Akbani R, Liu Y, et al. Integrated genomic characterization of endometrial carcinoma. Nature 2013;497(7447):67‑73.
4. Raffone A, Travaglino A, Mascolo M, Carbone L, Guida M, Insabato L, et al. TCGA molecular groups of endometrial cancer: Pooled data about prognosis. Gynecol Oncol 2019;155(2):374‑83.
5. Board WC of TE. Female Genital Tumours (internet) [cité le 11 avril 2022]. Disponible sur https://publications.iarc.fr/Book-And-Report-Series/Who-Classification-Of-Tumours/Female-Genital-Tumours-2020
6. Concin N, Matias-Guiu X, Vergote I, Cibula D, Mirza MR, Marnitz S, et al. ESGO/ESTRO/ESP guidelines for the management of patients with endometrial carcinoma. Int J Gynecol Cancer 2021;31(1):12‑39.
7. León-Castillo A, de Boer SM, Powell ME, Mileshkin LR, Mackay HJ, Leary A, et al. Molecular classification of the PORTEC-3 trial for high-risk endometrial cancer: Impact on prognosis and benefit from adjuvant therapy. J Clin Oncol 2020;38(29):3388‑97.