L’ischémie mésentérique (ou ischémie intestinale) est une entité clinique large regroupant l’ensemble des troubles de la perfusion intestinale. Sa définition associe une souffrance intestinale, anatomique ou fonctionnelle, consécutive à une insuffisance vasculaire mésentérique. L’insuffisance de perfusion intestinale peut être occlusive ou non occlusive, aiguë ou chronique, artérielle ou veineuse, segmentaire ou étendue.1, 2 L’ischémie mésentérique aiguë (IMA) artérielle, ou ischémie intestinale aiguë, est une urgence vasculaire et intestinale. Il s’agit d’un accident vasculaire, le plus souvent lié à une obstruction artérielle, à l’origine d’un processus ischémique intestinal. En d’autres termes, l’IMA est à l’intestin ce que l’accident vasculaire cérébral est au cerveau et l’infarctus du myocarde au cœur. Le diagnostic clinique est difficile, en raison d’une sémiologie peu spécifique, expliquant de fréquents retards diagnostiques.3 Dans ce dossier, nous traiterons des formes occlusives artérielles, qui représentent environ 85 à 95 % des ischémies mésentériques.
Comprendre la physiopathologie
Connaître la vascularisation du système digestif, ses particularités et les mécanismes qui président à l’ischémie est un prérequis nécessaire à une prise en soins de qualité.
Trois principaux axes artériels pour le système digestif
La vascularisation des organes digestifs est assurée par trois axes artériels principaux : le tronc cœliaque (TC), l’artère mésentérique supérieure (AMS) et l’artère mésentérique inférieure (AMI), naissant de l’aorte abdominale, d’amont en aval. De façon schématique, on associe volontiers à chacun de ces grands axes artériels la vascularisation des organes suivants :
– TC : organes sus-mésocoliques (foie, rate, duodéno-pancréas, estomac, voies biliaires intra- et extra-hépatiques) ;
– AMS : pancréas, jéjunum, iléon, côlon droit ;
– AMI : côlon transverse et côlon gauche.
Ces territoires artériels communiquent entre eux par des réseaux anastomotiques complexes, suivant de multiples variations interindividuelles. Les réseaux anastomotiques ont une propriété de plasticité vasculaire. Il s’agit de la susceptibilité de certains territoires artériels à se développer de manière compensatoire en réponse à une occlusion artérielle tronculaire ou distale, par exemple post-embolique ou athéromateuse. En pratique, ce phénomène est appelé la « collatéralité artérielle ». Cette multiplicité des vascularisations intestinales rend difficile la correspondance systématique entre la topographie des lésions vasculaires et celle des lésions intestinales et/ou coliques. De plus, les conséquences intestinales varient selon le mode d’installation, aiguë ou progressive, des lésions vasculaires.
Toutefois, l’artère princeps de la vascularisation intestinale est l’artère mésentérique supérieure. Elle constitue ainsi la cible privilégiée des revascularisations. Il est fréquent qu’une atteinte tronculaire proximale de cette AMS entraîne une souffrance intestinale étendue, alors qu’une atteinte distale, par exemple de l’artère iléo-cæco-appendiculaire, est associée à une atteinte segmentaire iléocæcale.
En résumé, l’ischémie mésentérique aiguë est l’expression d’une insuffisance de perfusion intestinale dans un territoire artériel majoritairement dominé par l’artère mésentérique supérieure, mais où les autres axes (tronc cœliaque et artère mésentérique inférieure) jouent des rôles secondaires et néanmoins non négligeables, par l’intermédiaire de réseaux anastomotiques variables.
La confusion entre ischémie colique gauche et ischémie mésentérique est fréquente. Cependant, leur physiopathologie, leur traitement et leur pronostic diffèrent en tous points. Quant à l’ischémie du côlon droit, elle doit être considérée, a priori, comme une IMA.
– TC : organes sus-mésocoliques (foie, rate, duodéno-pancréas, estomac, voies biliaires intra- et extra-hépatiques) ;
– AMS : pancréas, jéjunum, iléon, côlon droit ;
– AMI : côlon transverse et côlon gauche.
Ces territoires artériels communiquent entre eux par des réseaux anastomotiques complexes, suivant de multiples variations interindividuelles. Les réseaux anastomotiques ont une propriété de plasticité vasculaire. Il s’agit de la susceptibilité de certains territoires artériels à se développer de manière compensatoire en réponse à une occlusion artérielle tronculaire ou distale, par exemple post-embolique ou athéromateuse. En pratique, ce phénomène est appelé la « collatéralité artérielle ». Cette multiplicité des vascularisations intestinales rend difficile la correspondance systématique entre la topographie des lésions vasculaires et celle des lésions intestinales et/ou coliques. De plus, les conséquences intestinales varient selon le mode d’installation, aiguë ou progressive, des lésions vasculaires.
Toutefois, l’artère princeps de la vascularisation intestinale est l’artère mésentérique supérieure. Elle constitue ainsi la cible privilégiée des revascularisations. Il est fréquent qu’une atteinte tronculaire proximale de cette AMS entraîne une souffrance intestinale étendue, alors qu’une atteinte distale, par exemple de l’artère iléo-cæco-appendiculaire, est associée à une atteinte segmentaire iléocæcale.
En résumé, l’ischémie mésentérique aiguë est l’expression d’une insuffisance de perfusion intestinale dans un territoire artériel majoritairement dominé par l’artère mésentérique supérieure, mais où les autres axes (tronc cœliaque et artère mésentérique inférieure) jouent des rôles secondaires et néanmoins non négligeables, par l’intermédiaire de réseaux anastomotiques variables.
La confusion entre ischémie colique gauche et ischémie mésentérique est fréquente. Cependant, leur physiopathologie, leur traitement et leur pronostic diffèrent en tous points. Quant à l’ischémie du côlon droit, elle doit être considérée, a priori, comme une IMA.
De l’ischémie réversible à la défaillance multiviscérale
Le débit sanguin splanchno-mésentérique dépend des besoins métaboliques de l’intestin. Il représente entre 20 et 35 % du débit cardiaque, et augmente de façon significative lors des repas. L’ischémie mésentérique aiguë est la conséquence d’un défaut entre les besoins et les apports vasculaires de l’intestin. L’interruption ou la diminution brutale du débit sanguin splanchno-mésentérique peut être liée à une occlusion vasculaire (formes occlusives) et/ou à un bas débit systémique ou local (vasospasme) [formes non occlusives]. L’hypoperfusion et l’hypoxie touchent initialement l’épithélium des villosités intestinales. Le processus ischémique progresse ensuite en profondeur pour devenir transmural. Cette perte de la fonction de barrière entraîne une translocation de bactéries, d’endotoxines et de débris cellulaires qui conduit à une libération locale, régionale puis systémique de médiateurs pro-inflammatoires, elle-même à l’origine d’un syndrome inflammatoire de réponse systémique (SIRS), faisant du tube digestif un véritable foyer infectieux. La première phase du processus ischémique, déclenché par l’obstruction vasculaire, est réversible.4 Une prise en charge précoce pendant cette phase de réversibilité permet de sauver les segments d’intestin concernés. Si la prise en charge tarde, l’infarctus évolue vers la nécrose transmurale, c’est-à-dire atteignant l’ensemble des couches intestinales de la muqueuse à la séreuse. Ce stade est irréversible et nécessite une résection intestinale. En l’absence de revascularisation, le SIRS évolue vers un syndrome de défaillance multiviscérale et le décès.
Athérothrombose et embolie : principales causes
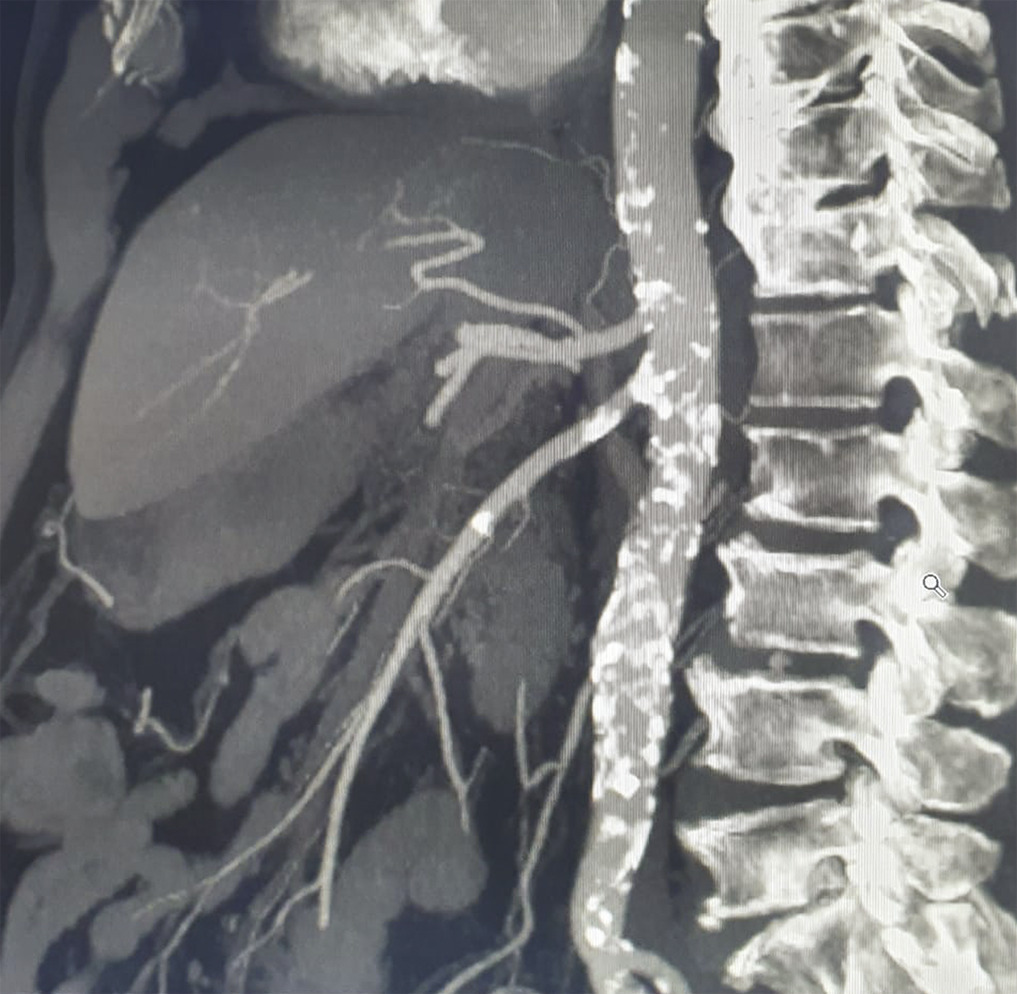
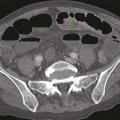
L’ischémie mésentérique aiguë artérielle représente 85 à 95 % des ischémies mésentériques et prédomine largement sur l’ischémie veineuse ou l’ischémie non occlusive. Les deux grandes causes d’occlusion de l’artère mésentérique supérieure sont l’athérothrombose (fig. 1 ) et l’embolie (fig. 2 ). L’atteinte athéromateuse des artères digestives, autrement appelée maladie occlusive mésentérique, est la principale cause d’ischémie mésentérique (60-65 %). Elle se caractérise par des lésions sténosantes calcifiées siégeant à la partie proximale des artères digestives. Une atteinte athéromateuse de l’aorte et des artères des membres inférieurs est souvent associée. La prévalence des lésions athéromateuses des artères digestives dans la population générale est élevée (17-50 %). Ces lésions sont néanmoins asymptomatiques dans la majorité des cas.
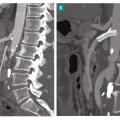
L’embolie est la deuxième cause d’ischémie mésentérique aiguë. L’IMA peut ainsi être la manifestation inaugurale d’une cardiopathie emboligène ou survenir chez des patients ayant une cardiopathie connue. L’ischémie mésentérique aiguë embolique doit faire rechercher une fibrillation atriale (FA) ou un flutter, un thrombus intracardiaque ou une plaque athéromateuse emboligène de l’aorte thoracique. L’IMA peut donc être considérée comme une complication rare mais grave de la FA.
Les autres causes sont nettement plus rares : la dissection aortique, la médiolyse artérielle segmentaire, les vascularites inflammatoires, le syndrome du ligament arqué. La connaissance épidémiologique des maladies vasculaires intestinales est limitée par l’absence d’étude longitudinale exhaustive et de centres de référence. Par conséquent, une étiologie vasculaire devrait être systématiquement évoquée devant toute douleur abdominale postprandiale et/ou brutale, intense et inhabituelle, et recherchée par un angioscanner abdomino-pelvien.
L’embolie est la deuxième cause d’ischémie mésentérique aiguë. L’IMA peut ainsi être la manifestation inaugurale d’une cardiopathie emboligène ou survenir chez des patients ayant une cardiopathie connue. L’ischémie mésentérique aiguë embolique doit faire rechercher une fibrillation atriale (FA) ou un flutter, un thrombus intracardiaque ou une plaque athéromateuse emboligène de l’aorte thoracique. L’IMA peut donc être considérée comme une complication rare mais grave de la FA.
Les autres causes sont nettement plus rares : la dissection aortique, la médiolyse artérielle segmentaire, les vascularites inflammatoires, le syndrome du ligament arqué. La connaissance épidémiologique des maladies vasculaires intestinales est limitée par l’absence d’étude longitudinale exhaustive et de centres de référence. Par conséquent, une étiologie vasculaire devrait être systématiquement évoquée devant toute douleur abdominale postprandiale et/ou brutale, intense et inhabituelle, et recherchée par un angioscanner abdomino-pelvien.
Ischémie mésentérique aiguë : réduction drastique de la mortalité
En l’absence de traitement, l’IMA conduit au décès dans près de 100 % des cas. Dans les formes traitées, sa mortalité historique est de l’ordre de 50 à 80 % dans la littérature. Ce pronostic sombre a nourri l’imaginaire de plusieurs générations de médecins. Déconstruire cet imaginaire et ancrer la réalité des résultats actuels des centres experts dans les représentations collectives sont un défi pédagogique immense. Il se jouera tant au niveau de la formation médicale initiale que dans la formation continue. Depuis la création de la Structure d’URgences Vasculaires Intestinales (SURVI), une prise en charge multidisciplinaire et multimodale, répondant à la physiopathologie de l’IMA et fondée sur la préservation intestinale, a permis de réduire drastiquement la mortalité à 20 %, soit une survie de 80 %.5 Dans notre expérience, la résection intestinale peut être évitée dans deux cas sur trois.
Diagnostic : un faisceau d’arguments
Le diagnostic d’ischémie mésentérique aiguë repose sur l’association d’arguments cliniques, biologiques et radiologiques.
– une défaillance d’organe et, a fortiori, un état de choc ;
– un taux de lactate plasmatique > 2 mmol/L ;
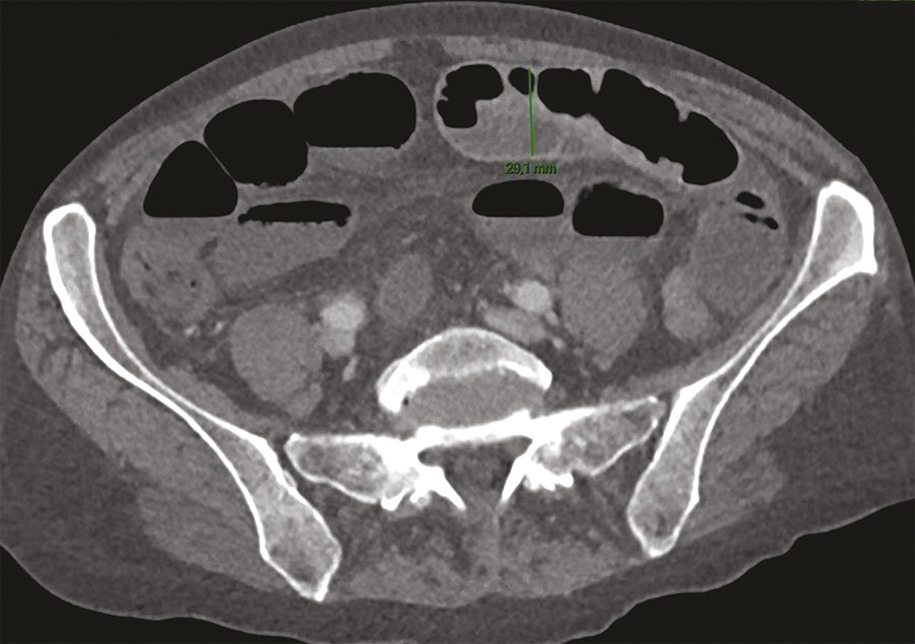
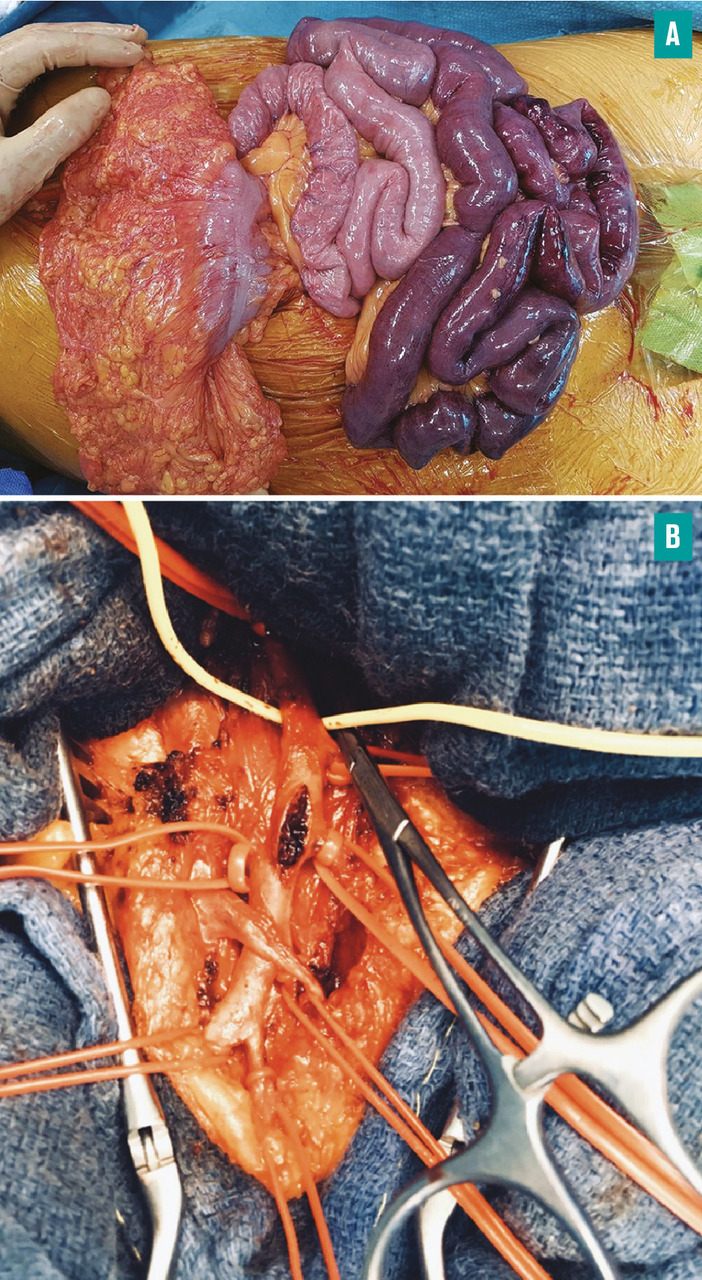
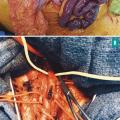
– une dilatation intestinale > 25 mm ou des signes directs de complication : perforation, péritonite (fig. 3 ).
L’IMA tardive est associée à une forte suspicion de nécrose intestinale, nécessitant une exploration chirurgicale urgente.
L’ischémie mésentérique aiguë précoce se caractérise par l’absence de ces critères. Cette forme ne doit toutefois surtout pas rassurer le clinicien et doit conduire à une prise en charge urgente et agressive, visant à rétablir la perfusion vasculaire. L’enjeu thérapeutique est d’autant plus important à ce stade réversible.
– de poser le diagnostic positif d’IMA ;
– de s’assurer de l’absence de diagnostic différentiel ;
– d’évaluer les lésions vasculaires : l’indication du geste de revascularisation est guidée par le mécanisme de l’occlusion, athérothrombose ou embolie, et la morphologie des lésions ;
– d’évaluer la viabilité intestinale.
Les signes de souffrance intestinale incluent un épaississement ou un amincissement pariétal, une hyperhémie muqueuse ou un défaut de rehaussement de la paroi intestinale, une pneumatose pariétale, un signe du peigne, un feces sign ou une infiltration de la graisse périmésentérique, enfin la dilatation des anses intestinales > 25 mm.
Clinique : identifier les formes précoces
La sémiologie de l’IMA est fruste et trompeuse. Or l’enjeu diagnostique est majeur, puisque le pronostic des formes précoces est sans commune mesure avec celui des formes tardives. À l’encontre des idées reçues, la plupart des patients consultent aux urgences à un stade précoce, donc potentiellement réversible mais encore insuffisamment reconnu. En effet, lors de la consultation initiale, la majorité des patients n’a ni défaillance d’organe, ni défense abdominale, ni élévation du lactate, et ne rapporte pas toujours d’antécédent cardiovasculaire. En revanche, la douleur abdominale aiguë est constante, inaugurale ou aggravant un angor mésentérique évoluant depuis plusieurs semaines. La douleur abdominale est d’apparition brutale ou rapidement progressive, intense (requérant un morphinique), continue, périombilicale ou diffuse, et contraste avec une palpation abdominale qui peut être faussement rassurante, même au stade de nécrose intestinale étendue. Les vomissements, une diarrhée, une hémorragie digestive sont inconstants.Formes tardives et nécrose intestinale sont liées
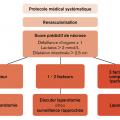
L’ischémie mésentérique aiguë tardive est définie par au moins un des critères suivants :6– une défaillance d’organe et, a fortiori, un état de choc ;
– un taux de lactate plasmatique > 2 mmol/L ;
– une dilatation intestinale > 25 mm ou des signes directs de complication : perforation, péritonite (
L’IMA tardive est associée à une forte suspicion de nécrose intestinale, nécessitant une exploration chirurgicale urgente.
L’ischémie mésentérique aiguë précoce se caractérise par l’absence de ces critères. Cette forme ne doit toutefois surtout pas rassurer le clinicien et doit conduire à une prise en charge urgente et agressive, visant à rétablir la perfusion vasculaire. L’enjeu thérapeutique est d’autant plus important à ce stade réversible.
Angioscanner abdominal, examen de référence
L’angioscanner abdominopelvien injecté aux temps artériel et portal est l’examen de référence dans l’ischémie mésentérique aiguë.7 C’est le seul examen d’imagerie à réaliser en urgence, même en cas d’insuffisance rénale aiguë, le risque de méconnaître une IMA dépassant largement celui de l’injection de produit de contraste. Il permet :– de poser le diagnostic positif d’IMA ;
– de s’assurer de l’absence de diagnostic différentiel ;
– d’évaluer les lésions vasculaires : l’indication du geste de revascularisation est guidée par le mécanisme de l’occlusion, athérothrombose ou embolie, et la morphologie des lésions ;
– d’évaluer la viabilité intestinale.
Les signes de souffrance intestinale incluent un épaississement ou un amincissement pariétal, une hyperhémie muqueuse ou un défaut de rehaussement de la paroi intestinale, une pneumatose pariétale, un signe du peigne, un feces sign ou une infiltration de la graisse périmésentérique, enfin la dilatation des anses intestinales > 25 mm.
La biologie n’est pas spécifique
À l’heure actuelle, il n’existe aucun biomarqueur spécifique de d’ischémie mésentérique aiguë. Le L-lactate n’a aucun rôle dans le diagnostic, mais semble avoir un intérêt pronostique car son élévation traduit une forme plutôt tardive.6 Le syndrome inflammatoire de réponse systémique (SIRS) induit par l’IMA se traduit par un syndrome inflammatoire biologique aspécifique, avec une élévation de la protéine C réactive (CRP) et une hyperleucocytose.Des avancées thérapeutiques majeures
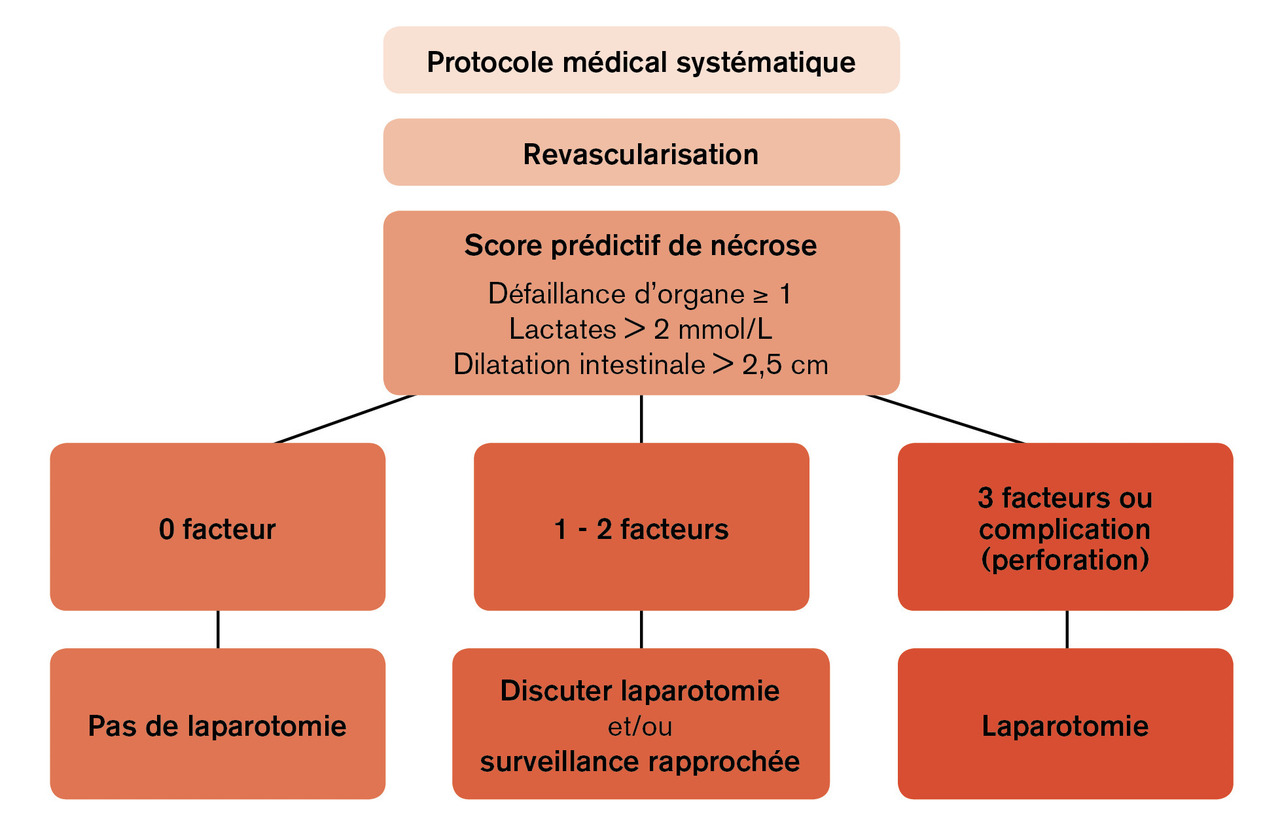
Les progrès récents de la prise en charge de l’ischémie mésentérique aiguë au sein de SURVI ont été réalisés grâce à une collaboration multidisciplinaire et multimodale. Les trois grands principes du traitement sont :
– un protocole médical multimodal anti-ischémique ;
– une revascularisation intestinale la plus précoce possible ;
– l’évaluation et la résection intestinale en cas de nécrose irréversible.
Le traitement doit être réalisé sans délai. Les conséquences des retards de prise en charge, encore trop fréquents, sont extrêmement péjoratives.
– une anticoagulation curative par héparine non fractionnée ;
– une anti-agrégation intraveineuse par aspirine ;
– une antibiothérapie orale de décontamination digestive voire systémique en cas de sepsis sévère8 ;
– le repos intestinal strict ;
– un traitement par inhibiteur de la pompe à protons à double dose ;
– le maintien d’une volémie efficace.
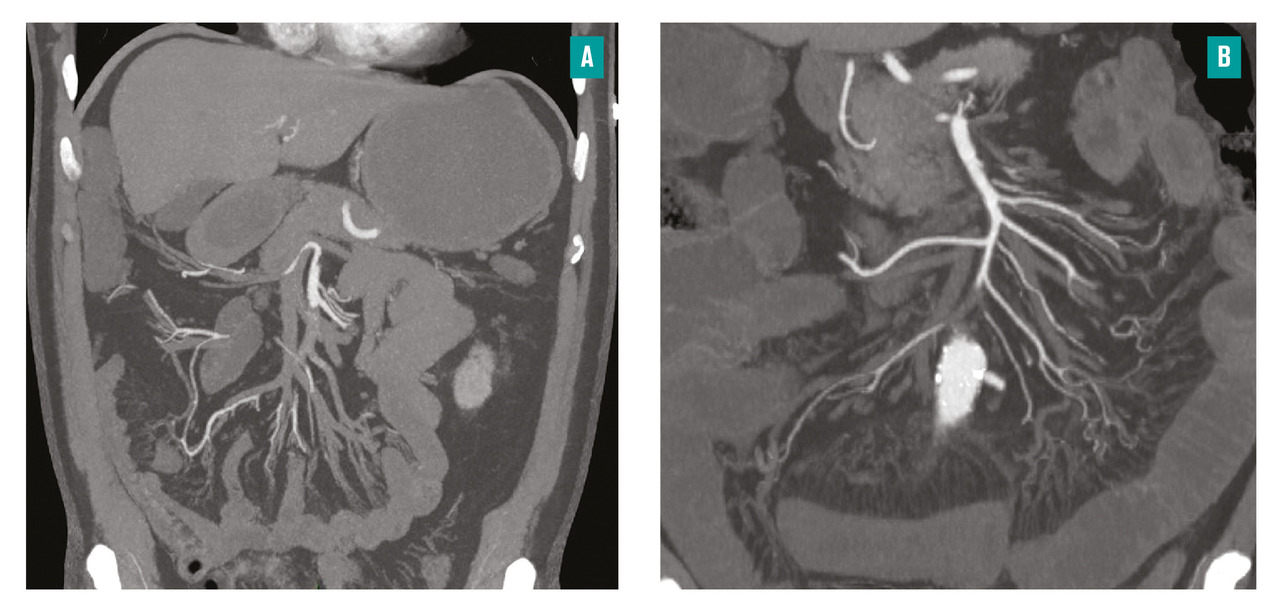
Concernant les formes précoces, les procédures endovasculaires percutanées mini-invasives sont privilégiées : thrombo-aspiration et/ou fibrinolyse in situ pour les formes emboliques, stenting de l’artère mésentérique supérieure antérograde pour les formes athéromateuses (fig. 4 ).10 Concernant les formes tardives, une laparotomie est indiquée car la forte probabilité de nécrose intestinale irréversible impose une évaluation chirurgicale de l’intestin grêle. Les techniques alors utilisées sont la thrombectomie à la sonde de Fogarty pour les formes emboliques, le stenting rétrograde de l’AMS ou le pontage ilio-mésentérique.11
fig. 5 ). L’étendue de la résection intestinale doit être discutée de façon collégiale avant/pendant l’intervention de façon à éviter des résections déraisonnables, notamment chez le sujet âgé. Des stomies sont systématiquement confectionnées et dans le même orifice. Elles permettent la surveillance postopératoire de l’intestin et évitent le plus souvent un « deuxième look » chirurgical. La continuité intestinale est rétablie par voie élective après un délai de 6 à 8 semaines.
– un protocole médical multimodal anti-ischémique ;
– une revascularisation intestinale la plus précoce possible ;
– l’évaluation et la résection intestinale en cas de nécrose irréversible.
Le traitement doit être réalisé sans délai. Les conséquences des retards de prise en charge, encore trop fréquents, sont extrêmement péjoratives.
Un protocole médical multimodal anti-ischémique
Un protocole médical répondant à la physiopathologie de l'ischémie mésentérique aigüe doit être instauré dès la confirmation du diagnostic.5 Son objectif est la préservation intestinale, le traitement du SIRS et des défaillances d’organes. Il comprend :– une anticoagulation curative par héparine non fractionnée ;
– une anti-agrégation intraveineuse par aspirine ;
– une antibiothérapie orale de décontamination digestive voire systémique en cas de sepsis sévère8 ;
– le repos intestinal strict ;
– un traitement par inhibiteur de la pompe à protons à double dose ;
– le maintien d’une volémie efficace.
Revasculariser l’intestin viable au plus vite
La revascularisation précoce est la seule thérapeutique susceptible d’éviter/limiter une nécrose irréversible.9 La stratégie de revascularisation est conditionnée par l’étiologie, la morphologie des lésions de l’artère mésentérique supérieure à l’angioscanner et le caractère précoce ou tardif de l’IMA. La revascularisation cible l’artère mésentérique supérieure. Elle doit être réalisée dans un centre où l’ensemble des techniques de radiologie et de chirurgie vasculaire peuvent être proposées, car il n’est pas rare que l’on ait recours à plusieurs techniques chez un même patient.Concernant les formes précoces, les procédures endovasculaires percutanées mini-invasives sont privilégiées : thrombo-aspiration et/ou fibrinolyse in situ pour les formes emboliques, stenting de l’artère mésentérique supérieure antérograde pour les formes athéromateuses (
Réséquer l’intestin non viable
La revascularisation précède la résection et en délimite les marges (Suivi et poursuite des explorations
Une fois l’ischémie mésentérique aiguë résolue et le patient stabilisé, l’enquête étiologique doit être poursuivie, notamment par un bilan cardiovasculaire et de thrombophilie complet. Les facteurs de risque associés doivent être identifiés et traités. Un suivi au long cours, notamment nutritionnel, dans un centre spécialisé est essentiel.
Ischémie mésentérique chronique : de nombreuses formes atypiques
L’ischémie mésentérique chronique est caractérisée par une ischémie fonctionnelle, ou angor d’effort en période prandiale/postprandiale. Classiquement, elle survient chez des patients ayant une atteinte d’au moins deux artères digestives sur trois (règle de Mikkelsen) dont l’artère mésentérique supérieure. Une atteinte monotronculaire (AMS ou tronc cœliaque) est possible, bien que nettement plus rare. Du fait de la prévalence élevée des lésions asymptomatiques des artères digestives dans la population générale, poser le diagnostic d’ischémie mésentérique chronique n’est pas toujours évident, surtout si la symptomatologie abdominale est atypique.12
Le diagnostic peut être difficile
Le diagnostic d’ischémie mésentérique chronique repose sur l’association d’une symptomatologie concordante, de lésions occlusives des artères digestives et de l’absence de diagnostic différentiel.
– des douleurs abdominales per- ou postprandiales mal systématisées ;
– une peur de l’alimentation (« food fear ») ;
– une perte de poids (à un stade plus tardif).
L’examen clinique est peu contributif. Un angor initialement stable peut entraîner une dénutrition. Progressivement, le seuil alimentaire à partir duquel la douleur abdominale survient diminue. Il s’agit alors d’un angor instable. Dans sa forme la plus sévère, l’angor instable évolue en syndrome de menace, ou acutisation d’une forme chronique (« acute-on-chronic » des Anglo-Saxons). Cliniquement, le syndrome de menace se manifeste par une douleur abdominale intense déclenchée par la moindre prise alimentaire et tardant à s’apaiser entre les prises. Dans cette situation, le risque d’ischémie mésentérique aiguë est majeur. Cette symptomatologie ischémique se rapproche de celle de l’artériopathie des membres inférieurs au stade d’ischémie critique, ou de l’angor coronarien instable. Cependant, les formes typiques ne représentent pas la majorité des ischémies mésentériques chroniques. Les manifestations atypiques sont nombreuses, mimant une maladie intestinale inflammatoire ou fonctionnelle.
– un angioscanner abdominal non injecté, artériel et portal ;
– un écho-Doppler des artères digestives (par un opérateur entraîné +++), à jeun et après effort (repas test) ;
– une exploration endoscopique haute et basse ;
– un bilan nutritionnel ;
– un bilan étiologique cardiovasculaire et thromboembolique.
Pour pallier les difficultés diagnostiques persistantes, notamment des formes précoces et/ou atypiques, un nouvel outil endoscopique prometteur est en cours d’évaluation : l’oxymétrie tissulaire par spectroscopie de lumière blanche (visible light spectroscopy, VLS). Cette technique permet de mesurer la saturation en dioxygène de l’hémoglobine tissulaire de la muqueuse œsogastroduodénale, au moyen d’un cathéter introduit par le canal opérateur de l’endoscope.
Angor mésentérique
Typiquement, l’angor mésentérique se manifeste par une triade symptomatique associant :– des douleurs abdominales per- ou postprandiales mal systématisées ;
– une peur de l’alimentation (« food fear ») ;
– une perte de poids (à un stade plus tardif).
L’examen clinique est peu contributif. Un angor initialement stable peut entraîner une dénutrition. Progressivement, le seuil alimentaire à partir duquel la douleur abdominale survient diminue. Il s’agit alors d’un angor instable. Dans sa forme la plus sévère, l’angor instable évolue en syndrome de menace, ou acutisation d’une forme chronique (« acute-on-chronic » des Anglo-Saxons). Cliniquement, le syndrome de menace se manifeste par une douleur abdominale intense déclenchée par la moindre prise alimentaire et tardant à s’apaiser entre les prises. Dans cette situation, le risque d’ischémie mésentérique aiguë est majeur. Cette symptomatologie ischémique se rapproche de celle de l’artériopathie des membres inférieurs au stade d’ischémie critique, ou de l’angor coronarien instable. Cependant, les formes typiques ne représentent pas la majorité des ischémies mésentériques chroniques. Les manifestations atypiques sont nombreuses, mimant une maladie intestinale inflammatoire ou fonctionnelle.
Une batterie d’explorations paracliniques
La suspicion clinique d’ischémie mésentérique chronique impose les examens suivants :– un angioscanner abdominal non injecté, artériel et portal ;
– un écho-Doppler des artères digestives (par un opérateur entraîné +++), à jeun et après effort (repas test) ;
– une exploration endoscopique haute et basse ;
– un bilan nutritionnel ;
– un bilan étiologique cardiovasculaire et thromboembolique.
Pour pallier les difficultés diagnostiques persistantes, notamment des formes précoces et/ou atypiques, un nouvel outil endoscopique prometteur est en cours d’évaluation : l’oxymétrie tissulaire par spectroscopie de lumière blanche (visible light spectroscopy, VLS). Cette technique permet de mesurer la saturation en dioxygène de l’hémoglobine tissulaire de la muqueuse œsogastroduodénale, au moyen d’un cathéter introduit par le canal opérateur de l’endoscope.
Revascularisation par voie endovasculaire ou chirurgie ouverte ?
La pierre angulaire du traitement de l’ischémie mésentérique chronique est la revascularisation des artères digestives, dont la cible privilégiée est l’artère mésentérique supérieure. Une revascularisation associée du tronc cœliaque est de plus en plus pratiquée.
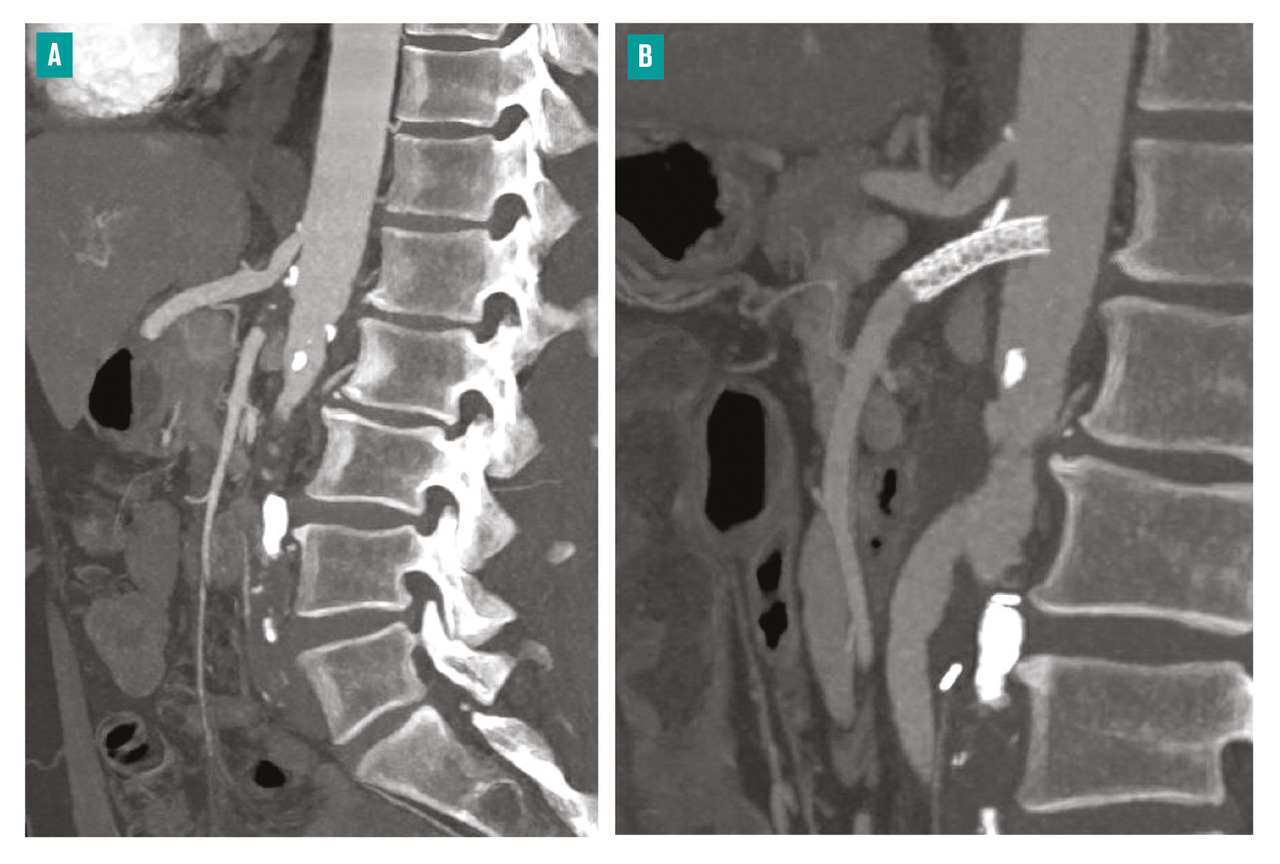
Les techniques endovasculaires percutanées mini-invasives sont privilégiées chaque fois que c’est possible, selon la morphologie des lésions. En cas d’échec ou de non-faisabilité du traitement endovasculaire, nous avons recours à des techniques chirurgicales ouvertes, par laparotomie (fig. 6 ) ou lombotomie : pontages aorto- ou iliomésentériques, stenting rétrograde de l’AMS.
Le choix de la technique de revascularisation doit être discuté de façon pluridisciplinaire et en accord avec le patient. Ces techniques offrent de bons résultats à court et moyen termes, mais nécessitent toutefois un suivi clinique et d’imagerie à long terme. Les réinterventions, le plus souvent endovasculaires, ne sont pas rares. Le traitement médical doit comprendre un inhibiteur de la pompe à protons et un antiagrégant plaquettaire au long cours.
Les techniques endovasculaires percutanées mini-invasives sont privilégiées chaque fois que c’est possible, selon la morphologie des lésions. En cas d’échec ou de non-faisabilité du traitement endovasculaire, nous avons recours à des techniques chirurgicales ouvertes, par laparotomie (
Le choix de la technique de revascularisation doit être discuté de façon pluridisciplinaire et en accord avec le patient. Ces techniques offrent de bons résultats à court et moyen termes, mais nécessitent toutefois un suivi clinique et d’imagerie à long terme. Les réinterventions, le plus souvent endovasculaires, ne sont pas rares. Le traitement médical doit comprendre un inhibiteur de la pompe à protons et un antiagrégant plaquettaire au long cours.
Favoriser le lien avec la médecine de ville
L’ischémie mésentérique est une urgence médicochirurgicale vasculaire et intestinale grave. Sa prise en charge est complexe puisqu’elle nécessite la coopération de nombreux acteurs et l’utilisation d’un plateau technique performant. Comprendre la nécessité d’une prise en charge multidisciplinaire et multimodale a récemment permis de réaliser des progrès majeurs. La création de SURVI a transformé le pronostic, en rassemblant l’expertise de gastroentérologues, chirurgiens vasculaires et digestifs, radiologues et anesthésistes-réanimateurs spécialisés dans l’ischémie mésentérique, au sein d’une même unité où le parcours des patients est optimisé. Afin de reconnaître et d’orienter les ischémies mésentériques aiguës à un stade encore plus précoce, le concours des médecins généralistes et des médecins urgentistes, au premier plan de la chaîne de soins, est essentiel pour continuer à améliorer ensemble le pronostic de cette maladie que l’on pensait autrefois incurable.
Le projet SURVI est soutenu financièrement par MSD Avenir.Dans le but de favoriser le lien avec la médecine de ville et les services d’accueil des urgences, l’équipe SURVI est disponible 24 h/24 (01 40 87 55 50) pour toute demande d’avis, avec possibilité de transmission d’une imagerie à distance.
Références
1. Corcos O, Nuzzo A. Gastro-intestinal vascular emergencies. Best Pract Res Clin Gastroenterol 2013;27(5):709-25.
2. Clair DG, Beach JM. Mesenteric ischemia. N Engl J Med 2016;374(10):959-68.
3. Nuzzo A, Joly F, Ronot M, Castier Y, Huguet A, Paugam-Burtz C, et al. Normal lactate and unenhanced CT-scan result in delayed diagnosis of acute Mmesenteric ischemia; SURVI group. Am J Gastroenterol 2020;115(11):1902-5.
4. Nuzzo A, Corcos O. Reversible acute mesenteric ischemia. N Engl J Med 2016;375(15):e31.
5. Corcos O, Castier Y, Sibert A, Gaujoux S, Ronot M, Joly F, et al. Effects of a multimodal management strategy for acute mesenteric ischemia on survival and intestinal failure. Clin Gastroenterol Hepatol 2013;11(2):158-65.e2.4.
6. Nuzzo A, Maggiori L, Ronot M, Becq A, Plessier A, Gault N, et al. Predictive factors of intestinal necrosis in acute mesenteric ischemia: prospective study from an intestinal stroke center. Am J Gastroenterol 2017;112(4):597-605.
7. Copin P, Zins M, Nuzzo A, Purcell Y, Beranger-Gibert S, Maggiori L, et al. Acute mesenteric ischemia: A critical role for the radiologist. Diagn Interv Imaging 2018;99(3):123-34.
8. Nuzzo A, Maggiori L, Paugam-Burtz C, Cazals-Hatem D, Ronot M, Huguet A, et al. Oral antibiotics reduce intestinal necrosis in acute mesenteric ischemia: A prospective cohort Study. Am J Gastroenterol 2019;114(2):348-51.
9. Roussel A, Castier Y, Nuzzo A, Pellenc Q, Sibert A, Panis Y, et al. Revascularization of acute mesenteric ischemia after creation of a dedicated multidisciplinary center. J Vasc Surg 2015;62(5):1251-6.
10. Girault A, Pellenc Q, Roussel A, Senemaud J, Cerceau P, Maggiori L, et al. Midterm results after covered stenting of the superior mesenteric artery. J Vasc Surg 2021:S0741-5214(21)00343-8.
11. Sénémaud JN, Roussel A, Pellenc Q, Chardigny C, Cerceau P, Corcos O, et al. Retrograde open mesenteric stenting for acute and chronic mesenteric ischaemia: Results from an intestinal stroke centre. Eur J Vasc Endovasc Surg 2021:S1078-5884(21)00276-8.
12. Terlouw LG, Moelker A, Abrahamsen J, Acosta S, Bakker OJ, Baumgartner I, et al. European guidelines on chronic mesenteric ischaemia - joint United European Gastroenterology, European Association for Gastroenterology, Endoscopy and Nutrition, European Society of Gastrointestinal and Abdominal Radiology, Netherlands Association of Hepatogastroenterologists, Hellenic Society of Gastroenterology, Cardiovascular and Interventional Radiological Society of Europe, and Dutch Mesenteric Ischemia Study group clinical guidelines on the diagnosis and treatment of patients with chronic mesenteric ischaemia. United European Gastroenterol J 2020;8(4):371-95.
2. Clair DG, Beach JM. Mesenteric ischemia. N Engl J Med 2016;374(10):959-68.
3. Nuzzo A, Joly F, Ronot M, Castier Y, Huguet A, Paugam-Burtz C, et al. Normal lactate and unenhanced CT-scan result in delayed diagnosis of acute Mmesenteric ischemia; SURVI group. Am J Gastroenterol 2020;115(11):1902-5.
4. Nuzzo A, Corcos O. Reversible acute mesenteric ischemia. N Engl J Med 2016;375(15):e31.
5. Corcos O, Castier Y, Sibert A, Gaujoux S, Ronot M, Joly F, et al. Effects of a multimodal management strategy for acute mesenteric ischemia on survival and intestinal failure. Clin Gastroenterol Hepatol 2013;11(2):158-65.e2.4.
6. Nuzzo A, Maggiori L, Ronot M, Becq A, Plessier A, Gault N, et al. Predictive factors of intestinal necrosis in acute mesenteric ischemia: prospective study from an intestinal stroke center. Am J Gastroenterol 2017;112(4):597-605.
7. Copin P, Zins M, Nuzzo A, Purcell Y, Beranger-Gibert S, Maggiori L, et al. Acute mesenteric ischemia: A critical role for the radiologist. Diagn Interv Imaging 2018;99(3):123-34.
8. Nuzzo A, Maggiori L, Paugam-Burtz C, Cazals-Hatem D, Ronot M, Huguet A, et al. Oral antibiotics reduce intestinal necrosis in acute mesenteric ischemia: A prospective cohort Study. Am J Gastroenterol 2019;114(2):348-51.
9. Roussel A, Castier Y, Nuzzo A, Pellenc Q, Sibert A, Panis Y, et al. Revascularization of acute mesenteric ischemia after creation of a dedicated multidisciplinary center. J Vasc Surg 2015;62(5):1251-6.
10. Girault A, Pellenc Q, Roussel A, Senemaud J, Cerceau P, Maggiori L, et al. Midterm results after covered stenting of the superior mesenteric artery. J Vasc Surg 2021:S0741-5214(21)00343-8.
11. Sénémaud JN, Roussel A, Pellenc Q, Chardigny C, Cerceau P, Corcos O, et al. Retrograde open mesenteric stenting for acute and chronic mesenteric ischaemia: Results from an intestinal stroke centre. Eur J Vasc Endovasc Surg 2021:S1078-5884(21)00276-8.
12. Terlouw LG, Moelker A, Abrahamsen J, Acosta S, Bakker OJ, Baumgartner I, et al. European guidelines on chronic mesenteric ischaemia - joint United European Gastroenterology, European Association for Gastroenterology, Endoscopy and Nutrition, European Society of Gastrointestinal and Abdominal Radiology, Netherlands Association of Hepatogastroenterologists, Hellenic Society of Gastroenterology, Cardiovascular and Interventional Radiological Society of Europe, and Dutch Mesenteric Ischemia Study group clinical guidelines on the diagnosis and treatment of patients with chronic mesenteric ischaemia. United European Gastroenterol J 2020;8(4):371-95.